bb589b0a95b781de4278468c5d6f9725.ppt
- Количество слайдов: 61
 Universidad de Chile Facultad de Ciencias Químicas y Farmacéuticas Departamento de Química Orgánica y Fisicoquímica Programa de Doctorado Historia y Filosofía de la Historia y Filosofíade la Ciencia http: //www. filosofia. tk/foto/museo/La%20 escuela%20 de%20 Atenas. jpg Profesor: Dr. Jorge Valenzuela Pedevila
Universidad de Chile Facultad de Ciencias Químicas y Farmacéuticas Departamento de Química Orgánica y Fisicoquímica Programa de Doctorado Historia y Filosofía de la Historia y Filosofíade la Ciencia http: //www. filosofia. tk/foto/museo/La%20 escuela%20 de%20 Atenas. jpg Profesor: Dr. Jorge Valenzuela Pedevila
 John Dalton, 1766 -1844 http: //www. kjemi. uio. no/software/dalton/g raphics/john_dalton. gif
John Dalton, 1766 -1844 http: //www. kjemi. uio. no/software/dalton/g raphics/john_dalton. gif
 Inglés. Se educó en una escuela. Su padre fue criador de ovejas. Fue autodidacta. Su única enseñanza la recibió de Mr. John Gough, un filósofo ciego. En 1793 se trasladó a Manchester, donde enseñó matemática durante 30 años. En 1796 comenzó a trabajar en química. Era muy trabajador. Decía: “No existe el genio, y si he logrado algo considerado valioso por el mundo, era el fruto de una perseverante laboriosidad, orientada hacia una meta practicable especial. ” Autor de la teoría atómica y de la ley de proporciones múltiples. En 1832 tuvo un reconocimiento. La Universidad de Oxford le otorgó el Doctorado Honorario en Leyes. Su influencia científica fue muy grande. http: //www. marcdatabase. com/~lemur /lemur. com/gallery-of-antiquariantechnology/worthies/dalton-1200 scale 1000. jpg
Inglés. Se educó en una escuela. Su padre fue criador de ovejas. Fue autodidacta. Su única enseñanza la recibió de Mr. John Gough, un filósofo ciego. En 1793 se trasladó a Manchester, donde enseñó matemática durante 30 años. En 1796 comenzó a trabajar en química. Era muy trabajador. Decía: “No existe el genio, y si he logrado algo considerado valioso por el mundo, era el fruto de una perseverante laboriosidad, orientada hacia una meta practicable especial. ” Autor de la teoría atómica y de la ley de proporciones múltiples. En 1832 tuvo un reconocimiento. La Universidad de Oxford le otorgó el Doctorado Honorario en Leyes. Su influencia científica fue muy grande. http: //www. marcdatabase. com/~lemur /lemur. com/gallery-of-antiquariantechnology/worthies/dalton-1200 scale 1000. jpg
 Ley de la proporciones múltiples (1803 -1804) En términos modernos: Si dos elementos forman más de un compuesto, los diferentes pesos de uno de ellos, que se combinan con el mismo peso del otro, están en una razón de números enteros y pequeños.
Ley de la proporciones múltiples (1803 -1804) En términos modernos: Si dos elementos forman más de un compuesto, los diferentes pesos de uno de ellos, que se combinan con el mismo peso del otro, están en una razón de números enteros y pequeños.
 Teoría atómica de Dalton (1808) 1. La materia consta de partículas muy pequeñas, 2. 3. 4. indivisibles, indestructibles, llamadas átomos. Todos los átomos de un mismo elemento son idénticos entre sí, particularmente en el peso. Elementos diferentes poseen átomos que difieren en el peso. Cada elemento está caracterizado por el peso de su átomo. Cuando se combinan diferentes elementos para formar un compuesto, la porción más pequeña del compuesto consta de un número definido de átomos de cada elemento. En las reacciones químicas, los átomos no se crean ni se destruyen, sólo cambia su distribución.
Teoría atómica de Dalton (1808) 1. La materia consta de partículas muy pequeñas, 2. 3. 4. indivisibles, indestructibles, llamadas átomos. Todos los átomos de un mismo elemento son idénticos entre sí, particularmente en el peso. Elementos diferentes poseen átomos que difieren en el peso. Cada elemento está caracterizado por el peso de su átomo. Cuando se combinan diferentes elementos para formar un compuesto, la porción más pequeña del compuesto consta de un número definido de átomos de cada elemento. En las reacciones químicas, los átomos no se crean ni se destruyen, sólo cambia su distribución.
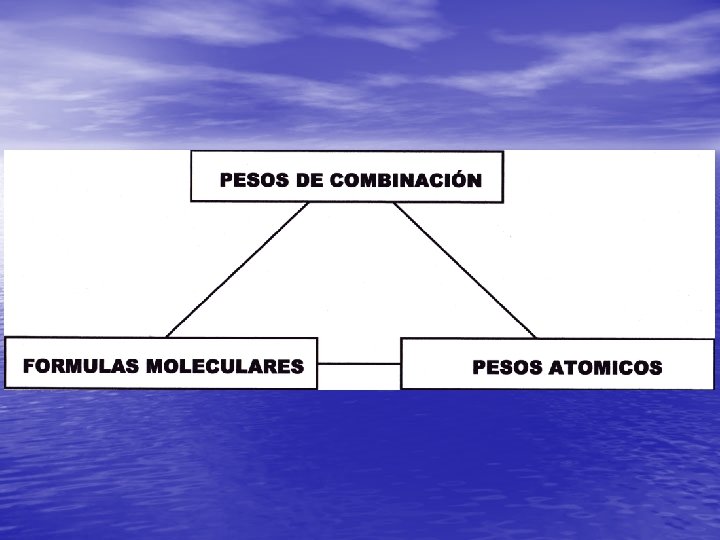
 Reglas de Dalton 1. Si sólo existe un compuesto de dos elementos 2. 3. se presume binario (uno át A + 1 át B). Cuando existen dos compuestos se supone uno binario (uno át A + 1 át B) y otro ternario (1 át A + 2 át B o 2 át A + 1 át B). Cuando se conocen tres compuestos: uno es binario y los otros dos ternarios.
Reglas de Dalton 1. Si sólo existe un compuesto de dos elementos 2. 3. se presume binario (uno át A + 1 át B). Cuando existen dos compuestos se supone uno binario (uno át A + 1 át B) y otro ternario (1 át A + 2 át B o 2 át A + 1 át B). Cuando se conocen tres compuestos: uno es binario y los otros dos ternarios.
 http: //www. chemheritage. org/Educational. Services/ch emach/ppt/jd 03. gif
http: //www. chemheritage. org/Educational. Services/ch emach/ppt/jd 03. gif
 http: //www. uh. edu/engin es/jdsymbols. jpg
http: //www. uh. edu/engin es/jdsymbols. jpg
 Apuntes de Dalton. http: //homepage. mac. com/dtrapp/e. Chem. f/lab. C 1. html
Apuntes de Dalton. http: //homepage. mac. com/dtrapp/e. Chem. f/lab. C 1. html




 John Dalton http: //www. eia. doe. gov/kids/history/p eople/pioneers. html
John Dalton http: //www. eia. doe. gov/kids/history/p eople/pioneers. html
 Justus von Liebig, 1803 -1873 http: //utopia. utexas. edu/project /portraits/index. html? img=230
Justus von Liebig, 1803 -1873 http: //utopia. utexas. edu/project /portraits/index. html? img=230
 Alemán. En 1822 se incorporó al laboratorio de Gay-Lussac. Trabajó en fulminatos. En 1824 fue nombrado profesor de Química en Giessen, donde alcanzó gran fama. Fue uno de los primeros en implantar la enseñanza práctica de la Química. En 1852 ocupó la cátedra de Química de Munich. Liebig ha sido uno de los más grandes químicos de todos los tiempos. Era muy estricto. Era un hombre de temperamento violento. Trabajó en Química Orgánica. http: //www. med. unigiessen. de/sfb 547/images/lieb ig. gif
Alemán. En 1822 se incorporó al laboratorio de Gay-Lussac. Trabajó en fulminatos. En 1824 fue nombrado profesor de Química en Giessen, donde alcanzó gran fama. Fue uno de los primeros en implantar la enseñanza práctica de la Química. En 1852 ocupó la cátedra de Química de Munich. Liebig ha sido uno de los más grandes químicos de todos los tiempos. Era muy estricto. Era un hombre de temperamento violento. Trabajó en Química Orgánica. http: //www. med. unigiessen. de/sfb 547/images/lieb ig. gif
 Liebig señaló que “convenció con todo el peso de su autoridad de que el verdadero centro de interés del estudio de la Química no estaba en las clases teóricas sino en el trabajo práctico”. Entre otros trabajos, perfeccionó el método de análisis orgánico. Con esto obtuvo las fórmulas de muchos compuestos. Descubrió el ácido hipúrico, cloroformo, cloral. Trabajó en derivados de ácido úrico, alcaloides, aminoácidos, creatinina, etc.
Liebig señaló que “convenció con todo el peso de su autoridad de que el verdadero centro de interés del estudio de la Química no estaba en las clases teóricas sino en el trabajo práctico”. Entre otros trabajos, perfeccionó el método de análisis orgánico. Con esto obtuvo las fórmulas de muchos compuestos. Descubrió el ácido hipúrico, cloroformo, cloral. Trabajó en derivados de ácido úrico, alcaloides, aminoácidos, creatinina, etc.
 Laboratorio de Liebig. http: //www. uh. edu/engines /epi 185. htm
Laboratorio de Liebig. http: //www. uh. edu/engines /epi 185. htm
 Friedrich Wöhler, 1800 -1882 http: //sl. wikipedia. org/wiki/Sli ka: Friedrich_woehler. jpg
Friedrich Wöhler, 1800 -1882 http: //sl. wikipedia. org/wiki/Sli ka: Friedrich_woehler. jpg
 http: //www. bioanalytical. com/info/calendar/98/08 wohl. htm
http: //www. bioanalytical. com/info/calendar/98/08 wohl. htm
 http: //www. deutschesmuseum. de/ausstell/dauer/_ehr en/wf. htm Alemán. Estudió con Gmelin y con Berzelius. Fue profesor en Berlín, Cassel y Göttingen. Era tranquilo. Trabajó en Química Inorgánica en el aluminio, el boro, el silicio, descubriendo el hidruro de silicio. En Química Orgánica trabajó en quinonas, hidroquinona, quinhidrona. Su mayor éxito fue la síntesis de la urea (H 2 N-CO-NH 2), a partir de cianato de amonio (NH 4 OCN). Como resultado de esta famosa síntesis comenzó a desaparecer la separación entre compuestos inorgánicos y orgánicos. Realizó muchos trabajos conjuntos con Liebig.
http: //www. deutschesmuseum. de/ausstell/dauer/_ehr en/wf. htm Alemán. Estudió con Gmelin y con Berzelius. Fue profesor en Berlín, Cassel y Göttingen. Era tranquilo. Trabajó en Química Inorgánica en el aluminio, el boro, el silicio, descubriendo el hidruro de silicio. En Química Orgánica trabajó en quinonas, hidroquinona, quinhidrona. Su mayor éxito fue la síntesis de la urea (H 2 N-CO-NH 2), a partir de cianato de amonio (NH 4 OCN). Como resultado de esta famosa síntesis comenzó a desaparecer la separación entre compuestos inorgánicos y orgánicos. Realizó muchos trabajos conjuntos con Liebig.
 Síntesis de Urea de Wöhler. http: //www. sparknotes. com/chemistry/organic 2/alkanes/section 1. html http: //ublib. buffalo. edu/libraries/asl/e xhibits/stamps/urea. jpg
Síntesis de Urea de Wöhler. http: //www. sparknotes. com/chemistry/organic 2/alkanes/section 1. html http: //ublib. buffalo. edu/libraries/asl/e xhibits/stamps/urea. jpg
 Photograph of Friedrich Wöhler(center) surrounded by many students and assistants. Member certificate of Swedish Science Academy for F. Wöhler. We can see Berzelius's signature who was a secretary of the Academy at that time. http: //www. origin-life. gr. jp/3002079/3002079. html
Photograph of Friedrich Wöhler(center) surrounded by many students and assistants. Member certificate of Swedish Science Academy for F. Wöhler. We can see Berzelius's signature who was a secretary of the Academy at that time. http: //www. origin-life. gr. jp/3002079/3002079. html
 Radicales Benzoílo y Etilo • Liebig y Wöhler trabajaron sobre el aceite de almendras • amargas. Demostraron que el aceite podía transformarse en una serie de compuestos que contenían el radical C 7 H 5 O (ellos lo formularon C 14 H 10 O 2), que denominaron benzoílo. (Actualmente se escribe C 6 H 5 CO). Así tenemos, por ejemplo, el cloruro de benzoílo C 6 H 5 COCl (o C 7 H 5 OCl). Liebig descubrió en 1834 que el alcohol, el éter y éter muriático podían considerarse compuestos del radical C 2 H 5. Denominó a este radical como radical etilo. Sin embargo, Liebig, quien duplicaba todas las fórmulas, lo escribía C 4 H 10.
Radicales Benzoílo y Etilo • Liebig y Wöhler trabajaron sobre el aceite de almendras • amargas. Demostraron que el aceite podía transformarse en una serie de compuestos que contenían el radical C 7 H 5 O (ellos lo formularon C 14 H 10 O 2), que denominaron benzoílo. (Actualmente se escribe C 6 H 5 CO). Así tenemos, por ejemplo, el cloruro de benzoílo C 6 H 5 COCl (o C 7 H 5 OCl). Liebig descubrió en 1834 que el alcohol, el éter y éter muriático podían considerarse compuestos del radical C 2 H 5. Denominó a este radical como radical etilo. Sin embargo, Liebig, quien duplicaba todas las fórmulas, lo escribía C 4 H 10.
 Radical Metilo Dumas y Peligot demostraron la existencia de un radical, que Berzelius llamó radical metilo Jean Baptiste André Dumas Eugène Melchior PELIGOT http: //www. ouraline. com /Dico/dico_peligot. htm
Radical Metilo Dumas y Peligot demostraron la existencia de un radical, que Berzelius llamó radical metilo Jean Baptiste André Dumas Eugène Melchior PELIGOT http: //www. ouraline. com /Dico/dico_peligot. htm
 Concepto de radical orgánico (Liebig, 1838) • Es un constituyente invariante de una serie de compuestos. • Puede ser reemplazado en ellos por elementos. • En sus compuestos con un elemento éste puede ser reemplazado o separado por cantidades equivalentes de otros elementos.
Concepto de radical orgánico (Liebig, 1838) • Es un constituyente invariante de una serie de compuestos. • Puede ser reemplazado en ellos por elementos. • En sus compuestos con un elemento éste puede ser reemplazado o separado por cantidades equivalentes de otros elementos.
 Friedich August Kekulé, 1829 -1896 http: //www. ruf. rice. edu/~whit mir/genealogy/kekule. jpg
Friedich August Kekulé, 1829 -1896 http: //www. ruf. rice. edu/~whit mir/genealogy/kekule. jpg
 Alemán. Estudió Arquitectura en la U. de Giessen. Discípulo de Liebig, Dumas, Gerhardt y Williamson. Fue profesor en Ghent en 1858. Estaba en ese cargo cuando descubrió la constitución del benceno (18651866). Reconoció al mismo tiempo que Cooper la tetravalencia del carbono (1857 -1858). Obtuvo acetileno por electrólisis de ácido fumárico (1864), descubrió el trifenilmetano (1872). Su obra “Lehrbuch der Organischen chemie” contiene una importante introducción histórica. http: //dbhs. wvusd. k 12. ca. us/webdocs /Gallery/Kekule. GIF
Alemán. Estudió Arquitectura en la U. de Giessen. Discípulo de Liebig, Dumas, Gerhardt y Williamson. Fue profesor en Ghent en 1858. Estaba en ese cargo cuando descubrió la constitución del benceno (18651866). Reconoció al mismo tiempo que Cooper la tetravalencia del carbono (1857 -1858). Obtuvo acetileno por electrólisis de ácido fumárico (1864), descubrió el trifenilmetano (1872). Su obra “Lehrbuch der Organischen chemie” contiene una importante introducción histórica. http: //dbhs. wvusd. k 12. ca. us/webdocs /Gallery/Kekule. GIF
 Kekulé y la Valencia • En 1857 Kekulé agregó a los tipos de Gerhardt el tipo del gas de los pantanos y adoptó los pesos equivalentes en uso en Alemania: C=6; O=8; N=14. escribió, por ejemplo, las fórmulas: Gas de los pantanos C 2 HHHH Cloruro de metilo C 2 HHHCl Cloroformo C 2 HCl. Cl
Kekulé y la Valencia • En 1857 Kekulé agregó a los tipos de Gerhardt el tipo del gas de los pantanos y adoptó los pesos equivalentes en uso en Alemania: C=6; O=8; N=14. escribió, por ejemplo, las fórmulas: Gas de los pantanos C 2 HHHH Cloruro de metilo C 2 HHHCl Cloroformo C 2 HCl. Cl
 • Kekulé extendió a todos los compuestos del carbono el tipo gas de los pantanos y adoptó los pesos atómicos de Gerhardt (C=12, O=16, etc). En 1858 kekulé señala: La cantidad de carbono reconocida por los químicos como un átomo siempre se une con cuatro átomos de un elemento monoátomico o dos átomos de un elemento diatómico y en general la suma de las unidades químicas de los elementos unidos a un átomo de carbono es 4. http: //ww w. woodro w. org/tea chers/che mistry/ins titutes/19 92/KEKUL E. GIF
• Kekulé extendió a todos los compuestos del carbono el tipo gas de los pantanos y adoptó los pesos atómicos de Gerhardt (C=12, O=16, etc). En 1858 kekulé señala: La cantidad de carbono reconocida por los químicos como un átomo siempre se une con cuatro átomos de un elemento monoátomico o dos átomos de un elemento diatómico y en general la suma de las unidades químicas de los elementos unidos a un átomo de carbono es 4. http: //ww w. woodro w. org/tea chers/che mistry/ins titutes/19 92/KEKUL E. GIF
 Junto con reconocer que el carbono es tetravalente, introdujo la concepción de la unión de átomos de carbono entre sí. En los casos de sustancias que contienen varios átomos de carbono debe admitirse que por lo menos algunos de los átomos se encuentran formando parte del compuesto, mantenidos por la afinidad del carbono se unen entre sí y en ese caso una parte de la afinidad de un átomo está naturalmente unida con una parte igual de la afinidad del otro. El caso más sencillo, y por lo tanto el más probable de tales uniones entre átomos de carbono, es aquel en el cual una unidad de afinidad de uno está ligada a unidad de afinidad del otro. De las 2 x 4 unidades de afinidad de los dos átomos de carbono, dos se emplean en mantener unidos entre sí los dos átomos y las otras seis quedan libres para unirse a átomos de otros elementos. En otras palabras, un grupo de dos átomos de carbono, C 2 puede ser hexatómico y formar un compuesto con seis átomos de un elemento monoatómico, o en general, con un número tal de átomos que la suma de sus unidades químicas sea seis. http: //www. uniheidelberg. de/institute/fak 12/texte/kekule. html
Junto con reconocer que el carbono es tetravalente, introdujo la concepción de la unión de átomos de carbono entre sí. En los casos de sustancias que contienen varios átomos de carbono debe admitirse que por lo menos algunos de los átomos se encuentran formando parte del compuesto, mantenidos por la afinidad del carbono se unen entre sí y en ese caso una parte de la afinidad de un átomo está naturalmente unida con una parte igual de la afinidad del otro. El caso más sencillo, y por lo tanto el más probable de tales uniones entre átomos de carbono, es aquel en el cual una unidad de afinidad de uno está ligada a unidad de afinidad del otro. De las 2 x 4 unidades de afinidad de los dos átomos de carbono, dos se emplean en mantener unidos entre sí los dos átomos y las otras seis quedan libres para unirse a átomos de otros elementos. En otras palabras, un grupo de dos átomos de carbono, C 2 puede ser hexatómico y formar un compuesto con seis átomos de un elemento monoatómico, o en general, con un número tal de átomos que la suma de sus unidades químicas sea seis. http: //www. uniheidelberg. de/institute/fak 12/texte/kekule. html
 • Kekulé agrega que la mayor de sus concepciones no son • originales y agradece a Williamson, Olding, Gerhardt y Wurtz. Sin embargo, omite el nombre de Frankland. Hay que destacar que la tetravalencia del carbono también fue admitida en 1858, en forma independiente, por el químico escocés Archibald Scott Couper. Una enfermedad le impidió a Couper desarrollar sus ideas. Archibald Scott Couper http: //www. chemheritage. org/classroom/ch emach/chemsynthesis/couper-kekule. html
• Kekulé agrega que la mayor de sus concepciones no son • originales y agradece a Williamson, Olding, Gerhardt y Wurtz. Sin embargo, omite el nombre de Frankland. Hay que destacar que la tetravalencia del carbono también fue admitida en 1858, en forma independiente, por el químico escocés Archibald Scott Couper. Una enfermedad le impidió a Couper desarrollar sus ideas. Archibald Scott Couper http: //www. chemheritage. org/classroom/ch emach/chemsynthesis/couper-kekule. html
 La fórmula del Benceno • En 1858 Kekulé sugirió que las fórmulas del benceno y naftaleno se ordenaban de una manera más densa. Escribió la fórmula correcta en 1865. el mismo Kekulé cuenta que la idea le surgió de un sueño. Durante un sueño que tuve cuando estudiaba con Gerhardt ví una larga cadena de átomos de carbono como serpientes que se retorcían y enroscaban hasta que una cogía su propia cola y el cuadro remolineaba impasiblemente delante de mis propios ojos. http: //somm eil. univlyon 1. fr/articl es/savenir/ge nie/images/f 1. gif
La fórmula del Benceno • En 1858 Kekulé sugirió que las fórmulas del benceno y naftaleno se ordenaban de una manera más densa. Escribió la fórmula correcta en 1865. el mismo Kekulé cuenta que la idea le surgió de un sueño. Durante un sueño que tuve cuando estudiaba con Gerhardt ví una larga cadena de átomos de carbono como serpientes que se retorcían y enroscaban hasta que una cogía su propia cola y el cuadro remolineaba impasiblemente delante de mis propios ojos. http: //somm eil. univlyon 1. fr/articl es/savenir/ge nie/images/f 1. gif
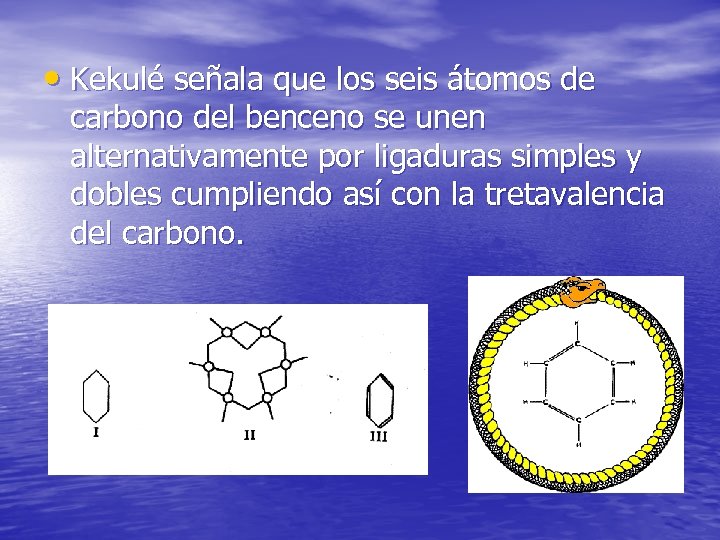 • Kekulé señala que los seis átomos de carbono del benceno se unen alternativamente por ligaduras simples y dobles cumpliendo así con la tretavalencia del carbono.
• Kekulé señala que los seis átomos de carbono del benceno se unen alternativamente por ligaduras simples y dobles cumpliendo así con la tretavalencia del carbono.
 • La existencia de dobles ligaduras ya había sido • • reconocida por Crum Brown al escribir en 1864 la fórmula del etileno y triples ligaduras por Erlenmeyer (1862) en el acetileno. Los nombres aromáticos y alifáticos se deben a Kekulé y Hofmann, respectivamente. Erlenmeyer sugirió en 1866 que el naftaleno está formado por dos anillos bencénicos unidos entre si a través de dos átomos de carbono comunes. La estructura del antraceno fue determinada por Graebe y Lieberman en 1868.
• La existencia de dobles ligaduras ya había sido • • reconocida por Crum Brown al escribir en 1864 la fórmula del etileno y triples ligaduras por Erlenmeyer (1862) en el acetileno. Los nombres aromáticos y alifáticos se deben a Kekulé y Hofmann, respectivamente. Erlenmeyer sugirió en 1866 que el naftaleno está formado por dos anillos bencénicos unidos entre si a través de dos átomos de carbono comunes. La estructura del antraceno fue determinada por Graebe y Lieberman en 1868.
 Stanislao Cannizzaro, 1826 -1910 http: //www. chimica. unige. it/museo/Canizz aro. htm
Stanislao Cannizzaro, 1826 -1910 http: //www. chimica. unige. it/museo/Canizz aro. htm
 http: //www. agenziadogane. it/ita liano/laboratori/storia/cannizzar o. htm Italiano. Profesor en Génova (1855), Palermo (1861) y Roma (1871). Su primera investigación sobre el cloruro de cianógeno fue en colaboración con Cloëz en el laboratorio de Chevreul en París. En el mismo año publicó un trabajo sobre la acción de la potasa sobre el benzaldehído, obteniéndose alcohol bencílico (reacción de Cannizzaro). Su mayor contribución fue la explicación en 1858 de que el peso atómico de un elemento podía determinarse mediante la aplicación de la hipótesis de Avogadro, complementada por la ley de los calores atómicos de Dulong y Petit. Llegó a ser senador.
http: //www. agenziadogane. it/ita liano/laboratori/storia/cannizzar o. htm Italiano. Profesor en Génova (1855), Palermo (1861) y Roma (1871). Su primera investigación sobre el cloruro de cianógeno fue en colaboración con Cloëz en el laboratorio de Chevreul en París. En el mismo año publicó un trabajo sobre la acción de la potasa sobre el benzaldehído, obteniéndose alcohol bencílico (reacción de Cannizzaro). Su mayor contribución fue la explicación en 1858 de que el peso atómico de un elemento podía determinarse mediante la aplicación de la hipótesis de Avogadro, complementada por la ley de los calores atómicos de Dulong y Petit. Llegó a ser senador.
 http: //www. ul. ie/~childsp/Cin. A/Issue 67/T OC 18_Chymists. htm
http: //www. ul. ie/~childsp/Cin. A/Issue 67/T OC 18_Chymists. htm
 Cannizzaro y la determinación de los pesos atómicos. (Karlsruhe 1860) Cannizzaro se dio cuenta de la importancia de la hipótesis de Avogadro (1811). Señaló que “el peso molecular de una sustancia volátil puede encontrarse por determinación de su densidad de vapor, siendo la relación entre ésta y la de una sustancia patrón igual a la relación de los pesos moleculares de ambas. ” “Como sustancia patrón se eligió al hidrógeno, la sustancia menos densa conocida; pero puesto que la molécula de hidrógeno contiene dos átomos, según el razonamiento de Avogadro, la densidad relativa, respecto del hidrógeno, debe ser multiplicada por dos para dar el peso molecular del vapor como suma de los pesos atómicos, estando estos últimos referidos al H = 1. ” “El peso atómico de un elemento es entonces la menor masa de él contenido en una masa igual al peso molecular de sus compuestos volátiles”.
Cannizzaro y la determinación de los pesos atómicos. (Karlsruhe 1860) Cannizzaro se dio cuenta de la importancia de la hipótesis de Avogadro (1811). Señaló que “el peso molecular de una sustancia volátil puede encontrarse por determinación de su densidad de vapor, siendo la relación entre ésta y la de una sustancia patrón igual a la relación de los pesos moleculares de ambas. ” “Como sustancia patrón se eligió al hidrógeno, la sustancia menos densa conocida; pero puesto que la molécula de hidrógeno contiene dos átomos, según el razonamiento de Avogadro, la densidad relativa, respecto del hidrógeno, debe ser multiplicada por dos para dar el peso molecular del vapor como suma de los pesos atómicos, estando estos últimos referidos al H = 1. ” “El peso atómico de un elemento es entonces la menor masa de él contenido en una masa igual al peso molecular de sus compuestos volátiles”.
 • 1869 La ley periódica fue enunciada casi en forma simultánea e independiente por Dimitri Ivanovich Mendeleev (1834 -1907, ruso) y Julius Lothar Meyer (1830 -1895, alemán). Mendeleev. Meyer. http: //www. quimica. net/emilia no/quimica_geral/personalidad es/mendeleyev. htm http: //www. answers. com/to pic/julius-lothar-meyer
• 1869 La ley periódica fue enunciada casi en forma simultánea e independiente por Dimitri Ivanovich Mendeleev (1834 -1907, ruso) y Julius Lothar Meyer (1830 -1895, alemán). Mendeleev. Meyer. http: //www. quimica. net/emilia no/quimica_geral/personalidad es/mendeleyev. htm http: //www. answers. com/to pic/julius-lothar-meyer
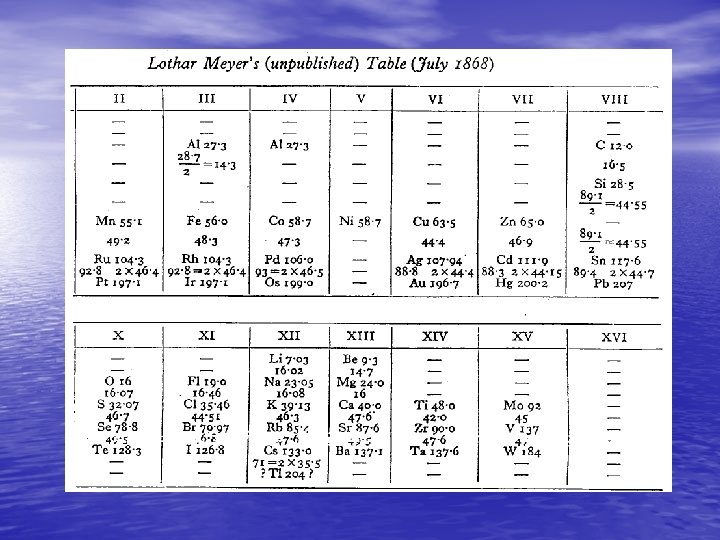
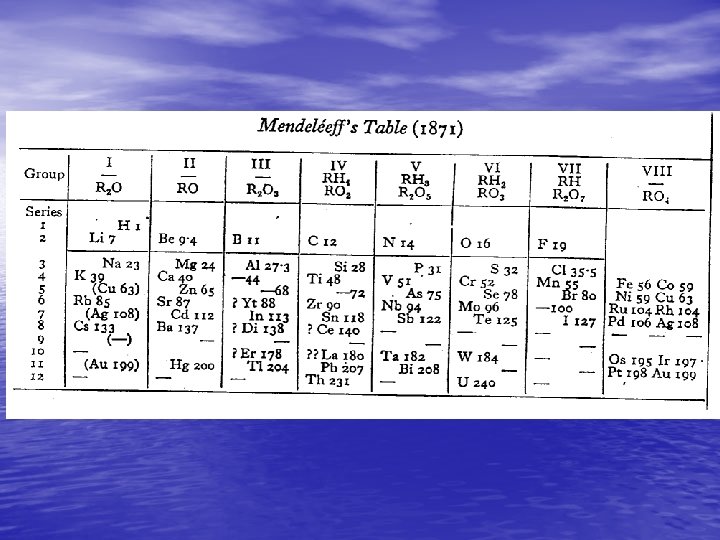
 • Mendeleev publicó su primera Tabla periódica en Abril de 1869, pero fue presentada en marzo. En tanto, Lothar Meyer publicó su Tabla en 1870, aunque estaba fechada en diciembre de 1869. Meyer había construido una tabla muy imperfecta en 1868, pero que no publicó.
• Mendeleev publicó su primera Tabla periódica en Abril de 1869, pero fue presentada en marzo. En tanto, Lothar Meyer publicó su Tabla en 1870, aunque estaba fechada en diciembre de 1869. Meyer había construido una tabla muy imperfecta en 1868, pero que no publicó.






 Las predicciones de mendeleev • Mendeleev predijo la existencia de los siguientes • • • elementos. Eka-alumino (Galio Ga, desc. 1875) Eka-boro (Escandio Sc, desc. 1879) Eka-silicio (Germanio Ge, desc. 1886) • También predijo los elementos Eka-cesio (Francio Fr, • desc. 1939), Eka-yodo (Astato At, desc. 1940), y Ekamanganeso (tecnecio Tc, desc. 1937). (desc. = descubierto)
Las predicciones de mendeleev • Mendeleev predijo la existencia de los siguientes • • • elementos. Eka-alumino (Galio Ga, desc. 1875) Eka-boro (Escandio Sc, desc. 1879) Eka-silicio (Germanio Ge, desc. 1886) • También predijo los elementos Eka-cesio (Francio Fr, • desc. 1939), Eka-yodo (Astato At, desc. 1940), y Ekamanganeso (tecnecio Tc, desc. 1937). (desc. = descubierto)

 Ley Periódica Enunciado de Mendeleev (1869). Las propiedades de los elementos dependen de un modo periódico de sus pesos atómicos. http: //www. lenntech. com/ periodic-chart. htm Enunciado moderno: “Las propiedades periódicas de los elementos dependen de un modo periódico de sus números atómicos”
Ley Periódica Enunciado de Mendeleev (1869). Las propiedades de los elementos dependen de un modo periódico de sus pesos atómicos. http: //www. lenntech. com/ periodic-chart. htm Enunciado moderno: “Las propiedades periódicas de los elementos dependen de un modo periódico de sus números atómicos”
 Elementos que no cumplen el orden esperado por Mendeleev • Mendeleev consideró que había fallas en la determinación de los pesos atómicos de los siguientes elementos, porque si se utilizaban estos pesos fallaba la ordenación de la tabla. • • • Argón 39, 94 Potasio 39, 10 Cobalto 58, 94 Níquel 58, 69 Teluro 127, 5 Yodo 126, 92 En realidad, no había fallas en estas determinaciones. Lo que ocurre es que la Tabla periódica debe ordenarse en términos del Número Atómico, concepto desconocido en la época de Mendeleev. Tampoco él conocía la existencia de los isótopos.
Elementos que no cumplen el orden esperado por Mendeleev • Mendeleev consideró que había fallas en la determinación de los pesos atómicos de los siguientes elementos, porque si se utilizaban estos pesos fallaba la ordenación de la tabla. • • • Argón 39, 94 Potasio 39, 10 Cobalto 58, 94 Níquel 58, 69 Teluro 127, 5 Yodo 126, 92 En realidad, no había fallas en estas determinaciones. Lo que ocurre es que la Tabla periódica debe ordenarse en términos del Número Atómico, concepto desconocido en la época de Mendeleev. Tampoco él conocía la existencia de los isótopos.
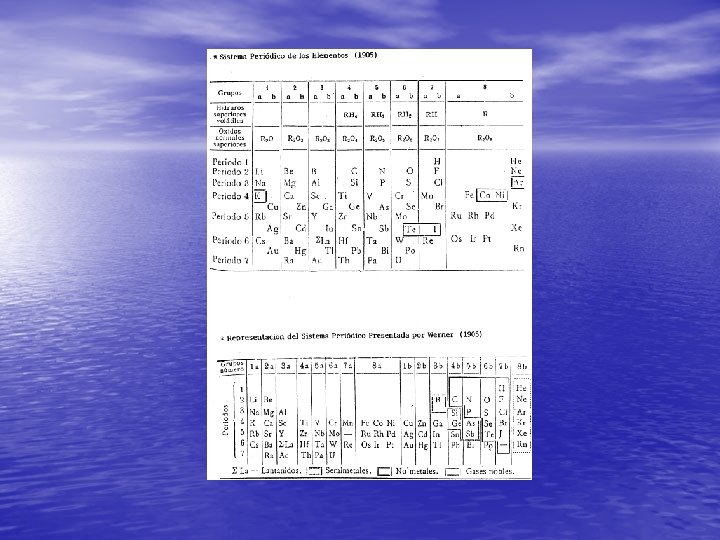
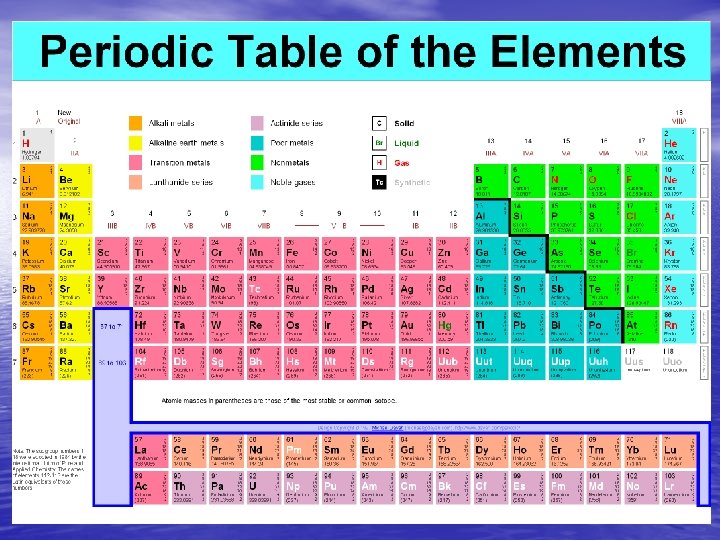
 Tabla Periódica moderna • La nueva Tabla Periódica se pudo desarrollar en su forma final gracias al estudio de la estructura atómica de los físicos del siglo XX, entre ellos Rutherford, Moseley, Bohr, Heisenberg, etc.
Tabla Periódica moderna • La nueva Tabla Periódica se pudo desarrollar en su forma final gracias al estudio de la estructura atómica de los físicos del siglo XX, entre ellos Rutherford, Moseley, Bohr, Heisenberg, etc.
 5
5
 Emil Fischer, 1852 -1919 http: //www. generalanaesthesia. com/people/emilfischer. html
Emil Fischer, 1852 -1919 http: //www. generalanaesthesia. com/people/emilfischer. html
 Alemán. Alumno de Kekulé. Se graduó con Baeyer en Estrasburgo en 1874. Profesor en Erlangen y Würzburg. Sucedió a Hofmann en Berlín en 1892. Investigó la constitución del colorante rosanilina (1878), descubrió la fenilhidracina (1875), la cual llegó a ser un reactivo general del grupo carbonilo. Trabajó en la constitución, síntesis y configuración de azúcares (1884 -1900). Así en 1887, junto a Tafel, encontró que a partir de la acroleína (CH 2=CHCHO), podían sintetizarse dos azúcares. Más adelante, obtuvo azúcares ópticamente activos como la dextrosa, manosa y fructosa. Sintetizó algunos compuestos (unos 130) del grupo de la purina (1882 -1901) http: //wwwcsi. unian. it/educa/laboratorio/microp ro. html
Alemán. Alumno de Kekulé. Se graduó con Baeyer en Estrasburgo en 1874. Profesor en Erlangen y Würzburg. Sucedió a Hofmann en Berlín en 1892. Investigó la constitución del colorante rosanilina (1878), descubrió la fenilhidracina (1875), la cual llegó a ser un reactivo general del grupo carbonilo. Trabajó en la constitución, síntesis y configuración de azúcares (1884 -1900). Así en 1887, junto a Tafel, encontró que a partir de la acroleína (CH 2=CHCHO), podían sintetizarse dos azúcares. Más adelante, obtuvo azúcares ópticamente activos como la dextrosa, manosa y fructosa. Sintetizó algunos compuestos (unos 130) del grupo de la purina (1882 -1901) http: //wwwcsi. unian. it/educa/laboratorio/microp ro. html
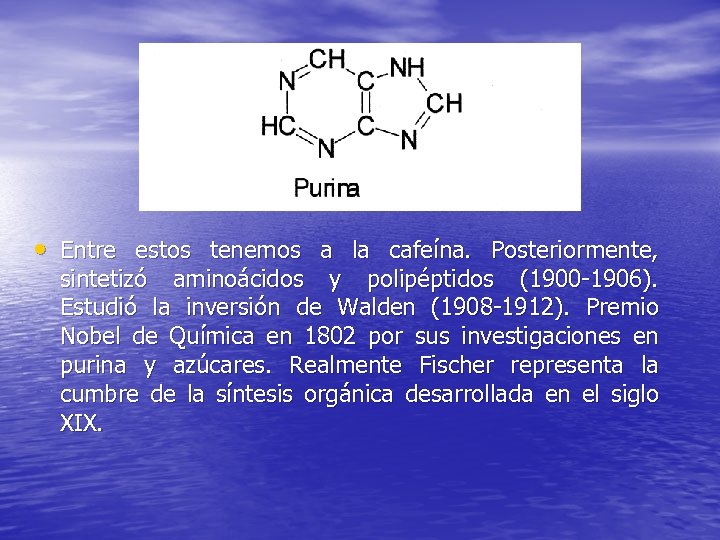 • Entre estos tenemos a la cafeína. Posteriormente, sintetizó aminoácidos y polipéptidos (1900 -1906). Estudió la inversión de Walden (1908 -1912). Premio Nobel de Química en 1802 por sus investigaciones en purina y azúcares. Realmente Fischer representa la cumbre de la síntesis orgánica desarrollada en el siglo XIX.
• Entre estos tenemos a la cafeína. Posteriormente, sintetizó aminoácidos y polipéptidos (1900 -1906). Estudió la inversión de Walden (1908 -1912). Premio Nobel de Química en 1802 por sus investigaciones en purina y azúcares. Realmente Fischer representa la cumbre de la síntesis orgánica desarrollada en el siglo XIX.
 http: //www. modeling. unibas. ch/Vedani/GIFs/002 -Emil_Fischer. gif
http: //www. modeling. unibas. ch/Vedani/GIFs/002 -Emil_Fischer. gif


