ультрафильтрация.ppt
- Количество слайдов: 57
 Ультрафильтрация 1
Ультрафильтрация 1
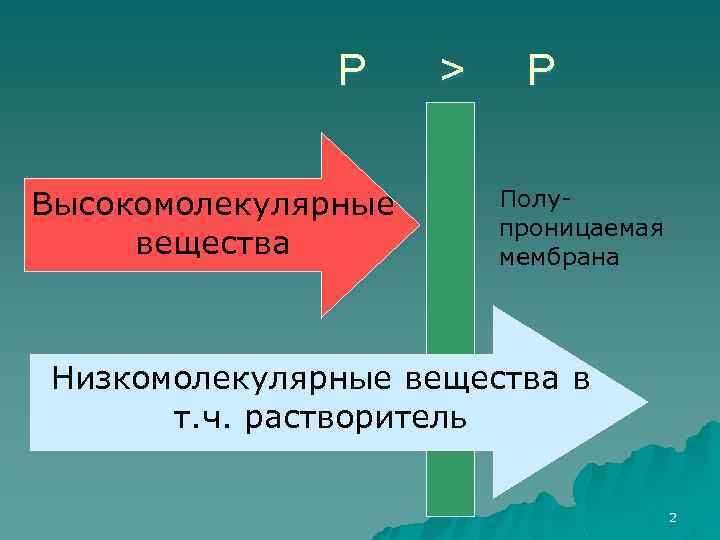 Р Высокомолекулярные вещества > Р Полупроницаемая мембрана Низкомолекулярные вещества в т. ч. растворитель 2
Р Высокомолекулярные вещества > Р Полупроницаемая мембрана Низкомолекулярные вещества в т. ч. растворитель 2
 Движущая сила процесса – градиент гидростатического давления (создается насосами) 3
Движущая сила процесса – градиент гидростатического давления (создается насосами) 3
 Преимущества: u Дешевизна u Отсутствие тепловой инактивации u Одновременно с концентрированием идет очистка от НМС и некоторых ВМС 4
Преимущества: u Дешевизна u Отсутствие тепловой инактивации u Одновременно с концентрированием идет очистка от НМС и некоторых ВМС 4
 Главный элемент аппарата: МЕМБРАНА 5
Главный элемент аппарата: МЕМБРАНА 5
 Требования к мембране: u Высокая проницаемость u Высокая селективность u Механическая прочность u Химическая стойкость u Не должна адсорбировать продукт u Не должна менять технические характеристики продукта u Минимальная стоимость 6
Требования к мембране: u Высокая проницаемость u Высокая селективность u Механическая прочность u Химическая стойкость u Не должна адсорбировать продукт u Не должна менять технические характеристики продукта u Минимальная стоимость 6
 Материалы мембраны: u Целлофан u Каучук u Полиэтилен u Полистирол u Полифенолы u Производные целлюлозы u Пористое стекло 7
Материалы мембраны: u Целлофан u Каучук u Полиэтилен u Полистирол u Полифенолы u Производные целлюлозы u Пористое стекло 7
 8
8
 Мембраны бывают: u Изотропные (однослойные) u Анизотропные (двухслойные) Первый слой – селективность Второй слой - прочность 9
Мембраны бывают: u Изотропные (однослойные) u Анизотропные (двухслойные) Первый слой – селективность Второй слой - прочность 9
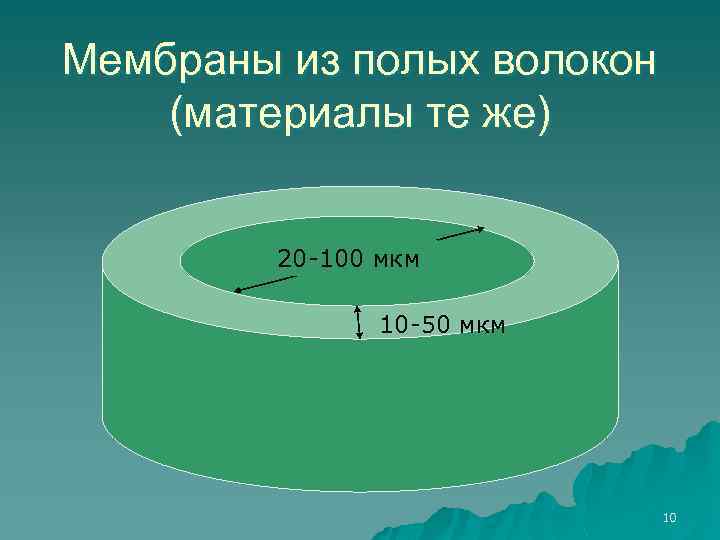 Мембраны из полых волокон (материалы те же) 20 -100 мкм 10 -50 мкм 10
Мембраны из полых волокон (материалы те же) 20 -100 мкм 10 -50 мкм 10
 Срок службы мембраны От нескольких месяцев до нескольких лет. Часто срок зависит от дренажной подложки 11
Срок службы мембраны От нескольких месяцев до нескольких лет. Часто срок зависит от дренажной подложки 11
 Материалы дренажной подложки u Вспененный полиэтилен u Пористая нержавеющая сталь u Капроновые сетки (0, 2 мм; 0, 1 х0, 1 мм) 12
Материалы дренажной подложки u Вспененный полиэтилен u Пористая нержавеющая сталь u Капроновые сетки (0, 2 мм; 0, 1 х0, 1 мм) 12
 Технические характеристики мембраны u Водопроницаемость G=V/ F*T м куб. / м кв. *час u Селективность R = 100 * (1 – C фильтрата /С ) исх. р-ра 13
Технические характеристики мембраны u Водопроницаемость G=V/ F*T м куб. / м кв. *час u Селективность R = 100 * (1 – C фильтрата /С ) исх. р-ра 13
 uр. Н - в районе ИЭТ фермента u. Температура «+» влияет на ультрафильтрацию но «–» на активность фермента 14
uр. Н - в районе ИЭТ фермента u. Температура «+» влияет на ультрафильтрацию но «–» на активность фермента 14
 Концентрационная поляризация Появляется при достижении концентрации белка 0, 4 г/л на поверхности мембраны образуется гелеобразный слой и при дальнейшем росте Ргидростат. Скорость фильтрации снижается. 15
Концентрационная поляризация Появляется при достижении концентрации белка 0, 4 г/л на поверхности мембраны образуется гелеобразный слой и при дальнейшем росте Ргидростат. Скорость фильтрации снижается. 15
 Способы устранения концентрационной поляризации Создание турбулентности за счет увеличения скорости потока над мембранами u Центрифугование и фильтрование раствора фермента u Применение стерилизующей фильтрации u Диафильтрация – промывка р-ра фермента водой идет со скоростью, с которой она уходит из фильтра u 16
Способы устранения концентрационной поляризации Создание турбулентности за счет увеличения скорости потока над мембранами u Центрифугование и фильтрование раствора фермента u Применение стерилизующей фильтрации u Диафильтрация – промывка р-ра фермента водой идет со скоростью, с которой она уходит из фильтра u 16
 Состав ультрафильтрационной установки u Ультрафильтрационный аппарат u Насосы u Емкости сбора фильтрата и концентрата u Емкость для исходного раствора u Теплообменники для охлаждения 17
Состав ультрафильтрационной установки u Ультрафильтрационный аппарат u Насосы u Емкости сбора фильтрата и концентрата u Емкость для исходного раствора u Теплообменники для охлаждения 17
 Типы ультрафильтрационных аппаратов u Фильтр – прессы с плоскими фильтрующими элементами u Аппараты с трубчатыми фильтрующими элементами u Аппараты рулонного типа u Аппарат с полыми волокнами (наиболее производительные) 18
Типы ультрафильтрационных аппаратов u Фильтр – прессы с плоскими фильтрующими элементами u Аппараты с трубчатыми фильтрующими элементами u Аппараты рулонного типа u Аппарат с полыми волокнами (наиболее производительные) 18
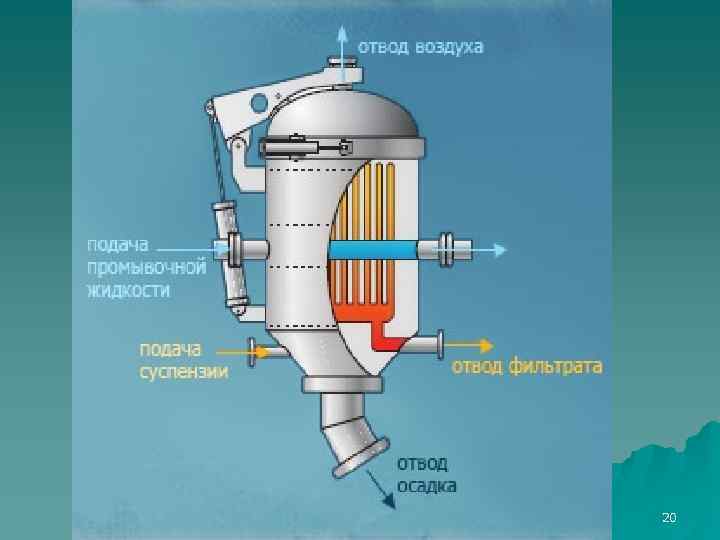
 Фильтр – пресс (200 кв. м/куб. м) 19
Фильтр – пресс (200 кв. м/куб. м) 19
 20
20
 Трубчатые фильтрующие элементы (100 кв. м/куб. м) 21
Трубчатые фильтрующие элементы (100 кв. м/куб. м) 21
 Аппарат рулонного типа До 800 кв. м/куб. м 22
Аппарат рулонного типа До 800 кв. м/куб. м 22
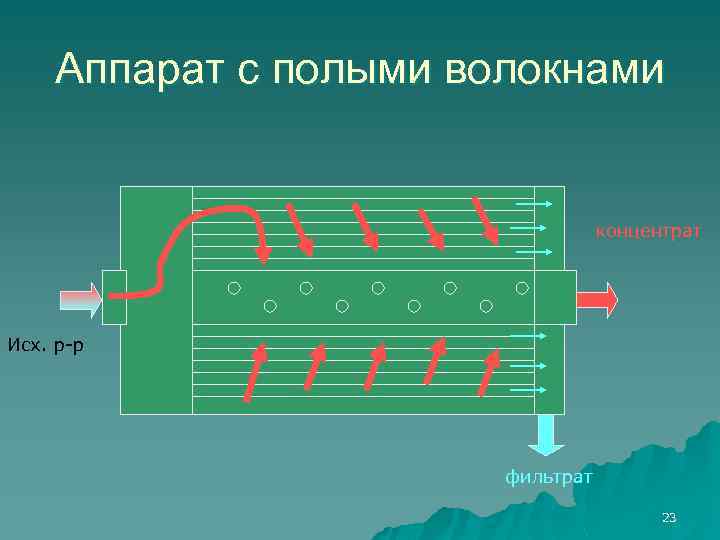 Аппарат с полыми волокнами концентрат Исх. р-р фильтрат 23
Аппарат с полыми волокнами концентрат Исх. р-р фильтрат 23
 Получение препаратов марки 3 х 24
Получение препаратов марки 3 х 24
 Концентрат сушат в распылительной сушилке до 6 -8% влажности Потеря активности со стабилизатором = 10% без такового = 30%. В качестве него часто используют хлорид натрия 25
Концентрат сушат в распылительной сушилке до 6 -8% влажности Потеря активности со стабилизатором = 10% без такового = 30%. В качестве него часто используют хлорид натрия 25
 Осаждение ферментов из экстракта 26
Осаждение ферментов из экстракта 26
 Осаждение органическими растворителями На сольватацию органического растворителя расходуются молекулы воды, которые уходят из сольватационной оболочки молекулы фермента. Сольватационная оболочка разрушается и белок выпадает в осадок 27
Осаждение органическими растворителями На сольватацию органического растворителя расходуются молекулы воды, которые уходят из сольватационной оболочки молекулы фермента. Сольватационная оболочка разрушается и белок выпадает в осадок 27
 Факторы, влияющие на процесс u. Растворитель (нетоксичность, полное смешение с водой, не инактивирует фермент. Лучше всего по порядку изопропанолэтанол-ацетон) 28
Факторы, влияющие на процесс u. Растворитель (нетоксичность, полное смешение с водой, не инактивирует фермент. Лучше всего по порядку изопропанолэтанол-ацетон) 28
 Осаждение изопропанолом идет при низких 15 -55%, осаждается меньше балласта, возможна очистка белка от балласта 29
Осаждение изопропанолом идет при низких 15 -55%, осаждается меньше балласта, возможна очистка белка от балласта 29
 u Ионы металлов (стабилизаторы кальций, магний, кобальт; ингибиторы – тяжелые металлы) u Температура + 4 С u р. Н = ИЭТ фермента u Оптим. Конц. Белка 10 -12% u Длительность процесса – как можно меньше 30
u Ионы металлов (стабилизаторы кальций, магний, кобальт; ингибиторы – тяжелые металлы) u Температура + 4 С u р. Н = ИЭТ фермента u Оптим. Конц. Белка 10 -12% u Длительность процесса – как можно меньше 30
 Аппаратурное оформление процесса u Периодическое осаждение u Непрерывное осаждение 31
Аппаратурное оформление процесса u Периодическое осаждение u Непрерывное осаждение 31
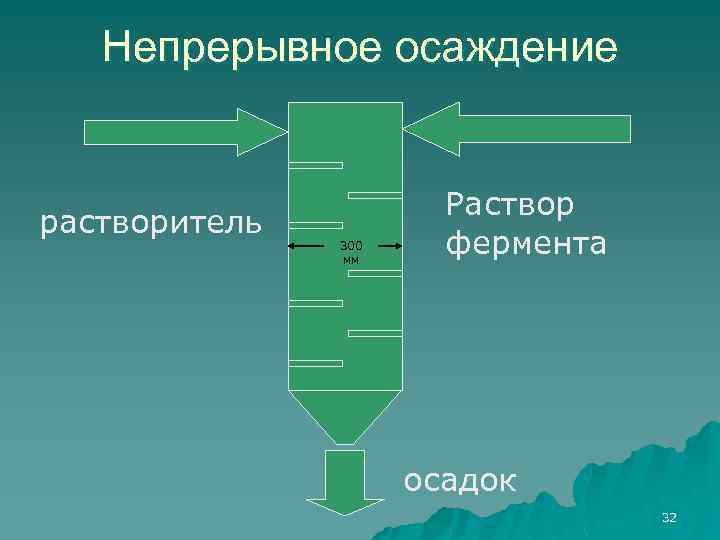 Непрерывное осаждение растворитель 300 мм Раствор фермента осадок 32
Непрерывное осаждение растворитель 300 мм Раствор фермента осадок 32
 Параметры процесса u Продолжительность – 15 минут u Осадок нуждается в дополнительной сепарации u Потери активности = 15% u Потери растворителя = 10% 33
Параметры процесса u Продолжительность – 15 минут u Осадок нуждается в дополнительной сепарации u Потери активности = 15% u Потери растворителя = 10% 33
 Высаливание На сольватацию ионов расходуются молекулы воды, которые уходят из сольватационной оболочки молекулы фермента. Сольватационная оболочка разрушается и белок выпадает в осадок. Высаливание дает больше балласта в осадке (до 85%). 34
Высаливание На сольватацию ионов расходуются молекулы воды, которые уходят из сольватационной оболочки молекулы фермента. Сольватационная оболочка разрушается и белок выпадает в осадок. Высаливание дает больше балласта в осадке (до 85%). 34
 Факторы, влияющие на процесс: u р. Н среды ИЭТ фермента, u Температура 20 -30 С, u степень чистоты ферментного раствора, u длительность процесса u и т. д. 35
Факторы, влияющие на процесс: u р. Н среды ИЭТ фермента, u Температура 20 -30 С, u степень чистоты ферментного раствора, u длительность процесса u и т. д. 35
 Растворимость белков в солевых растворах подчиняется эмпирическому уравнению Кона lg. S = lg. S 0 — k*x, u где S, So — растворимость белка соответственно в растворе солн и чистой воде; к, — константа высаливании; х — ионная сила раствора. 36
Растворимость белков в солевых растворах подчиняется эмпирическому уравнению Кона lg. S = lg. S 0 — k*x, u где S, So — растворимость белка соответственно в растворе солн и чистой воде; к, — константа высаливании; х — ионная сила раствора. 36
 Для успешного осуществления процесса высаливания необходимо, чтобы величина k была как можно больше. Величина к, зависит от природы соли, но не зависит от концентрации водородных ионов. 37
Для успешного осуществления процесса высаливания необходимо, чтобы величина k была как можно больше. Величина к, зависит от природы соли, но не зависит от концентрации водородных ионов. 37
 Она изменяется в широких пределах: для цитрата натрия k равна 1, 29, фосфата калия — 1, 15, сульфата натрия — 1, 08, сульфата аммония — 0, 84, сульфата магния — 0, 62 и в условиях эксперимента является постоянной величиной. Реально усилить эффект высаливания можно, увеличивая ионную силу раствора. 38
Она изменяется в широких пределах: для цитрата натрия k равна 1, 29, фосфата калия — 1, 15, сульфата натрия — 1, 08, сульфата аммония — 0, 84, сульфата магния — 0, 62 и в условиях эксперимента является постоянной величиной. Реально усилить эффект высаливания можно, увеличивая ионную силу раствора. 38
 Самая сложная стадия процесса высаливания — это внесение соли и способ ее растворения. Соль измельчают и медленно добавляют небольшими порциями при постоянном перемешивании, чтобы избежать локальных зон повышения концентрации соли в растворе. При перемешивании может наблюдаться вспенивание раствора, которое нежелательно, так как при попадании фермента в пузырьки пены он может денатурироваться в результате воздействия поверхностного натяжения. Поэтому перемешивание должно быть умеренным, без пенообразования. 39
Самая сложная стадия процесса высаливания — это внесение соли и способ ее растворения. Соль измельчают и медленно добавляют небольшими порциями при постоянном перемешивании, чтобы избежать локальных зон повышения концентрации соли в растворе. При перемешивании может наблюдаться вспенивание раствора, которое нежелательно, так как при попадании фермента в пузырьки пены он может денатурироваться в результате воздействия поверхностного натяжения. Поэтому перемешивание должно быть умеренным, без пенообразования. 39
 После введения последней порции соли перемешивание следует продолжать еще 20— 40 мии до достижения полного равновесия между растворенными и агрегированными белками. Образование осадка начинается со слабого помутнения, которое постепенно переходит в суспензию со взвешенными хлопьями. Процесс формирования осадка зависит от температуры, объема 'обрабатываемой жидкости, р. Н среды и может длиться от 20— 40 мин до нескольких часов. 40
После введения последней порции соли перемешивание следует продолжать еще 20— 40 мии до достижения полного равновесия между растворенными и агрегированными белками. Образование осадка начинается со слабого помутнения, которое постепенно переходит в суспензию со взвешенными хлопьями. Процесс формирования осадка зависит от температуры, объема 'обрабатываемой жидкости, р. Н среды и может длиться от 20— 40 мин до нескольких часов. 40
 Повышение температуры при высаливании благоприятствует быстрому агрегированию молекул белка в крупные хлопья, поэтому процесс ведут при 20— 30°С. При высаливании можно добиться частичного фракционирования комплекса ферментов. 41
Повышение температуры при высаливании благоприятствует быстрому агрегированию молекул белка в крупные хлопья, поэтому процесс ведут при 20— 30°С. При высаливании можно добиться частичного фракционирования комплекса ферментов. 41
 Осаждение полиэтиленгликолем u «+» малые (6 -12%) концентрации и стабилизирующее действие на белки u «-» сложность удаления (удаление ультрафильтрацией) 42
Осаждение полиэтиленгликолем u «+» малые (6 -12%) концентрации и стабилизирующее действие на белки u «-» сложность удаления (удаление ультрафильтрацией) 42
 Осаждение балластных белков методом избирательной денатурации 43
Осаждение балластных белков методом избирательной денатурации 43
 Способ хорош для термостабильных ферментов, и ферментов устойчивых к негативным факторам более, чем балластные вещества. Наиболее часто процедура сводится к прогреванию до 7080 С 44
Способ хорош для термостабильных ферментов, и ферментов устойчивых к негативным факторам более, чем балластные вещества. Наиболее часто процедура сводится к прогреванию до 7080 С 44
 Получение препаратов марки 10 х 45
Получение препаратов марки 10 х 45
 Высушивание u Распылительная сушка (не выше 40 С) u Вакуумная сушка (30 -60 С, 13 -130 Па) процесс идет около 10 часов, потери активности – 5 -6%. 46
Высушивание u Распылительная сушка (не выше 40 С) u Вакуумная сушка (30 -60 С, 13 -130 Па) процесс идет около 10 часов, потери активности – 5 -6%. 46
 Полочная сушильная камера 47
Полочная сушильная камера 47
 Общий вид вакуумной конической сушилки с перемешиванием и подогревом производства компании BOC Edwards. 48
Общий вид вакуумной конической сушилки с перемешиванием и подогревом производства компании BOC Edwards. 48
 Лиофильная (сублимационная) сушка Замораживание -50 -40 С (удаление 15% воды); u Возгонка льда до – 30. Удаление основной массы влаги. u Далее – удаление остаточной воды – 1, 5 часа при +40 С u Остаточная влажность – 6 -8% Общая продолжительность процессов – до 2 суток 49
Лиофильная (сублимационная) сушка Замораживание -50 -40 С (удаление 15% воды); u Возгонка льда до – 30. Удаление основной массы влаги. u Далее – удаление остаточной воды – 1, 5 часа при +40 С u Остаточная влажность – 6 -8% Общая продолжительность процессов – до 2 суток 49
 Общий вид лиофильной сушки BOC Edwards для лекарственных субстанций площадь стеллажей от 0, 4 до 100 м 2 50
Общий вид лиофильной сушки BOC Edwards для лекарственных субстанций площадь стеллажей от 0, 4 до 100 м 2 50
 Готовые формы ферментных препаратов u ПХ, ГХ – биомасса u П 2 Х, Г 2 х – жидкие концентраты u П 3 х, Г 3 х – сухие технические препараты u П 10 х, Г 10 х – очищенные фармпрепараты 3 х и 10 х обычно порошки 2 Х и 10 х иммобилизованые ферменты 51
Готовые формы ферментных препаратов u ПХ, ГХ – биомасса u П 2 Х, Г 2 х – жидкие концентраты u П 3 х, Г 3 х – сухие технические препараты u П 10 х, Г 10 х – очищенные фармпрепараты 3 х и 10 х обычно порошки 2 Х и 10 х иммобилизованые ферменты 51
 Стандартизация препарата производится по активности 52
Стандартизация препарата производится по активности 52
 Наполнители u Крахмал u Кизельгур u Желатин u Глина, бетонит u Хлорид натрия, калия Желательно, чтобы наполнитель был стабилизатором 53
Наполнители u Крахмал u Кизельгур u Желатин u Глина, бетонит u Хлорид натрия, калия Желательно, чтобы наполнитель был стабилизатором 53
 Измельчение сухих препаратов u Производится в шаровых мельницах до 50 -100 мкм Гранулирование препаратов u Окатывание u Прессование u Таблетирование Чаще всего – экструзия с последующим центробежным 54
Измельчение сухих препаратов u Производится в шаровых мельницах до 50 -100 мкм Гранулирование препаратов u Окатывание u Прессование u Таблетирование Чаще всего – экструзия с последующим центробежным 54
 Экструдер Leistritz Extrusionstechnik Gmb. H MICRO 27 55
Экструдер Leistritz Extrusionstechnik Gmb. H MICRO 27 55
 гранулятор 56
гранулятор 56
 Роторный таблетпресс ЗП-33 57
Роторный таблетпресс ЗП-33 57


