Полтава_280313.ppt
- Количество слайдов: 43
 • Украинская медицинская стоматологическая академия Пути достижения контроля бронхиальной астмы ГОПКО А. Ф. к. мед. н. , ассистент кафедры внутренней медицины № 1 Член ERS
• Украинская медицинская стоматологическая академия Пути достижения контроля бронхиальной астмы ГОПКО А. Ф. к. мед. н. , ассистент кафедры внутренней медицины № 1 Член ERS
 Бронхиальная астма èХроническое воспалительное заболевание дыхательных путей, в котором принимают участие многие клетки и клеточные элементы. èХроническое воспаление обусловливает развитие бронхиальной гиперреактивности, которая приводит к повторяющимся эпизодам свистящих хрипов, одышки, чувства заложенности в груди и кашля, особенно по ночам или ранним утром. èЭпизоды обычно связаны с распространенной, но изменяющейся по своей выраженности обструкцией дыхательных путей в легких, которая часто бывает обратимой либо спонтанно, либо под действием лечения.
Бронхиальная астма èХроническое воспалительное заболевание дыхательных путей, в котором принимают участие многие клетки и клеточные элементы. èХроническое воспаление обусловливает развитие бронхиальной гиперреактивности, которая приводит к повторяющимся эпизодам свистящих хрипов, одышки, чувства заложенности в груди и кашля, особенно по ночам или ранним утром. èЭпизоды обычно связаны с распространенной, но изменяющейся по своей выраженности обструкцией дыхательных путей в легких, которая часто бывает обратимой либо спонтанно, либо под действием лечения.
 Фенотипы тяжелой БА ➔пациенты с персистирующими симптомами БА и повторяющимися обострениями, несмотря на высокие дозы ИКС и ДДБА; ➔больные БА, нуждающиеся в постоянном приеме системных кортикостероидов для достижения контроля; ➔пациенты с угрожающими жизни приступами БА в анамнезе ➔мультисимптомная астма (БА требует применения бронхолитиков, сопровождается приступами удушья, характеризуется периодическим свистящим дыханием и наличием одышки при физической нагрузке и/или при вдыхании холодного воздуха (L. Ekerljung et al. , 2011).
Фенотипы тяжелой БА ➔пациенты с персистирующими симптомами БА и повторяющимися обострениями, несмотря на высокие дозы ИКС и ДДБА; ➔больные БА, нуждающиеся в постоянном приеме системных кортикостероидов для достижения контроля; ➔пациенты с угрожающими жизни приступами БА в анамнезе ➔мультисимптомная астма (БА требует применения бронхолитиков, сопровождается приступами удушья, характеризуется периодическим свистящим дыханием и наличием одышки при физической нагрузке и/или при вдыхании холодного воздуха (L. Ekerljung et al. , 2011).
 ➔Профессиональная астма – вызывается профессиональными факторами либо усугубляется из за них. Пациентам по возможности следует избегать контакта с раздражителем. ➔БА у лиц пожилого возраста характеризуется высоким риском смертности и поэтому требует пристального внимания. Плохо диагностируется. Редко назначается адекватная базисная терапия. ➔Воспалительные фенотипы БА: ➔эозинофильный (количество эозинофилов в мокроте >12, 75%); ➔нейтрофильный (количество нейтрофилов в мокроте >5165%); ➔олигогранулоцитарный (в мокроте эозинофилов <1 -2, 75% и нейтрофилов <51 -65%). ➔Воспалительный паттерн у взрослых пациентов является стабильным, даже в период обострений Simpson, 2006; Jayaram, 2006.
➔Профессиональная астма – вызывается профессиональными факторами либо усугубляется из за них. Пациентам по возможности следует избегать контакта с раздражителем. ➔БА у лиц пожилого возраста характеризуется высоким риском смертности и поэтому требует пристального внимания. Плохо диагностируется. Редко назначается адекватная базисная терапия. ➔Воспалительные фенотипы БА: ➔эозинофильный (количество эозинофилов в мокроте >12, 75%); ➔нейтрофильный (количество нейтрофилов в мокроте >5165%); ➔олигогранулоцитарный (в мокроте эозинофилов <1 -2, 75% и нейтрофилов <51 -65%). ➔Воспалительный паттерн у взрослых пациентов является стабильным, даже в период обострений Simpson, 2006; Jayaram, 2006.
 Определение контроля бронхиальной астмы Контроль астмы определяется как тот уровень уменьшения или исчезновения проявлений астмы, который может быть достигнут с помощью терапии Данное определение включает 2 компонента: Ø контроль астмы в настоящее время Ø снижение риска проявлений астмы в будущем Reddel HK, et al, ARJCCM 2009: 180: 59 -99
Определение контроля бронхиальной астмы Контроль астмы определяется как тот уровень уменьшения или исчезновения проявлений астмы, который может быть достигнут с помощью терапии Данное определение включает 2 компонента: Ø контроль астмы в настоящее время Ø снижение риска проявлений астмы в будущем Reddel HK, et al, ARJCCM 2009: 180: 59 -99
 Контроль астмы вчера (данные 2000 года) 5, 3% Только у 5, 3% пациентов астма могла расцениваться как контролируемая по критериям GINA Субоптимальный контроль Хороший контроль Rabe et al. Eur Respir J 2000; 16: 802– 807
Контроль астмы вчера (данные 2000 года) 5, 3% Только у 5, 3% пациентов астма могла расцениваться как контролируемая по критериям GINA Субоптимальный контроль Хороший контроль Rabe et al. Eur Respir J 2000; 16: 802– 807
 Контроль астмы в Европейских странах сегодня Плохой контроль, % Ситуация не изменилась с 2006 года 57 % пациентов с БА имеют плохой контроль заболевания Demoloy P. et al. Eur Respir Rev 2010; 19: 150 -7
Контроль астмы в Европейских странах сегодня Плохой контроль, % Ситуация не изменилась с 2006 года 57 % пациентов с БА имеют плохой контроль заболевания Demoloy P. et al. Eur Respir Rev 2010; 19: 150 -7
 Контроль над астмой в России Контроль над симптомами БА в зависимости от тяжести заболевания В целом контролируемая БА отмечалась у 23 % больных, частичный контроль и неконтролируемое течение заболевания – у 35 % и 42 % соответственно. Архипов В. В. и др. Пульмонология 6/2011
Контроль над астмой в России Контроль над симптомами БА в зависимости от тяжести заболевания В целом контролируемая БА отмечалась у 23 % больных, частичный контроль и неконтролируемое течение заболевания – у 35 % и 42 % соответственно. Архипов В. В. и др. Пульмонология 6/2011
 Контроль БА в Украине Количество ингаляционных препаратов, проданных в Украине в 2011 г. (упаковки) Proxima Research, 2011
Контроль БА в Украине Количество ингаляционных препаратов, проданных в Украине в 2011 г. (упаковки) Proxima Research, 2011
 Почему достижение контроля астмы имеет значение? • Пациенты с плохим контролем: – Госпитализируются приблизительно в два раза чаще, чем пациенты с хорошим контролем 1 – Имеют повышенный риск будущих обострений 2 1. GINA 2009. 2. Demoly et al. Eur Respir Rev 2010
Почему достижение контроля астмы имеет значение? • Пациенты с плохим контролем: – Госпитализируются приблизительно в два раза чаще, чем пациенты с хорошим контролем 1 – Имеют повышенный риск будущих обострений 2 1. GINA 2009. 2. Demoly et al. Eur Respir Rev 2010
 Основная причина недостаточного охвата пациентов с БА и ХОЗЛ адекватной базисной терапией в ряде регионов нашей страны – низкая приверженность к терапии, что в свою очередь в значительной степени является недоработкой врачей. Фещенко Ю. И. , Яшина Л. А. , Мостовой Ю. М. , 2012
Основная причина недостаточного охвата пациентов с БА и ХОЗЛ адекватной базисной терапией в ряде регионов нашей страны – низкая приверженность к терапии, что в свою очередь в значительной степени является недоработкой врачей. Фещенко Ю. И. , Яшина Л. А. , Мостовой Ю. М. , 2012
 Факторы, предопределяющие плохой контроль астмы Связанные с врачом: èЗапутанность существующих схем терапии 1 èНедооценка плохого контроля БА у пациента 2 èОрганизационные проблемы 1 Fitz. Gerald JM, et al. Can Resp J 2006; 13: 253– 259 2 Leuppi et al. , Curr Med Res Opin. 2006. 11: 2159 -2166
Факторы, предопределяющие плохой контроль астмы Связанные с врачом: èЗапутанность существующих схем терапии 1 èНедооценка плохого контроля БА у пациента 2 èОрганизационные проблемы 1 Fitz. Gerald JM, et al. Can Resp J 2006; 13: 253– 259 2 Leuppi et al. , Curr Med Res Opin. 2006. 11: 2159 -2166
 Лечебная тактика, выбираемая врачами, не всегда соответствует требованиям стандартов Назначения не соответствуют требованиям GINA 51, 5% 48, 5% Назначения соответствуют требованиям GINA Цой А. Н. Пульмонология 8/1/2006
Лечебная тактика, выбираемая врачами, не всегда соответствует требованиям стандартов Назначения не соответствуют требованиям GINA 51, 5% 48, 5% Назначения соответствуют требованиям GINA Цой А. Н. Пульмонология 8/1/2006
 Врачи часто недооценивают плохой контроль БА Leuppi et al. , Curr Med Res Opin. 2006. 11: 2159 -2166
Врачи часто недооценивают плохой контроль БА Leuppi et al. , Curr Med Res Opin. 2006. 11: 2159 -2166
 http: //www. explosm. net/comics/2253/
http: //www. explosm. net/comics/2253/
 Проблема контроля БА – не эффективность действия ИГКС, а правильность их применения и приверженность терапии Milgrom H et al, 2002
Проблема контроля БА – не эффективность действия ИГКС, а правильность их применения и приверженность терапии Milgrom H et al, 2002
 Факторы плохого комплаенса (GINA, 2010) Медикаментозные Сложности использования ингаляторов Немедикаментозные Недопонимание/недостаточно информации Страх возникновения побочных эффектов Стоимость Несоответствующие ожидания Сложности приобретения лекарства Недооценка тяжести своего состояния Отношение к болезни Культуральные факторы Плохая коммуникация Сложный режим приема Побочные эффекты
Факторы плохого комплаенса (GINA, 2010) Медикаментозные Сложности использования ингаляторов Немедикаментозные Недопонимание/недостаточно информации Страх возникновения побочных эффектов Стоимость Несоответствующие ожидания Сложности приобретения лекарства Недооценка тяжести своего состояния Отношение к болезни Культуральные факторы Плохая коммуникация Сложный режим приема Побочные эффекты
 Факторы, предопределяющие плохой контроль астмы Связанные с пациентом: ➔Чрезмерное использование препаратов для купирования симптомов 1 ➔Низкая приверженность к поддерживающей терапии 1 ➔Переоценка своего состояния 3 ➔Отсутствие/не ведение пациентом дневника лечения 4 ➔Неправильная техника ингаляции 4 Дополнительные факторы: используемые для лечения БА медикаменты, история курения, возраст, ИМТ 1 Fitz. Gerald JM, et al. Can Resp J 2006; 13: 253– 259 2 Rabe KF, et al. Eur Respir J 2000; 16: 802– 807 3 Partridge MR, et al. BMC Pulm Med 2006; 6: 13 4 Sims JS Allergy Asthma Immunol Res. 2011; Oct 3(4): 217 -225
Факторы, предопределяющие плохой контроль астмы Связанные с пациентом: ➔Чрезмерное использование препаратов для купирования симптомов 1 ➔Низкая приверженность к поддерживающей терапии 1 ➔Переоценка своего состояния 3 ➔Отсутствие/не ведение пациентом дневника лечения 4 ➔Неправильная техника ингаляции 4 Дополнительные факторы: используемые для лечения БА медикаменты, история курения, возраст, ИМТ 1 Fitz. Gerald JM, et al. Can Resp J 2006; 13: 253– 259 2 Rabe KF, et al. Eur Respir J 2000; 16: 802– 807 3 Partridge MR, et al. BMC Pulm Med 2006; 6: 13 4 Sims JS Allergy Asthma Immunol Res. 2011; Oct 3(4): 217 -225
 Чрезмерное использование препаратов для купирования симптомов Использование БАКД и ИКС в зависимости от тяжести симптомов Противовоспалительный препарат (ИКС) Пациенты, использующие препарат (%) Препарат скорой помощи (БАКД) 90 81% 80 75% 76% 70 63% 60 50 44% 40 30 26% 23% 26% 30% 18% 20 10 0 Всего в исслед. AIRE Тяжелая Средней тяжести персистирующая астма AIRE, Asthma Insights and Reality in Europe Интермиттирующая Легкая персистирующая астма Rabe KF, et al. Eur Respir J 2000; 16: 802– 807.
Чрезмерное использование препаратов для купирования симптомов Использование БАКД и ИКС в зависимости от тяжести симптомов Противовоспалительный препарат (ИКС) Пациенты, использующие препарат (%) Препарат скорой помощи (БАКД) 90 81% 80 75% 76% 70 63% 60 50 44% 40 30 26% 23% 26% 30% 18% 20 10 0 Всего в исслед. AIRE Тяжелая Средней тяжести персистирующая астма AIRE, Asthma Insights and Reality in Europe Интермиттирующая Легкая персистирующая астма Rabe KF, et al. Eur Respir J 2000; 16: 802– 807.
 Пациенты переоценивают уровень контроля своего заболевания 55% пациентов с неконтролируемой бронхиальной астмой оценивают свой контроль как относительно хороший Partrige MR et al. BMC Pulm Med. 2006; 6: 13
Пациенты переоценивают уровень контроля своего заболевания 55% пациентов с неконтролируемой бронхиальной астмой оценивают свой контроль как относительно хороший Partrige MR et al. BMC Pulm Med. 2006; 6: 13
 ВСЕГО 2 ПРОСТЫХ ШАГА МОГУТ УЛУЧШИТЬ КОНТРОЛЬ НАД АСТМОЙ: 1. Заподозрить отсутствие контроля по расходу средств «спасательной терапии» (ЕСЛИ ПАЦИЕНТ ПРИМЕНЯЕТ СКОРОПОМОЩНЫЕ СРЕДСТВА ЧАЩЕ ДВУХ РАЗ В НЕДЕЛЮ ) 2. Подтвердить отсутствие контроля (Если показатель АСТ менее 20 – составляйте план по улучшению контроля над астмой) GINA 2007 (www. ginasthma. org); Nathan R et al. J Allergy Clin Immunol 2004; 113: 59– 65
ВСЕГО 2 ПРОСТЫХ ШАГА МОГУТ УЛУЧШИТЬ КОНТРОЛЬ НАД АСТМОЙ: 1. Заподозрить отсутствие контроля по расходу средств «спасательной терапии» (ЕСЛИ ПАЦИЕНТ ПРИМЕНЯЕТ СКОРОПОМОЩНЫЕ СРЕДСТВА ЧАЩЕ ДВУХ РАЗ В НЕДЕЛЮ ) 2. Подтвердить отсутствие контроля (Если показатель АСТ менее 20 – составляйте план по улучшению контроля над астмой) GINA 2007 (www. ginasthma. org); Nathan R et al. J Allergy Clin Immunol 2004; 113: 59– 65
 GINA 2011: уровни контроля симптомов Параметры, по которым оценивается контроль над БА Уровень контроля Контроль Частичный контроль Симптомы днем НЕТ (≤ 2 в нед) > 2 раз в нед Ограничение активности НЕТ ЛЮБОЕ Симптомы ночью / пробуждения НЕТ ЛЮБЫЕ Потребность в ингаляциях бронхолитиков НЕТ (≤ 2 в нед) > 2 раз в нед Спирометрия (ОФВ 1 или ПСВ) НОРМА Отсутствие контроля Три и более признака частичного контроля в любую неделю <80% от должного Global Initiative for Asthma. Global strategy for asthma management
GINA 2011: уровни контроля симптомов Параметры, по которым оценивается контроль над БА Уровень контроля Контроль Частичный контроль Симптомы днем НЕТ (≤ 2 в нед) > 2 раз в нед Ограничение активности НЕТ ЛЮБОЕ Симптомы ночью / пробуждения НЕТ ЛЮБЫЕ Потребность в ингаляциях бронхолитиков НЕТ (≤ 2 в нед) > 2 раз в нед Спирометрия (ОФВ 1 или ПСВ) НОРМА Отсутствие контроля Три и более признака частичного контроля в любую неделю <80% от должного Global Initiative for Asthma. Global strategy for asthma management
 Комплаенс - взаимопонимания врача и пациента è благожелательная манера поведения (дружелюбие, юмор и внимательное отношение); èвовлечение пациента в диалог; èодобрение и ободрение пациента; èсочувственное отношение к тревожащим пациента проблемам, их обсуждение с целью устранения тревоги; èпредоставление информации, необходимой конкретному пациенту; èустановление общих целей; èобратная связь и проверка
Комплаенс - взаимопонимания врача и пациента è благожелательная манера поведения (дружелюбие, юмор и внимательное отношение); èвовлечение пациента в диалог; èодобрение и ободрение пациента; èсочувственное отношение к тревожащим пациента проблемам, их обсуждение с целью устранения тревоги; èпредоставление информации, необходимой конкретному пациенту; èустановление общих целей; èобратная связь и проверка
 Лечение астмы – непрерывный процесс, необходимый для поддержания контроля
Лечение астмы – непрерывный процесс, необходимый для поддержания контроля
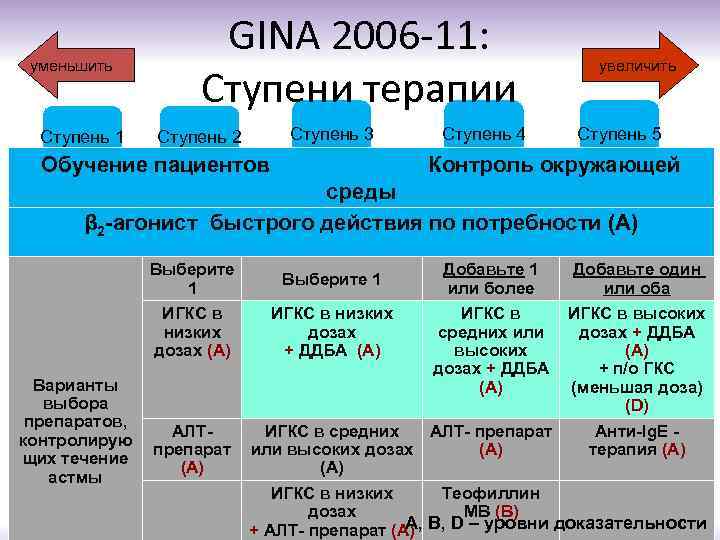 уменьшить Ступень 1 GINA 2006 -11: Ступени терапии Ступень 3 Ступень 2 Обучение пациентов Ступень 4 увеличить Ступень 5 Контроль окружающей среды β 2 -агонист быстрого действия по потребности (А) Выберите 1 ИГКС в низких дозах (А) Варианты выбора препаратов, контролирую щих течение астмы Выберите 1 ИГКС в низких дозах + ДДБA (А) АЛТпрепарат (А) Добавьте 1 или более Добавьте один или оба ИГКС в средних или высоких дозах + ДДБA (А) ИГКС в высоких дозах + ДДБA (А) + п/о ГКС (меньшая доза) (D) ИГКС в средних АЛТ- препарат или высоких дозах (А) Анти-Ig. E терапия (А) ИГКС в низких Теофиллин дозах МВ (В) A, B, D – уровни доказательности + АЛТ- препарат (А)
уменьшить Ступень 1 GINA 2006 -11: Ступени терапии Ступень 3 Ступень 2 Обучение пациентов Ступень 4 увеличить Ступень 5 Контроль окружающей среды β 2 -агонист быстрого действия по потребности (А) Выберите 1 ИГКС в низких дозах (А) Варианты выбора препаратов, контролирую щих течение астмы Выберите 1 ИГКС в низких дозах + ДДБA (А) АЛТпрепарат (А) Добавьте 1 или более Добавьте один или оба ИГКС в средних или высоких дозах + ДДБA (А) ИГКС в высоких дозах + ДДБA (А) + п/о ГКС (меньшая доза) (D) ИГКС в средних АЛТ- препарат или высоких дозах (А) Анти-Ig. E терапия (А) ИГКС в низких Теофиллин дозах МВ (В) A, B, D – уровни доказательности + АЛТ- препарат (А)
 Терапевтический подход к достижению контроля: как правильно выбрать тактику?
Терапевтический подход к достижению контроля: как правильно выбрать тактику?
 Алгоритм ведения пациентов с тяжелой БА предполагает: èтщательно собранный анамнез; èклиническое обследование; èопределение прогноза течения заболевания; èобследование функции легких; èопределение типа бронхообструкции; èморфологическое и морфометрическое исследование; èопределение триггеров; èдиагностика сопутствующих заболеваний.
Алгоритм ведения пациентов с тяжелой БА предполагает: èтщательно собранный анамнез; èклиническое обследование; èопределение прогноза течения заболевания; èобследование функции легких; èопределение типа бронхообструкции; èморфологическое и морфометрическое исследование; èопределение триггеров; èдиагностика сопутствующих заболеваний.
 Лекарственные препараты для лечения БА НЕОТЛОЖНАЯ ПОМОЩЬ бета-2 -агонисты короткого действия (сальбутамол, фенотерол), холинолитики короткого действия (ипратропий), комбинированные (беродуал) БАЗИСНАЯ ТЕРАПИЯ бета-2 -агонисты длительного действия + ингаляционные глюкокортикостероиды
Лекарственные препараты для лечения БА НЕОТЛОЖНАЯ ПОМОЩЬ бета-2 -агонисты короткого действия (сальбутамол, фенотерол), холинолитики короткого действия (ипратропий), комбинированные (беродуал) БАЗИСНАЯ ТЕРАПИЯ бета-2 -агонисты длительного действия + ингаляционные глюкокортикостероиды
 Почему комбинированные препараты – наиболее эффективная тактика достижения контроля?
Почему комбинированные препараты – наиболее эффективная тактика достижения контроля?
 Почему САЛ/ФЛУ? ➔ b 2 -Агонисты расслабляют гладкую мускулатуру дыхательных путей ➔ препятствуют освобождению медиаторов воспаления из тучных клеток, экссудации плазмы крови и угнетают активацию сенсорных нервных окончаний ➔ Салметерол усиливает действие и. ГКС — повышает плотность кортикостероидных рецепторов в ядре, а также увеличивать сродство флутиказона к рецепторным участкам ДНК - усиление противовоспалительного эффекта ➔ Салметерол усиливает способность флутиказона подавлять синтез интерлейкинов в периферических мононуклеарах, оказывающих провоспалительное действие. ➔ Угнетает образование молекул межклеточной адгезии (ICAM-1) в фибробластах, которые играют важную роль в воспалительном процессе
Почему САЛ/ФЛУ? ➔ b 2 -Агонисты расслабляют гладкую мускулатуру дыхательных путей ➔ препятствуют освобождению медиаторов воспаления из тучных клеток, экссудации плазмы крови и угнетают активацию сенсорных нервных окончаний ➔ Салметерол усиливает действие и. ГКС — повышает плотность кортикостероидных рецепторов в ядре, а также увеличивать сродство флутиказона к рецепторным участкам ДНК - усиление противовоспалительного эффекта ➔ Салметерол усиливает способность флутиказона подавлять синтез интерлейкинов в периферических мононуклеарах, оказывающих провоспалительное действие. ➔ Угнетает образование молекул межклеточной адгезии (ICAM-1) в фибробластах, которые играют важную роль в воспалительном процессе
 Влияние кортикостероидов на различные клеточные элементы Клетки воспаления ¯ количества (апоптоз) Структурные клеточные элементы Эозинофил Эпителиальные клетки цитокинов медиаторов Т-лимфоцит цитокинов Клетки эндотелия Кортикостероиды Тучная клетка количества проницаемости Гладкомышечные клетки дыхательных путей Макрофаг β 2 -рецепторов цитокинов Слизистые железы Дендритные клетки секреция слизи количества Barnes PJ & Adcock IM. Ann Intern Med 2003; 139: 359– 370.
Влияние кортикостероидов на различные клеточные элементы Клетки воспаления ¯ количества (апоптоз) Структурные клеточные элементы Эозинофил Эпителиальные клетки цитокинов медиаторов Т-лимфоцит цитокинов Клетки эндотелия Кортикостероиды Тучная клетка количества проницаемости Гладкомышечные клетки дыхательных путей Макрофаг β 2 -рецепторов цитокинов Слизистые железы Дендритные клетки секреция слизи количества Barnes PJ & Adcock IM. Ann Intern Med 2003; 139: 359– 370.
 Синергизм действия сальметерола и флютиказона пропионата флютиказона пропионат неактивный рецептор взаимодействие с фактором транскрипции сальметерол активный неактивный рецептор предактивированный белок 2 -рецептора противовоспалите льная активность
Синергизм действия сальметерола и флютиказона пропионата флютиказона пропионат неактивный рецептор взаимодействие с фактором транскрипции сальметерол активный неактивный рецептор предактивированный белок 2 -рецептора противовоспалите льная активность
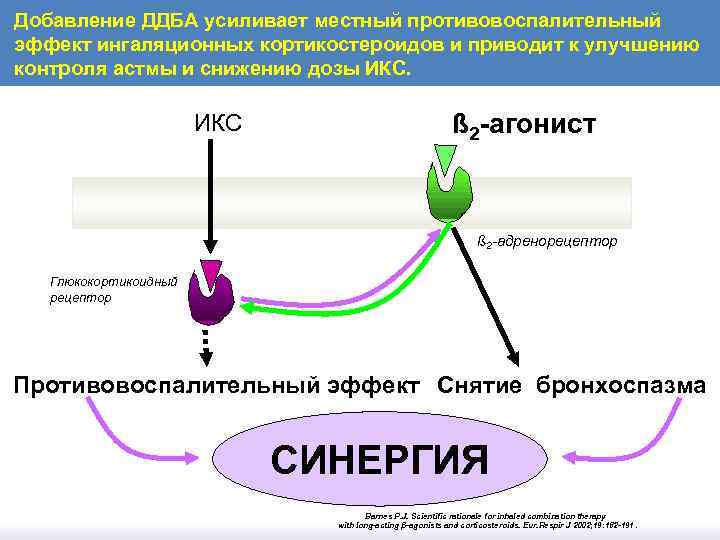 Добавление ДДБА усиливает местный противовоспалительный эффект ингаляционных кортикостероидов и приводит к улучшению контроля астмы и снижению дозы ИКС ß 2 -агонист ß 2 -адренорецептор Глюкокортикоидный рецептор Противовоспалительный эффект Снятие бронхоспазма СИНЕРГИЯ Barnes P. J. Scientific rationale for inhaled combination therapy with long-acting β-agonists and corticosteroids. Eur. Respir J 2002; 19: 182 -191.
Добавление ДДБА усиливает местный противовоспалительный эффект ингаляционных кортикостероидов и приводит к улучшению контроля астмы и снижению дозы ИКС ß 2 -агонист ß 2 -адренорецептор Глюкокортикоидный рецептор Противовоспалительный эффект Снятие бронхоспазма СИНЕРГИЯ Barnes P. J. Scientific rationale for inhaled combination therapy with long-acting β-agonists and corticosteroids. Eur. Respir J 2002; 19: 182 -191.
 СЕРЕТИД – механизмы действия Уменьшение фиброза и пролиферации фибробластов Стимуляция мукоцилиарного клиренса, уменьшение мукозного повреждения Муко-цилиарная дисфункция Уменьшение клеток и медиаторов воспаления Уменьшение количества моноцитов и нейтрофилов Структурные изменения Расслабление мускулатуры бронхов Воспаление Системный компонент Затруднение движения воздуха
СЕРЕТИД – механизмы действия Уменьшение фиброза и пролиферации фибробластов Стимуляция мукоцилиарного клиренса, уменьшение мукозного повреждения Муко-цилиарная дисфункция Уменьшение клеток и медиаторов воспаления Уменьшение количества моноцитов и нейтрофилов Структурные изменения Расслабление мускулатуры бронхов Воспаление Системный компонент Затруднение движения воздуха
 Преимущества сочетания ИКС и 2 агониста длительного действия в одном ингаляторе ► комплиментарное действие на молекулярном уровне ► более легкое и глубокое проникновение комбинации в дыхательные пути ► контроль БА на низших дозах ИКС ► уверенность в том, что не прекращается прием ИКС когда применяется бронходилятатор ► более удобно в использовании Barnes P. J. Scientific rationale for inhaled combination therapy with long-acting β-agonists and corticosteroids. Eur. Respir J 2002; 19: 182 -191.
Преимущества сочетания ИКС и 2 агониста длительного действия в одном ингаляторе ► комплиментарное действие на молекулярном уровне ► более легкое и глубокое проникновение комбинации в дыхательные пути ► контроль БА на низших дозах ИКС ► уверенность в том, что не прекращается прием ИКС когда применяется бронходилятатор ► более удобно в использовании Barnes P. J. Scientific rationale for inhaled combination therapy with long-acting β-agonists and corticosteroids. Eur. Respir J 2002; 19: 182 -191.
 Геометрическое среднее концентрации кортизола в сыворотке крови (н. М/л) Сальметерол/флютиказона пропионат: не выявлено значимого влияния на уровень кортизола в сыворотке крови Серетид 50/500 мкг дважды в день Комбинированная терапия ФП и сальмет. 500 флютиказона пропионат 500 мкг дважды в день 400 300 20 0 100 0 Исходно Неделя 12 Неделя 28 Нижний предел нормального значения Aubier et al. Resp Med 1999; 93: 876
Геометрическое среднее концентрации кортизола в сыворотке крови (н. М/л) Сальметерол/флютиказона пропионат: не выявлено значимого влияния на уровень кортизола в сыворотке крови Серетид 50/500 мкг дважды в день Комбинированная терапия ФП и сальмет. 500 флютиказона пропионат 500 мкг дважды в день 400 300 20 0 100 0 Исходно Неделя 12 Неделя 28 Нижний предел нормального значения Aubier et al. Resp Med 1999; 93: 876
 ТЕХНИКА ИНГАЛЯЦИЙ: РАСПРОСТРАНЕННЫЕ ОШИБКИ èСлишком быстрый вдох – 64% пациентов; èОтсутствие координации старта ингаляции и вдоха – 57%; èСлишком быстрая ингаляция следующей дозы – 46%; èОтсутствие встряхивания ингалятора – 43%; èОтсутствие задержки дыхания на вдохе – 43%; èНеправильное положение ингалятора – 29% èНе снимают колпачок при ингаляции – 7%
ТЕХНИКА ИНГАЛЯЦИЙ: РАСПРОСТРАНЕННЫЕ ОШИБКИ èСлишком быстрый вдох – 64% пациентов; èОтсутствие координации старта ингаляции и вдоха – 57%; èСлишком быстрая ингаляция следующей дозы – 46%; èОтсутствие встряхивания ингалятора – 43%; èОтсутствие задержки дыхания на вдохе – 43%; èНеправильное положение ингалятора – 29% èНе снимают колпачок при ингаляции – 7%
 «Идеальный» ингалятор èУдобен для пациента èМульти-дозовый, с индикатором доз èБезопасен для окружающей среды è 100% легочная депозиция èНе зависит от скорости вдоха èНебольшого размера èДешевый èкрасивый
«Идеальный» ингалятор èУдобен для пациента èМульти-дозовый, с индикатором доз èБезопасен для окружающей среды è 100% легочная депозиция èНе зависит от скорости вдоха èНебольшого размера èДешевый èкрасивый
 Эволюция доставочных устройств V поколение – Airmax (Аэрмакс), порошковый ингалятор, активируемый вдохом со счётчиком доз IV поколение (90 -е годы): BOI (Breathe Operated Inhaler) – дозированный аэрозоль, активируемый вдохом: Easi-Breathe – Лёгкое Дыхание III поколение (80 -е годы): DPI (Dry Powder Inhaler) - сухопорошковый ингалятор, активируемый вдохом, мультидозовый: Diskhaler (1985), Turbohaler (1989), Diskus (Accuhaler) II поколение (70 -е годы): DPI (Dry Powder Inhaler) - сухопорошковый ингалятор, активируемый вдохом, однодозовый: Rotahaler, Spinhaler I поколение 1956: p. MDI (pressurized Metered Dose Inhaler) - стандартный дозированный ингалятор под давлением
Эволюция доставочных устройств V поколение – Airmax (Аэрмакс), порошковый ингалятор, активируемый вдохом со счётчиком доз IV поколение (90 -е годы): BOI (Breathe Operated Inhaler) – дозированный аэрозоль, активируемый вдохом: Easi-Breathe – Лёгкое Дыхание III поколение (80 -е годы): DPI (Dry Powder Inhaler) - сухопорошковый ингалятор, активируемый вдохом, мультидозовый: Diskhaler (1985), Turbohaler (1989), Diskus (Accuhaler) II поколение (70 -е годы): DPI (Dry Powder Inhaler) - сухопорошковый ингалятор, активируемый вдохом, однодозовый: Rotahaler, Spinhaler I поколение 1956: p. MDI (pressurized Metered Dose Inhaler) - стандартный дозированный ингалятор под давлением
 Доставочные устройства (1 -е поколение) Дозированные ингаляторы под давлением • • • Pressurised Metered Doses Inhaler (p. MDI) 1956 г. – создание первого p. MDI. Были заполнены неселективными β 2 -агонистами (астмопент, алупент). конец 60 гг. – предпринята попытка наполнить ингалятор глюкокортикоидами (преднизолон, гидрокортизон) начало 70 -х гг. – открытие бекламетазона дипропионата, первого жирорастворимого ГКС Недостатки p. MDI: • • • турбулентное движение частиц, что приводит к оседанию большого количества ЛВ* на слизистой ВДП** разнодисперсные смеси, крупные частицы оседают в просвете бронхов и адсорбируют мелкие, низкий процент дохождения до мелких бронхов лечебная эффективность зависит от атмосферных условий и снижается при повышенной влажности и похолодании * – лекарственное вещество, ** - верхние дыхательные пути
Доставочные устройства (1 -е поколение) Дозированные ингаляторы под давлением • • • Pressurised Metered Doses Inhaler (p. MDI) 1956 г. – создание первого p. MDI. Были заполнены неселективными β 2 -агонистами (астмопент, алупент). конец 60 гг. – предпринята попытка наполнить ингалятор глюкокортикоидами (преднизолон, гидрокортизон) начало 70 -х гг. – открытие бекламетазона дипропионата, первого жирорастворимого ГКС Недостатки p. MDI: • • • турбулентное движение частиц, что приводит к оседанию большого количества ЛВ* на слизистой ВДП** разнодисперсные смеси, крупные частицы оседают в просвете бронхов и адсорбируют мелкие, низкий процент дохождения до мелких бронхов лечебная эффективность зависит от атмосферных условий и снижается при повышенной влажности и похолодании * – лекарственное вещество, ** - верхние дыхательные пути
 Дополнительные устройства к ингаляторам 1 2 3 Спейсеры устройства, позволяющие решить ряд проблем, связанных с применением аэрозолей: • спейсер, присоединённый к ингалятору, преобразовывает турбулентное движение частиц в ламинарное • крупнодисперсные частицы оседают на стенках насадки Виды спейсеров 1. Волюматик – «Volumatic Spacer Device» . Предназначено для введения в ДП* высоких доз инг. КС**. GSK, зарегистриован в 1999 г. 2. Бебихалер – «Babyhaler» . GSK, зарегистрирован в 2000 г. Клапанный спейсер с маской, используется для детей от 1 мес до 5 лет. 3. Оптимайзер - спейсер среднего размера, идёт в комплекте с «Лёгким Дыханием» компании «Айвекс» . * -дыхательные пути, ** - ингаляционные кортикостпероиды
Дополнительные устройства к ингаляторам 1 2 3 Спейсеры устройства, позволяющие решить ряд проблем, связанных с применением аэрозолей: • спейсер, присоединённый к ингалятору, преобразовывает турбулентное движение частиц в ламинарное • крупнодисперсные частицы оседают на стенках насадки Виды спейсеров 1. Волюматик – «Volumatic Spacer Device» . Предназначено для введения в ДП* высоких доз инг. КС**. GSK, зарегистриован в 1999 г. 2. Бебихалер – «Babyhaler» . GSK, зарегистрирован в 2000 г. Клапанный спейсер с маской, используется для детей от 1 мес до 5 лет. 3. Оптимайзер - спейсер среднего размера, идёт в комплекте с «Лёгким Дыханием» компании «Айвекс» . * -дыхательные пути, ** - ингаляционные кортикостпероиды
 Сухопорошковые ингалятор (2 -3 -е поколения доставочных устройств) • 1959 – первый сухопорошковы ингалятор – спинхалер Сухопорошковые устройства. й 1 поколение 2 поколение 3 поколение Спинхалер Ротахелер Турбухалер Циклохалер Аутохалер Дискус Изихейлер • наиболее известен в мире – турбохалер и дискус Принцип работы: воздушный поток, который образуется во время вдоха, втягивает в ДП порошковую пудру из капсулы, предварительно проколотой спец. иголкой Недостатки: • нужен сильный побуждающий поток (мощный вдох) • отличаются по форме от привычных ингаляторов • порошок может вызывать кашель • возможна повышенная чувствительность к порошку
Сухопорошковые ингалятор (2 -3 -е поколения доставочных устройств) • 1959 – первый сухопорошковы ингалятор – спинхалер Сухопорошковые устройства. й 1 поколение 2 поколение 3 поколение Спинхалер Ротахелер Турбухалер Циклохалер Аутохалер Дискус Изихейлер • наиболее известен в мире – турбохалер и дискус Принцип работы: воздушный поток, который образуется во время вдоха, втягивает в ДП порошковую пудру из капсулы, предварительно проколотой спец. иголкой Недостатки: • нужен сильный побуждающий поток (мощный вдох) • отличаются по форме от привычных ингаляторов • порошок может вызывать кашель • возможна повышенная чувствительность к порошку
 Цена – один из ведущий факторов, определяющих приверженность лечению БЕСПРЕЦЕДЕНТНАЯ ПРОГРАММА В УКРАИНЕ
Цена – один из ведущий факторов, определяющих приверженность лечению БЕСПРЕЦЕДЕНТНАЯ ПРОГРАММА В УКРАИНЕ


