Углеводы.pptx
- Количество слайдов: 17

Углеводы
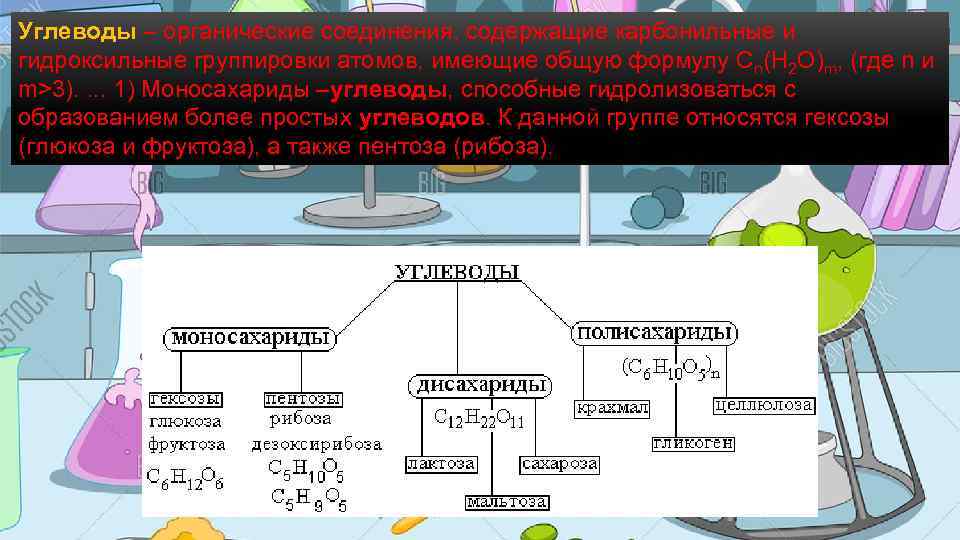
Углеводы – органические соединения, содержащие карбонильные и гидроксильные группировки атомов, имеющие общую формулу Cn(H 2 O)m, (где n и m>3). . 1) Моносахариды –углеводы, способные гидролизоваться с образованием более простых углеводов. К данной группе относятся гексозы (глюкоза и фруктоза), а также пентоза (рибоза).

В циклической форме альдозы (в отличие от ациклической) имеется хиральный центр С 1, несущий полуацетальный гидроксил. Соответствующие энантиомерные формы называются аномерами. В β-аномерах (слева на схеме А) ОН-группа при С-1 (аномерная) и CH 2 OH-группа (С-6) располагаются над плоскостью кольца, а в αаномерах (справа на схеме А) — по разные стороны кольца. Переход аномеров из одной формы в другую носит название мутаротация Образование гликозидов. Конденсации аномерной ОН-грулпы со спиртовой группировкой с отщеплением молекулы воды приводит к образованию О-гликозида (в данном случае α-метил глюкозида). Олиго- и полисахариды построены за счет образования О-гликозидных связей. При взаимодействии аномерной ОН-грулпы с NН 2 -группой образуется Nгликозид. N-Гликозидная связь присутствует, например, в нуклеотидах (см. с. 86) и гликопротеинах (см. с. 50).
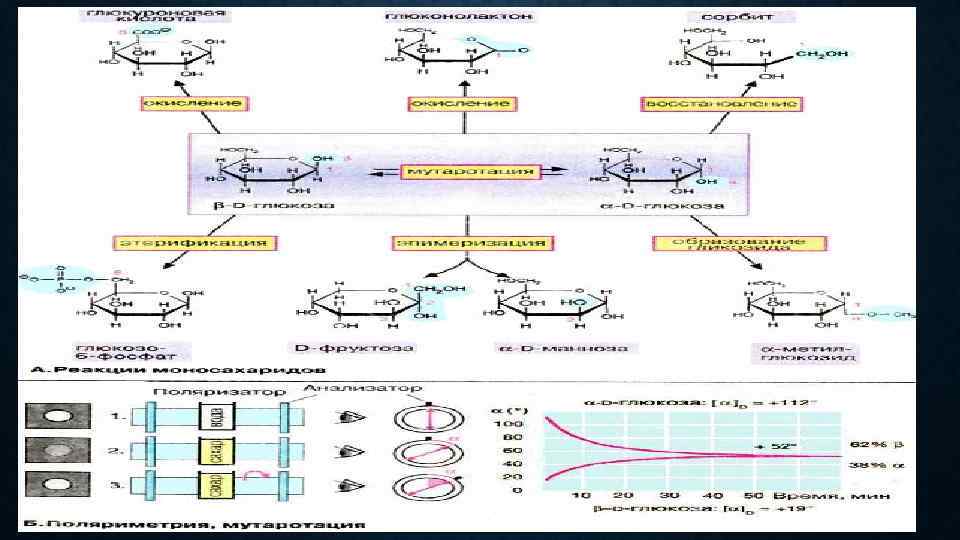

Восстановление и окисление. Восстановление аномерного центра С 1 приводит к образованию сахароспирта сорбита. Путем окисления альдегидной группы при C-1 получают лактон гликоновой кислоты (в общем случае — лактон гликоновой кислоты). При окислении С-6 образуется глюкуроновая кислота (в общем случае — гликуроновая кислота). Глюкуроновая кислота играет важную роль в процессах биотрансформации в печени Эпимеризация. В слабощелочном растворе D-глюкоза находится в равновесии с кетогексозой, D-фруктозой, и альдогексозой, D-маннозой. Глюкоза и манноза различаются конфигурацией при С-2. Такие пары сахаров называются зпимерами, а процесс их взаимопревращения — эпимеризацией.

Для анализа углеводов в растворе используется метод поляриметрии, который основан на свойстве оптически активных вещесгв взаимодействовать с поляризованным светом. В поляриметре луч от источника света проходит через два последовательно установленных фильтра — неподвижный, поляризатор, и вращаемый, анализатор. Оба поляризующих фильтра находятся в одной фазе и беспрепятственно пропускают поляризованный свет. Две части поля анализатора выглядят при этом максимально освещенными (1). Оптически активные вещества обладают свойством вращать плоскость поляризованного света вправо или влево на угол α. Если раствор такого вещества поместить между двумя фильтрами, рабочее поле анализатора темнеет (2). Вращением анализатора устанавливают равенство освещенности двух частей поля (3), угол поворота анализатора отсчитывают по лимбу. Измеряемый угол вращения и зависит от типа хирального соединения, его концентрации и толщины слоя раствора (длины поляриметрической трубки). Полученный при измерении угол α пересчитывается на удельное или на молекулярное вращение, соответственно [α] или [M].

сахароза (обычный пищевой сахар), которая при гидролизе образует одну молекулу глюкозы и молекулу фруктозы. Она содержится в большом количестве в сахарной свекле, сахарном тростнике (отсюда и названия — свекловичный или тростниковый сахар), клене (канадские первопроходцы добывали кленовый сахар), сахарной пальме, кукурузе и т. д. ;

мальтоза (солодовый сахар), которая гидролизуется с образованием двух молекул глюкозы. Мальтозу можно получить при гидролизе крахмала под действием ферментов, содержащихся в солоде, — пророщенных, высушенных и размолотых зернах ячменя;

лактоза (молочный сахар), которая гидролизуется с образованием молекулы глюкозы и галактозы. Она содержится в молоке млекопитающих (до 4— 6%), обладает невысокой сладостью и используется как наполнитель в драже и аптечных таблетках.

Кроме того, углеводы участвуют в построении сложных белков, ферментов, гормонов. Углеводами являются и такие жизненно необходимые вещества, как гепарин (он играет важнейшую роль — предотвращает свертывание крови), агар-агар (его получают из морских водорослей и применяют в микробиологической и кондитерской промышленности — вспомните знаменитый торт «Птичье молоко» ).

Циклические (полуацетальные) формы моносахаридов (формулы Толленса). Любой из моносахаридов, обладая рядом конкретных физических свойств (температура плавления, растворимость и т. д. ), характеризуется специфической величиной удельного вращения [α]20 D. Установлено, что величина удельного вращения при растворении любого моносахарида постепенно меняется и лишь при длительном стоянии раствора достигает вполне определенного значения. Так, например, свежеприготовленный раствор глюкозы имеет [α]20 D = + 112, 2°, которое после длительного стояния достигает равновесного значения [α]20 D = + 52, 5°. Изменение удельного вращения растворов моносахаридов при стоянии (во времени) называется мутаротацией. Очевидно, мутаротация должна вызываться изменением асимметрии молекулы, а следовательно, трансформацией ее структуры в растворе. Явление мутаротации имеет следующее объяснение. Известно, что альдегиды и кетоны легко и обратимо реагируют с эквимолярным количеством спирта с образованием полуацеталей: Удельное вращение [α]20 D - угол поворота плоскости поляризованного луча света при прохождении через кювету толщиной 1 см с раствором вещества, имеющего концентрацию 1 моль/л. При определенной температуре, растворителе и длине волны проходящего света величина удельного вращения определяется только природой растворенного вещества.
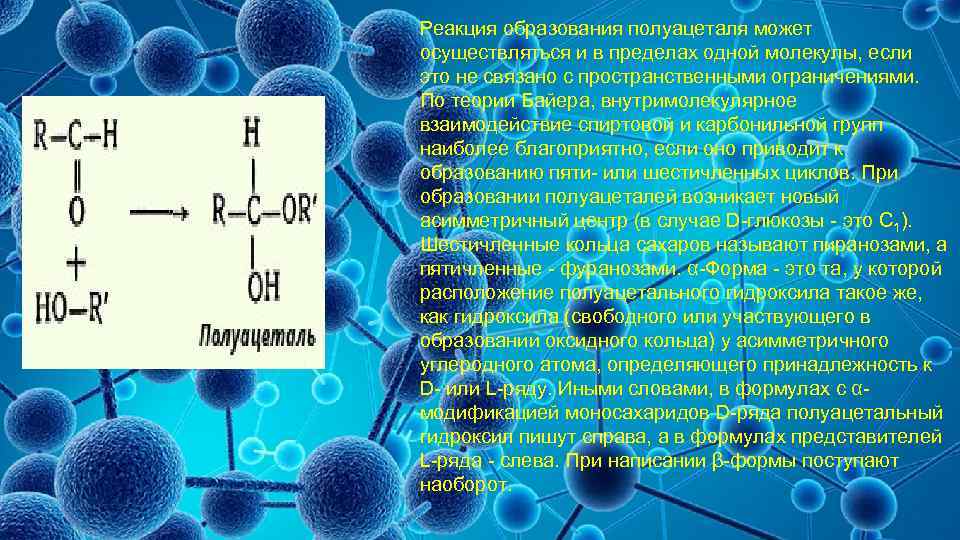
Реакция образования полуацеталя может осуществляться и в пределах одной молекулы, если это не связано с пространственными ограничениями. По теории Байера, внутримолекулярное взаимодействие спиртовой и карбонильной групп наиболее благоприятно, если оно приводит к образованию пяти- или шестичленных циклов. При образовании полуацеталей возникает новый асимметричный центр (в случае D-глюкозы - это C 1). Шестичленные кольца сахаров называют пиранозами, а пятичленные - фуранозами. α-Форма - это та, у которой расположение полуацетального гидроксила такое же, как гидроксила (свободного или участвующего в образовании оксидного кольца) у асимметричного углеродного атома, определяющего принадлежность к D- или L-ряду. Иными словами, в формулах с αмодификацией моносахаридов D-ряда полуацетальный гидроксил пишут справа, а в формулах представителей L-ряда - слева. При написании β-формы поступают наоборот.
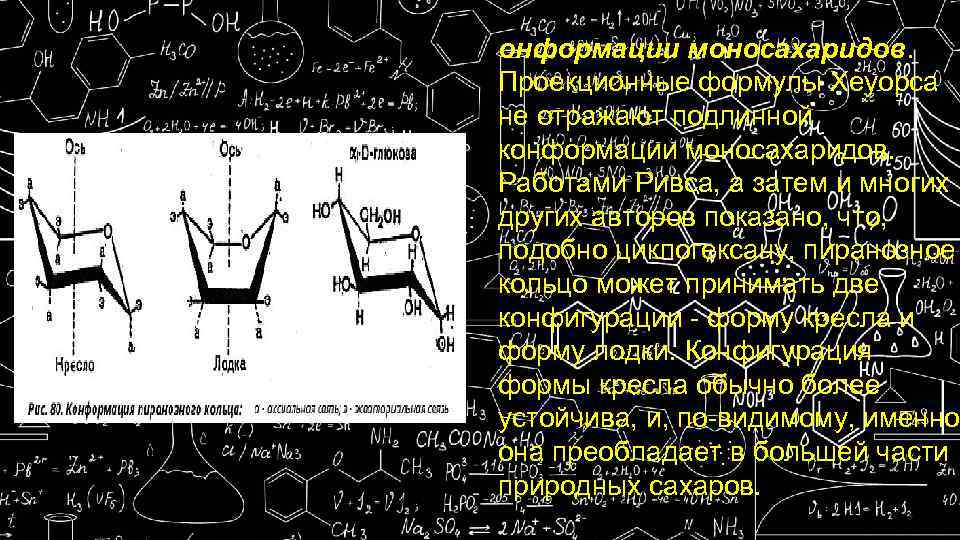
онформации моносахаридов. Проекционные формулы Хеуорса не отражают подлинной конформации моносахаридов. Работами Ривса, а затем и многих других авторов показано, что, подобно циклогексану, пиранозное кольцо может принимать две конфигурации - форму кресла и форму лодки. Конфигурация формы кресла обычно более устойчива, и, по-видимому, именно она преобладает в большей части природных сахаров.

Обработка альдоз слабыми окислителями (например, гипойодидом натрия) приводит к превращению альдегидной группы при С 1 в карбоксильную группу с образованием так называемых альдоновых кислот. Примером альдоновых кислот может быть D-глюконовая кислота, которая образуется при окислении альдегидной группы D-глюкозы. Фосфорилированная форма D-глюконовой кислоты играет важную роль в качестве промежуточного продукта углеводного обмена. Другим примером может быть D-галактоновая кислота - продукт окисления альдегидной группы D-галактозы:

Другой класс сахарных кислот называется альдуроновыми, или уроновыми кислотами. В уроновых кислотах окислена (с образованием карбоксильной группы) первичная спиртовая группа, а альдегидная группа остается неокисленной. Уроновая кислота, образующаяся из D-глюкозы, носит название D-глюкуроновой кислоты, а из D-галактозы - D-галактуроновой кислоты: Уроновые кислоты весьма важны в биологическом отношении, многие из них являются компонентами полисахаридов.

Моносахариды легко гидрируются по связи С = 0 и при этом превращаются в многоатомные спирты (сахароспирты). D-глюкоза, например, дает сахароспирт - сорбит, а D-манноза - маннит. Восстановление D-фруктозы приводит к эквимолекулярной смеси эпимеров - D-маннита и D-сорбита, так как в результате гидрирования второй атом углерода становится асимметричным. Такого рода восстановление может быть осуществлено также и при помощи ферментов.
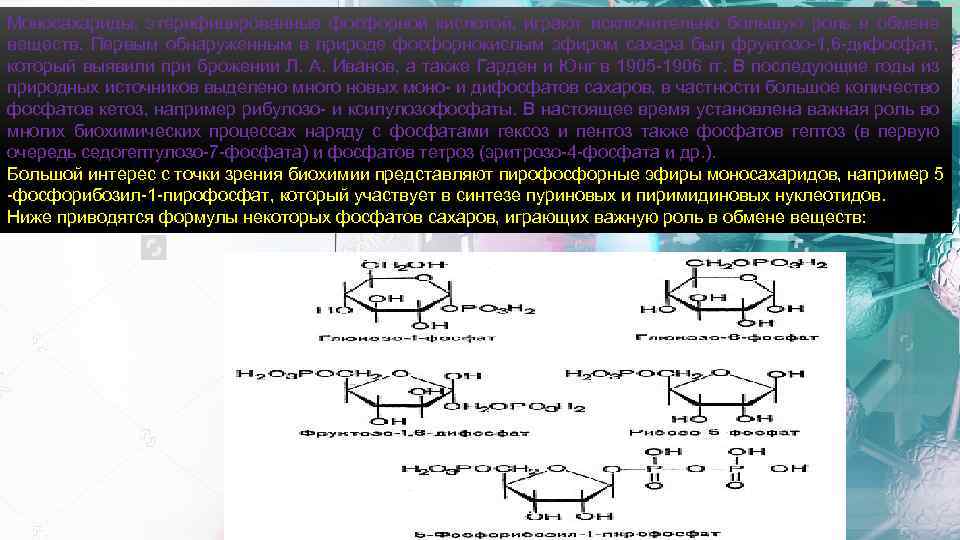
Моносахариды, этерифицированные фосфорной кислотой, играют исключительно большую роль в обмене веществ. Первым обнаруженным в природе фосфорнокислым эфиром сахара был фруктозо-1, 6 -дифосфат, который выявили при брожении Л. А. Иванов, а также Гарден и Юнг в 1905 -1906 гг. В последующие годы из природных источников выделено много новых моно- и дифосфатов сахаров, в частности большое количество фосфатов кетоз, например рибулозо- и ксилулозофосфаты. В настоящее время установлена важная роль во многих биохимических процессах наряду с фосфатами гексоз и пентоз также фосфатов гептоз (в первую очередь седогептулозо-7 -фосфата) и фосфатов тетроз (эритрозо-4 -фосфата и др. ). Большой интерес с точки зрения биохимии представляют пирофосфорные эфиры моносахаридов, например 5 -фосфорибозил-1 -пирофосфат, который участвует в синтезе пуриновых и пиримидиновых нуклеотидов. Ниже приводятся формулы некоторых фосфатов сахаров, играющих важную роль в обмене веществ:
Углеводы.pptx