УГЛЕВОДЫ нач.pptx
- Количество слайдов: 153

УГЛЕВОДЫ 1

Будучи первыми продуктами фотосинтеза, углеводы являются первыми органическими веществами в круговороте углерода в природе. Углеводы широко распространены в природе, особенно в растительном мире: до 80% сухого вещества растений приходится на долю углеводов. Они являются одним из главных пищевых продуктов и служат исходным веществом для промышленного производства искусственного волокна, бумаги, этилового спирта и взрывчатых веществ. 2

Название «УГЛЕВОДЫ» было предложено профессором Дерптского (Юрьевского) университета К. Шмидтом в 1844 году, т. к. элементный состав известных на тот момент углеводов мог быть выражен так В настоящее время понятие «УГЛЕВОДЫ» стало гораздо шире, но название до сих пор остаётся общепринятым. Другое название углеводов – «сахара» или «сахариды» . 3
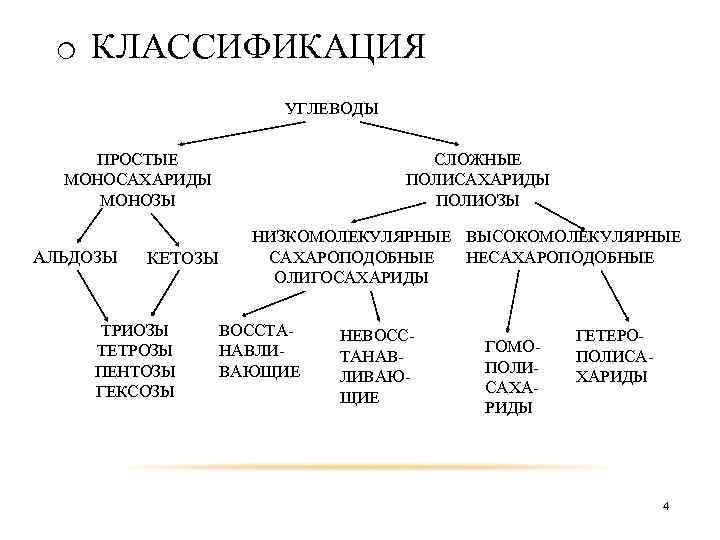
o КЛАССИФИКАЦИЯ УГЛЕВОДЫ ПРОСТЫЕ МОНОСАХАРИДЫ МОНОЗЫ АЛЬДОЗЫ КЕТОЗЫ ТРИОЗЫ ТЕТРОЗЫ ПЕНТОЗЫ ГЕКСОЗЫ СЛОЖНЫЕ ПОЛИСАХАРИДЫ ПОЛИОЗЫ НИЗКОМОЛЕКУЛЯРНЫЕ ВЫСОКОМОЛЕКУЛЯРНЫЕ НЕСАХАРОПОДОБНЫЕ ОЛИГОСАХАРИДЫ ВОССТАНАВЛИВАЮЩИЕ НЕВОССТАНАВЛИВАЮЩИЕ ГОМОПОЛИСАХАРИДЫ ГЕТЕРОПОЛИСАХАРИДЫ 4

МОНОСАХАРИДЫ 5

По строению моносахариды являются полигидроксиальдегидами и полигидроксикетонами. 6

Альдозы Кетозы тетрозы пентозы гексозы 7

В процессе фотосинтеза моносахариды конденсируются в полисахариды. Реакция сопровождается выделением воды и усложнением структуры. При гидролизе полисахаридов наблюдается обратный процесс 8

МОНОСАХАРИДЫ АЛЬДОЗЫ 9

ОПТИЧЕСКАЯ ИЗОМЕРИЯ Молекулы всех альдоз содержат ассиметрические атомы углерода, поэтому все альдозы имеют по нескольку оптических изомеров. Ассиметрическими называют такие атомы, которые находясь в составе молекулы в состоянии максимальной валентности связаны с атомами разных элементов или атомами, входящими в отличные по составу группы. 10

Оптическая изомерия Общее число оптических изомеров (N) может быть определено по формуле, предложенной и доказанной немецким химикоморгаником Эмилем Фишером. где n-число ассиметрических атомов углерода в молекуле 11

Оптическая изомерия Таким образом число оптических изомеров для триозы будет равно 2, для тетрозы – 4. * * 12
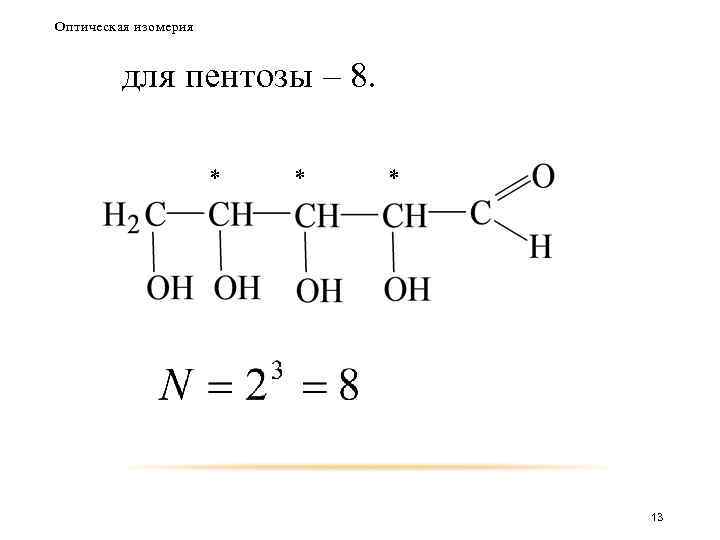
Оптическая изомерия для пентозы – 8. * * * 13
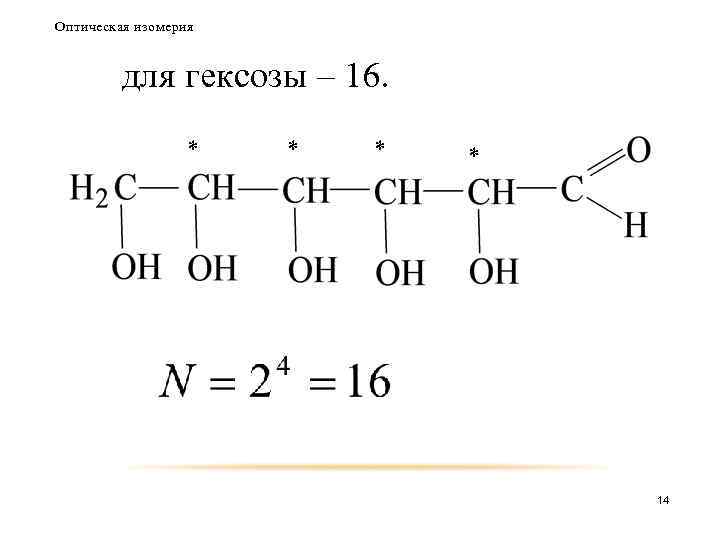
Оптическая изомерия для гексозы – 16. * * 14

Для каждого оптического изомера существует один его оптический антипод – энантиомер, а остальные оптические изомеры называют диастериомерами. 15

Таким образом , две триозы составляют одну пару антиподов, четыре тетрозы – две пары, восемь пентоз – четыре пары, шестнадцать гексоз – восемь пар антиподов, которые относят к двум рядам: правому (D-ряд) и левому (L-ряд). 16

Все альдозы хорошо изучены. Одни из них выделены из природных продуктов, другие получены синтетически. Для всех альдоз установлены относительные конфигурации, то есть пространственное расположение заместителей у асимметрических атомов относительно конфигураций глицериновых альдегидов. 17

Для более быстрого и удобного написания конфигурации моноз немецкий химик-органик Эмиль Фишер в 1891 году предложил изображать их проекционными формулами. 18

При построении на плоскости пространственных структур соединений с асимметрическими атомами для соединений с одним асимметрическим атомом на плоскость проецируют модель молекулы, которую условно располагают так, что бы асимметрический атом находился в плоскости чертежа, заместители, расположенные слева и справа - перед плоскостью, а заместители расположенные вверху и внизу – за плоскостью чертежа (связи этих заместителей с асимметрическим атомом иногда показывают пунктирными линиями). 19
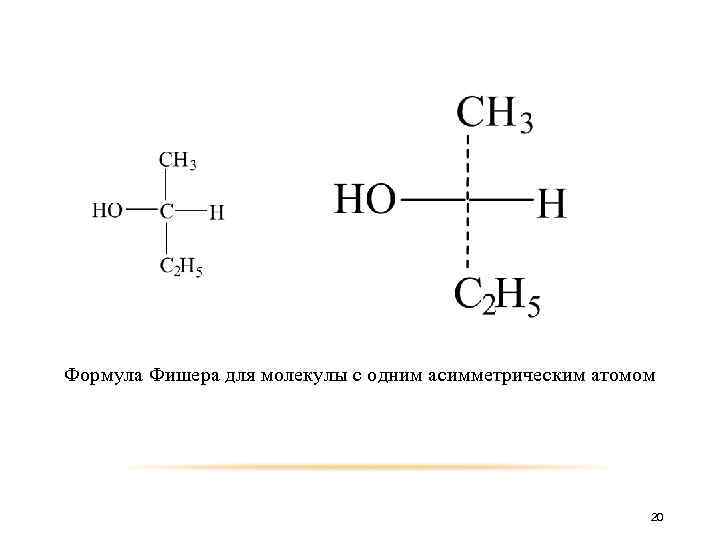
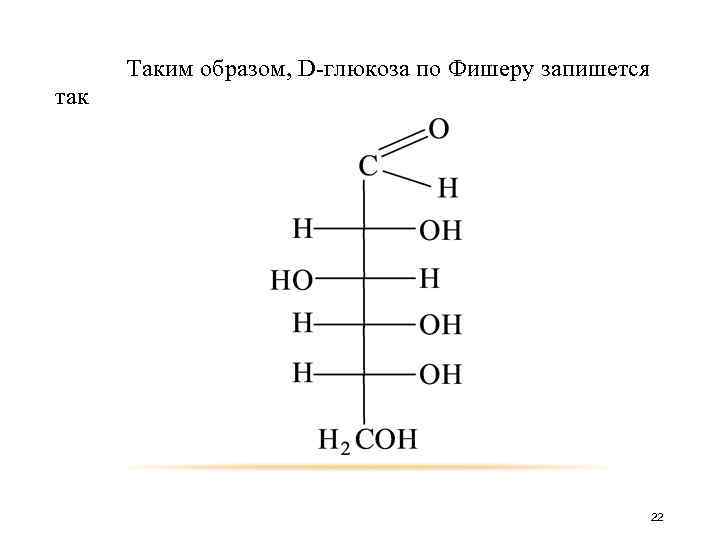
Формула Фишера для молекулы с одним асимметрическим атомом 20

Цепь молекулы с несколькими асимметрическими атомами располагают в пространстве вертикально в виде равномерно выпуклой ломаной линии, обращенной выпуклостью к наблюдателю, причем главную функциональную группу изображают вверху. 21
Таким образом, D-глюкоза по Фишеру запишется так 22

Представить себе пространственное строение оптических изомеров альдоз удобнее всего, если выводить их из глицеринового альдегида, который существует в виде двух антиподов. 23
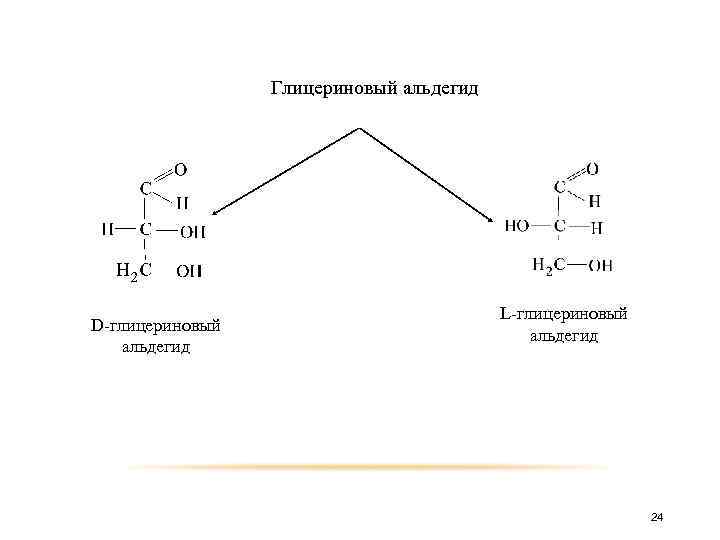
Глицериновый альдегид D-глицериновый альдегид L-глицериновый альдегид 24
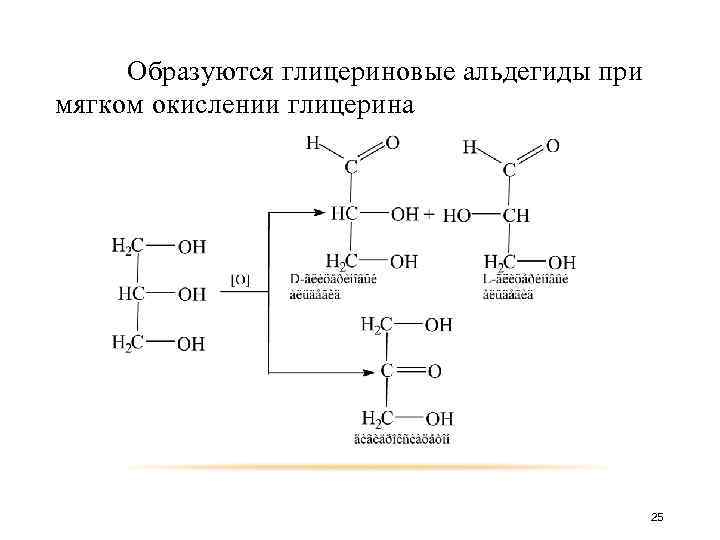
Образуются глицериновые альдегиды при мягком окислении глицерина 25

Таким образом из D-глицеринового, путём добавления атома углерода между карбонильной группой и вторым атомом, получаем 26
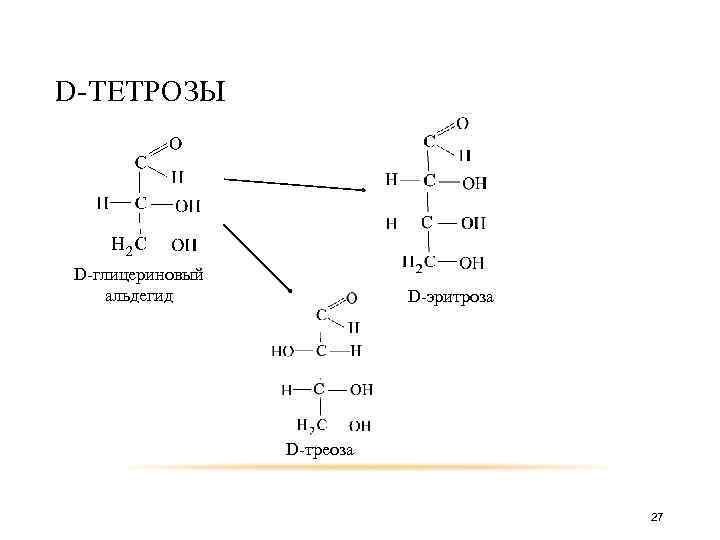
D-ТЕТРОЗЫ D-глицериновый альдегид D-эритроза D-треоза 27
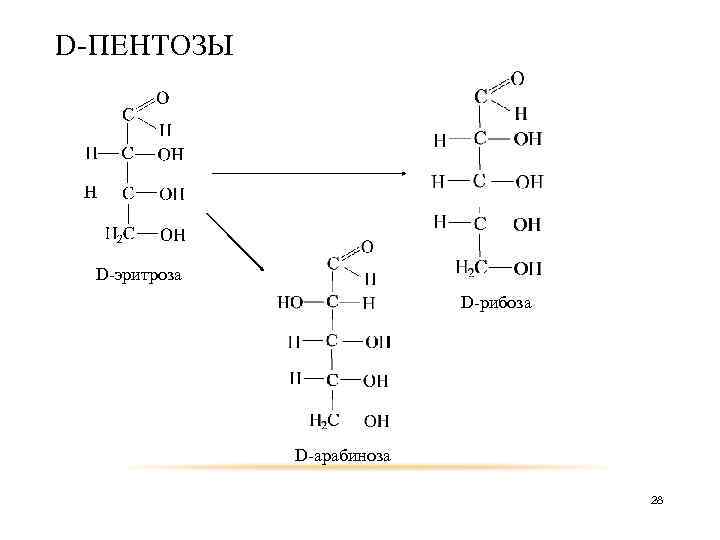
D-ПЕНТОЗЫ D-эритроза D-рибоза D-арабиноза 28
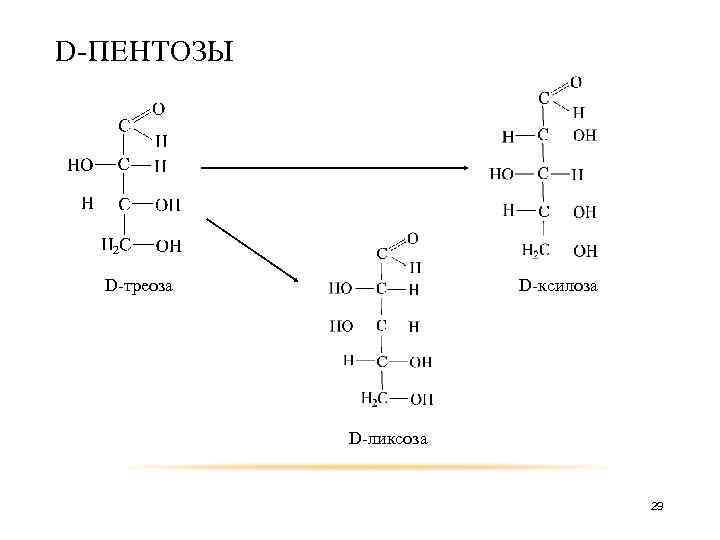
D-ПЕНТОЗЫ D-треоза D-ксилоза D-ликсоза 29
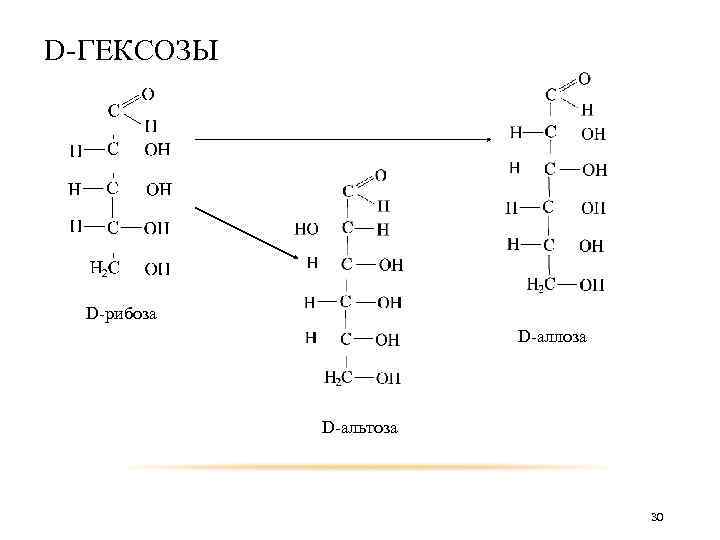
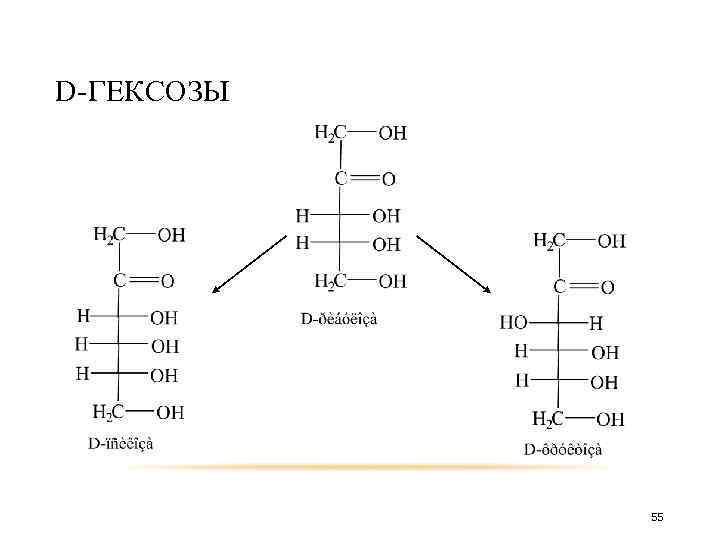
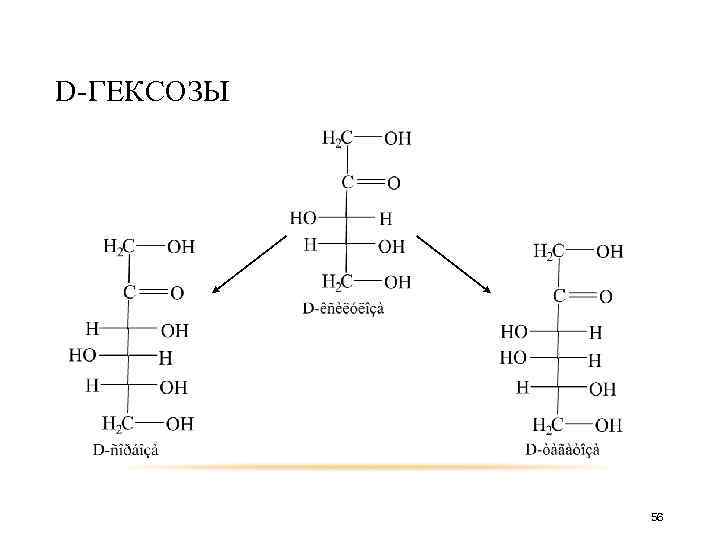
D-ГЕКСОЗЫ D-рибоза D-аллоза D-альтоза 30

D-ГЕКСОЗЫ D-арабиноза D-глюкоза D-манноза 31
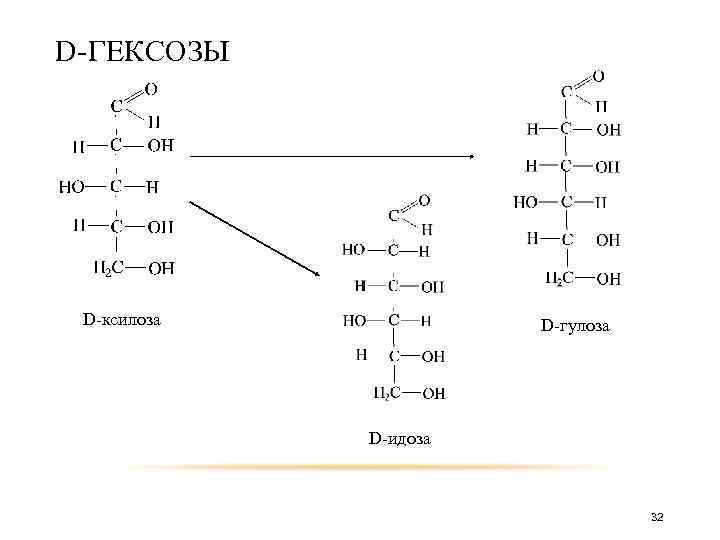
D-ГЕКСОЗЫ D-ксилоза D-гулоза D-идоза 32
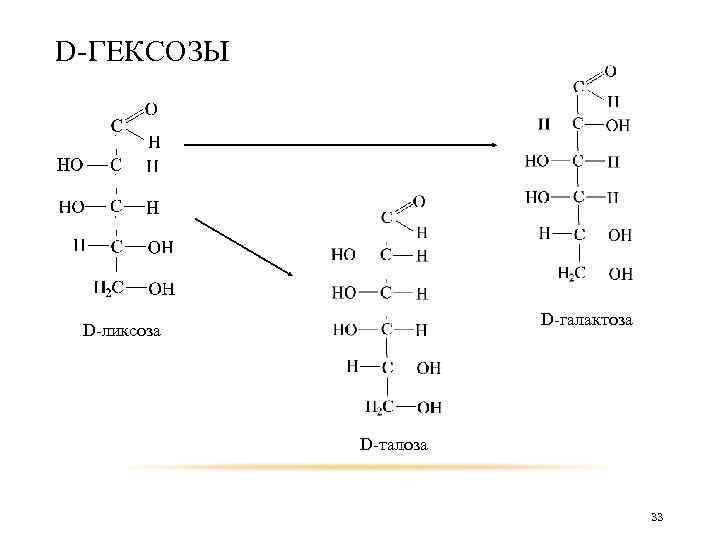
D-ГЕКСОЗЫ D-галактоза D-ликсоза D-талоза 33
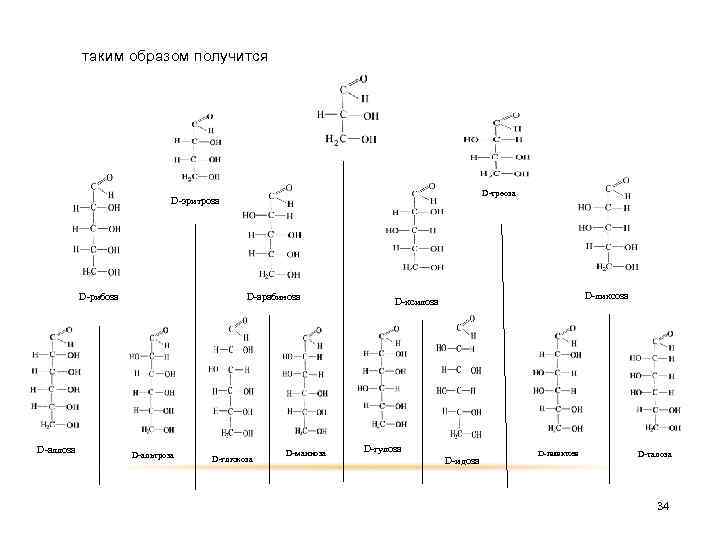
таким образом получится D-треоза D-эритроза D-арабиноза D-рибоза D-аллоза D-альтроза D-глюкоза D-манноза D-ликсоза D-ксилоза D-гулоза D-идоза D-галактоза D-талоза 34

Принадлежность моносахарида к тому или иному генетическому ряду определяют по конфигурации его последнего (считая от альдегидной группы) асимметрического атома углерода. Если она соответствует конфигурации D-глицеринового альдегида, то есть гидроксил стоит справа, то моноза относится к Dряду. Если же гидроксил стоит слева и конфигурация последнего асимметрического атома моноза соответствует L-глицериновому альдегиду, ее относят к L-ряду. Принадлежность моносахарида к D-ряду или Lряду указывает только на то, что он формально может быть получен из D- или L-глицеринового альдегида. Направление вращения плоскости поляризации света растворами моносахаридов зависит от конфигурации всех асимметрических атомов молекулы. 35

Поэтому конфигурацию моноз, то есть принадлежность их к тому или иному генетическому ряду, принято обозначать буквами (D и L соответственно), а направление вращения плоскости поляризации света – знаками: «+» – вправо и «-» – влево. Так D(-) – рибоза относится к D-ряду, плоскость поляризации света вращает влево. Альдозы, отличающиеся друг от друга конфигурацией лишь у асимметрического атома углерода, соседнего с карбонильной группой, называют эпимерами. Эпимерами, в более широком смысле этого слова, называют оптические изомеры, отличающиеся конфигурацией лишь у одного из асимметрических атомов молекулы, но в таком случае, обязательно должно быть указано у какого. 36

В природе наиболее широко распространены пентозы и гексозы. 37
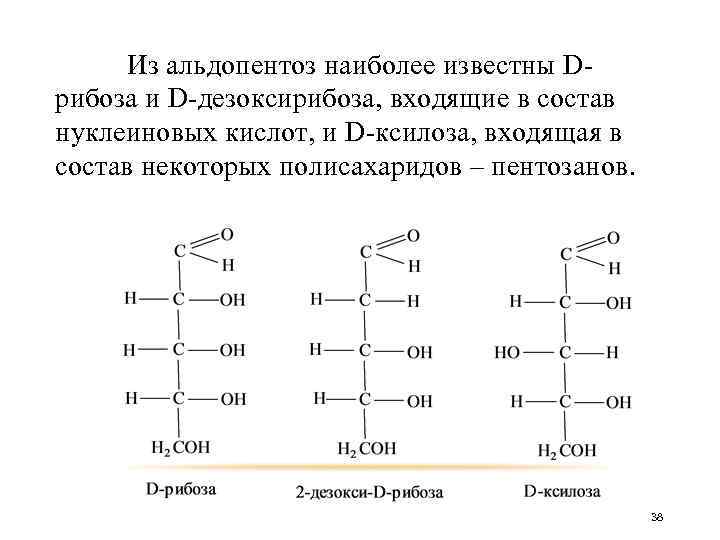
Из альдопентоз наиболее известны Dрибоза и D-дезоксирибоза, входящие в состав нуклеиновых кислот, и D-ксилоза, входящая в состав некоторых полисахаридов – пентозанов. 38
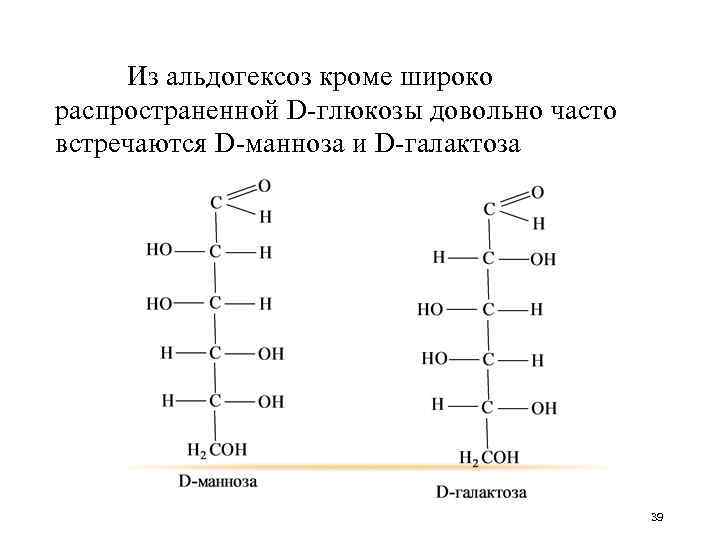
Из альдогексоз кроме широко распространенной D-глюкозы довольно часто встречаются D-манноза и D-галактоза 39

Большинство природных моносахаридов относятся к D-ряду. 40

Моносахариды могут иметь двоякое строение: не только альдегидо- и кетоспиртов, но и внутрициклических полуацеталей, не содержащих свободной альдегидной (или кетонной) группы, но легко дающей ее при разрыве цикла. Так в кристаллическом состоянии моносахариды имеют циклическое строение, а в растворах представлены циклическими и открытыми формами, находящимися в динамическом равновесии, называемом циклоцепной таутомерией. 41

Образование циклических форм обусловлено взаимодействием альдегидной группы с гидроксилом пятого или реже, четвертого углеродного атома. Циклизация происходит так, что атом водорода гидроксильной группы присоединяется к кислороду альдегидной группы за счет разрыва π-связи, образуя так называемый полуацетальный, или гликозидный, гидроксил. 42
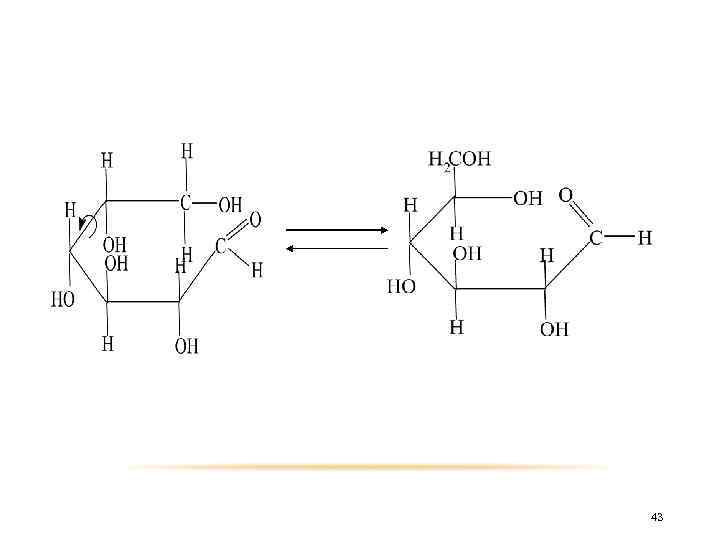
43

Атом кислорода гидроксильной группы у пятого атома углерода после отщепления от него атома водорода соединяется с атомом углерода альдегидной группы. Таким образом, возникает кислородный мостик между пятым и первым атомами углерода замыкающий шестичленный цикл. В полуацетальной форме нет свободной альдегидной группы. В молекуле появляется пятый (новый) асимметрический центр. 44
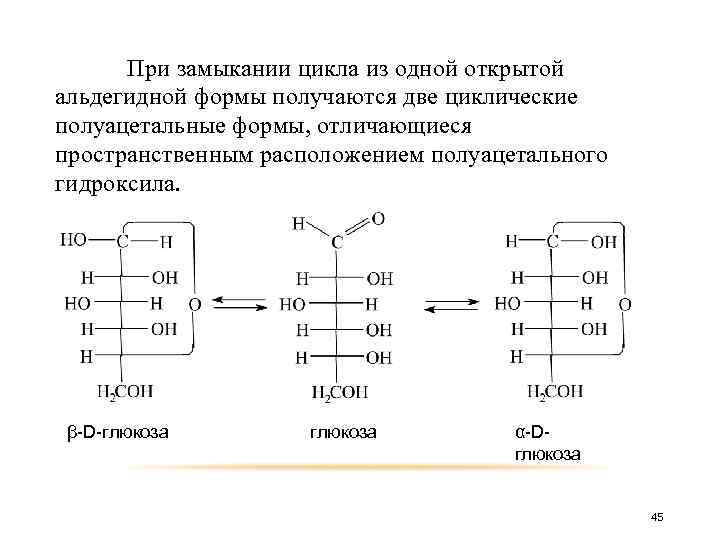
При замыкании цикла из одной открытой альдегидной формы получаются две циклические полуацетальные формы, отличающиеся пространственным расположением полуацетального гидроксила. β-D-глюкоза α-Dглюкоза 45
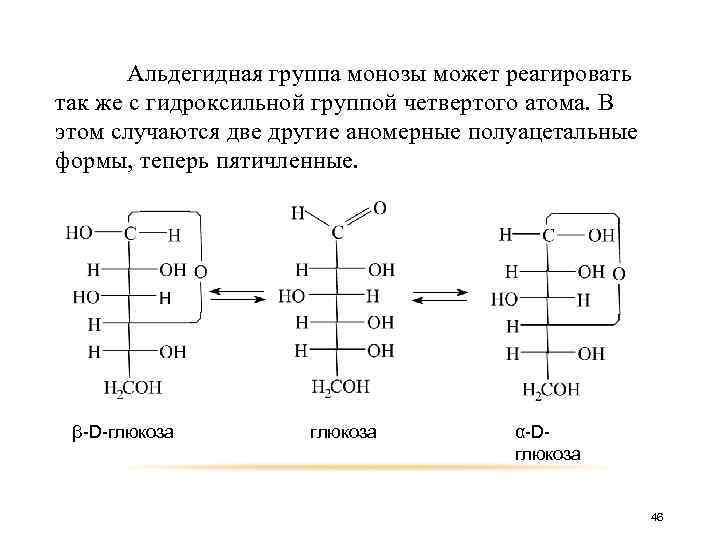
Альдегидная группа монозы может реагировать так же с гидроксильной группой четвертого атома. В этом случаются две другие аномерные полуацетальные формы, теперь пятичленные. β-D-глюкоза α-Dглюкоза 46
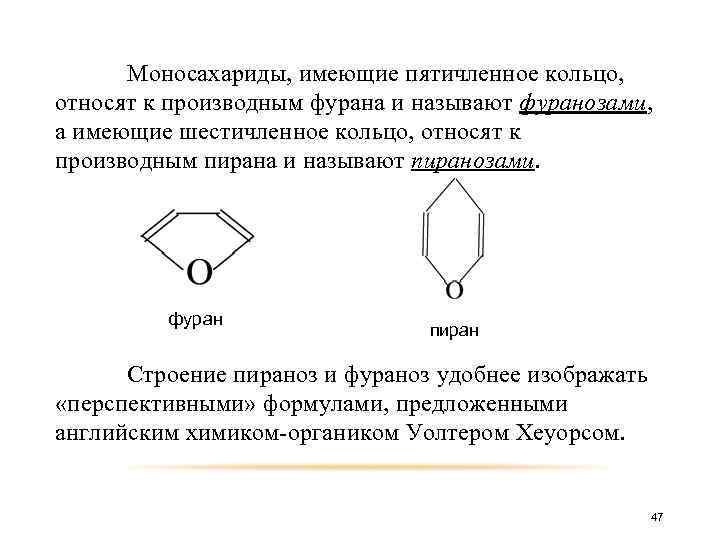
Моносахариды, имеющие пятичленное кольцо, относят к производным фурана и называют фуранозами, а имеющие шестичленное кольцо, относят к производным пирана и называют пиранозами. фуран пиран Строение пираноз и фураноз удобнее изображать «перспективными» формулами, предложенными английским химиком-органиком Уолтером Хеуорсом. 47
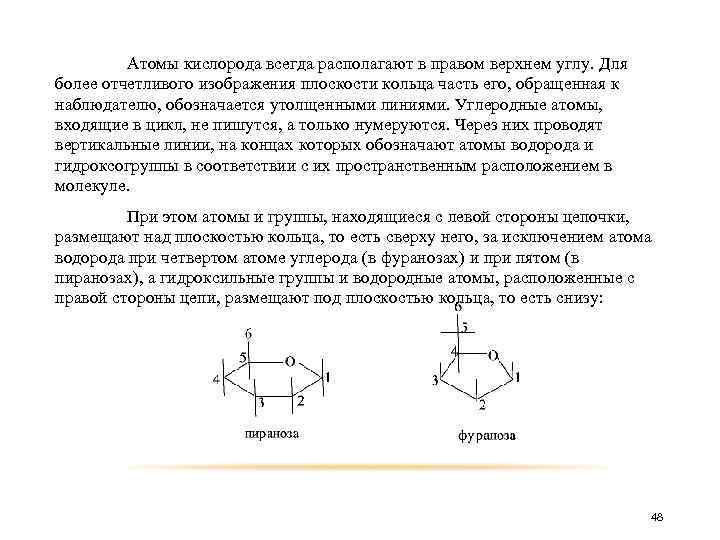
Атомы кислорода всегда располагают в правом верхнем углу. Для более отчетливого изображения плоскости кольца часть его, обращенная к наблюдателю, обозначается утолщенными линиями. Углеродные атомы, входящие в цикл, не пишутся, а только нумеруются. Через них проводят вертикальные линии, на концах которых обозначают атомы водорода и гидроксогруппы в соответствии с их пространственным расположением в молекуле. При этом атомы и группы, находящиеся с левой стороны цепочки, размещают над плоскостью кольца, то есть сверху него, за исключением атома водорода при четвертом атоме углерода (в фуранозах) и при пятом (в пиранозах), а гидроксильные группы и водородные атомы, расположенные с правой стороны цепи, размещают под плоскостью кольца, то есть снизу: 48
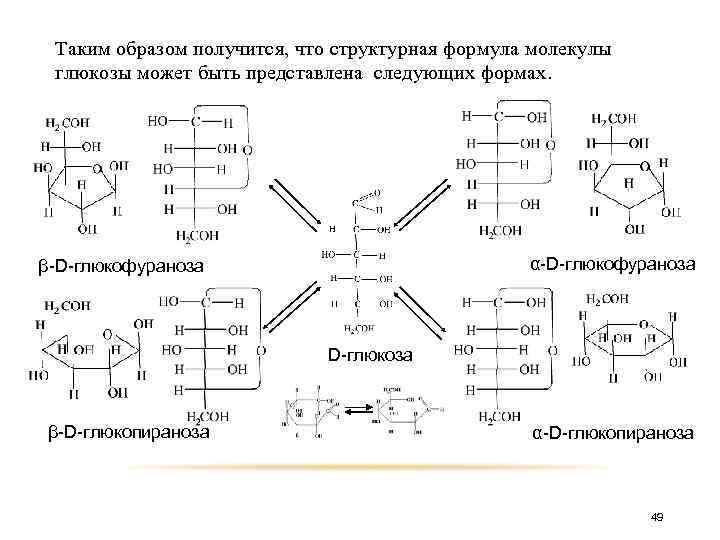
Таким образом получится, что структурная формула молекулы глюкозы может быть представлена следующих формах. α-D-глюкофураноза β-D-глюкофураноза D-глюкоза β-D-глюкопираноза α-D-глюкопираноза 49

МОНОСАХАРИДЫ КЕТОЗЫ 50

Кетозы являются изомерами альдоз с тем же числом углеродных атомов и так же подразделяются на тетрозы, пентозы, гексозы и т. д. Кетозы содержат на один асимметрический атом углерода меньше, чем соответствующие альдозы, и поэтому имеют меньшее число оптических изомеров. Таким образом , две тетрозы составляют одну пару антиподов, четыре пентозы– две пары, восемь гексоз – четыре пары, которые относят к двум рядам: правому (D-ряд) и левому (L-ряд). 51

Принадлежность кетоз к D- или L-ряду определяется по расположению гидроксила у последнего (считая от карбонильной группы) асимметрического атома углерода. Представить себе пространственное строение оптических изомеров кетоз удобнее всего, если выводить их из глицеринового кетона, который существует в виде единственного оптического изомера. Таким образом из дигроксиацетона, путём добавления атома углерода между карбонильной группой и соседним атомом, получаем эритрулозу, которая существует в виде двух оптических изомеров. 52
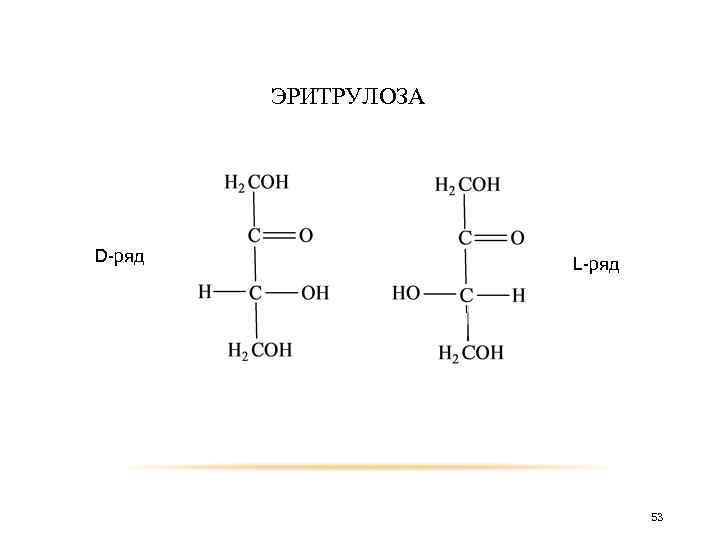
D-ряд ЭРИТРУЛОЗА L-ряд 53
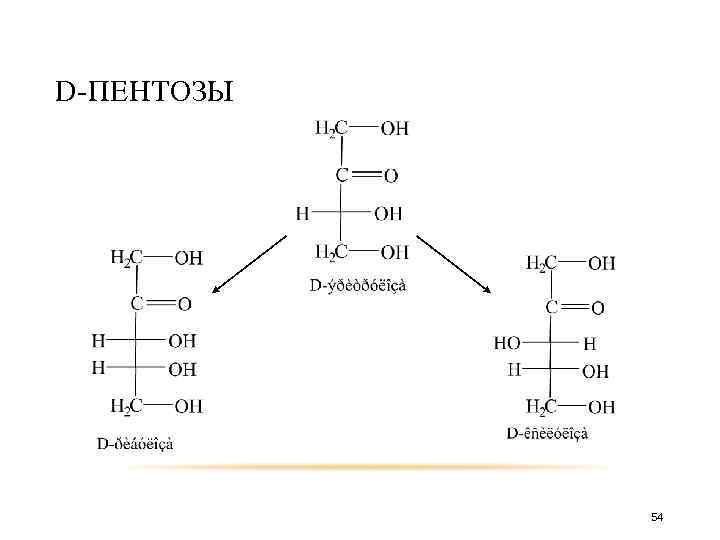
D-ПЕНТОЗЫ 54
D-ГЕКСОЗЫ 55
D-ГЕКСОЗЫ 56

Таким образом получим генетический ряд D-кетоз 57

В природе наиболее широко распространены пентозы и гексозы. Из кетогексоз кроме широко распространенной Dфруктозы довольно часто встречаются D-псикоза и Lсорбоза Моносахариды могут иметь двоякое строение: не только альдегидо- и кетоспиртов, но и внутрициклических полуацеталей, не содержащих свободной альдегидной (или кетонной) группы, но легко дающей ее при разрыве цикла. Так в кристаллическом состоянии моносахариды имеют циклическое строение, а в растворах представлены циклическими и открытыми формами, находящимися в динамическом равновесии, называемом цикло-цепной таутомерией. 58

• Образование циклических форм обусловлено взаимодействием кетонной группы с гидроксилом шестого или пятого углеродного атома. • Циклизация происходит так, что атом водорода гидроксильной группы присоединяется к кислороду кетонной группы за счет разрыва πсвязи, образуя так называемый полуацетальный, или гликозидный, гидроксил. 59

• Атом кислорода гидроксильной группы у пятого атома углерода после отщепления от него атома водорода соединяется с атомом углерода кетонной группы. Таким образом, возникает кислородный мостик между пятым и вторым атомами углерода замыкающий пятичленный цикл. • В полуацетальной форме нет свободной кетонной группы. В молекуле появляется новый асимметрический центр. 60

При замыкании цикла из одной открытой кетонной формы получаются две циклические полуацетальные формы, отличающиеся пространственным расположением полуацетального гидроксила. 61
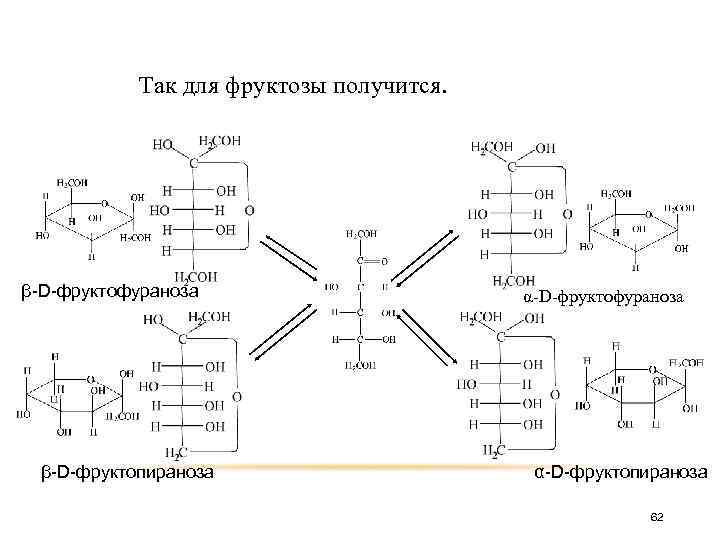
Так для фруктозы получится. β-D-фруктофураноза β-D-фруктопираноза α-D-фруктофураноза α-D-фруктопираноза 62

МОНОСАХАРИДЫ свойства 63

Альдопентозам свойственны почти все реакции альдегидов и многоатомных спиртов. • окисление (дают реакции серебряного зеркала и Фелинга, при мягком окислении образуют карбоновые кислоты (в виде лактона) • восстановление (дают пятиатомные спирты – пентиты) • взаимодействие с фенилгидразином • алкилирование альдопентоз приводит к образованию простых эфиров. Алкилирование сильными реагентами (например: диметилсульфатом) приводит к образованию тетраметилового эфира, у которого одна метильная группа (гликозидная) легко отщепляется. 64

Известны как альдогексозы так и кетогексозы. Для гексоз характерны реакции карбонильных соединений и многоатомных спиртов – гекситов; окисляются до монокарбоновых кислот, с фенилгидрозином образуют озазоны. Кроме того для них характерны процессы расщепления под действием различных микроорганизмов (брожение). 65
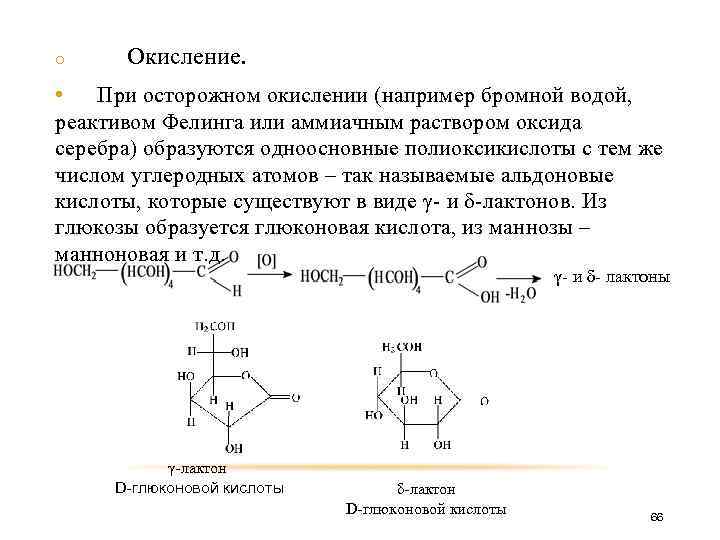
o Окисление. • При осторожном окислении (например бромной водой, реактивом Фелинга или аммиачным раствором оксида серебра) образуются одноосновные полиоксикислоты с тем же числом углеродных атомов – так называемые альдоновые кислоты, которые существуют в виде γ- и δ-лактонов. Из глюкозы образуется глюконовая кислота, из маннозы – манноновая и т. д. γ- и δ- лактоны γ-лактон D-глюконовой кислоты δ-лактон D-глюконовой кислоты 66
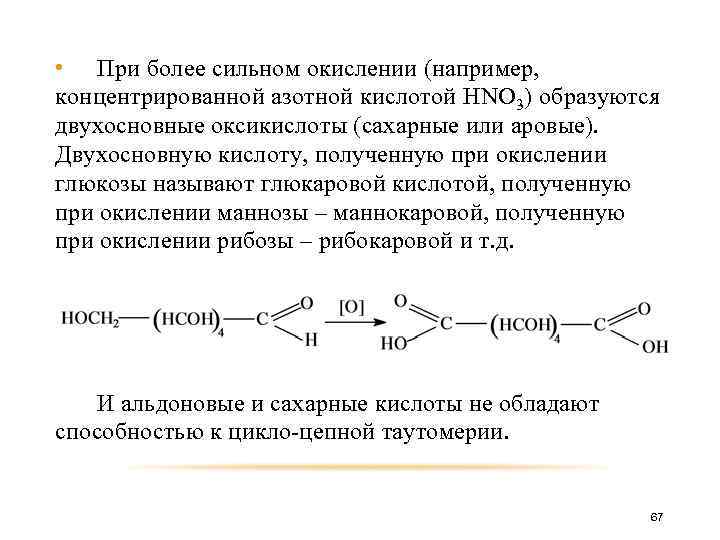
• При более сильном окислении (например, концентрированной азотной кислотой HNO 3) образуются двухосновные оксикислоты (сахарные или аровые). Двухосновную кислоту, полученную при окислении глюкозы называют глюкаровой кислотой, полученную при окислении маннозы – маннокаровой, полученную при окислении рибозы – рибокаровой и т. д. И альдоновые и сахарные кислоты не обладают способностью к цикло-цепной таутомерии. 67

Полная схема окисления глюкозы 68
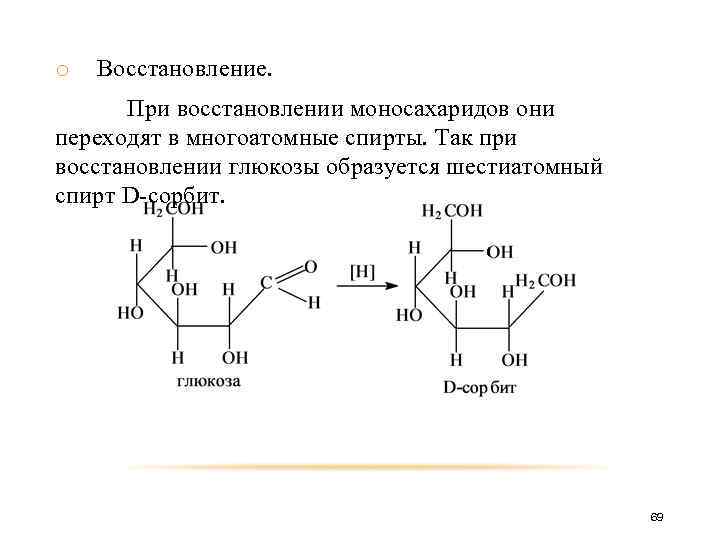
o Восстановление. При восстановлении моносахаридов они переходят в многоатомные спирты. Так при восстановлении глюкозы образуется шестиатомный спирт D-сорбит. 69

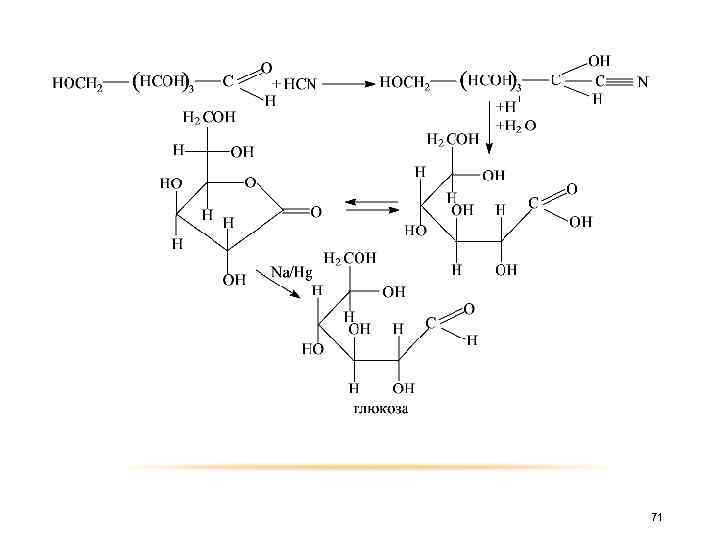
o Удлинение цепи. Альдегидная группа альдоз присоединяет обычным путем синильную кислоту, образующийся циангидрин гидролизуется до содержащей на один атом углерода больше альдоновой кислоты, которая в виде лактона может быть восстановлена амальгамой натрия до высшей альдозы. 70
71
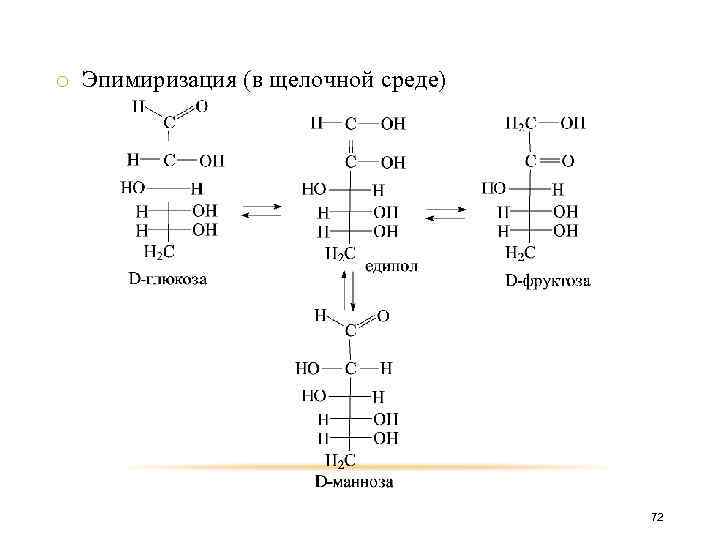
o Эпимиризация (в щелочной среде) 72
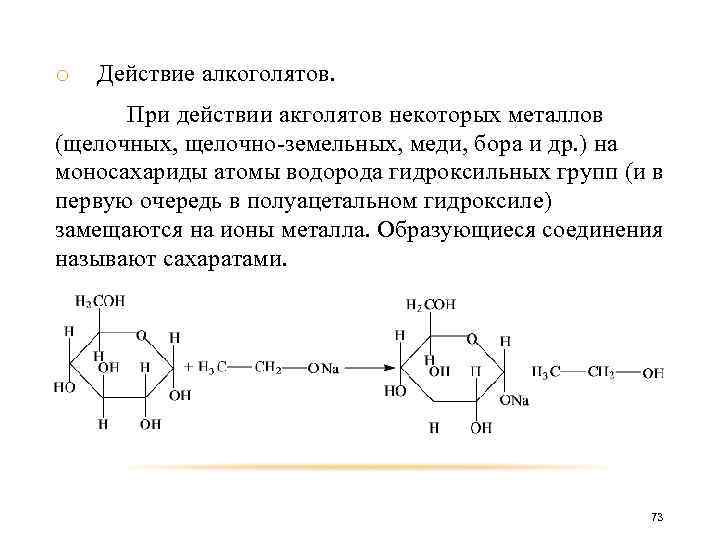
o Действие алкоголятов. При действии акголятов некоторых металлов (щелочных, щелочно-земельных, меди, бора и др. ) на моносахариды атомы водорода гидроксильных групп (и в первую очередь в полуацетальном гидроксиле) замещаются на ионы металла. Образующиеся соединения называют сахаратами. 73

При взаимодействии с ацилирующими и алкилирующими агентами образуются простые и сложные эфиры. Наиболее ле 6 гко реагирует гликозидная гидроксогруппа, при этом образуется смесь α- и β -гликозидов.
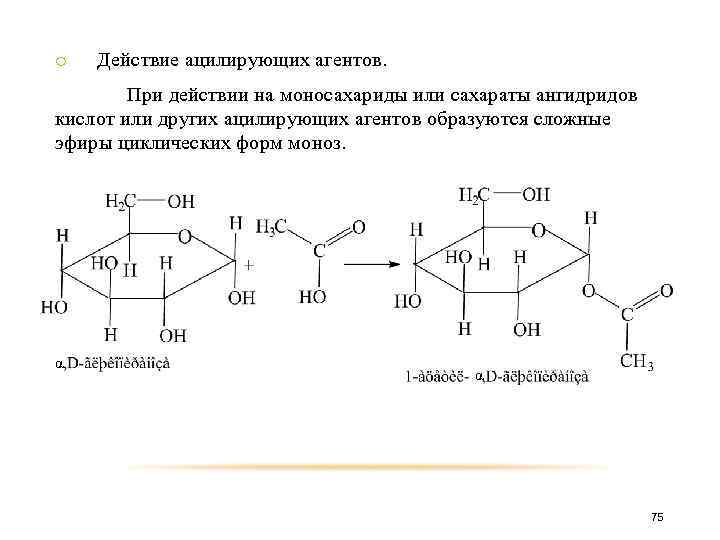
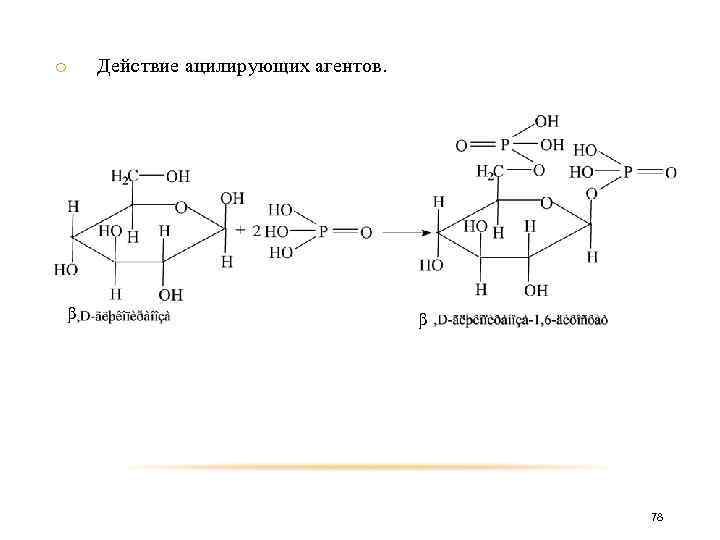
o Действие ацилирующих агентов. При действии на моносахариды или сахараты ангидридов кислот или других ацилирующих агентов образуются сложные эфиры циклических форм моноз. α α 75
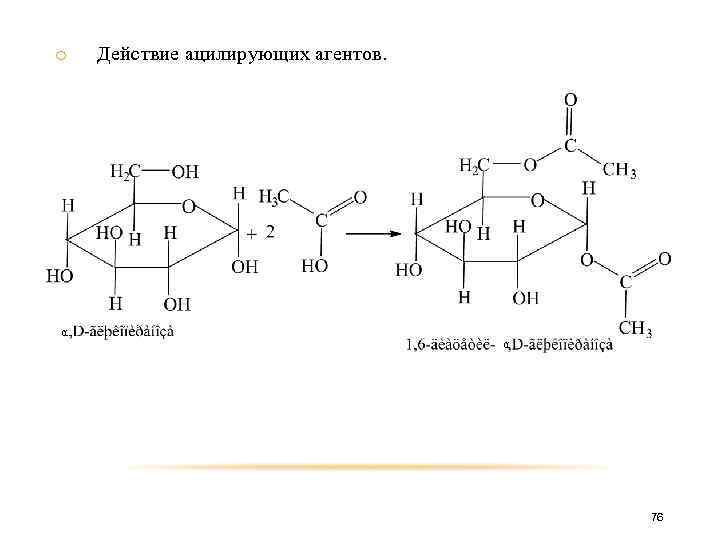
o α Действие ацилирующих агентов. α 76
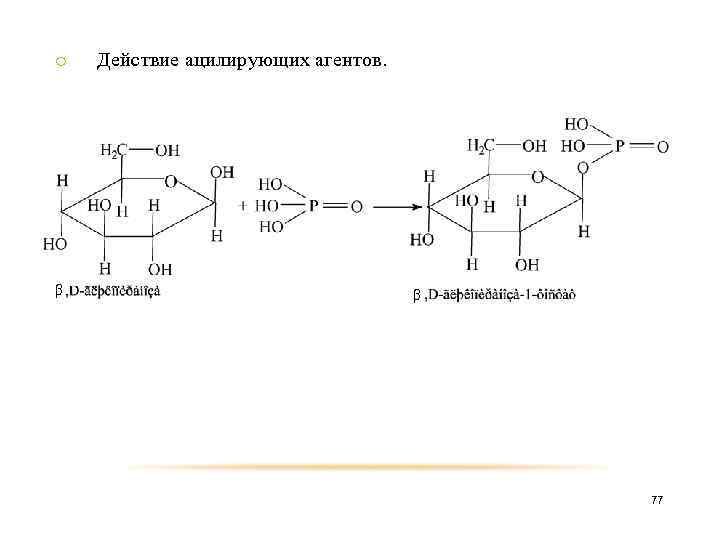
o β Действие ацилирующих агентов. β 77
o β Действие ацилирующих агентов. β 78
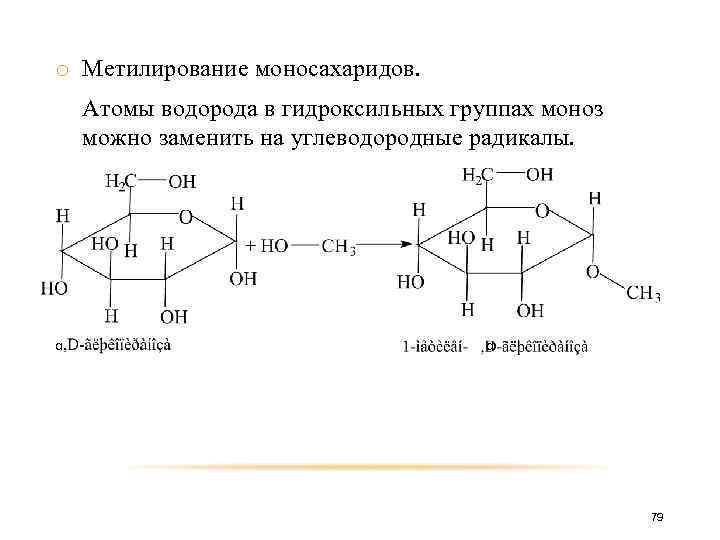
o Метилирование моносахаридов. Атомы водорода в гидроксильных группах моноз можно заменить на углеводородные радикалы. α α 79
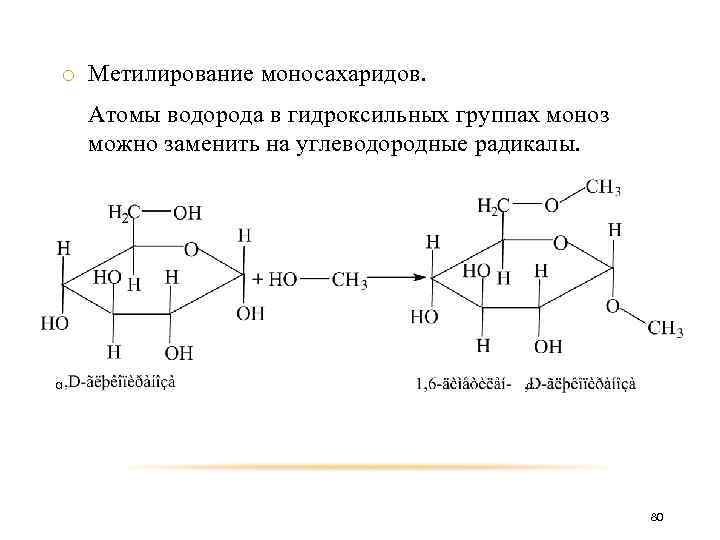
o Метилирование моносахаридов. Атомы водорода в гидроксильных группах моноз можно заменить на углеводородные радикалы. α α 80
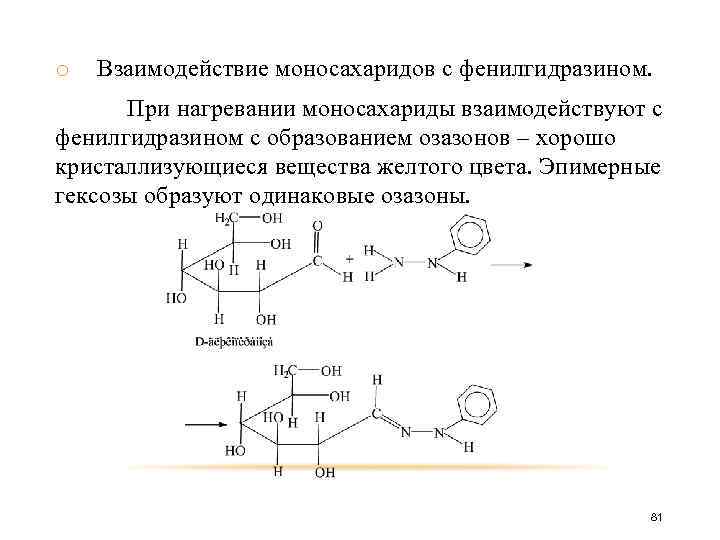
o Взаимодействие моносахаридов с фенилгидразином. При нагревании моносахариды взаимодействуют с фенилгидразином с образованием озазонов – хорошо кристаллизующиеся вещества желтого цвета. Эпимерные гексозы образуют одинаковые озазоны. 81
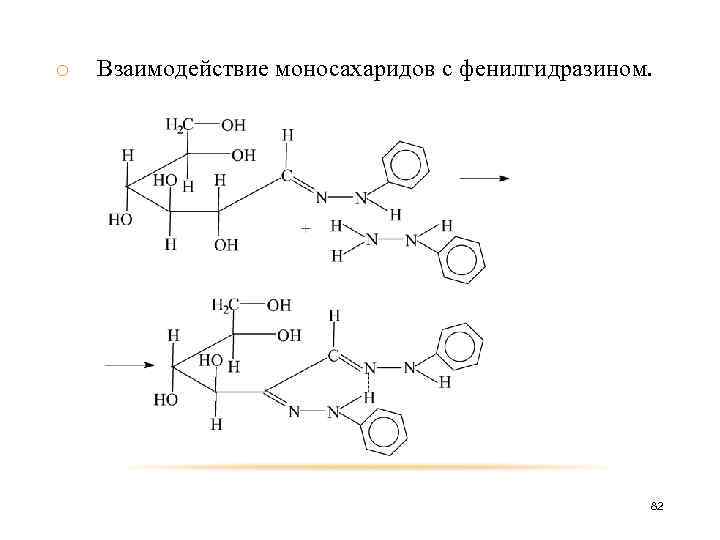
o Взаимодействие моносахаридов с фенилгидразином. 82

o Брожение. различают: § Спиртовое (дрожжи) § Молочнокислое (молочнокислые бактерии) § Маслянокислое (маслянокислые бактерии) § Лимоннокислое (грибки) 83
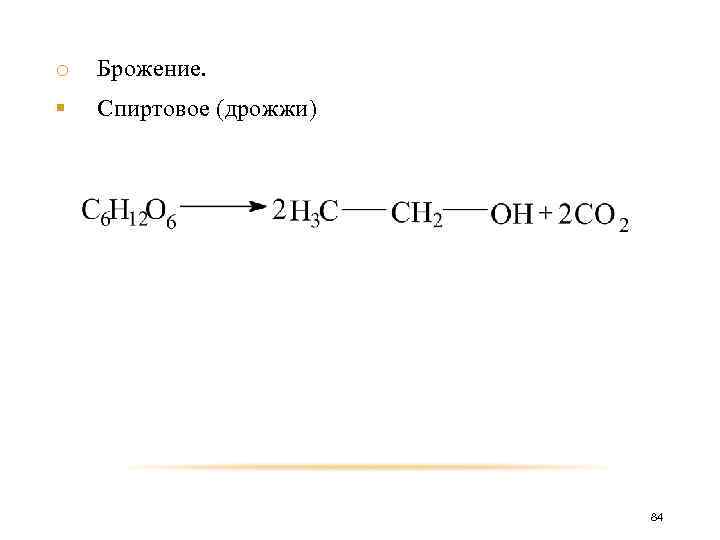
o Брожение. § Спиртовое (дрожжи) 84
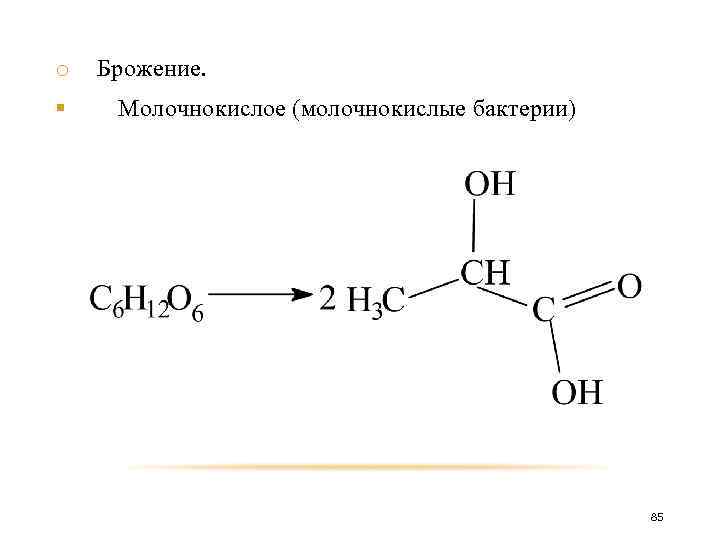
o § Брожение. Молочнокислое (молочнокислые бактерии) 85
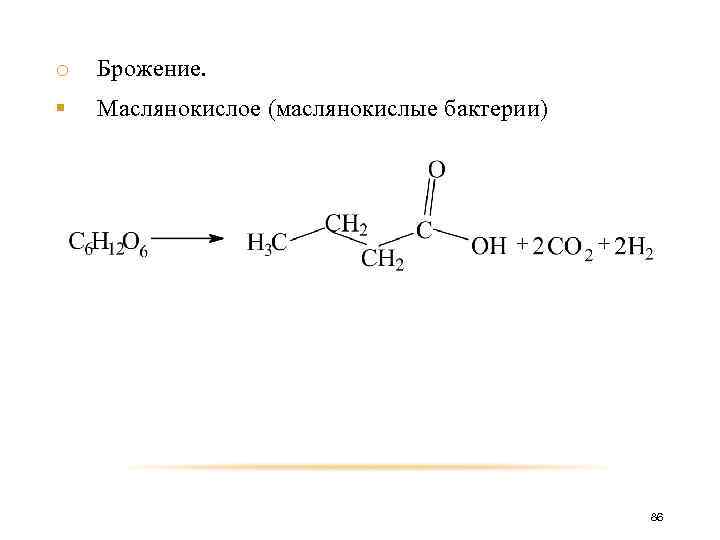
o Брожение. § Маслянокислое (маслянокислые бактерии) 86
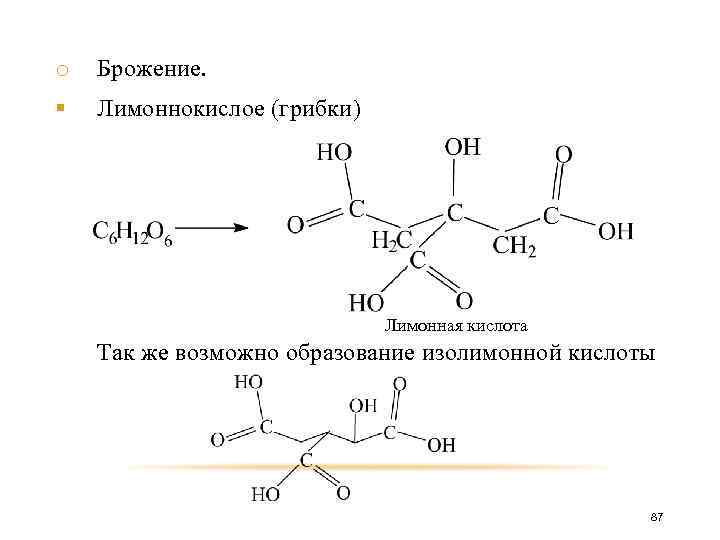
o Брожение. § Лимоннокислое (грибки) Лимонная кислота Так же возможно образование изолимонной кислоты 87
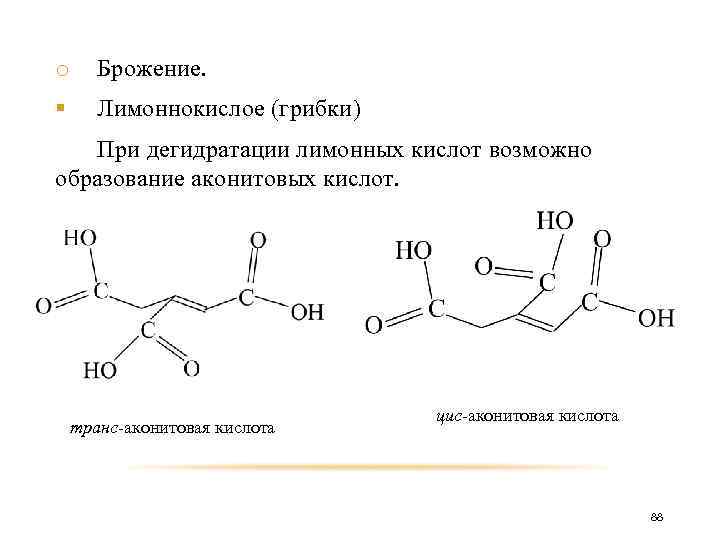
o Брожение. § Лимоннокислое (грибки) При дегидратации лимонных кислот возможно образование аконитовых кислот. транс-аконитовая кислота цис-аконитовая кислота 88

МОНОСАХАРИДЫ Важнейшие представители 89

КСИЛОЗА «древесный сахар» , моносахарид из группы пентоз, принадлежит к альдозам. Удельное вращение водного раствора +18, 8°. Не сбраживается обычными дрожжами. При восстановлении образует многоатомный спирт ксилит. При окислении образует ксилоновую, а затем триоксиксилоглутаровую кислоту, используемую в аналитической химии и как заменитель лимонной кислоты в пищевой промышленности. Содержится в эмбрионах растений в качестве эргастического вещества. Входит в состав растительных слизей, гумми, является одним из мономеров полисахарида клеточных стенок — гемицеллюлозы ксилана. Образуется в растениях при декарбоксилировании глюкоуроновой кислоты. Получают путём кислотного гидролиза отрубей, соломы, древесины, хлопковой шелухи, кукурузных кочерыжек. На растворах ксилозы возможно выращивание дрожжеподобных организмов, используемых для получения ценного корма для скота. 90
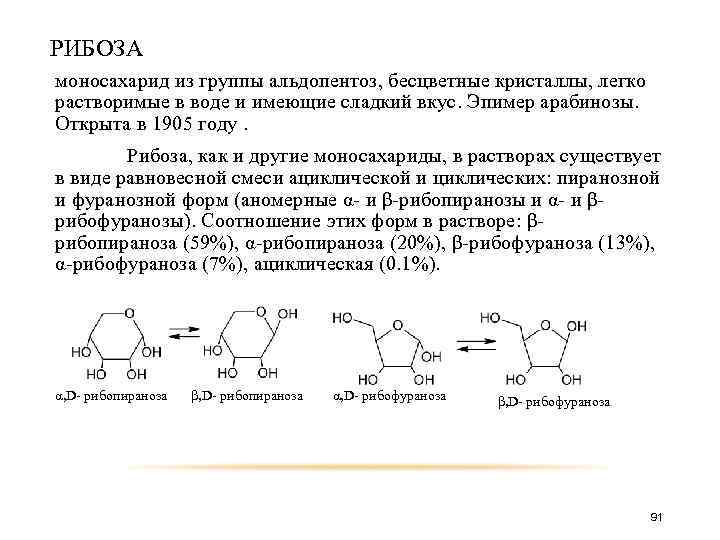
РИБОЗА моносахарид из группы альдопентоз, бесцветные кристаллы, легко растворимые в воде и имеющие сладкий вкус. Эпимер арабинозы. Открыта в 1905 году. Рибоза, как и другие моносахариды, в растворах существует в виде равновесной смеси ациклической и циклических: пиранозной и фуранозной форм (аномерные α- и β-рибопиранозы и α- и βрибофуранозы). Соотношение этих форм в растворе: βрибопираноза (59%), α-рибопираноза (20%), β-рибофураноза (13%), α-рибофураноза (7%), ациклическая (0. 1%). α, D- рибопираноза β, D- рибопираноза α, D- рибофураноза β, D- рибофураноза 91

РИБОЗА Рибоза восстанавливается водородом или амальгамой натрия до рибита и окисляется по альдегидной группе до рибоновой кислоты, способной циклизоваться в условиях синтеза в рибонолактон, с гидразинами образует озазоны. Рибоза в форме β-D-рибофуранозы входит в состав рибонуклеиновой кислоты, нуклеозидов, нуклеотидов и других биологических важных веществ. Рибоза является компонентом РНК и используется при генетической транскрипции. Производное β-D-рибозы — β-Dдезоксирибоза является компонентом ДНК. Также β-D-рибоза является компонентом АТФ и некоторых других веществ, участвующих в метаболизме. Рибоза, входящая в состав биологических структур, обладает свойством хиральной чистоты: молекулы ДНК и РНК построены исключительно на «правой» рибозе. 92
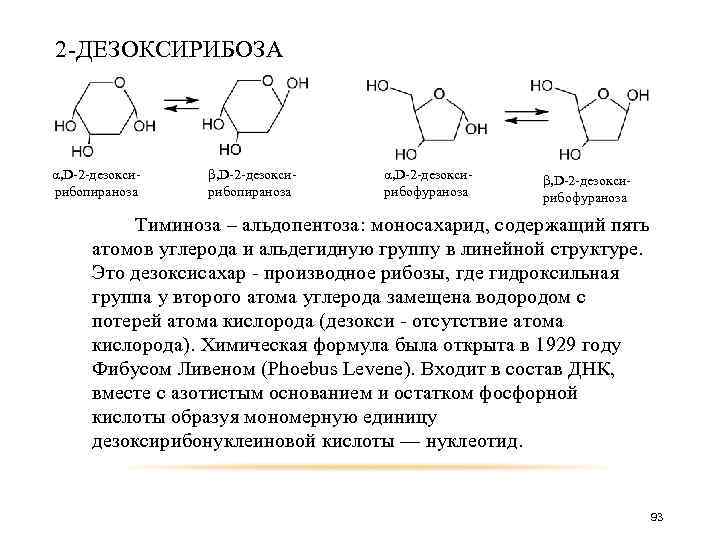
2 -ДЕЗОКСИРИБОЗА α, D-2 -дезоксирибопираноза β, D-2 -дезоксирибопираноза α, D-2 -дезоксирибофураноза β, D-2 -дезоксирибофураноза Тиминоза – альдопентоза: моносахарид, содержащий пять атомов углерода и альдегидную группу в линейной структуре. Это дезоксисахар - производное рибозы, где гидроксильная группа у второго атома углерода замещена водородом с потерей атома кислорода (дезокси - отсутствие атома кислорода). Химическая формула была открыта в 1929 году Фибусом Ливеном (Phoebus Levene). Входит в состав ДНК, вместе с азотистым основанием и остатком фосфорной кислоты образуя мономерную единицу дезоксирибонуклеиновой кислоты — нуклеотид. 93

ГЛЮКОЗА 94

ГАЛАКТОЗА 95

ЭРИТРУЛОЗА Или малиновый сахар – натуральное соединение, которое применяется в составе косметики для загара и бронзанатах. Это именно то вещество, которое обеспечивает стойкий, долгосрочный, мягкий и равномерный загар разных оттенков коричневого цвета. Эритрулоза выполняет в косметике двойную функцию: это не только стойкий бронзант, но и эффективный солнцезащитный компонент. 96

ФРУКТОЗА В водных растворах фруктоза существует в виде смеси таутомеров, в которой преобладает β-Dфруктопираноза и содержится, при 20 °C, около 20 % βD-фруктофуранозы и около 5 % α-D-фруктофуранозы. Из водных растворов D-фруктоза кристаллизуется в пиранозной форме (D-фpyктoпиpaнозa) — бесцветных кристаллов, хорошо растворимых в воде, при низких температурах — в виде моно- и полугидратов, выше 21, 4 °C — в безводной форме. 97

СОРБОЗА И АСКОРБИНОВАЯ КИСЛОТА Сорбоза (от лат. sorbum - рябина), моносахарид из группы кетогексоз. Кристаллы сладкого вкуса, хорошо растворимы в воде. Существует в виде оптически-активных D- и L-форм. В природе (например, в сброженном бактериями соке рябины) встречается Lформа (tnл =159 161°С). В плодах семейства розоцветных распространён соответствующий сорбозе шестиатомный спирт - сорбит (в ягодах рябины - до 7%). Сорбоза может быть получена химическим путём (конденсацией глицеринового альдегида с диоксиацетоном в щелочной среде) или ферментативным (с помощью микроорганизмов) окислением Dсорбита. Последний метод используется в промышленности, т. к. сорбоза служит важным промежуточным продуктом в синтезе аскорбиновой кислоты (витамина С). 98
![СОРБОЗА И АСКОРБИНОВАЯ КИСЛОТА Ni, H 2 микроорганизмы L-сорбоза D-сорбит β, D-глюкоза [O] диацетон-2 СОРБОЗА И АСКОРБИНОВАЯ КИСЛОТА Ni, H 2 микроорганизмы L-сорбоза D-сорбит β, D-глюкоза [O] диацетон-2](https://present5.com/presentation/85938059_452691219/image-99.jpg)
СОРБОЗА И АСКОРБИНОВАЯ КИСЛОТА Ni, H 2 микроорганизмы L-сорбоза D-сорбит β, D-глюкоза [O] диацетон-2 кето-Lгулоновая кислота H+, H 2 O диацетон-L-сорбоза L-аскорбиновая кислота 99

ТАГАТОЗА • D-Тагатоза (tплав 134– 135 °С) является природной кетогексозой, отличается от фруктозы только различным расположением заместителей у четвертого углеродного атома; используется в качестве низкокалорийного подсластителя. Степень сладости тагатозы составляет 0, 92, она некариогенна, имеет низкую калорийность (1, 5 ккал/г), и для ее метаболизма не требуется инсулин. Получают D-тагатозу из лактозы в двухстадийном процессе. На первой стадии ферментативным гидролизом с использованием лактозы получают глюкозу и галактозу. На второй стадии галактозу изомеризуют действием гидроксида кальция. После очистки и кристаллизации получают кристаллический продукт чистотой более 99 %. Предложен также микробиологический способ получения тагатозы с использованием в качестве продуцента Lactobacillus gayonii 100
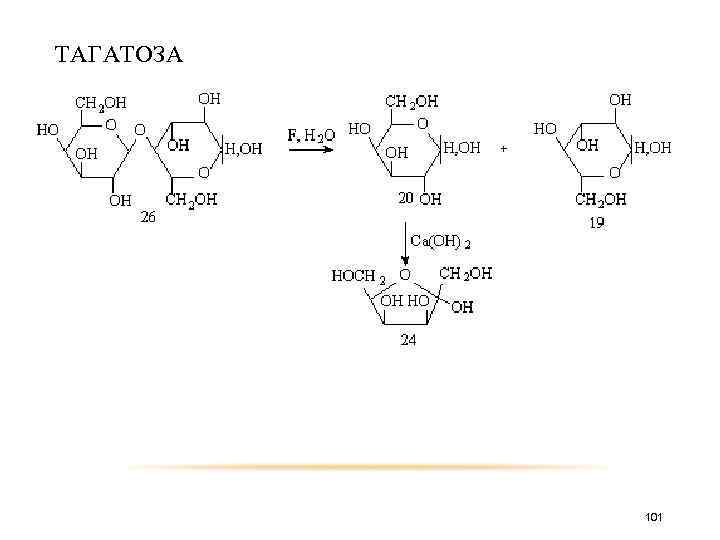
ТАГАТОЗА 101

РИБУЛОЗА Рибулоза (ribulose) [англ. rib(ose) — рибоза, от перестановки букв в англ. arabinose — арабиноза и франц. -ose — суффикс, обозначающий принадлежность к сахарам] — природный моносахарид (кетопентоза), имеющий кетонную группу у второго атома углерода; некоторые производные одного из стереоизомеров рибулозы (D-рибулозы) являются промежуточными продуктами обмена углеводов в организме. В форме бифосфата рибулоза участвует на начальных этапах фотосинтетического процесса. 102

КСИЛУЛОЗА (3 R, 4 S)-1, 3, 4, 5 -тетрагидроксипентан-2 -он - это кетопентоза, моносахарид, содержащий пять атомов углерода, и имеющий кетогруппу. В природе находится в форме L- и Dэнантиомеров. Кристаллическое вещество, хорошо растворимое в воде. Растворенная в воде D-ксилулоза находится в трех изомерных формах: в двух циклических (фуранозные таутомеры) и в линейной. Ксилулоза реагирует с Фелинговой жидкостью, при сильном нагревании с пиридином. Ксилулоза участвует в пентозофосфатном цикле окисления углеводов, образуясь из рибулозо-5 -фосфата под действием эпимеразы и являясь донором гликольальдегидной группы в транскетолазной реакции; гликольальдегидный фрагмент в этой реакции переносится к рибозо-5 -фосфату с образованием седогептулозо-7 -фосфата и к эритрозо -4 -фосфату с образованием фруктозо-6 -фосфата. 103

ПСИКОЗА • Псико за — моносахарид, относящийся к кетогексозам. В формуле Фишера у D(+)-формы все ОН -группы находятся справа. Гидролиз псикозы высвобождает только 0, 3 % энергии, высвобождаемой при гидролизе глюкозы. В природе псикоза обнаруживается только в следовых количествах. 104

ДИСАХАРИДЫ 105
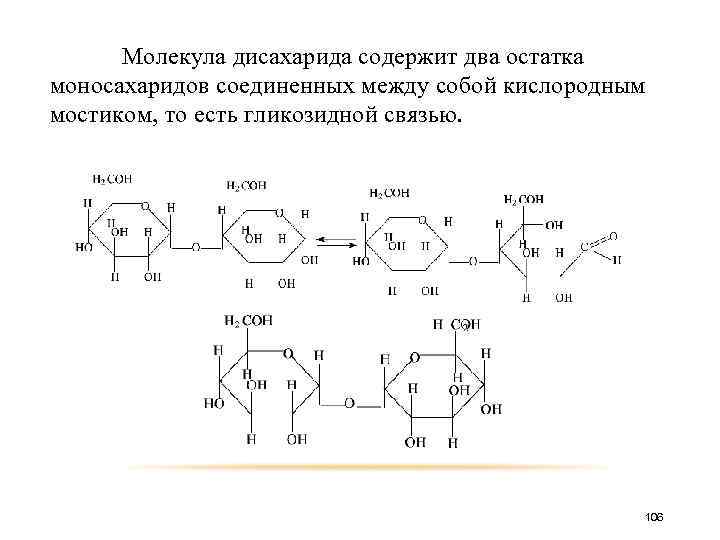
Молекула дисахарида содержит два остатка моносахаридов соединенных между собой кислородным мостиком, то есть гликозидной связью. 106

дисахариды Для дисахаридов характерны все те же химические реакции, что и для моносахаридов: • Действие алкоголятов • Действие ацилирующих агентов • Метилирование дисахаридов И для восстанавливающих дисахаридов характерны: • Восстановление • Удлинение цепи • Окисление 107
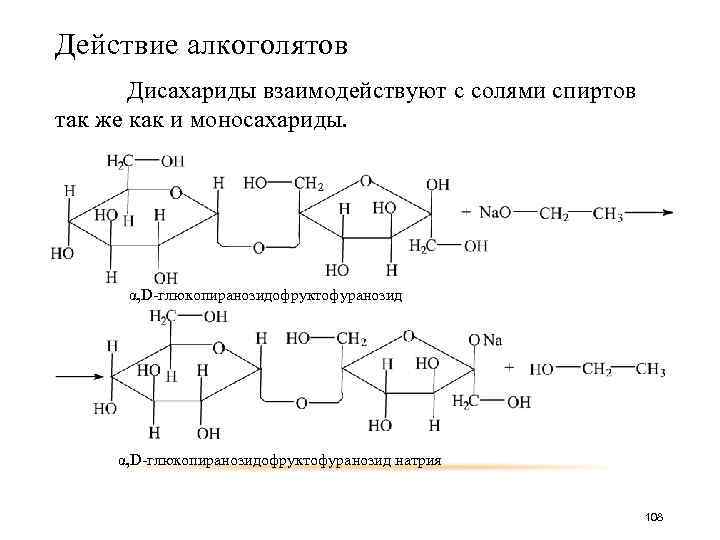
Действие алкоголятов Дисахариды взаимодействуют с солями спиртов так же как и моносахариды. α, D-глюкопиранозидофруктофуранозид натрия 108
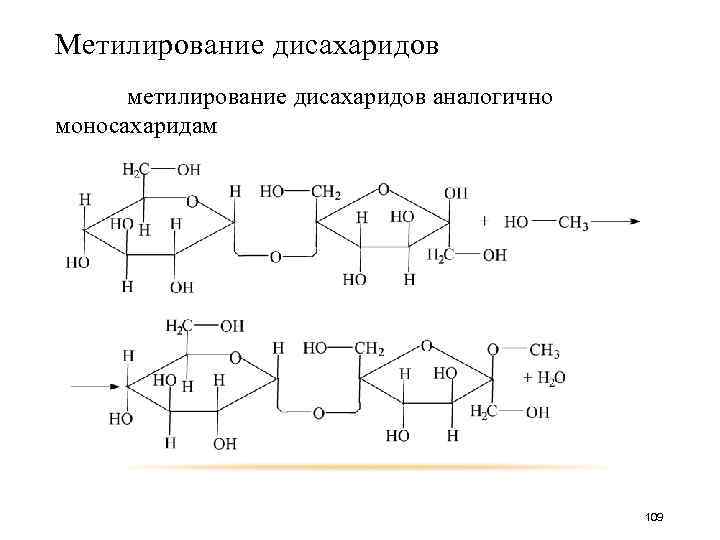
Метилирование дисахаридов метилирование дисахаридов аналогично моносахаридам 109
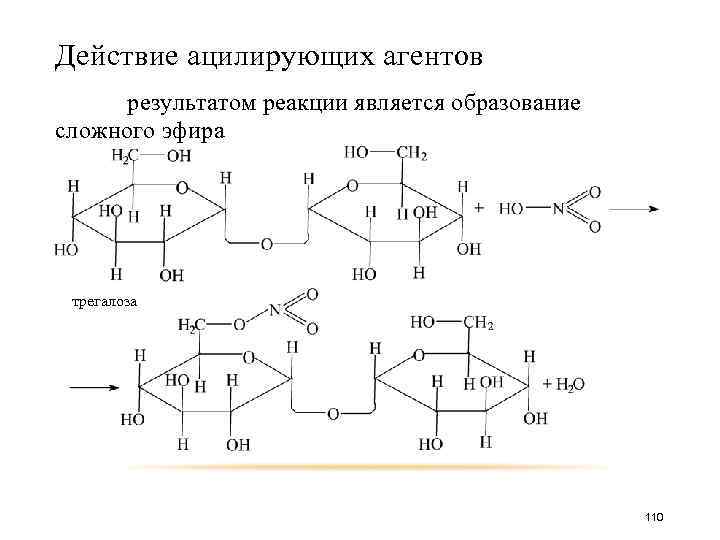
Действие ацилирующих агентов результатом реакции является образование сложного эфира трегалоза 110
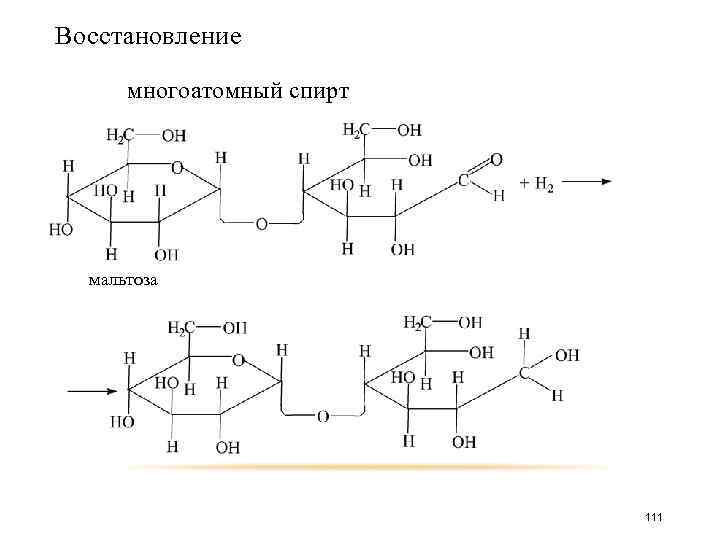
Восстановление многоатомный спирт мальтоза 111
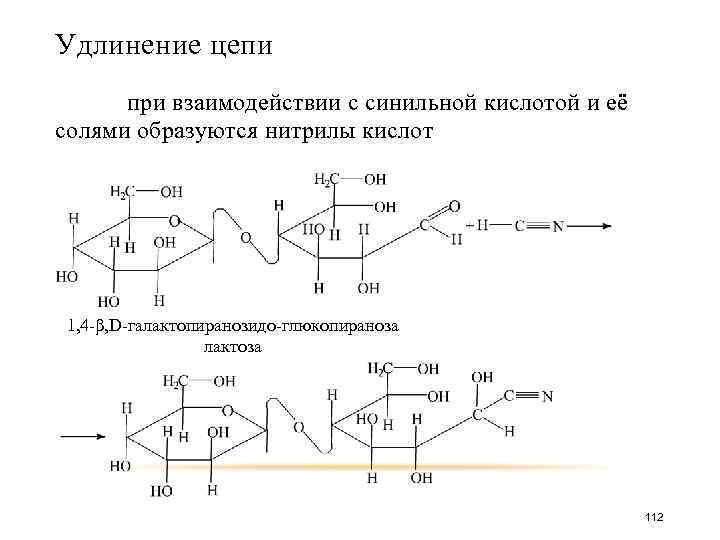
Удлинение цепи при взаимодействии с синильной кислотой и её солями образуются нитрилы кислот 1, 4 -β, D-галактопиранозидо-глюкопираноза лактоза 112

Окисление дисахаридов протекает не так глубоко, как моносахаридов. Кроме того окислению подвергаются только те из них, которые способны к существованию в открытой форме. И называют восстанавливающими сахарами. 113

Окисление 114

ПОЛИСАХАРИДЫ 115

Полисахариды – это углеводы, которые при гидролизе образуют сотни или даже тысячи моносахаридов. Это природные полимеры, которые являются продуктами поликонденсации альдоз и кетоз. 116

Полисахариды делятся на: üСахароподобные (олигосахариды) – низкомолекулярные углеводы, содержащие в молекуле небольшое число (2 10) остатков моноз. Они имеют ярко выраженное кристаллическое строение, растворяются в воде и обладают сладким вкусом. Одни из них обладают способностью восстанавливать слабые окислители (такие как ионы и ) и их относят к восстанавливающим, а остальные – к не восстанавливающим. 117

ü Несахароподобные – высокомолекулярные полисахариды, содержащие в молекуле от десятков до нескольких десятков тысяч остатков моноз, имеют ярко выраженное кристаллическое строение, не растворимы в воде и безвкусны. 118

Если молекулы полисахарида состоят из остатков одного моносахарида, он является гомополисахаридом, а если различных – гетерополисахаридом. 119

• 120

Общая формула полисахаридов 121

Наиболее важные представители o Крахмал o Целлюлоза o Гликоген 122

КРАХМАЛ Содержится в зернах растений и в картофеле. Обычно его выделяют из картофеля или кукурузных зерен. Образуется в виде микроскопических зернышек (20÷ 100 мкм), набухает в воде с последующим распадом и образованием вязких растворов, клейстеров (гелей). 123

КРАХМАЛ Представляет собой неоднородный полисахарид и состоит из полисахаридов: амилозы (≈20%) и амилопектина (≈80%). 124
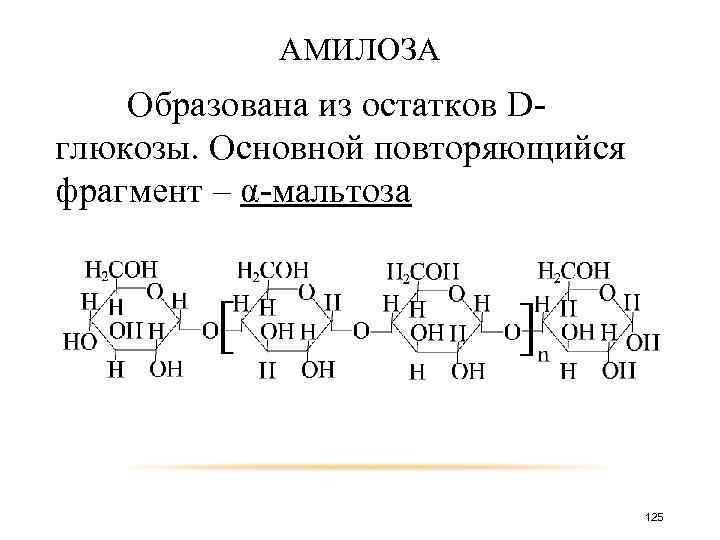
АМИЛОЗА Образована из остатков Dглюкозы. Основной повторяющийся фрагмент – α-мальтоза. 125

АМИЛОЗА В образовании кислородных мостиков участвует α-полуацетальный гидрок-сил одного моносахарида и четвертый гидроксил следующей молекулы (α-1, 4 глюкозид-глюкозидная связь). 126

Предположительно, амилоза состоит из длинных цепей, содержащих 200 и более звеньев D-глюкозы. Цепи, как правило, не разветвленные. Молекула амилозы свернута в спираль. В воде растворяется. С йодом образует интенсивное синее окрашивание. 127

АМИЛОПЕКТИН Молекула амилопектина характеризуется высокой степенью разветвления и состоит из нескольких стен коротких цепей, каждая из которых содержит по 20÷ 25 глюкозных остатков, связанных α-1, 4 гликозид-гликозидной, а отдельные цепи α-1, 6 -гликозидной. 128
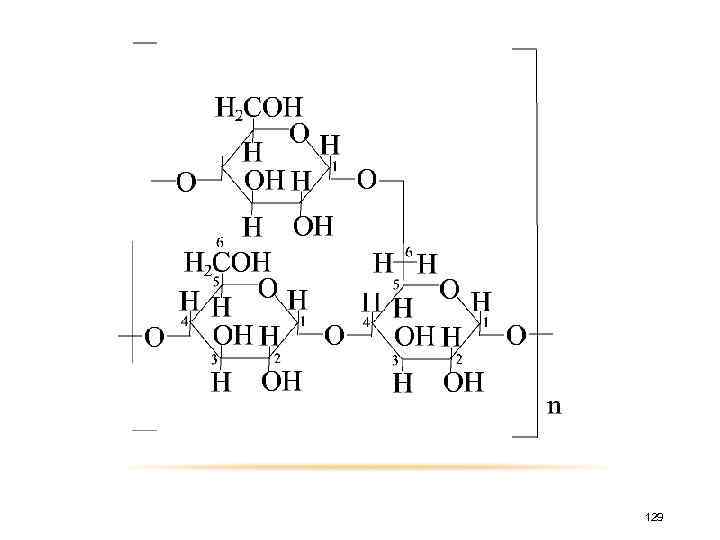
129
130

• В горячей воде набухает с образованием клейстера. • При взаимодействии с йодом образует соединение с фиолетовым окрашиванием. 131

В общем виде формула крахмала может быть представлена в следующем виде Не восстанавливающая часть Повторяющаяся часть Восстанавливающая часть 132

СВОЙСТВА КРАХМАЛА • Очень характерным свойством крахмала является цветная реакция с йодом. Образуется соединение с ярко синей окраской (max поглощения 620÷ 650 нм). 133

Считают, что появление окраски связано со специфическим донорноакцепторным взаимодействием между гидроксогруппами молекулы крахмала и молекулами йода, при этом йод помещается внутри спирали макромолекулы амилозы. 134

НАХОЖДЕНИЕ В ПРИРОДЕ. ПРИМЕНЕНИЕ. Крахмал имеет очень широкий спектр применения. Он является главной составной частью пищевых продуктов (хлеб, крупы, мука, картофель, кукуруза). 135

• Из него получают сироп и глюкозу. • В результате ферментативных процессов получают этиловый и нбутиловый спирты, молочную и лимонную кислоты и др. • При гидролизе крахмала происходит расщепление его молекулы на более мелкие полисахариды и, в конечном итоге, моносахариды. 136

137

ПРИМЕНЕНИЕ • Используют в текстильной промышленности для изготовления красок и клеев. • Применяют в медицине для изготовления присыпки, таблеток, мазей и д. р. ) 138

ГЛИКОГЕН Имеет структуру близкую к структуре амилопектина, но более разветвленную (с α-1, 4 и α-1, 6 гликозидными связями. Образуется только в животных организмах. С йодом дает красно-бурое окрашивание. 139

Целлюлоза (или клетчатка) широко распространенный в природе полисахарид. Она содержится в растениях и является главным компонентом древесины и растительного волокна. Примером чистой целлюлозы может быть рассмотрен хлопок, фильтровальная бумага. 140
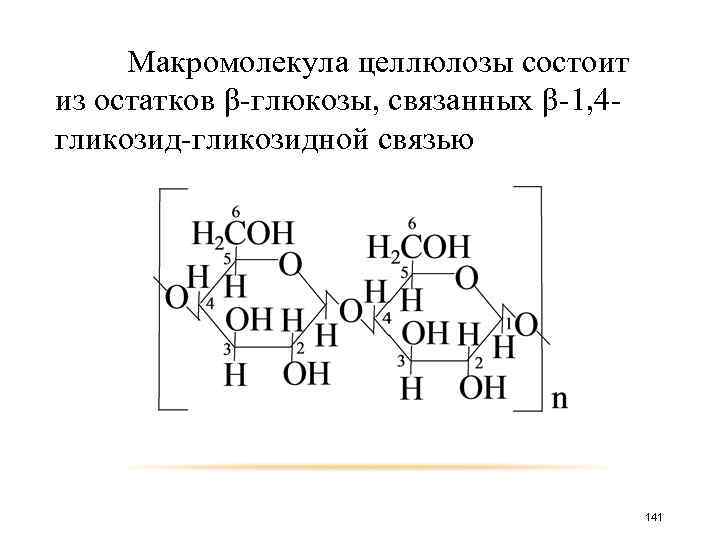
Макромолекула целлюлозы состоит из остатков β-глюкозы, связанных β-1, 4 гликозид-гликозидной связью 141
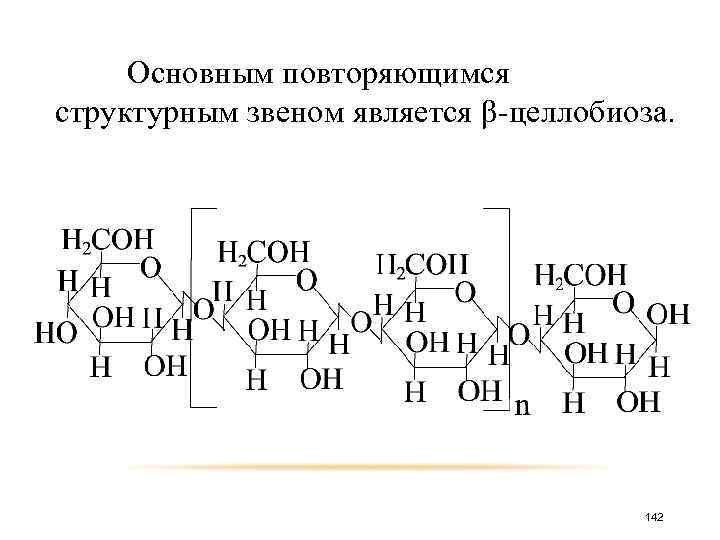
Основным повторяющимся структурным звеном является β-целлобиоза. 142
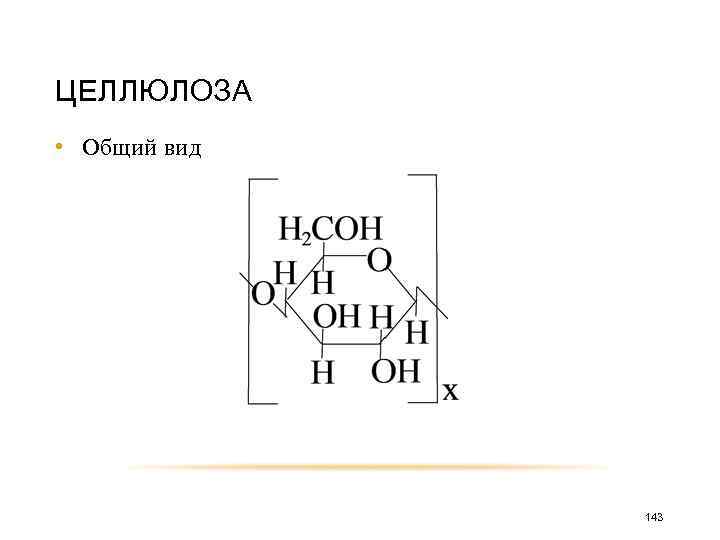
ЦЕЛЛЮЛОЗА • Общий вид 143
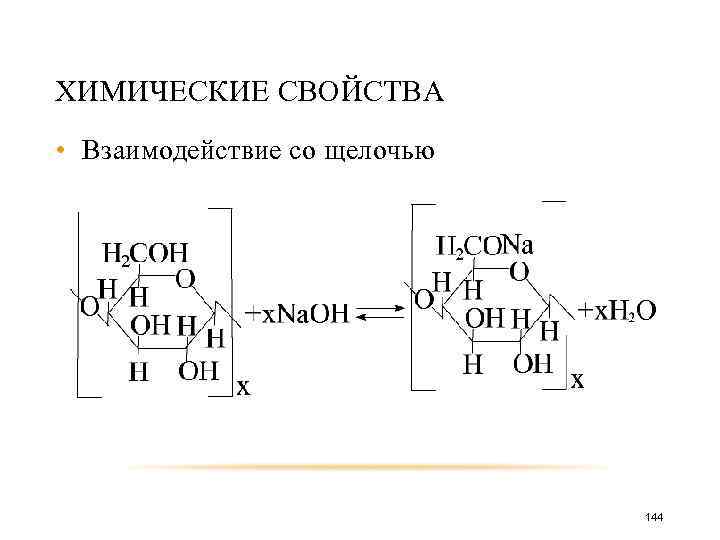
ХИМИЧЕСКИЕ СВОЙСТВА • Взаимодействие со щелочью 144
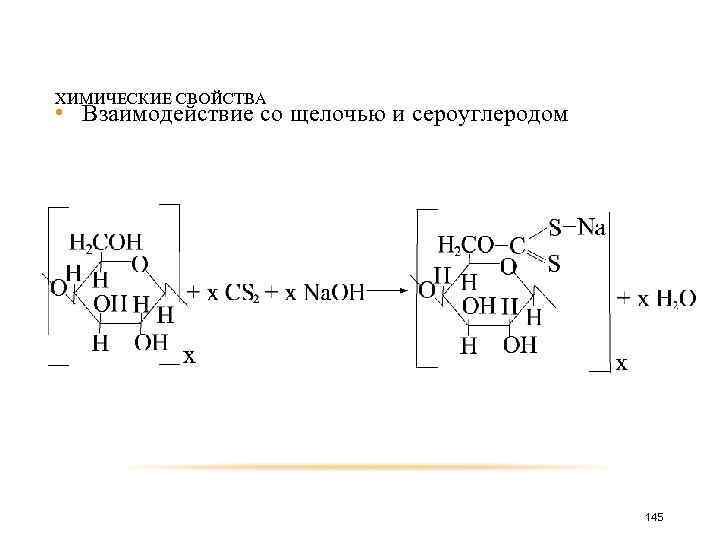
ХИМИЧЕСКИЕ СВОЙСТВА • Взаимодействие со щелочью и сероуглеродом 145
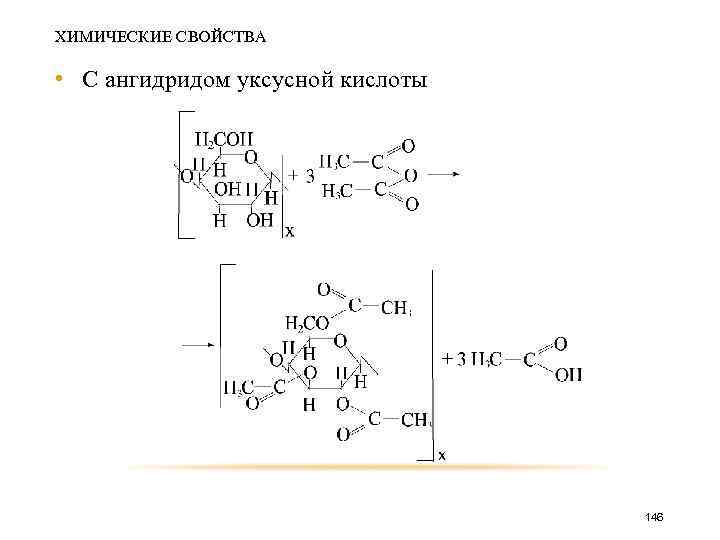
ХИМИЧЕСКИЕ СВОЙСТВА • С ангидридом уксусной кислоты 146
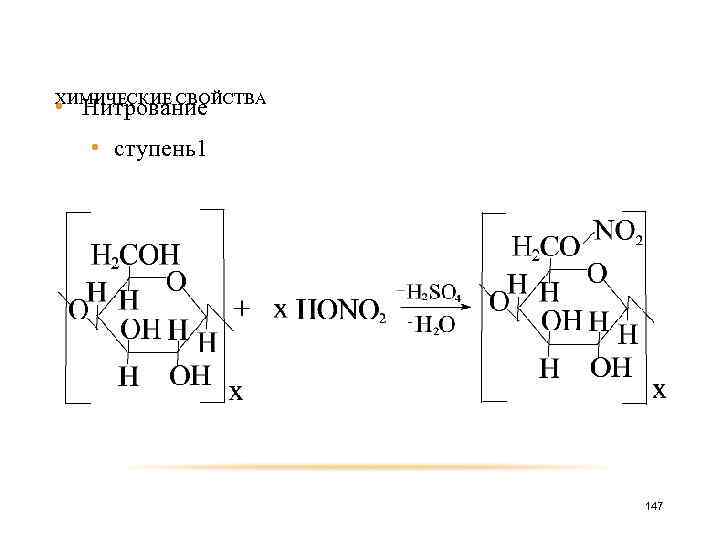
ХИМИЧЕСКИЕ СВОЙСТВА • Нитрование • ступень1 147
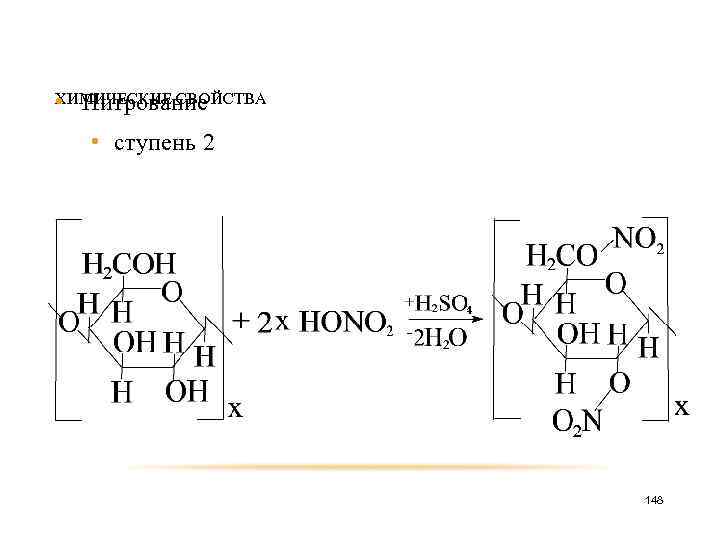
ХИМИЧЕСКИЕ СВОЙСТВА • Нитрование • ступень 2 148
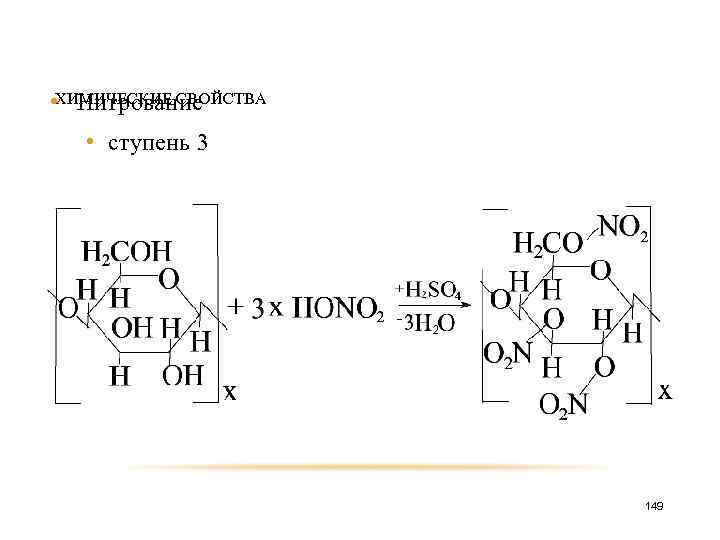
• ХИМИЧЕСКИЕ СВОЙСТВА Нитрование • ступень 3 149
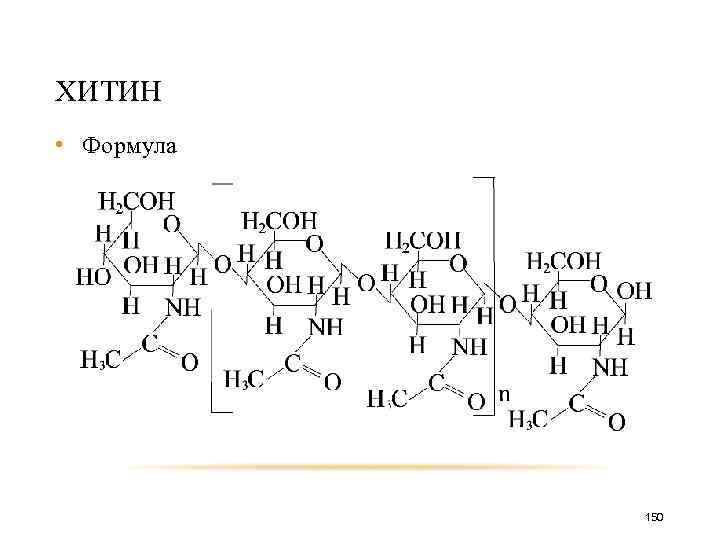
ХИТИН • Формула 150
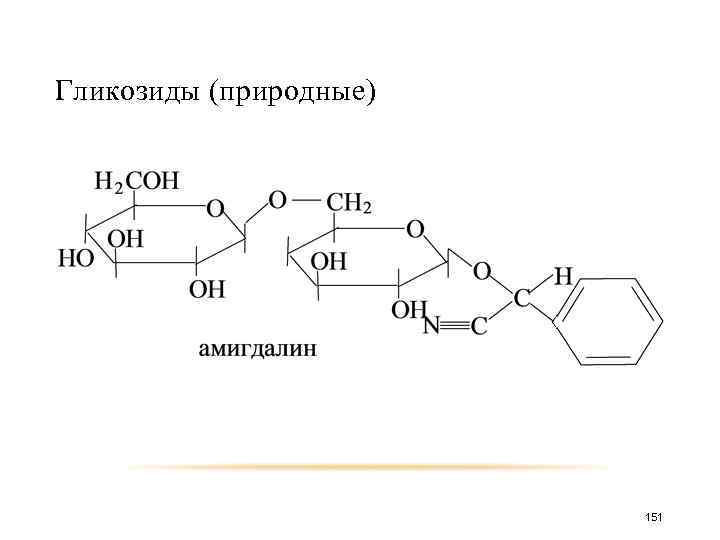
Гликозиды (природные) 151

Гликозиды (природные) 152

Гликозиды (природные) 153
УГЛЕВОДЫ нач.pptx