3. Конспект урока. Углеводороды. Природный газ. Алканы.ppt
- Количество слайдов: 15
 Углеводороды Природный газ. Алканы (предельные углеводороды, насыщенные углеводороды, парафины)
Углеводороды Природный газ. Алканы (предельные углеводороды, насыщенные углеводороды, парафины)
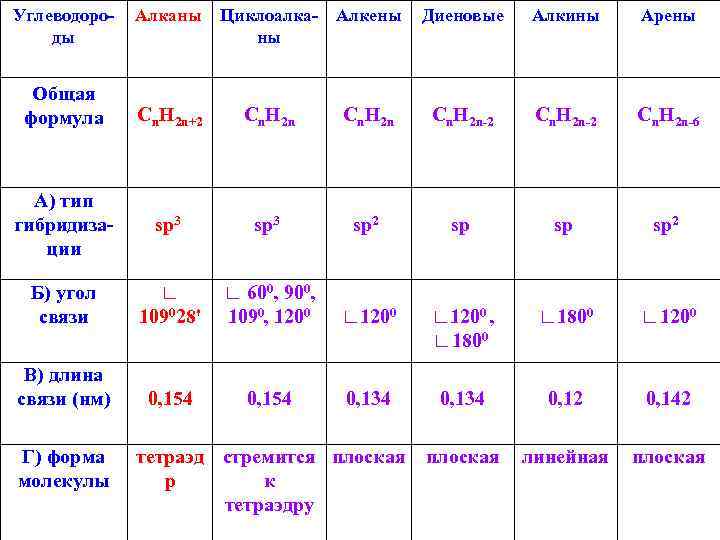 Углеводороды Общая формула Алканы Циклоалка- Алкены ны Диеновые Алкины Арены Cn. H 2 n+2 Cn. H 2 n-2 Cn. H 2 n-6 А) тип гибридизации sp 3 sp 2 sp sp 2 Б) угол связи ∟ 109028' ∟ 1200 , ∟ 1800 ∟ 1200 0, 134 0, 12 0, 142 плоская линейная плоская В) длина связи (нм) Г) форма молекулы 0, 154 ∟ 600, 900, 1090, 1200 ∟ 1200 0, 154 0, 134 тетраэд стремится плоская р к тетраэдру
Углеводороды Общая формула Алканы Циклоалка- Алкены ны Диеновые Алкины Арены Cn. H 2 n+2 Cn. H 2 n-2 Cn. H 2 n-6 А) тип гибридизации sp 3 sp 2 sp sp 2 Б) угол связи ∟ 109028' ∟ 1200 , ∟ 1800 ∟ 1200 0, 134 0, 12 0, 142 плоская линейная плоская В) длина связи (нм) Г) форма молекулы 0, 154 ∟ 600, 900, 1090, 1200 ∟ 1200 0, 154 0, 134 тетраэд стремится плоская р к тетраэдру
 Алканы – это органические ациклические соединения, состоящие из атомов химических элементов углерода и водорода. • С 1 – С 4 – газы. • С 5 – С 15 – жидкости. • С 16 –… – твердые вещества (парафины). В молекулах алканов только одинарные (ϭ – связи).
Алканы – это органические ациклические соединения, состоящие из атомов химических элементов углерода и водорода. • С 1 – С 4 – газы. • С 5 – С 15 – жидкости. • С 16 –… – твердые вещества (парафины). В молекулах алканов только одинарные (ϭ – связи).
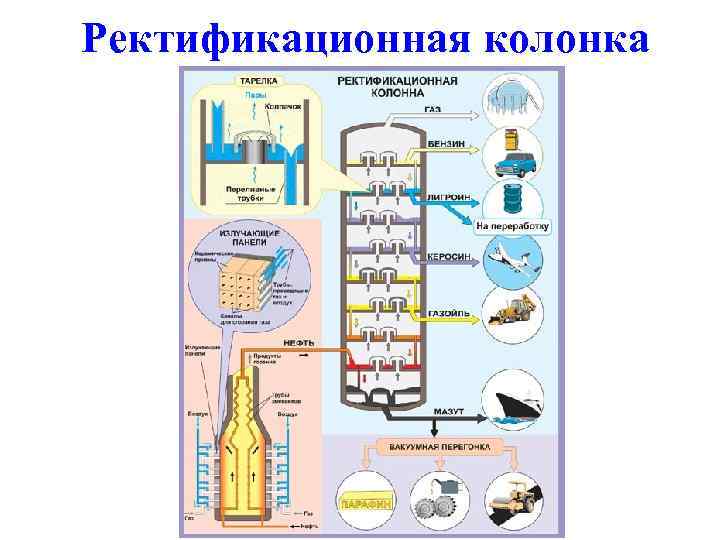 Ректификационная колонка
Ректификационная колонка
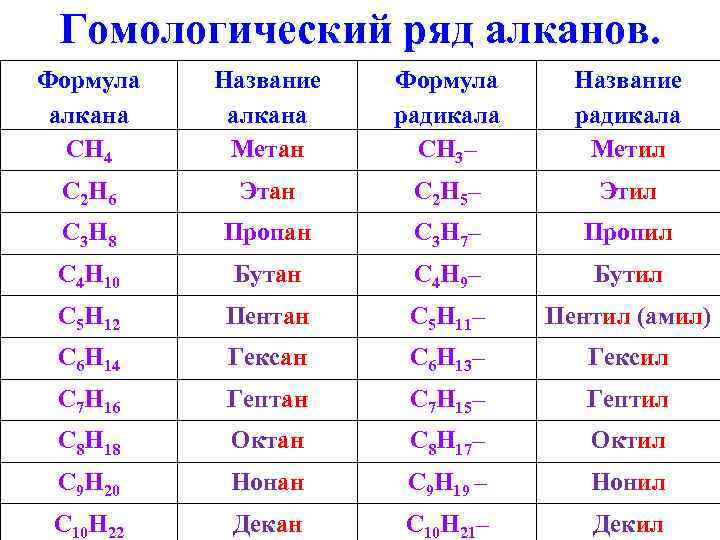 Гомологический ряд алканов. Формула алкана CH 4 Название алкана Метан Формула радикала CH 3– Название радикала Метил C 2 H 6 Этан C 2 H 5– Этил C 3 H 8 Пропан C 3 H 7– Пропил C 4 H 10 Бутан C 4 H 9– Бутил C 5 H 12 Пентан C 5 H 11– Пентил (амил) C 6 H 14 Гексан C 6 H 13– Гексил C 7 H 16 Гептан C 7 H 15– Гептил C 8 H 18 Октан C 8 H 17– Октил C 9 H 20 Нонан C 9 H 19 – Нонил C 10 H 22 Декан C 10 H 21– Декил
Гомологический ряд алканов. Формула алкана CH 4 Название алкана Метан Формула радикала CH 3– Название радикала Метил C 2 H 6 Этан C 2 H 5– Этил C 3 H 8 Пропан C 3 H 7– Пропил C 4 H 10 Бутан C 4 H 9– Бутил C 5 H 12 Пентан C 5 H 11– Пентил (амил) C 6 H 14 Гексан C 6 H 13– Гексил C 7 H 16 Гептан C 7 H 15– Гептил C 8 H 18 Октан C 8 H 17– Октил C 9 H 20 Нонан C 9 H 19 – Нонил C 10 H 22 Декан C 10 H 21– Декил
 Номенклатура ИЮПАК Правила при составлении названий алканов: • В структурной формуле выбирают самую длинную цепь атомов углерода (главная цепь). • Атомы углерода главной цепи нумеруют, начиная с того конца, к которому ближе разветвление. • В начале перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. (Примечание) • Основой служит наименование предельного углеводорода с тем же числом атомов углерода,
Номенклатура ИЮПАК Правила при составлении названий алканов: • В структурной формуле выбирают самую длинную цепь атомов углерода (главная цепь). • Атомы углерода главной цепи нумеруют, начиная с того конца, к которому ближе разветвление. • В начале перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. (Примечание) • Основой служит наименование предельного углеводорода с тем же числом атомов углерода,
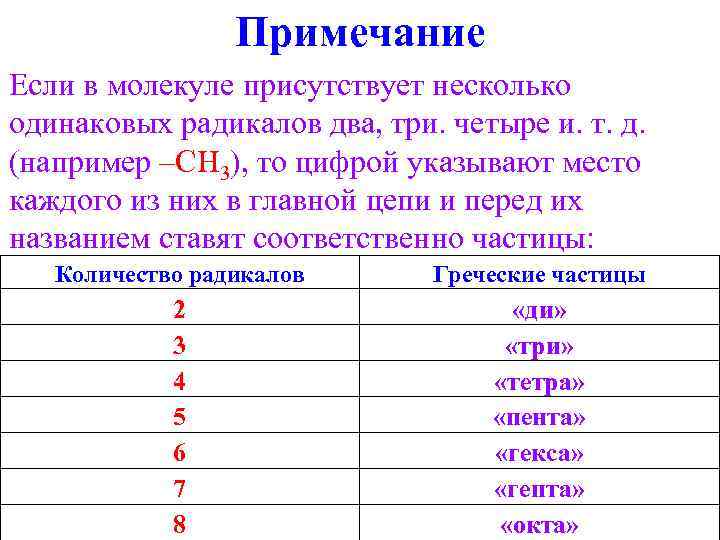 Примечание Если в молекуле присутствует несколько одинаковых радикалов два, три. четыре и. т. д. (например –CH 3), то цифрой указывают место каждого из них в главной цепи и перед их названием ставят соответственно частицы: Количество радикалов Греческие частицы 2 3 4 5 6 7 8 «ди» «три» «тетра» «пента» «гекса» «гепта» «окта»
Примечание Если в молекуле присутствует несколько одинаковых радикалов два, три. четыре и. т. д. (например –CH 3), то цифрой указывают место каждого из них в главной цепи и перед их названием ставят соответственно частицы: Количество радикалов Греческие частицы 2 3 4 5 6 7 8 «ди» «три» «тетра» «пента» «гекса» «гепта» «окта»
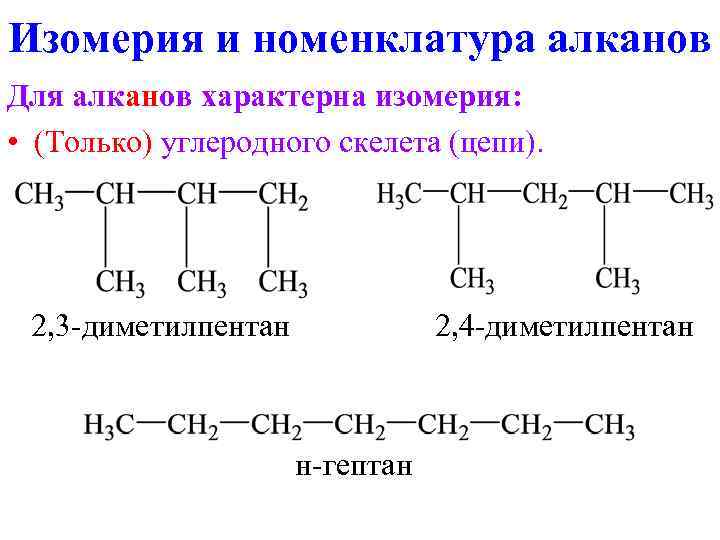 Изомерия и номенклатура алканов Для алканов характерна изомерия: • (Только) углеродного скелета (цепи). 2, 3 -диметилпентан 2, 4 -диметилпентан н-гептан
Изомерия и номенклатура алканов Для алканов характерна изомерия: • (Только) углеродного скелета (цепи). 2, 3 -диметилпентан 2, 4 -диметилпентан н-гептан
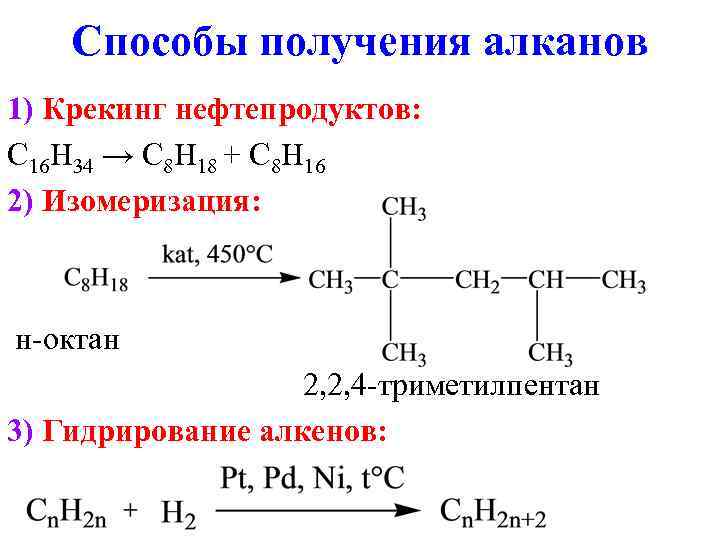 Способы получения алканов 1) Крекинг нефтепродуктов: C 16 H 34 → C 8 H 18 + C 8 H 16 2) Изомеризация: н-октан 2, 2, 4 -триметилпентан 3) Гидрирование алкенов:
Способы получения алканов 1) Крекинг нефтепродуктов: C 16 H 34 → C 8 H 18 + C 8 H 16 2) Изомеризация: н-октан 2, 2, 4 -триметилпентан 3) Гидрирование алкенов:
 4) Декарбоксилирование натриевых солей карбоновых кислот (р-я Дюма): СН 3 СОONа + Nа. ОН → СН 4 + Nа 2 СO 3 ацетат натрия метан 5) Синтез Вюрца: 2 СН 3 СН 2 Вr + 2 Nа → СН 3–СН 2–СН 3 + 2 Nа. Вr бромэтан н-бутан 6) Гидролиз карбидов: Аl 4 С 3 + 12 Н 2 O → ЗСН 4 + 4 Аl(ОН)3 метан
4) Декарбоксилирование натриевых солей карбоновых кислот (р-я Дюма): СН 3 СОONа + Nа. ОН → СН 4 + Nа 2 СO 3 ацетат натрия метан 5) Синтез Вюрца: 2 СН 3 СН 2 Вr + 2 Nа → СН 3–СН 2–СН 3 + 2 Nа. Вr бромэтан н-бутан 6) Гидролиз карбидов: Аl 4 С 3 + 12 Н 2 O → ЗСН 4 + 4 Аl(ОН)3 метан
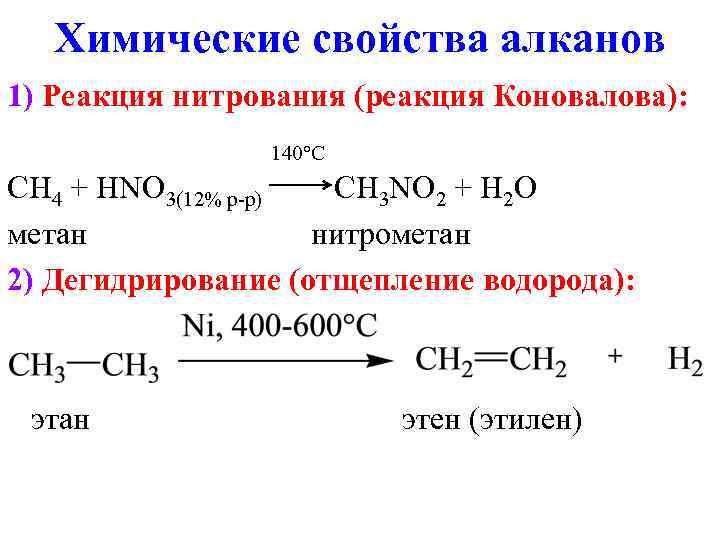 Химические свойства алканов 1) Реакция нитрования (реакция Коновалова): 140°C CH 4 + HNO 3(12% р-р) CH 3 NO 2 + H 2 O метан нитрометан 2) Дегидрирование (отщепление водорода): этан этен (этилен)
Химические свойства алканов 1) Реакция нитрования (реакция Коновалова): 140°C CH 4 + HNO 3(12% р-р) CH 3 NO 2 + H 2 O метан нитрометан 2) Дегидрирование (отщепление водорода): этан этен (этилен)
 Химические свойства алканов 3) Галогенирование (Cl 2, Br 2) на свету: hv CH 4 + Cl 2 → CH 3 Cl + HCl метан хлорметан hv CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl дихлорметан hv CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl трихлорметан hv CHCl 3 + Cl 2 → CCl 4 + HCl тетрахлорметан
Химические свойства алканов 3) Галогенирование (Cl 2, Br 2) на свету: hv CH 4 + Cl 2 → CH 3 Cl + HCl метан хлорметан hv CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl дихлорметан hv CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl трихлорметан hv CHCl 3 + Cl 2 → CCl 4 + HCl тетрахлорметан
 Химические свойства алканов 4) Горение (полное окисление): t°C C 2 H 6 + 7 O 2 → 4 СO 2↑ + 6 H 2 O + Q к. Дж При недостатке кислорода образуется угарный газ: t°C C 2 H 6 + 5 O 2 → 4 СO↑ + 6 H 2 O + Q к. Дж 5) Неполное окисление: t, p, кат C 2 H 5 OH (этанол) C 2 H 6 + [O] CH 3 CHO (этаналь) CH 3 COOH (уксусная кис-та) 6 CH 4 + O 2 → 2 C 2 H 2↑ + 2 CO↑ + 10 H 2↑ метан ацетилен
Химические свойства алканов 4) Горение (полное окисление): t°C C 2 H 6 + 7 O 2 → 4 СO 2↑ + 6 H 2 O + Q к. Дж При недостатке кислорода образуется угарный газ: t°C C 2 H 6 + 5 O 2 → 4 СO↑ + 6 H 2 O + Q к. Дж 5) Неполное окисление: t, p, кат C 2 H 5 OH (этанол) C 2 H 6 + [O] CH 3 CHO (этаналь) CH 3 COOH (уксусная кис-та) 6 CH 4 + O 2 → 2 C 2 H 2↑ + 2 CO↑ + 10 H 2↑ метан ацетилен
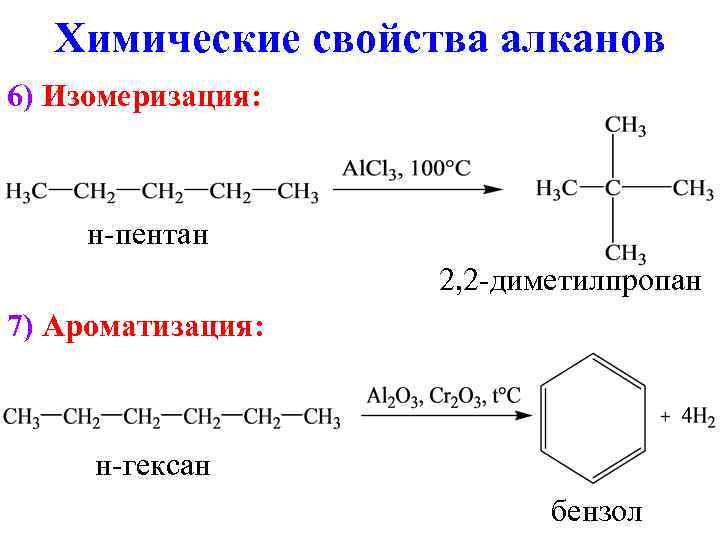 Химические свойства алканов 6) Изомеризация: н-пентан 2, 2 -диметилпропан 7) Ароматизация: н-гексан бензол
Химические свойства алканов 6) Изомеризация: н-пентан 2, 2 -диметилпропан 7) Ароматизация: н-гексан бензол
 Химические свойства алканов 8) Пиролиз (разложение) метана: 1000°C CH 4 C + 2 H 2 Ni, 1000°C 2 CH 4 C 2 H 4 + 2 H 2 1500°C 2 CH 4 C 2 H 2 +3 H 2 ацетилен 9) Сульфирование: t°C CH 4 + HO–SO 3 H(конц) → CH 3 SO 3 H + H 2 O метан сульфометан
Химические свойства алканов 8) Пиролиз (разложение) метана: 1000°C CH 4 C + 2 H 2 Ni, 1000°C 2 CH 4 C 2 H 4 + 2 H 2 1500°C 2 CH 4 C 2 H 2 +3 H 2 ацетилен 9) Сульфирование: t°C CH 4 + HO–SO 3 H(конц) → CH 3 SO 3 H + H 2 O метан сульфометан


