Лекции Органическая химия.pptx
- Количество слайдов: 40
 Углеводороды - органические соединения, состоящие из двух элементов - углерода и водорода. Предельными (насыщенными) называют углеводороды, которые не присоединяют водород и другие элементы, это углеводороды, в которых атомы углерода связаны между собой одинарными (простыми) связями.
Углеводороды - органические соединения, состоящие из двух элементов - углерода и водорода. Предельными (насыщенными) называют углеводороды, которые не присоединяют водород и другие элементы, это углеводороды, в которых атомы углерода связаны между собой одинарными (простыми) связями.
 Непредельными (ненасыщенными) называют углеводороды с открытой цепью, в молекулах которых между атомами углерода имеются двойные или тройные связи (кратные). Ароматическими называются углеводороды в молекулах, которых имеется бензольное ядро (кольцо).
Непредельными (ненасыщенными) называют углеводороды с открытой цепью, в молекулах которых между атомами углерода имеются двойные или тройные связи (кратные). Ароматическими называются углеводороды в молекулах, которых имеется бензольное ядро (кольцо).
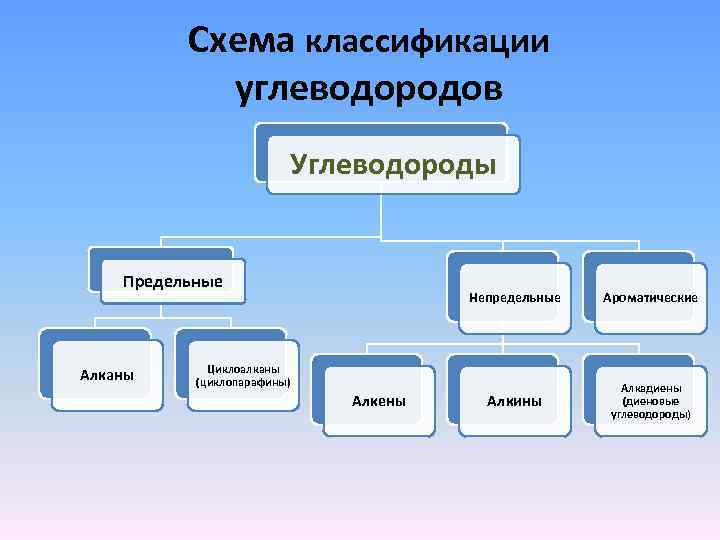 Схема классификации углеводородов Углеводороды Предельные Алканы Непредельные Ароматические Алкины Алкадиены (диеновые углеводороды) Циклоалканы (циклопарафины) Алкены
Схема классификации углеводородов Углеводороды Предельные Алканы Непредельные Ароматические Алкины Алкадиены (диеновые углеводороды) Циклоалканы (циклопарафины) Алкены
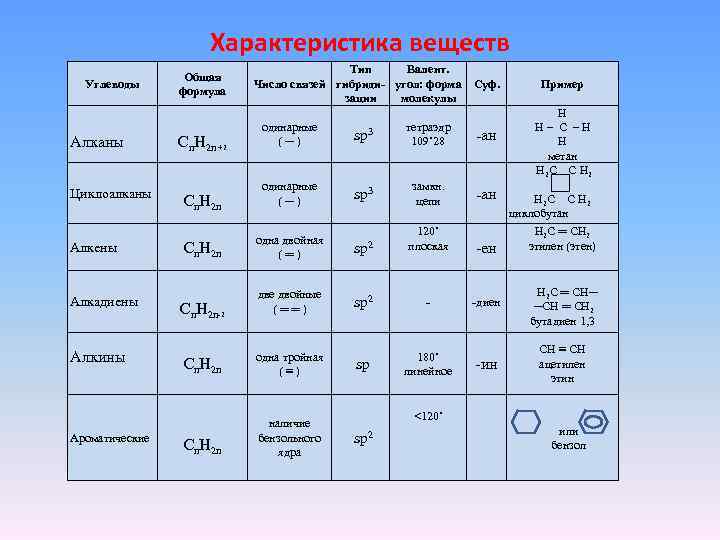 Характеристика веществ Углеводы Алканы Циклоалканы Алкены Алкадиены Алкины Ароматические Общая формула Тип Валент. Число связей гибриди- угол: форма зации молекулы Cn. H 2 n +2 одинарные (─) Суф. Пример Н Н– С –Н Н метан H 2 С С H 2 sp 3 тетраэдр 109˚ 28 -ан Cn. H 2 n одинарные (─) sp 3 замкн. цепи -ан Cn. H 2 n одна двойная (═) sp 2 120˚ плоская -ен Cn. H 2 n-2 две двойные (══) sp 2 - -диен Н 2 С ═ CH─ ─CH ═ CH 2 бутадиен 1, 3 Cn. H 2 n одна тройная (≡) sp 180˚ линейное -ин CH ≡ CH ацетилен этин Cn. H 2 n наличие бензольного ядра H 2 С С H 2 циклобутан Н 2 С ═ CH 2 этилен (этен) <120˚ sp 2 или бензол
Характеристика веществ Углеводы Алканы Циклоалканы Алкены Алкадиены Алкины Ароматические Общая формула Тип Валент. Число связей гибриди- угол: форма зации молекулы Cn. H 2 n +2 одинарные (─) Суф. Пример Н Н– С –Н Н метан H 2 С С H 2 sp 3 тетраэдр 109˚ 28 -ан Cn. H 2 n одинарные (─) sp 3 замкн. цепи -ан Cn. H 2 n одна двойная (═) sp 2 120˚ плоская -ен Cn. H 2 n-2 две двойные (══) sp 2 - -диен Н 2 С ═ CH─ ─CH ═ CH 2 бутадиен 1, 3 Cn. H 2 n одна тройная (≡) sp 180˚ линейное -ин CH ≡ CH ацетилен этин Cn. H 2 n наличие бензольного ядра H 2 С С H 2 циклобутан Н 2 С ═ CH 2 этилен (этен) <120˚ sp 2 или бензол
 Гомологический ряд алканов. Номенклатура и изомерия. • Гомологические ряды – группы родственных органических соединений, обладающими сходными химическими свойствами и отличающихся друг от друга на одну или несколько групп – СН 2 – в молекуле. • Гомологи – вещества, сходные по строению и химическим свойствам, но отличающиеся друг от друга по составу молекул на одну или несколько групп атомов – СН 2 – (называемой гомологической разностью).
Гомологический ряд алканов. Номенклатура и изомерия. • Гомологические ряды – группы родственных органических соединений, обладающими сходными химическими свойствами и отличающихся друг от друга на одну или несколько групп – СН 2 – в молекуле. • Гомологи – вещества, сходные по строению и химическим свойствам, но отличающиеся друг от друга по составу молекул на одну или несколько групп атомов – СН 2 – (называемой гомологической разностью).
 • Изомеры – вещества, имеющие одинаковый качественный и количественный состав, но различающиеся по строению, физическим и химическим свойствам. Сn. H 2 n+2 – общая формула гомологического ряда алканов. • Радикал – частица (атом, молекула, ион), характеризующаяся наличием неспаренного электрона, которая образуется при отрыве одного атома водорода от атома предельного углеводорода.
• Изомеры – вещества, имеющие одинаковый качественный и количественный состав, но различающиеся по строению, физическим и химическим свойствам. Сn. H 2 n+2 – общая формула гомологического ряда алканов. • Радикал – частица (атом, молекула, ион), характеризующаяся наличием неспаренного электрона, которая образуется при отрыве одного атома водорода от атома предельного углеводорода.
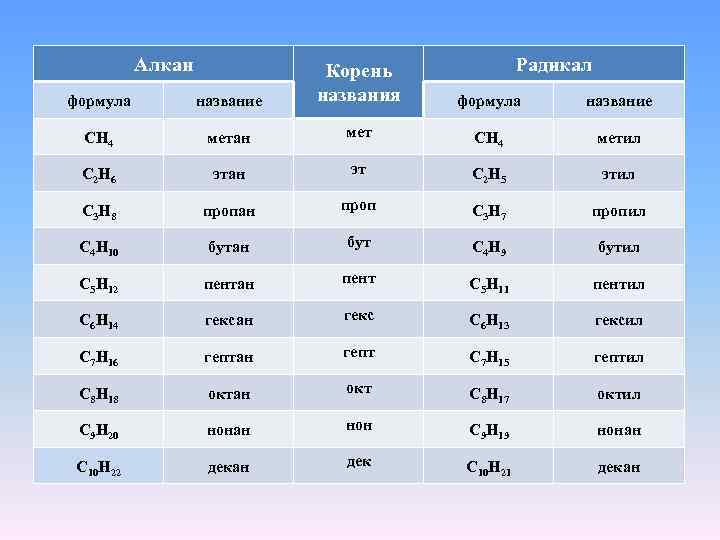 Алкан формула название Корень названия CH 4 метан C 2 H 6 Радикал формула название мет CH 4 метил этан эт C 2 H 5 этил C 3 H 8 пропан проп C 3 H 7 пропил C 4 H 10 бутан бут C 4 H 9 бутил C 5 H 12 пентан пент C 5 H 11 пентил C 6 H 14 гексан гекс C 6 H 13 гексил C 7 H 16 гептан гепт C 7 H 15 гептил C 8 H 18 октан окт C 8 H 17 октил C 9 H 20 нонан нон C 9 H 19 нонан C 10 H 22 декан дек C 10 H 21 декан
Алкан формула название Корень названия CH 4 метан C 2 H 6 Радикал формула название мет CH 4 метил этан эт C 2 H 5 этил C 3 H 8 пропан проп C 3 H 7 пропил C 4 H 10 бутан бут C 4 H 9 бутил C 5 H 12 пентан пент C 5 H 11 пентил C 6 H 14 гексан гекс C 6 H 13 гексил C 7 H 16 гептан гепт C 7 H 15 гептил C 8 H 18 октан окт C 8 H 17 октил C 9 H 20 нонан нон C 9 H 19 нонан C 10 H 22 декан дек C 10 H 21 декан
 Номенклатура: 1. Выбирают самую длинную углеродную цепь и пронумеровывают атомы углерода, начиная с того конца цепи, к которому ближе разветвление. 5 4 3 2 1 3 4 5 1 2 3 4 5 а)СН 3 – СН 2 – СН 3 б)СН 3 – СН 2 – СН 3 в) СН 3 - СН- СН 2 - СН 3 2 СН 2 СН 3 1 СН 3 2. Называют радикалы(начиная с простейшего) и при помощи цифр указывают их место у нумерованных атомов углерода. Если у одного ит номер повторяют дважды. Число одинаковых радикалов указывают при помощи чисел на греческом языке ( «ди» - два, «три» - три, «тетра» - четыре…). СН 3 1 2 3 4 г) СН 3 – СН 3 СН 3
Номенклатура: 1. Выбирают самую длинную углеродную цепь и пронумеровывают атомы углерода, начиная с того конца цепи, к которому ближе разветвление. 5 4 3 2 1 3 4 5 1 2 3 4 5 а)СН 3 – СН 2 – СН 3 б)СН 3 – СН 2 – СН 3 в) СН 3 - СН- СН 2 - СН 3 2 СН 2 СН 3 1 СН 3 2. Называют радикалы(начиная с простейшего) и при помощи цифр указывают их место у нумерованных атомов углерода. Если у одного ит номер повторяют дважды. Число одинаковых радикалов указывают при помощи чисел на греческом языке ( «ди» - два, «три» - три, «тетра» - четыре…). СН 3 1 2 3 4 г) СН 3 – СН 3 СН 3
 Номенклатура: 3) При наличии разных радикалов, их названия перечисляют в алфавитном ого же атома углерода находятся два одинаковых радикала, тогда 1 2 3 4 5 6 г) СН 3 – СН 2 – СН 3 СН 3 С 2 Н 5 4) По числу атомов углевода в нумерованной цепи дают название данному углеводороду. а) 2 – метилпентан; г) 3 -метил-4 -этилгексал б) 3 – метилпентан; д) 2, 3 -диметилпентан в) 2, 2, 3 -триметилбутан
Номенклатура: 3) При наличии разных радикалов, их названия перечисляют в алфавитном ого же атома углерода находятся два одинаковых радикала, тогда 1 2 3 4 5 6 г) СН 3 – СН 2 – СН 3 СН 3 С 2 Н 5 4) По числу атомов углевода в нумерованной цепи дают название данному углеводороду. а) 2 – метилпентан; г) 3 -метил-4 -этилгексал б) 3 – метилпентан; д) 2, 3 -диметилпентан в) 2, 2, 3 -триметилбутан
 Изомерия: 1. Изомерия углеродного скелета (начиная с С 4 Н 10). С – С – С С – С прямая цепь С разветвленная цепь 2. Оптическая изомерия (начиная с С 7 Н 16).
Изомерия: 1. Изомерия углеродного скелета (начиная с С 4 Н 10). С – С – С С – С прямая цепь С разветвленная цепь 2. Оптическая изомерия (начиная с С 7 Н 16).
 Получение 1. В лаборатории: а) из солей карбоновых кислот (реакция Дюма); CH 3 COONa + Na. OH → CH 4↑ +Na 2 CO 3 б) из галогенопроизводных алканов (реакция Вюрца). СН 3 – I + 2 Na → СН 3 – СН 3 + 2 Na I 2. В промышленности: а) из нефти; б) из природного и попутного нефтяных газов; в) каталитическое гидрирование этиленовых углеводородов. kat С 3 Н 6 + Н 2 → С 3 Н 8
Получение 1. В лаборатории: а) из солей карбоновых кислот (реакция Дюма); CH 3 COONa + Na. OH → CH 4↑ +Na 2 CO 3 б) из галогенопроизводных алканов (реакция Вюрца). СН 3 – I + 2 Na → СН 3 – СН 3 + 2 Na I 2. В промышленности: а) из нефти; б) из природного и попутного нефтяных газов; в) каталитическое гидрирование этиленовых углеводородов. kat С 3 Н 6 + Н 2 → С 3 Н 8
 Физические свойства С 1 – С 4 – газы, С 5 – С 15 – жидкости, далее твердые вещества. Ткип неразветв. выше, а у разветв. Ткип ниже Химические свойства Связи прочные, низкая поляризуемость, трудно разорвать, поэтому: Свободнорадикальный механизм СН 3 ׃ Н → СН 3 • + Н • . Для алканов характерны реакции замещения атомов водорода на другие атомы или группы атомов, т. е. реакции, протекающие по свободнорадикальному механизму, замещение идет в первую oчередь по менее гидрогенизированному атому водорода.
Физические свойства С 1 – С 4 – газы, С 5 – С 15 – жидкости, далее твердые вещества. Ткип неразветв. выше, а у разветв. Ткип ниже Химические свойства Связи прочные, низкая поляризуемость, трудно разорвать, поэтому: Свободнорадикальный механизм СН 3 ׃ Н → СН 3 • + Н • . Для алканов характерны реакции замещения атомов водорода на другие атомы или группы атомов, т. е. реакции, протекающие по свободнорадикальному механизму, замещение идет в первую oчередь по менее гидрогенизированному атому водорода.
 Дегидрирование – реакция отщепления водорода от соединений в присутствии катализаторов. Крекинг – процесс расщепления углеводородов, в результате которого образуются углеводороды с меньшим числом атомов углерода в молекуле.
Дегидрирование – реакция отщепления водорода от соединений в присутствии катализаторов. Крекинг – процесс расщепления углеводородов, в результате которого образуются углеводороды с меньшим числом атомов углерода в молекуле.
 Химические свойства Сn. H 2 n+2 Горение (+ О 2) → СО 2 + Н 2 О Разложение (t) → C + H 2 t = 1500˚C → С 2 H 2 + Н 2 (для метана) Крекинг → алкан + алкадиен Дегидрирование (-Н 2; kat-pt) → алкен, алкин изомеризация (t˚; kat) → изомер галогенирование (hν) (+Cl 2; Br 2) →Cn. H 2 n + 1 Cl + HCl нитрование (400˚C) (+HNO 3) →Cn. H 2 n + 1 NO 2 + H 2 O окисление CH 4 (t = 340˚C) t = 1500˚C, катализ. а) CH 4 +O 2→ CO + 2 H 2 O (22%) б) 2 CH 4 +O 2→ 2 CH 3 OH (17%) О в) CH 4 +O 2→ H – С + H 2 O (0, 75%) Н
Химические свойства Сn. H 2 n+2 Горение (+ О 2) → СО 2 + Н 2 О Разложение (t) → C + H 2 t = 1500˚C → С 2 H 2 + Н 2 (для метана) Крекинг → алкан + алкадиен Дегидрирование (-Н 2; kat-pt) → алкен, алкин изомеризация (t˚; kat) → изомер галогенирование (hν) (+Cl 2; Br 2) →Cn. H 2 n + 1 Cl + HCl нитрование (400˚C) (+HNO 3) →Cn. H 2 n + 1 NO 2 + H 2 O окисление CH 4 (t = 340˚C) t = 1500˚C, катализ. а) CH 4 +O 2→ CO + 2 H 2 O (22%) б) 2 CH 4 +O 2→ 2 CH 3 OH (17%) О в) CH 4 +O 2→ H – С + H 2 O (0, 75%) Н
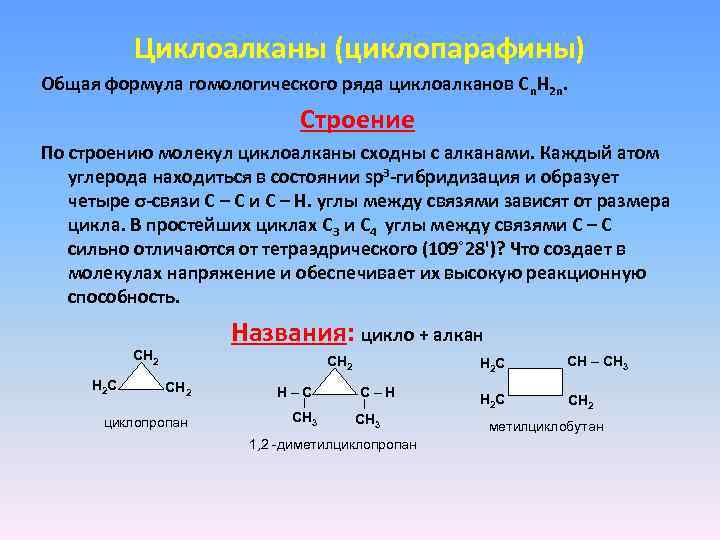 Циклоалканы (циклопарафины) Общая формула гомологического ряда циклоалканов Cn. H 2 n. Строение По строению молекул циклоалканы сходны с алканами. Каждый атом углерода находиться в состоянии sp 3 -гибридизация и образует четыре σ-связи С – С и С – Н. углы между связями зависят от размера цикла. В простейших циклах С 3 и С 4 углы между связями С – С сильно отличаются от тетраэдрического (109˚ 28')? Что создает в молекулах напряжение и обеспечивает их высокую реакционную способность. Названия: цикло + алкан СН 2 Н 2 С СН 2 циклопропaн Н–С СН 3 Н 2 С С–Н СН 3 1, 2 -диметилциклопропан СН – СН 3 Н 2 С СН 2 метилциклобутан
Циклоалканы (циклопарафины) Общая формула гомологического ряда циклоалканов Cn. H 2 n. Строение По строению молекул циклоалканы сходны с алканами. Каждый атом углерода находиться в состоянии sp 3 -гибридизация и образует четыре σ-связи С – С и С – Н. углы между связями зависят от размера цикла. В простейших циклах С 3 и С 4 углы между связями С – С сильно отличаются от тетраэдрического (109˚ 28')? Что создает в молекулах напряжение и обеспечивает их высокую реакционную способность. Названия: цикло + алкан СН 2 Н 2 С СН 2 циклопропaн Н–С СН 3 Н 2 С С–Н СН 3 1, 2 -диметилциклопропан СН – СН 3 Н 2 С СН 2 метилциклобутан
 Физическе свойства Первые два члена ряда (С 3 и С 4) – газы, С 5 – С 15 – жидкости, высшие – твердые вещества. Ткип, Тплав, как и их плотности, несколько выше , чем у алканов с равным числом атомов углерода. Нерастворимы в воде.
Физическе свойства Первые два члена ряда (С 3 и С 4) – газы, С 5 – С 15 – жидкости, высшие – твердые вещества. Ткип, Тплав, как и их плотности, несколько выше , чем у алканов с равным числом атомов углерода. Нерастворимы в воде.
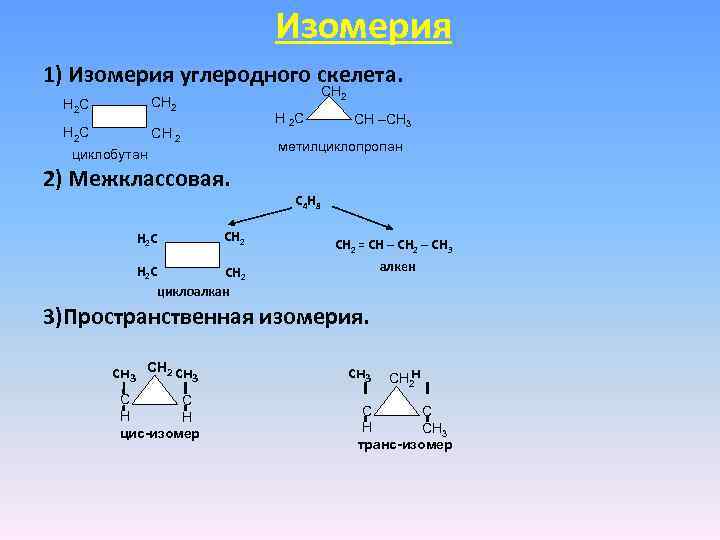 Изомерия 1) Изомерия углеродного скелета. СН СН НС Н С СH –CН НС СН метилциклопропан циклобутан 2) Межклассовая. 2 2 2 3 2 С 4 Н 8 Н 2 С СН 2 = СН – СН 2 – СН 3 алкен Н 2 С СН 2 циклоалкан 3)Пространственная изомерия. СН 2 сн 3 н СН 2 С С Н Н цис-изомер С С Н СН 3 транс-изомер
Изомерия 1) Изомерия углеродного скелета. СН СН НС Н С СH –CН НС СН метилциклопропан циклобутан 2) Межклассовая. 2 2 2 3 2 С 4 Н 8 Н 2 С СН 2 = СН – СН 2 – СН 3 алкен Н 2 С СН 2 циклоалкан 3)Пространственная изомерия. СН 2 сн 3 н СН 2 С С Н Н цис-изомер С С Н СН 3 транс-изомер
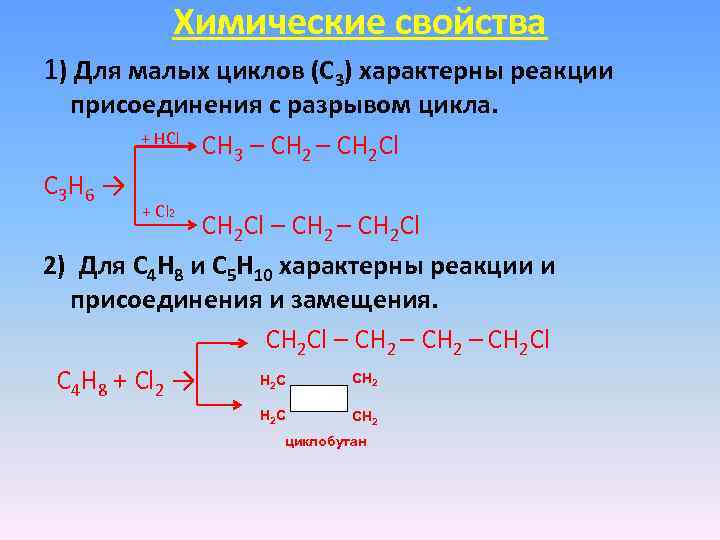 Химические свойства 1) Для малых циклов (С 3) характерны реакции присоединения с разрывом цикла. + НCl CH 3 – CH 2 Cl C 3 H 6 → + Сl 2 CH 2 Cl – CH 2 Cl 2) Для С 4 Н 8 и С 5 Н 10 характерны реакции и присоединения и замещения. CH 2 Cl – CH 2 Cl СН НС C 4 H 8 + Cl 2 → 2 2 Н 2 С СН 2 циклобутан
Химические свойства 1) Для малых циклов (С 3) характерны реакции присоединения с разрывом цикла. + НCl CH 3 – CH 2 Cl C 3 H 6 → + Сl 2 CH 2 Cl – CH 2 Cl 2) Для С 4 Н 8 и С 5 Н 10 характерны реакции и присоединения и замещения. CH 2 Cl – CH 2 Cl СН НС C 4 H 8 + Cl 2 → 2 2 Н 2 С СН 2 циклобутан
 3)Для больших циклов С 6 и более характерны только реакции замещения. С 6 Н 12 + Cl 2 → С 6 Н 11 Cl + НCl 4)Реакция гидрирования. Cn. H 2 n + Н 2 → Cn. H 2 n+2 5)Горение. С 4 Н 8 + 6 O 2 → 4 CO 2 + 4 Н 2 O 6)Реакция дегидрирования. C 6 H 12 → С 6 H 6 + 3 H 2
3)Для больших циклов С 6 и более характерны только реакции замещения. С 6 Н 12 + Cl 2 → С 6 Н 11 Cl + НCl 4)Реакция гидрирования. Cn. H 2 n + Н 2 → Cn. H 2 n+2 5)Горение. С 4 Н 8 + 6 O 2 → 4 CO 2 + 4 Н 2 O 6)Реакция дегидрирования. C 6 H 12 → С 6 H 6 + 3 H 2
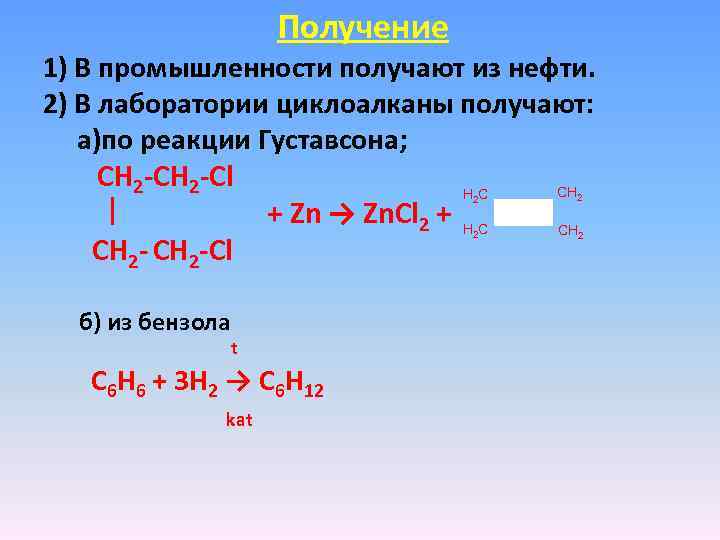 Получение 1) В промышленности получают из нефти. 2) В лаборатории циклоалканы получают: а)по реакции Густавсона; СН 2 -Сl СН НС + Zn → Zn. Сl 2 + Н С СН 2 -Сl 2 2 б) из бензола t C 6 H 6 + 3 Н 2 → C 6 H 12 kat 2 2
Получение 1) В промышленности получают из нефти. 2) В лаборатории циклоалканы получают: а)по реакции Густавсона; СН 2 -Сl СН НС + Zn → Zn. Сl 2 + Н С СН 2 -Сl 2 2 б) из бензола t C 6 H 6 + 3 Н 2 → C 6 H 12 kat 2 2
 Алкены (этиленовые углеводороды) Строение • Длина углерод -углеродной связи С = С равна 0, 134 нм. • Валентный угол равен 120˚, sp 2 – гибридизация. • Форма молекулы – плоская. • Свободное вращение вокруг π-связи невозможно. • Прочность π-связи гораздо ниже, чем σ-связи, а поляризуемость π-связи гораздо выше, чем σ-связи.
Алкены (этиленовые углеводороды) Строение • Длина углерод -углеродной связи С = С равна 0, 134 нм. • Валентный угол равен 120˚, sp 2 – гибридизация. • Форма молекулы – плоская. • Свободное вращение вокруг π-связи невозможно. • Прочность π-связи гораздо ниже, чем σ-связи, а поляризуемость π-связи гораздо выше, чем σ-связи.
 Гомологический ряд алкенов Общая формула ряда алкенов Cn. H 2 n. Номенклатура 1. Названия алкенов образуют путём изменения суффикса –ан соответствующего предельного углеводорода на –ен или –илен: C 2 H 6 – этан, C 2 H 4 – этен (этилен)
Гомологический ряд алкенов Общая формула ряда алкенов Cn. H 2 n. Номенклатура 1. Названия алкенов образуют путём изменения суффикса –ан соответствующего предельного углеводорода на –ен или –илен: C 2 H 6 – этан, C 2 H 4 – этен (этилен)
 2. Углеродная цепочка нумеруется с того конца, к которому ближе расположена двойная связь: В конце названия ставиться номер того атома углерода, после которого расположена двойная связь. 4 3 2 1 CH 3 – CH = CH 2 CH 3 3 – метилбутен – 1 3. В конце названия ставиться номер того атома углерода, после которого расположена двойная связь
2. Углеродная цепочка нумеруется с того конца, к которому ближе расположена двойная связь: В конце названия ставиться номер того атома углерода, после которого расположена двойная связь. 4 3 2 1 CH 3 – CH = CH 2 CH 3 3 – метилбутен – 1 3. В конце названия ставиться номер того атома углерода, после которого расположена двойная связь
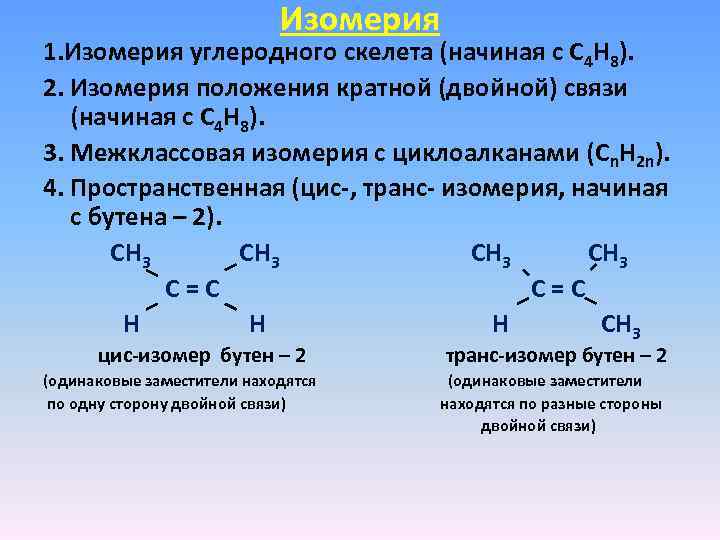 Изомерия 1. Изомерия углеродного скелета (начиная с С 4 Н 8). 2. Изомерия положения кратной (двойной) связи (начиная с С 4 Н 8). 3. Межклассовая изомерия с циклоалканами (Cn. H 2 n). 4. Пространственная (цис-, транс- изомерия, начиная с бутена – 2). СН 3 С = С Н СН 3 цис-изомер бутен – 2 транс-изомер бутен – 2 (одинаковые заместители находятся (одинаковые заместители по одну сторону двойной связи) находятся по разные стороны двойной связи)
Изомерия 1. Изомерия углеродного скелета (начиная с С 4 Н 8). 2. Изомерия положения кратной (двойной) связи (начиная с С 4 Н 8). 3. Межклассовая изомерия с циклоалканами (Cn. H 2 n). 4. Пространственная (цис-, транс- изомерия, начиная с бутена – 2). СН 3 С = С Н СН 3 цис-изомер бутен – 2 транс-изомер бутен – 2 (одинаковые заместители находятся (одинаковые заместители по одну сторону двойной связи) находятся по разные стороны двойной связи)
 • • • Физические свойства: при обычных условиях С 2 – С 4 – газы, С 5 – С 17 – жидкости, начиная с С 18 – твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях. Химические свойства Сn. H 2 n горение (+О 2) →CO 2 + H 2 O гидрирование (+Н 2) → Cn. H 2 n + 2 галогенирование (+Cl 2) →Cn. H 2 n. Cl 2 гидрогалогенирование (+HCl) → Cn. H 2 n + 1 Cl гидратация (+Н 2 O) → Cn. H 2 n + 1 OH дегидрирование (kat) → Cn. H 2 n - 2 + H 2 окисление (Н 2 O + [0]) →Cn. H 2 n (OH)2 Полимеризация (+n. Cn. H 2 n) → полимер
• • • Физические свойства: при обычных условиях С 2 – С 4 – газы, С 5 – С 17 – жидкости, начиная с С 18 – твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях. Химические свойства Сn. H 2 n горение (+О 2) →CO 2 + H 2 O гидрирование (+Н 2) → Cn. H 2 n + 2 галогенирование (+Cl 2) →Cn. H 2 n. Cl 2 гидрогалогенирование (+HCl) → Cn. H 2 n + 1 Cl гидратация (+Н 2 O) → Cn. H 2 n + 1 OH дегидрирование (kat) → Cn. H 2 n - 2 + H 2 окисление (Н 2 O + [0]) →Cn. H 2 n (OH)2 Полимеризация (+n. Cn. H 2 n) → полимер
 Гидрирование (гидрогенизация) – реакция присоединения водорода в присутствии катализатора. Гидратация – реакция взаимодействия веществ с водой. Полимеризация – процесс соединения многих одинаковых молекул в более крупные. kat n CH 2 = CH 2 → (– CH 2 –)n этилен полиэтилен Правило В. В. Марковникова: водород присоединяется к наиболее, а атом галогена – к наименее гидрированному атому углерода при взаимодействии алкенов с галогеноводородами.
Гидрирование (гидрогенизация) – реакция присоединения водорода в присутствии катализатора. Гидратация – реакция взаимодействия веществ с водой. Полимеризация – процесс соединения многих одинаковых молекул в более крупные. kat n CH 2 = CH 2 → (– CH 2 –)n этилен полиэтилен Правило В. В. Марковникова: водород присоединяется к наиболее, а атом галогена – к наименее гидрированному атому углерода при взаимодействии алкенов с галогеноводородами.
 Получение алкенов 1. В промышленности: a) при крекинге нефти и нефтепродуктов; t C 16 H 34 → C 8 H 18 + C 8 H 16 kat б) при дегидрировании алканов. 500˚С, Ni C 2 H 6 C 2 H 4 + H 2
Получение алкенов 1. В промышленности: a) при крекинге нефти и нефтепродуктов; t C 16 H 34 → C 8 H 18 + C 8 H 16 kat б) при дегидрировании алканов. 500˚С, Ni C 2 H 6 C 2 H 4 + H 2
 2. В лаборатории: а) дегидратацией спиртов; t˚ > 140˚С C 2 H 5 OH C 2 H 4 + H 2 O H 2 SO 4(k) б) из галогенопроизводных алканов; t˚, C 2 H 5 OH CH 3 – CH 2 – Cl + KOH C 2 H 4 + KCl + H 2 O в) при взаимодействии дигалогенпроизводных предельных углеводородов с металлами. CH 3 – CHBr – CH 2 Br + Zn → CH 3 – CH = CH 2 + Zn. Br 2
2. В лаборатории: а) дегидратацией спиртов; t˚ > 140˚С C 2 H 5 OH C 2 H 4 + H 2 O H 2 SO 4(k) б) из галогенопроизводных алканов; t˚, C 2 H 5 OH CH 3 – CH 2 – Cl + KOH C 2 H 4 + KCl + H 2 O в) при взаимодействии дигалогенпроизводных предельных углеводородов с металлами. CH 3 – CHBr – CH 2 Br + Zn → CH 3 – CH = CH 2 + Zn. Br 2
 Алкадиены (диеновые углеводороды) Алкадиены – углеводороды, содержащие двойные связи. Общая формула гомологического ряда Cn. H 2 n – 2. Номенклатура Так же как у этиленовых, но окончание –ен меняют на –диен. 1 2 3 4 CH 2 = CH – CH = CH 2 бутадиен – 1, 3 Строение 1. Если две двойные связи сосредоточены у одного атома углерода, то их называют кумулированными. CH 2 = CH – CH 3
Алкадиены (диеновые углеводороды) Алкадиены – углеводороды, содержащие двойные связи. Общая формула гомологического ряда Cn. H 2 n – 2. Номенклатура Так же как у этиленовых, но окончание –ен меняют на –диен. 1 2 3 4 CH 2 = CH – CH = CH 2 бутадиен – 1, 3 Строение 1. Если две двойные связи сосредоточены у одного атома углерода, то их называют кумулированными. CH 2 = CH – CH 3
 2. Если две двойные связи разделены одной простой связью, то их называют сопряжёнными. CH 2 = CH – (CH 2)n – CH = CH 2 3. Если двойные связи разделены двумя и более простыми связями, то их называют изолированными. CH 2 = CH – CH = CH 2 Практически значимыми алкадиенами являются: а) бутадиен – 1, 3 CH 2 = CH – CH = CH 2 или дивилин (группа атомов CH 2 = CH – называется винилом); б) 2 – метилбутадиен – 1, 3 CH 2 = C - CH = CH 2 или изопрен. CH 3 Эти два вещества являются исходными для получения каучуков
2. Если две двойные связи разделены одной простой связью, то их называют сопряжёнными. CH 2 = CH – (CH 2)n – CH = CH 2 3. Если двойные связи разделены двумя и более простыми связями, то их называют изолированными. CH 2 = CH – CH = CH 2 Практически значимыми алкадиенами являются: а) бутадиен – 1, 3 CH 2 = CH – CH = CH 2 или дивилин (группа атомов CH 2 = CH – называется винилом); б) 2 – метилбутадиен – 1, 3 CH 2 = C - CH = CH 2 или изопрен. CH 3 Эти два вещества являются исходными для получения каучуков
 Физические свойства Дивинил при обычных условиях – газ. Изопрен и другие простейшие диеновые углеводороды – жидкости. Химические свойства 1) Алкодиены обладают высокой реакционной способностью: легко окисляются, вступают в реакции присоединения с водородом, галогенами, галогеноводородами; реакции полимеризации. [ n. CH 2 = CH – CH = CH 2 → ( – CH 2 – CH = CH– CH 2 –)n ] 2) Сопряженные диены в реакциях присоединения образуют продукты 1, 4 – присоединения с одной двойной связью посередине 1 4 CH 2 = CH – CH = CH 2+ Br 2 → CH 2 Br – CH = CH – CH 2 Br
Физические свойства Дивинил при обычных условиях – газ. Изопрен и другие простейшие диеновые углеводороды – жидкости. Химические свойства 1) Алкодиены обладают высокой реакционной способностью: легко окисляются, вступают в реакции присоединения с водородом, галогенами, галогеноводородами; реакции полимеризации. [ n. CH 2 = CH – CH = CH 2 → ( – CH 2 – CH = CH– CH 2 –)n ] 2) Сопряженные диены в реакциях присоединения образуют продукты 1, 4 – присоединения с одной двойной связью посередине 1 4 CH 2 = CH – CH = CH 2+ Br 2 → CH 2 Br – CH = CH – CH 2 Br
 Получение 1) Дегидрирование алканов. t C 4 H 10 → CH 2 = CH – CH = CH 2 + 2 H 2 kat 2) Одновременное дегидрирование и дегидратация этанола с катализаторами Zn. O и Al 2 O 3 (реакция Лебедева С. В. ). 550˚C 2 C 2 H 5 OH CH 2 = CH – CH = CH 2 + 2 H 2 O
Получение 1) Дегидрирование алканов. t C 4 H 10 → CH 2 = CH – CH = CH 2 + 2 H 2 kat 2) Одновременное дегидрирование и дегидратация этанола с катализаторами Zn. O и Al 2 O 3 (реакция Лебедева С. В. ). 550˚C 2 C 2 H 5 OH CH 2 = CH – CH = CH 2 + 2 H 2 O
 Алкины (ацетиленовые углеводороды) Алкины – это непредельные углеводороды, содержащие тройную С ≡ С связь Строение 1. Длина углерод -углеродной связи С ≡ С 0, 120 мм. 2. Валентный угол равен 180˚. 3. Форма молекулы линейная. 4. sp – гибридизация. 5. Прочность тройной связи выше прочности двойной и простой связи, т. е. активность π-связи снижена. Гомологический ряд алкинов Общая формула гомологического ряда алкинов Cn. H 2 n – 2.
Алкины (ацетиленовые углеводороды) Алкины – это непредельные углеводороды, содержащие тройную С ≡ С связь Строение 1. Длина углерод -углеродной связи С ≡ С 0, 120 мм. 2. Валентный угол равен 180˚. 3. Форма молекулы линейная. 4. sp – гибридизация. 5. Прочность тройной связи выше прочности двойной и простой связи, т. е. активность π-связи снижена. Гомологический ряд алкинов Общая формула гомологического ряда алкинов Cn. H 2 n – 2.
 Номенклатура: Название алкинов образуют путем изменения суффикса –ан соответствующего предельного углеводорода на –ин. CH = С – CH 2 – CH 3 CH 3 – СН 2 – CH 3 бутин - 1 бутан Изомерия 1. Изомерия углеродного скелета (начиная с C 5 H 8). 2. Изомерия положения тройной связи (начиная с C 4 H 6). 3. Межклассовая изомерия с алкадиенами (Cn. H 2 n – 2).
Номенклатура: Название алкинов образуют путем изменения суффикса –ан соответствующего предельного углеводорода на –ин. CH = С – CH 2 – CH 3 CH 3 – СН 2 – CH 3 бутин - 1 бутан Изомерия 1. Изомерия углеродного скелета (начиная с C 5 H 8). 2. Изомерия положения тройной связи (начиная с C 4 H 6). 3. Межклассовая изомерия с алкадиенами (Cn. H 2 n – 2).
 Химические свойства Наличие двух π-связей обуславливает высокую реакционную способность алкинов в реакциях ступенчатого присоединения водорода, хлора, брома, галогеноводородов, воды (сначала образуются производные алкенов, затем алканов). Сn. H 2 n-2 (C 2 H 2) Горение (Ni; t˚) → CO 2 + H 2 O гидрирование (+Н 2) → C 2 H 4, C 2 H 6 галогенирование (+Cl 2) → CHCl = CHCl, CHCl 2 – CHCl 2 гидрогалогенирование (Hg. Cl 2) → H 2 C = CHCl, CH 3 – СHCl 2 гидратация (+Hg. SO 4) →CH 2 = CHOH, CH 3 – CНО (реакция Кучерова) димеризация (kat) →CH 2 = CH – С ≡ CH тримеризация(акт. уголь, t˚ > 450˚С) → C 6 H 6 качественная реакция → обесцвечивание бромной воды (Br 2) и перманганата калия (KMn. O 4)
Химические свойства Наличие двух π-связей обуславливает высокую реакционную способность алкинов в реакциях ступенчатого присоединения водорода, хлора, брома, галогеноводородов, воды (сначала образуются производные алкенов, затем алканов). Сn. H 2 n-2 (C 2 H 2) Горение (Ni; t˚) → CO 2 + H 2 O гидрирование (+Н 2) → C 2 H 4, C 2 H 6 галогенирование (+Cl 2) → CHCl = CHCl, CHCl 2 – CHCl 2 гидрогалогенирование (Hg. Cl 2) → H 2 C = CHCl, CH 3 – СHCl 2 гидратация (+Hg. SO 4) →CH 2 = CHOH, CH 3 – CНО (реакция Кучерова) димеризация (kat) →CH 2 = CH – С ≡ CH тримеризация(акт. уголь, t˚ > 450˚С) → C 6 H 6 качественная реакция → обесцвечивание бромной воды (Br 2) и перманганата калия (KMn. O 4)
 Физические свойства При обычных условиях С 2 – С 4 – газы, С 5 – С 16 – жидкости, начиная с С 18 – твердые вещества. Температуры кипения алкинов выше, чем у соответствующих алкенов. Получение алкинов 1. В промышленности: а)при взаимодействии карбида кальция с водой; Ca. C 2 + 2 H 2 O → C 2 H 2 + Ca(OH)2 б)путем термического разложения метана. 1500˚C 2 CH 4 H – C ≡ С – H + 3 H 2 2. В лаборатории из дигалогенопроизводных алканов, действуя на них спиртовым раствором щёлочи. спир. CH 2 Cl – CH 2 Cl + 2 KOH HC ≡ CH + 2 KCl + 2 H 2 O р-р.
Физические свойства При обычных условиях С 2 – С 4 – газы, С 5 – С 16 – жидкости, начиная с С 18 – твердые вещества. Температуры кипения алкинов выше, чем у соответствующих алкенов. Получение алкинов 1. В промышленности: а)при взаимодействии карбида кальция с водой; Ca. C 2 + 2 H 2 O → C 2 H 2 + Ca(OH)2 б)путем термического разложения метана. 1500˚C 2 CH 4 H – C ≡ С – H + 3 H 2 2. В лаборатории из дигалогенопроизводных алканов, действуя на них спиртовым раствором щёлочи. спир. CH 2 Cl – CH 2 Cl + 2 KOH HC ≡ CH + 2 KCl + 2 H 2 O р-р.
 Ароматические углеводороды (арены) - это углеводороды в молекулах которых содержится одно или несколько бензольных ядер – бензол – нафталин. Строение бензола 1. Тип гибридизации sp 2. 2. Длинна связи C – С 0, 140 нм. 3. Внутренние углы связи равны 120˚, плоская молекула. 4. Шесть p-электронов образуют единое πэлектронное облако.
Ароматические углеводороды (арены) - это углеводороды в молекулах которых содержится одно или несколько бензольных ядер – бензол – нафталин. Строение бензола 1. Тип гибридизации sp 2. 2. Длинна связи C – С 0, 140 нм. 3. Внутренние углы связи равны 120˚, плоская молекула. 4. Шесть p-электронов образуют единое πэлектронное облако.
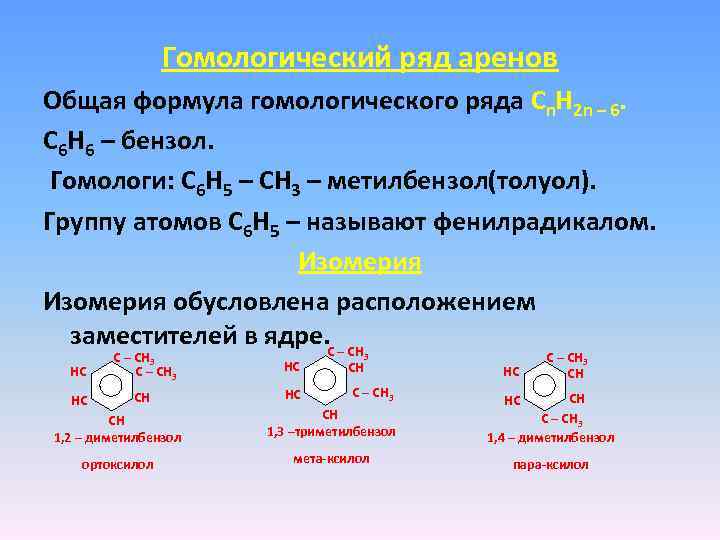 Гомологический ряд аренов Общая формула гомологического ряда Cn. H 2 n – 6. C 6 H 6 – бензол. Гомологи: C 6 H 5 – CH 3 – метилбензол(толуол). Группу атомов C 6 H 5 – называют фенилрадикалом. Изомерия обусловлена расположением заместителей в ядре. С – CH HC 6 С – CH 3 2 С – CH 3 HC CH HC 1 6 5 1 3 2 3 CH С – CH 3 HC 6 С – CH 3 2 CH 1, 2 – диметилбензол CH 1, 3 –триметилбензол CH С – CH 3 1, 4 – диметилбензол ортоксилол мета-ксилол пара-ксилол HC 5 3 4 4 HC 5 3 4
Гомологический ряд аренов Общая формула гомологического ряда Cn. H 2 n – 6. C 6 H 6 – бензол. Гомологи: C 6 H 5 – CH 3 – метилбензол(толуол). Группу атомов C 6 H 5 – называют фенилрадикалом. Изомерия обусловлена расположением заместителей в ядре. С – CH HC 6 С – CH 3 2 С – CH 3 HC CH HC 1 6 5 1 3 2 3 CH С – CH 3 HC 6 С – CH 3 2 CH 1, 2 – диметилбензол CH 1, 3 –триметилбензол CH С – CH 3 1, 4 – диметилбензол ортоксилол мета-ксилол пара-ксилол HC 5 3 4 4 HC 5 3 4
 Физические свойства Первые члены гомологического ряда бензола – бесцветные жидкости со специфическим запахом. Они легче воды и в ней не растворимы. Хорошо растворяются в органических растворителях и сами являются хорошими растворителями. Химические свойства C 6 H 5 Br + Br 2(Fe Br 3) + H 2 (Pt) замещение C 6 H 5 NO 2 + HNO 3 (H 2 SO 4) C 6 H 6 C 6 H 12 присоединение горение СO 2 + H 2 O горит коптящим пламенем + Cl 2 (свет) C 6 H 6 Сl 6
Физические свойства Первые члены гомологического ряда бензола – бесцветные жидкости со специфическим запахом. Они легче воды и в ней не растворимы. Хорошо растворяются в органических растворителях и сами являются хорошими растворителями. Химические свойства C 6 H 5 Br + Br 2(Fe Br 3) + H 2 (Pt) замещение C 6 H 5 NO 2 + HNO 3 (H 2 SO 4) C 6 H 6 C 6 H 12 присоединение горение СO 2 + H 2 O горит коптящим пламенем + Cl 2 (свет) C 6 H 6 Сl 6
 Получение В промышленности: а) из продуктов пиролиза каменного угля; б) в процессе ароматизации нефти, содержащей циклоалканы и алкены; C 6 H 12 300˚С Pt C 6 H 6 + 3 H 2 в) тримеризация ацетилена 3 C 2 H 2 500˚С акт. уголь C 6 H 6
Получение В промышленности: а) из продуктов пиролиза каменного угля; б) в процессе ароматизации нефти, содержащей циклоалканы и алкены; C 6 H 12 300˚С Pt C 6 H 6 + 3 H 2 в) тримеризация ацетилена 3 C 2 H 2 500˚С акт. уголь C 6 H 6


