5. Конспект урока. Алкины. Ацетилен.ppt
- Количество слайдов: 17
 Углеводороды Алкины. Ацетилен (ацетиленовые углеводороды)
Углеводороды Алкины. Ацетилен (ацетиленовые углеводороды)
 Углеводороды Алканы Общая формула А) тип гибридизаци и Б) угол связи В) длина связи (нм) Г) форма молекулы Циклоалка ны Алкены Диеновые Cn. H 2 n+2 Cn. H 2 n-2 sp 3 sp 2 ∟ 109028' 0, 154 ∟ 600, 900, 1090, 1200 ∟ 1200 0, 154 0, 134 тетраэд стремится плоская р к тетраэдру Алкины Cn. H 2 n-2 Арены Cn. H 2 n-6 sp sp 2 ∟ 1200 , ∟ 1800 ∟ 1200 0, 134 0, 12 плоская 0, 142 линейная плоская
Углеводороды Алканы Общая формула А) тип гибридизаци и Б) угол связи В) длина связи (нм) Г) форма молекулы Циклоалка ны Алкены Диеновые Cn. H 2 n+2 Cn. H 2 n-2 sp 3 sp 2 ∟ 109028' 0, 154 ∟ 600, 900, 1090, 1200 ∟ 1200 0, 154 0, 134 тетраэд стремится плоская р к тетраэдру Алкины Cn. H 2 n-2 Арены Cn. H 2 n-6 sp sp 2 ∟ 1200 , ∟ 1800 ∟ 1200 0, 134 0, 12 плоская 0, 142 линейная плоская
 Алкины — это ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь, между атомами углерода (С≡С). Алкины соответствуют общей формуле Сn. Н 2 n-2.
Алкины — это ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь, между атомами углерода (С≡С). Алкины соответствуют общей формуле Сn. Н 2 n-2.
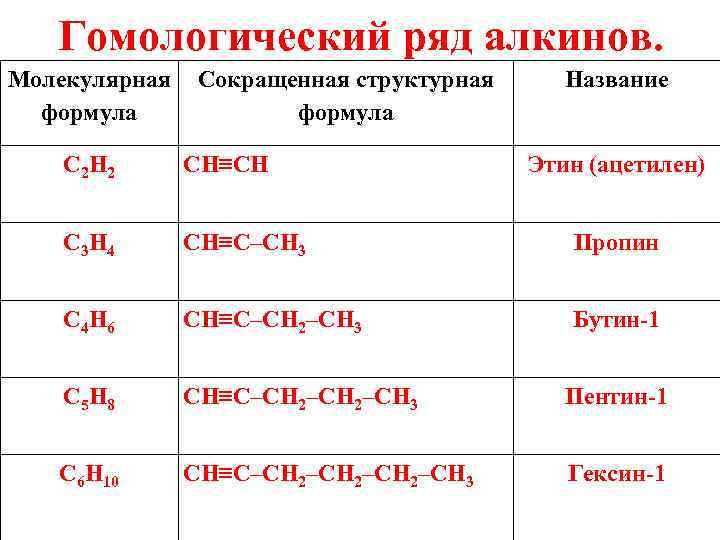 Гомологический ряд алкинов. Молекулярная Сокращенная структурная формула Название C 2 H 2 CH≡CH Этин (ацетилен) C 3 H 4 CH≡C–CH 3 Пропин C 4 H 6 CH≡C–CH 2–CH 3 Бутин-1 C 5 H 8 CH≡C–CH 2–CH 3 Пентин-1 C 6 H 10 CH≡C–CH 2–CH 3 Гексин-1
Гомологический ряд алкинов. Молекулярная Сокращенная структурная формула Название C 2 H 2 CH≡CH Этин (ацетилен) C 3 H 4 CH≡C–CH 3 Пропин C 4 H 6 CH≡C–CH 2–CH 3 Бутин-1 C 5 H 8 CH≡C–CH 2–CH 3 Пентин-1 C 6 H 10 CH≡C–CH 2–CH 3 Гексин-1
 Номенклатура ИЮПАК Правила при составлении названий алкинов: 1) Выбор главной цепи. В случае алкинов главная цепь должна содержать одну тройную связь (С≡С) 2) Нумерация главной цепи. Нумерация атомов углерода главной цепи начинается с того конца, к которому ближе находится тройная связь. 3) Формирование названия. С учетом всех заместителей.
Номенклатура ИЮПАК Правила при составлении названий алкинов: 1) Выбор главной цепи. В случае алкинов главная цепь должна содержать одну тройную связь (С≡С) 2) Нумерация главной цепи. Нумерация атомов углерода главной цепи начинается с того конца, к которому ближе находится тройная связь. 3) Формирование названия. С учетом всех заместителей.
 Примечание Если в молекуле присутствует несколько одинаковых радикалов два, три. четыре и. т. д. (например CH 3–), то цифрой указывают место каждого из них в главной цепи и перед их названием ставят соответственно частицы: Количество радикалов Греческие частицы 2 3 4 5 6 7 8 «ди» «три» «тетра» «пента» «гекса» «гепта» «окта»
Примечание Если в молекуле присутствует несколько одинаковых радикалов два, три. четыре и. т. д. (например CH 3–), то цифрой указывают место каждого из них в главной цепи и перед их названием ставят соответственно частицы: Количество радикалов Греческие частицы 2 3 4 5 6 7 8 «ди» «три» «тетра» «пента» «гекса» «гепта» «окта»
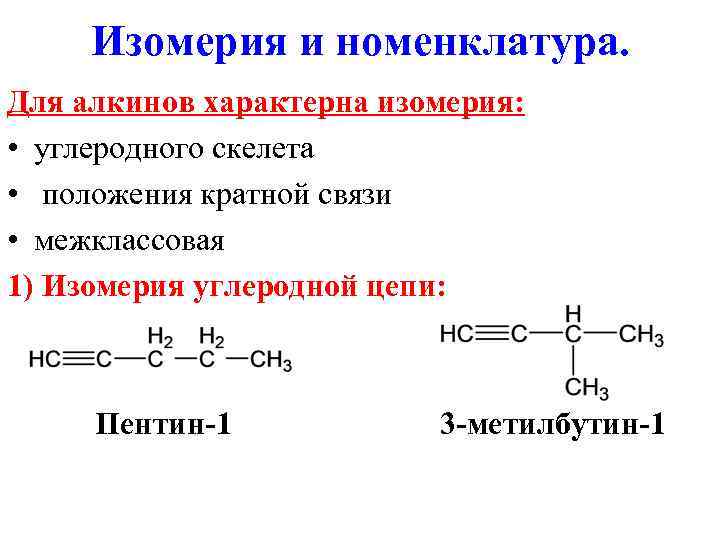 Изомерия и номенклатура. Для алкинов характерна изомерия: • углеродного скелета • положения кратной связи • межклассовая 1) Изомерия углеродной цепи: Пентин-1 3 -метилбутин-1
Изомерия и номенклатура. Для алкинов характерна изомерия: • углеродного скелета • положения кратной связи • межклассовая 1) Изомерия углеродной цепи: Пентин-1 3 -метилбутин-1
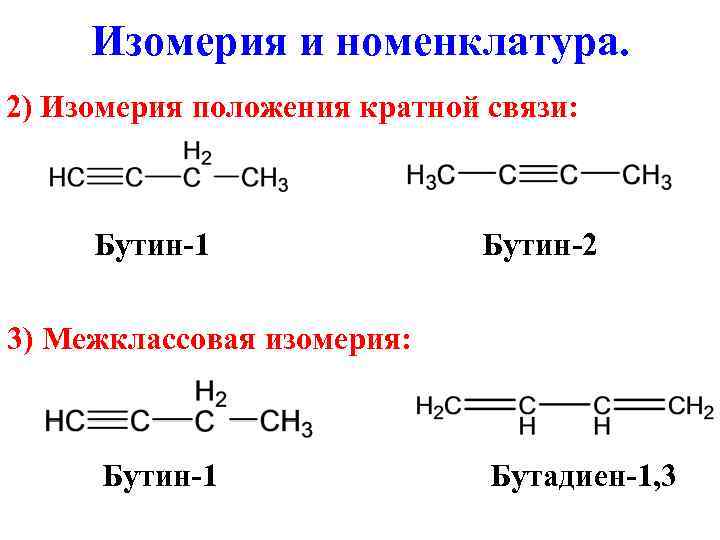 Изомерия и номенклатура. 2) Изомерия положения кратной связи: Бутин-1 Бутин-2 3) Межклассовая изомерия: Бутин-1 Бутадиен-1, 3
Изомерия и номенклатура. 2) Изомерия положения кратной связи: Бутин-1 Бутин-2 3) Межклассовая изомерия: Бутин-1 Бутадиен-1, 3
 Способы получения алкинов В промышленности: 1. Метановый способ: 2 CH 4 → C 2 H 2 + 3 H 2 (t = 1500 0 C) 2. Карбидный способ получения: Ca. C 2 + H 2 O → Ca(OH)2 + C 2 H 2↑ 3. Получение карбида кальция: t Ca. CO 3 → Ca. O + CO 2↑ Ca. O + 3 C → Ca. C 2 + CO↑
Способы получения алкинов В промышленности: 1. Метановый способ: 2 CH 4 → C 2 H 2 + 3 H 2 (t = 1500 0 C) 2. Карбидный способ получения: Ca. C 2 + H 2 O → Ca(OH)2 + C 2 H 2↑ 3. Получение карбида кальция: t Ca. CO 3 → Ca. O + CO 2↑ Ca. O + 3 C → Ca. C 2 + CO↑
 В лаборатории: 3. Способ дегидрогалогенирования галогеналканов:
В лаборатории: 3. Способ дегидрогалогенирования галогеналканов:
 Химические свойства алкинов 1) Галогенирование алкинов: CH≡CH + Br 2 → CHBr=CHBr + Br 2 → CHBr 2–CHBr 2 2) Гидрогалогенирование алкинов: CH 3–C≡CH + HBr → CH 3–CBr=CH 2 + HBr → CH 3–CBr 2–CH 3 3) Гидратация алкинов (реакция Кучерова):
Химические свойства алкинов 1) Галогенирование алкинов: CH≡CH + Br 2 → CHBr=CHBr + Br 2 → CHBr 2–CHBr 2 2) Гидрогалогенирование алкинов: CH 3–C≡CH + HBr → CH 3–CBr=CH 2 + HBr → CH 3–CBr 2–CH 3 3) Гидратация алкинов (реакция Кучерова):
 Химические свойства алкинов 4) Гидрирования алкинов (kat – Pt, Pd, Ni) Pt HC≡CH +H 2 → CH 2=CH 2 5) Тримеризация Cакт, 4000 С 3 HC≡CH → C 6 H 6 6) Димеризация
Химические свойства алкинов 4) Гидрирования алкинов (kat – Pt, Pd, Ni) Pt HC≡CH +H 2 → CH 2=CH 2 5) Тримеризация Cакт, 4000 С 3 HC≡CH → C 6 H 6 6) Димеризация
 Химические свойства алкинов 7) Горение 2 С 2 H 2 + 5 O 2 → 4 CO 2 + 2 H 2 O + 2600 к. Дж
Химические свойства алкинов 7) Горение 2 С 2 H 2 + 5 O 2 → 4 CO 2 + 2 H 2 O + 2600 к. Дж
 АЛГОРИТМ № 1 1. Вычисляем молярную массу вещества. М(в) = D(x)*М(х) (1) 2. Вычисляем количество атомов С: а) если СО 2 дано по массе: n(C) = (2) б) если СО 2 дано в объеме: n(C) = (3)
АЛГОРИТМ № 1 1. Вычисляем молярную массу вещества. М(в) = D(x)*М(х) (1) 2. Вычисляем количество атомов С: а) если СО 2 дано по массе: n(C) = (2) б) если СО 2 дано в объеме: n(C) = (3)
 3. Вычисляем количество атомов Н: Так как в молекуле Н 2 О 2 моля Н, тогда формулу умножаем на 2 (это применимо и к N) n(Н) = 2 (4) 4. Вычисляем молярную массу полученного вещества. 5. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
3. Вычисляем количество атомов Н: Так как в молекуле Н 2 О 2 моля Н, тогда формулу умножаем на 2 (это применимо и к N) n(Н) = 2 (4) 4. Вычисляем молярную массу полученного вещества. 5. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
 Задачи на вывод формул Задача № 1. При сгорании органического вещества массой 2, 37 г образовалось 3, 36 г оксида углерода(IV) (н. у. ), 1, 35 г воды и азот. Относительная плотность этого вещества по воздуху равна 2, 724. Выведите молекулярную формулу вещества.
Задачи на вывод формул Задача № 1. При сгорании органического вещества массой 2, 37 г образовалось 3, 36 г оксида углерода(IV) (н. у. ), 1, 35 г воды и азот. Относительная плотность этого вещества по воздуху равна 2, 724. Выведите молекулярную формулу вещества.
 Дано: Решение: m ( в-ва) = 2, 37 г V (CO 2) = 3, 36 л m (H 2 O) = 1, 35 г D (возд. ) = 2, 724 1. Применяем формулу (1) M(в-ва) = 29 г/моль * 2, 724 =79 г/моль. Находим количество атомов С по формуле (3) n(C) = 5 моль 2. Находим количество атомов Н по формуле (4) n(Н) = 5 моль 3. Вычисляем молярную массу С 5 Н 5. М(С 5 Н 5) = 12 * 5 + 1 * 5 = 65 г/моль 4. Вычисляем количество атомов азота (5) 79 – 65 = 14. т. к. атомная масса азота – 14, значит в данной формулу один атом N. Ответ: С 5 Н 5 N Найти: Cx. Hy. Nz
Дано: Решение: m ( в-ва) = 2, 37 г V (CO 2) = 3, 36 л m (H 2 O) = 1, 35 г D (возд. ) = 2, 724 1. Применяем формулу (1) M(в-ва) = 29 г/моль * 2, 724 =79 г/моль. Находим количество атомов С по формуле (3) n(C) = 5 моль 2. Находим количество атомов Н по формуле (4) n(Н) = 5 моль 3. Вычисляем молярную массу С 5 Н 5. М(С 5 Н 5) = 12 * 5 + 1 * 5 = 65 г/моль 4. Вычисляем количество атомов азота (5) 79 – 65 = 14. т. к. атомная масса азота – 14, значит в данной формулу один атом N. Ответ: С 5 Н 5 N Найти: Cx. Hy. Nz


