 Углеводороды Алкены. Этилен (непредельные углеводороды)
Углеводороды Алкены. Этилен (непредельные углеводороды)
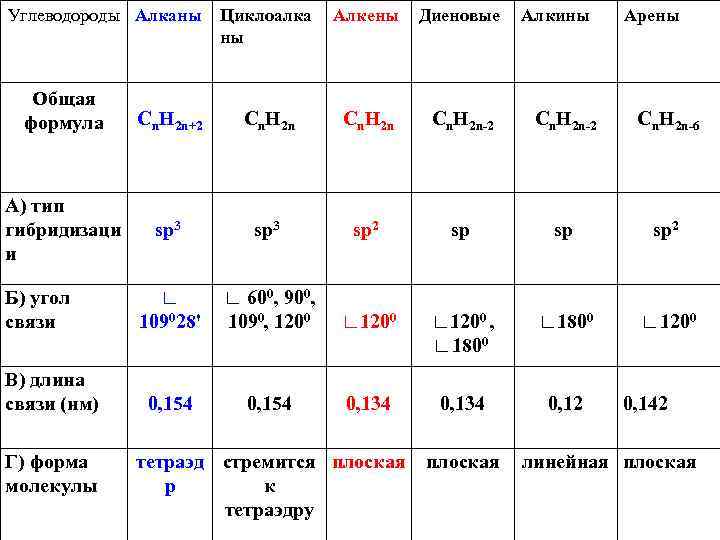 Углеводороды Алканы Общая формула А) тип гибридизаци и Б) угол связи В) длина связи (нм) Г) форма молекулы Циклоалка ны Алкены Диеновые Cn. H 2 n+2 Cn. H 2 n-2 sp 3 sp 2 ∟ 109028' 0, 154 ∟ 600, 900, 1090, 1200 ∟ 1200 0, 154 0, 134 тетраэд стремится плоская р к тетраэдру Алкины Cn. H 2 n-2 Арены Cn. H 2 n-6 sp sp 2 ∟ 1200 , ∟ 1800 ∟ 1200 0, 134 0, 12 плоская 0, 142 линейная плоская
Углеводороды Алканы Общая формула А) тип гибридизаци и Б) угол связи В) длина связи (нм) Г) форма молекулы Циклоалка ны Алкены Диеновые Cn. H 2 n+2 Cn. H 2 n-2 sp 3 sp 2 ∟ 109028' 0, 154 ∟ 600, 900, 1090, 1200 ∟ 1200 0, 154 0, 134 тетраэд стремится плоская р к тетраэдру Алкины Cn. H 2 n-2 Арены Cn. H 2 n-6 sp sp 2 ∟ 1200 , ∟ 1800 ∟ 1200 0, 134 0, 12 плоская 0, 142 линейная плоская
 Алкены (Олефины) Алкены — это непредельные углеводороды, содержащие в молекуле, кроме одинарных связей, одну двойную С=С связь. Алкены соответствуют общей формуле Сn. Н 2 n.
Алкены (Олефины) Алкены — это непредельные углеводороды, содержащие в молекуле, кроме одинарных связей, одну двойную С=С связь. Алкены соответствуют общей формуле Сn. Н 2 n.
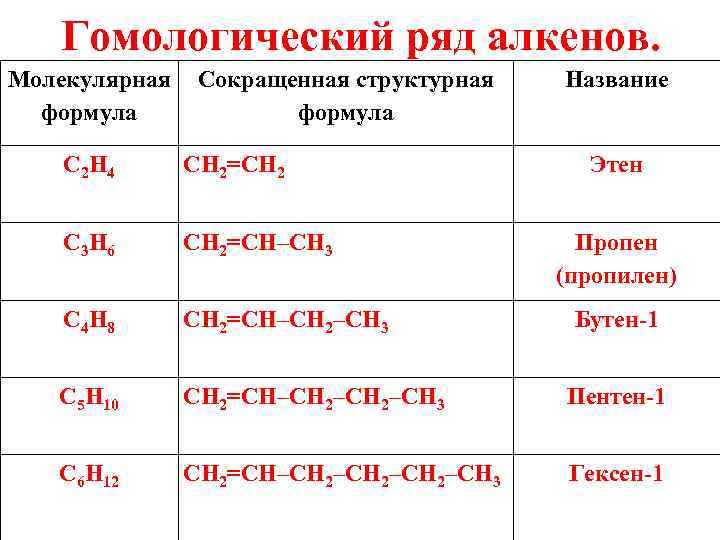 Гомологический ряд алкенов. Молекулярная Сокращенная структурная формула Название C 2 H 4 CH 2=CH 2 Этен C 3 H 6 CH 2=CH–CH 3 C 4 H 8 CH 2=CH–CH 2–CH 3 C 5 H 10 CH 2=CH–CH 2–CH 3 Пентен-1 C 6 H 12 CH 2=CH–CH 2–CH 3 Гексен-1 Пропен (пропилен) Бутен-1
Гомологический ряд алкенов. Молекулярная Сокращенная структурная формула Название C 2 H 4 CH 2=CH 2 Этен C 3 H 6 CH 2=CH–CH 3 C 4 H 8 CH 2=CH–CH 2–CH 3 C 5 H 10 CH 2=CH–CH 2–CH 3 Пентен-1 C 6 H 12 CH 2=CH–CH 2–CH 3 Гексен-1 Пропен (пропилен) Бутен-1
 Номенклатура ИЮПАК Правила при составлении названий алкенов: 1) Выбор главной цепи. В случае алкенов главная цепь должна содержать одну двойную связь (С=С) 2) Нумерация главной цепи. Нумерация атомов углерода главной цепи начинается с того конца, к которому ближе находится двойная связь. 3) Формирование названия. С учетом всех заместителей.
Номенклатура ИЮПАК Правила при составлении названий алкенов: 1) Выбор главной цепи. В случае алкенов главная цепь должна содержать одну двойную связь (С=С) 2) Нумерация главной цепи. Нумерация атомов углерода главной цепи начинается с того конца, к которому ближе находится двойная связь. 3) Формирование названия. С учетом всех заместителей.
 Примечание Если в молекуле присутствует несколько одинаковых радикалов два, три. четыре и. т. д. (например CH 3–), то цифрой указывают место каждого из них в главной цепи и перед их названием ставят соответственно частицы: Количество радикалов Греческие частицы 2 3 4 5 6 7 8 «ди» «три» «тетра» «пента» «гекса» «гепта» «окта»
Примечание Если в молекуле присутствует несколько одинаковых радикалов два, три. четыре и. т. д. (например CH 3–), то цифрой указывают место каждого из них в главной цепи и перед их названием ставят соответственно частицы: Количество радикалов Греческие частицы 2 3 4 5 6 7 8 «ди» «три» «тетра» «пента» «гекса» «гепта» «окта»
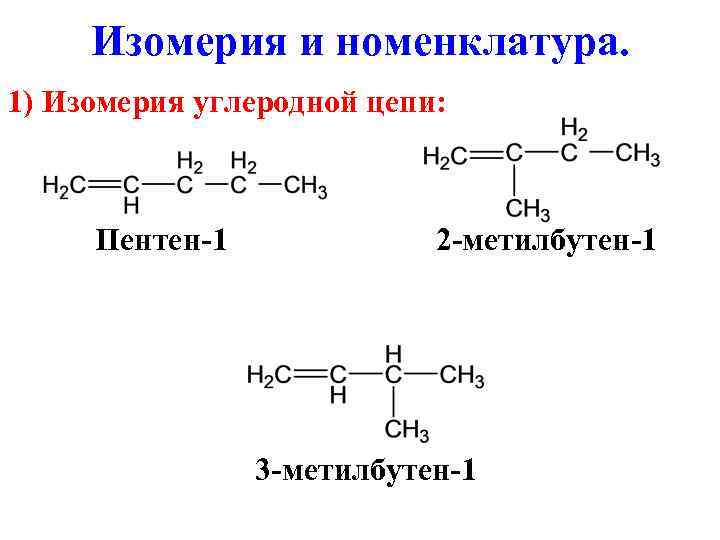 Изомерия и номенклатура. 1) Изомерия углеродной цепи: Пентен-1 2 -метилбутен-1 3 -метилбутен-1
Изомерия и номенклатура. 1) Изомерия углеродной цепи: Пентен-1 2 -метилбутен-1 3 -метилбутен-1
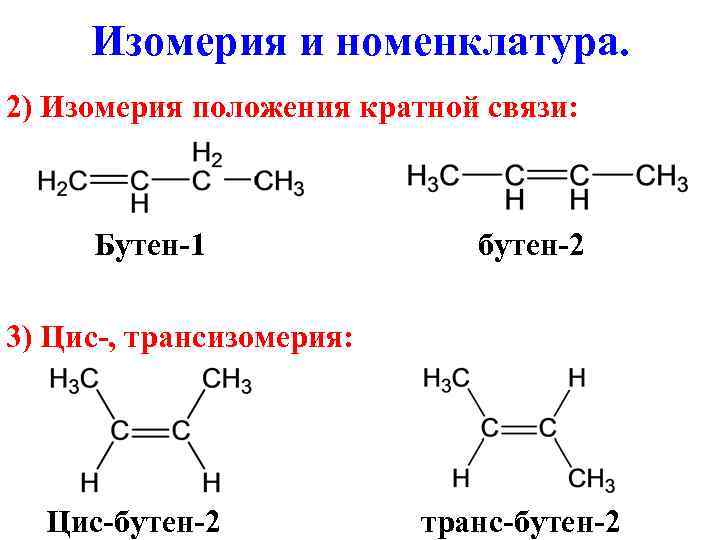 Изомерия и номенклатура. 2) Изомерия положения кратной связи: Бутен-1 бутен-2 3) Цис-, трансизомерия: Цис-бутен-2 транс-бутен-2
Изомерия и номенклатура. 2) Изомерия положения кратной связи: Бутен-1 бутен-2 3) Цис-, трансизомерия: Цис-бутен-2 транс-бутен-2
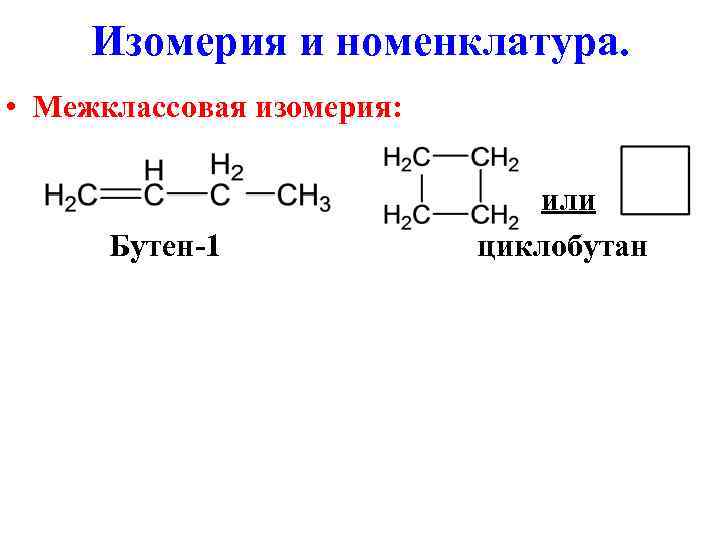 Изомерия и номенклатура. • Межклассовая изомерия: или Бутен-1 циклобутан
Изомерия и номенклатура. • Межклассовая изомерия: или Бутен-1 циклобутан
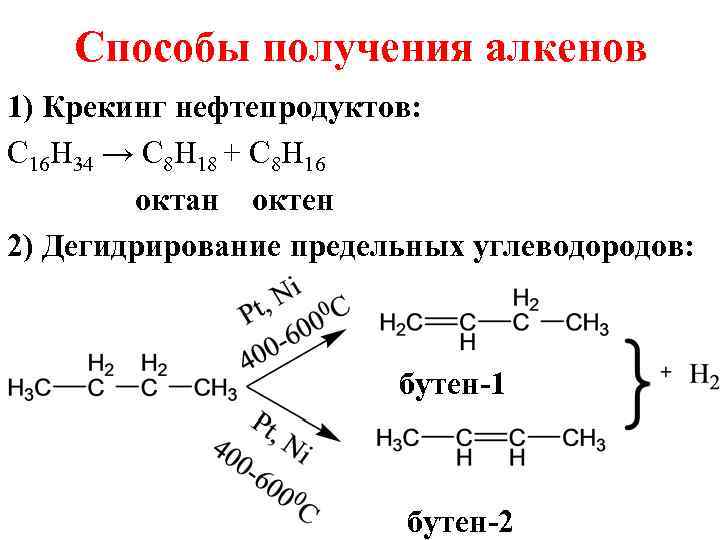 Способы получения алкенов 1) Крекинг нефтепродуктов: C 16 H 34 → C 8 H 18 + C 8 H 16 октан октен 2) Дегидрирование предельных углеводородов: бутен-1 бутен-2
Способы получения алкенов 1) Крекинг нефтепродуктов: C 16 H 34 → C 8 H 18 + C 8 H 16 октан октен 2) Дегидрирование предельных углеводородов: бутен-1 бутен-2
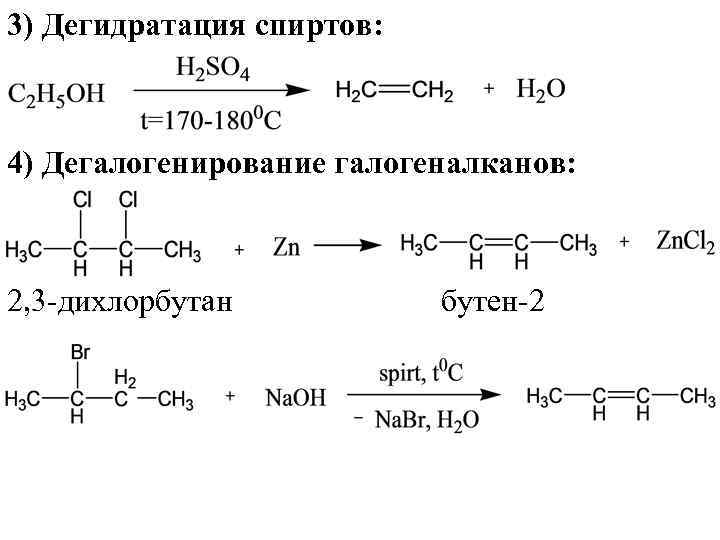 3) Дегидратация спиртов: 4) Дегалогенирование галогеналканов: 2, 3 -дихлорбутан бутен-2
3) Дегидратация спиртов: 4) Дегалогенирование галогеналканов: 2, 3 -дихлорбутан бутен-2
 Химические свойства алкенов 1) Гидрирования алкенов (kat – Pt, Pd, Ni): CH 3–CH=CH 2 + H 2 → CH 3–CH 2–CH 3 2) Галогенирование алкенов: CH 2=CH 2 +Br 2 → CH 2 Br–CH 2 Br 3) Гидрогалогенирование алкенов (правило Марковникова): CH 3–CH=CH 2 + HBr → CH 3–CHBr–CH 3 При присоединении галогеноводорода к алкену, водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген к менее гидрированному.
Химические свойства алкенов 1) Гидрирования алкенов (kat – Pt, Pd, Ni): CH 3–CH=CH 2 + H 2 → CH 3–CH 2–CH 3 2) Галогенирование алкенов: CH 2=CH 2 +Br 2 → CH 2 Br–CH 2 Br 3) Гидрогалогенирование алкенов (правило Марковникова): CH 3–CH=CH 2 + HBr → CH 3–CHBr–CH 3 При присоединении галогеноводорода к алкену, водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген к менее гидрированному.
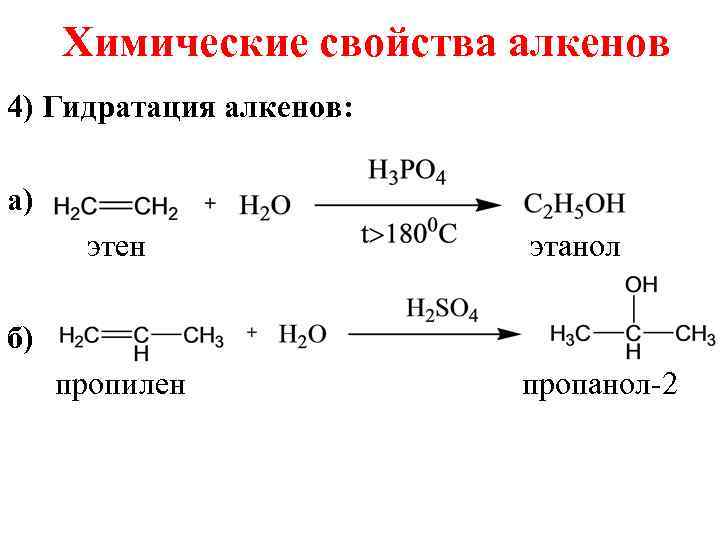 Химические свойства алкенов 4) Гидратация алкенов: а) этен этанол б) пропилен пропанол-2
Химические свойства алкенов 4) Гидратация алкенов: а) этен этанол б) пропилен пропанол-2
 Химические свойства алканов 5) Горение алкенов: С 2 H 4 + 3 O 2 → 2 CO 2 + 2 H 2 O 2 С 2 H 6 + 7 O 2 → 4 CO 2 + 6 H 2 O 6) Окисление алкенов: ([O] = KMn. O 4) CH 2=CH 2 + [O] + H 2 O → CH 2 OH–CH 2 OH [O] CH 3–CH=CH–CH 3 → 2 CH 3 COOH
Химические свойства алканов 5) Горение алкенов: С 2 H 4 + 3 O 2 → 2 CO 2 + 2 H 2 O 2 С 2 H 6 + 7 O 2 → 4 CO 2 + 6 H 2 O 6) Окисление алкенов: ([O] = KMn. O 4) CH 2=CH 2 + [O] + H 2 O → CH 2 OH–CH 2 OH [O] CH 3–CH=CH–CH 3 → 2 CH 3 COOH