 УГЛЕВОДОРОДЫ
УГЛЕВОДОРОДЫ
 • 2
• 2
 По этому признаку все углеводороды можно разделить на следующие группы: Ø Предельные – такие углеводороды в молекулах которых все химические связи насыщенные, то есть одинарные. Ø Непредельные – такие, в молекулах которых имеются дву- и трехкратные химические связи. Среди них различают: • Соединения с двойными связями (одна молекула может содержать не одну такую связь); • Соединения с тройными связями (одна молекула может содержать не одну такую связь). 3
По этому признаку все углеводороды можно разделить на следующие группы: Ø Предельные – такие углеводороды в молекулах которых все химические связи насыщенные, то есть одинарные. Ø Непредельные – такие, в молекулах которых имеются дву- и трехкратные химические связи. Среди них различают: • Соединения с двойными связями (одна молекула может содержать не одну такую связь); • Соединения с тройными связями (одна молекула может содержать не одну такую связь). 3
 Так как цепочки атомов углерода могут быть как линейными так и замкнутыми в кольца углеводороды делят на: Ø Ациклические – соединения с открытой цепью; Ø Карбоциклические – соединения с замкнутой цепью. 4
Так как цепочки атомов углерода могут быть как линейными так и замкнутыми в кольца углеводороды делят на: Ø Ациклические – соединения с открытой цепью; Ø Карбоциклические – соединения с замкнутой цепью. 4
 УГЛЕВОДОРОДЫ Номенклатура
УГЛЕВОДОРОДЫ Номенклатура
 • 6
• 6
 Ø Принадлежность соединения к типу циклических в названии отражают при помощи приставки цикло-. которые прибавляют к числительному, обозначающему количество атомов углерода в главной цепи. Числительное выбирают из следующего ряда: 7
Ø Принадлежность соединения к типу циклических в названии отражают при помощи приставки цикло-. которые прибавляют к числительному, обозначающему количество атомов углерода в главной цепи. Числительное выбирают из следующего ряда: 7
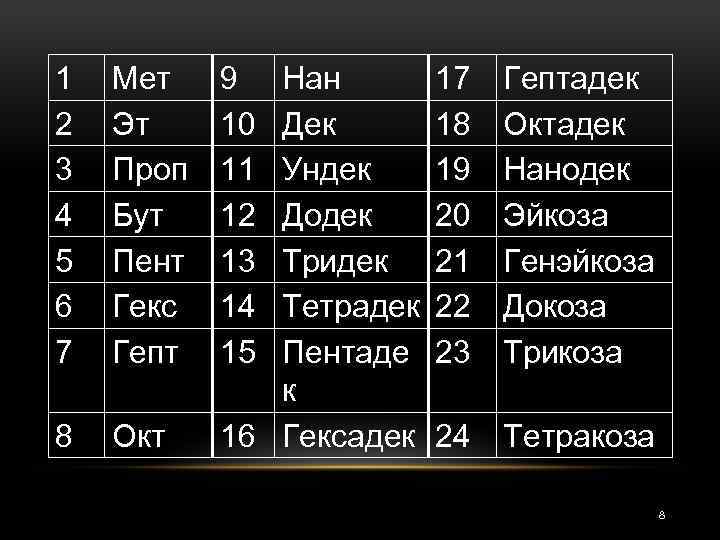 1 2 3 4 5 6 7 Мет Эт Проп Бут Пент Гекс Гепт 8 Окт 9 10 11 12 13 14 15 Нан Дек Ундек Додек Тридек Тетрадек Пентаде к 16 Гексадек 17 18 19 20 21 22 23 Гептадек Октадек Нанодек Эйкоза Генэйкоза Докоза Трикоза 24 Тетракоза 8
1 2 3 4 5 6 7 Мет Эт Проп Бут Пент Гекс Гепт 8 Окт 9 10 11 12 13 14 15 Нан Дек Ундек Додек Тридек Тетрадек Пентаде к 16 Гексадек 17 18 19 20 21 22 23 Гептадек Октадек Нанодек Эйкоза Генэйкоза Докоза Трикоза 24 Тетракоза 8
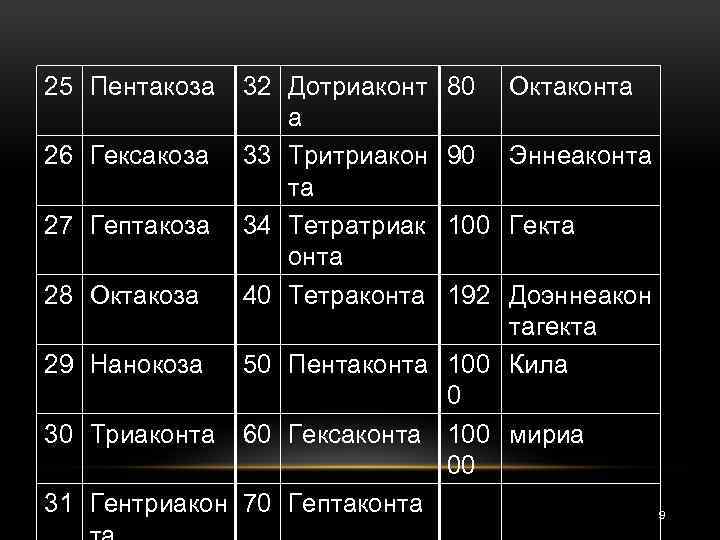 25 Пентакоза 26 Гексакоза 27 Гептакоза 28 Октакоза 32 Дотриаконт а 33 Тритриакон та 34 Тетратриак онта 40 Тетраконта 80 Октаконта 90 Эннеаконта 100 Гекта 192 Доэннеакон тагекта 29 Нанокоза 50 Пентаконта 100 Кила 0 30 Триаконта 60 Гексаконта 100 мириа 00 31 Гентриакон 70 Гептаконта 9
25 Пентакоза 26 Гексакоза 27 Гептакоза 28 Октакоза 32 Дотриаконт а 33 Тритриакон та 34 Тетратриак онта 40 Тетраконта 80 Октаконта 90 Эннеаконта 100 Гекта 192 Доэннеакон тагекта 29 Нанокоза 50 Пентаконта 100 Кила 0 30 Триаконта 60 Гексаконта 100 мириа 00 31 Гентриакон 70 Гептаконта 9
 • 10
• 10
 Одинаковых радикалов в составе одной молекулы может быть несколько. Их количество указывают при помощи приставки к названию радикала в виде соответствующего числительного: 1 2 Моно 4 Ди 5 3 Три 6 Тетра 7 Пент 8 а Гекса 9 Гепта 10 Окта 11 Нано 12 Дека Ундек а Додек а 11
Одинаковых радикалов в составе одной молекулы может быть несколько. Их количество указывают при помощи приставки к названию радикала в виде соответствующего числительного: 1 2 Моно 4 Ди 5 3 Три 6 Тетра 7 Пент 8 а Гекса 9 Гепта 10 Окта 11 Нано 12 Дека Ундек а Додек а 11
 ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Ациклические предельные углеводороды
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Ациклические предельные углеводороды
 Поскольку четыре электрона атома углерода различны (2 s- и 2 p- электроны), то должны бы быть различны и связи у атома углерода, однако однозначно показано, что связи в молекуле метана равнозначны. Оказывается при "смешении" четырех орбиталей возбужденного атома углерода (одной 2 s - и трех 2 p- орбиталей) образуются четыре равноценные sp 3 - гибридные орбитали. Они имеют форму гантели, одна из половин которой значительно больше другой. Вследствие взаимного отталкивания sp 3 - гибридные орбитали направлены в пространстве к вершинам тетраэдра и углы между ними равны 109° 28' (наиболее выгодное расположение). 13
Поскольку четыре электрона атома углерода различны (2 s- и 2 p- электроны), то должны бы быть различны и связи у атома углерода, однако однозначно показано, что связи в молекуле метана равнозначны. Оказывается при "смешении" четырех орбиталей возбужденного атома углерода (одной 2 s - и трех 2 p- орбиталей) образуются четыре равноценные sp 3 - гибридные орбитали. Они имеют форму гантели, одна из половин которой значительно больше другой. Вследствие взаимного отталкивания sp 3 - гибридные орбитали направлены в пространстве к вершинам тетраэдра и углы между ними равны 109° 28' (наиболее выгодное расположение). 13
 14
14
 sp 3 - Гибридизация характерна для атомов углерода в молекулах всех насыщенных углеводородов. 15
sp 3 - Гибридизация характерна для атомов углерода в молекулах всех насыщенных углеводородов. 15
 Предположим, что к одному атому углерода присоединился другой атом углерода. У этого последнего остались три свободные валентности, все они направлены к вершинам тетраэдра под углом 109° 28‘. 16
Предположим, что к одному атому углерода присоединился другой атом углерода. У этого последнего остались три свободные валентности, все они направлены к вершинам тетраэдра под углом 109° 28‘. 16
 17
17
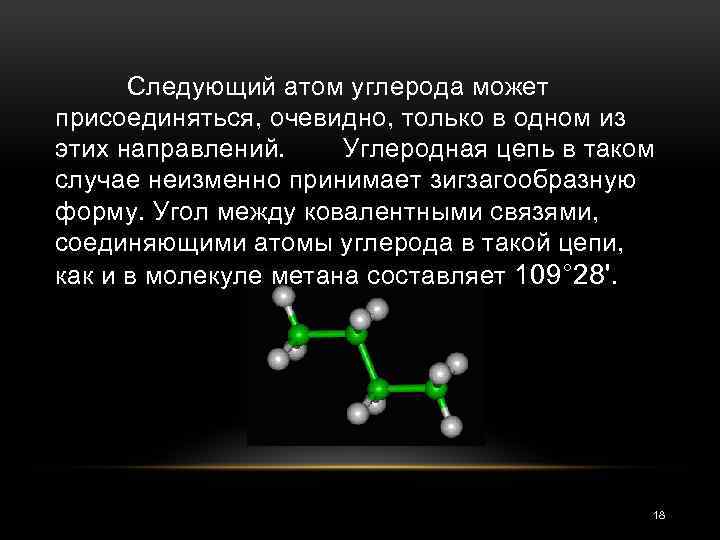 Следующий атом углерода может присоединяться, очевидно, только в одном из этих направлений. Углеродная цепь в таком случае неизменно принимает зигзагообразную форму. Угол между ковалентными связями, соединяющими атомы углерода в такой цепи, как и в молекуле метана составляет 109° 28'. 18
Следующий атом углерода может присоединяться, очевидно, только в одном из этих направлений. Углеродная цепь в таком случае неизменно принимает зигзагообразную форму. Угол между ковалентными связями, соединяющими атомы углерода в такой цепи, как и в молекуле метана составляет 109° 28'. 18
 Зигзагообразная цепь атомов углерода может принимать различные пространственные формы. Это связано с тем, что атомы в молекуле могут относительно свободно вращаться вокруг химических связей. Такое вращение существует в молекулах как проявление теплового движения (если нет препятствующих этому факторов). Наиболее энергетически выгодной является форма с наибольшим удалением атомов друг от друга. 19
Зигзагообразная цепь атомов углерода может принимать различные пространственные формы. Это связано с тем, что атомы в молекуле могут относительно свободно вращаться вокруг химических связей. Такое вращение существует в молекулах как проявление теплового движения (если нет препятствующих этому факторов). Наиболее энергетически выгодной является форма с наибольшим удалением атомов друг от друга. 19
 20
20
 21
21
 Рассматривая молекулярные формулы веществ, можно заметить постоянную разницу в составе молекул при переходе от одного члена ряда к другому на группу атомов CH 2 (эта группа называется метиленом). Если число атомов углерода в молекуле принять за n, то состав всех этих углеводородов можно выразить общей формулой Cn. H 2 n+2. Ряд таких соединений называют гомологическим рядом предельных углеводородов. 22
Рассматривая молекулярные формулы веществ, можно заметить постоянную разницу в составе молекул при переходе от одного члена ряда к другому на группу атомов CH 2 (эта группа называется метиленом). Если число атомов углерода в молекуле принять за n, то состав всех этих углеводородов можно выразить общей формулой Cn. H 2 n+2. Ряд таких соединений называют гомологическим рядом предельных углеводородов. 22
 НОМЕНКЛАТУРА • 23
НОМЕНКЛАТУРА • 23
 ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ Метан Этан Пропан Бутан Изобутан Метилпропа н 24
ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ Метан Этан Пропан Бутан Изобутан Метилпропа н 24
 ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ Пентан 2 -метилбутан 2, 2 диметилпропа н изопентан 25
ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ Пентан 2 -метилбутан 2, 2 диметилпропа н изопентан 25
 ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ гексан гептан октан нонан декан ундекан додекан эйкозан триконт ан 26
ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ гексан гептан октан нонан декан ундекан додекан эйкозан триконт ан 26
 ФИЗИЧЕСКИЕ СВОЙСТВА Первые четыре представителя ряда метана (C 1–C 4) при обычных условиях — газы; следующие одиннадцать углеводородов (C 5–C 15) — жидкости; начиная с углеводорода C 16 H 34— твердые вещества. С увеличением относительной молекулярной массы в ряду углеводородов нормального строения наблюдается последовательное возрастание температур плавления и кипения, а так же увеличение плотности. 27
ФИЗИЧЕСКИЕ СВОЙСТВА Первые четыре представителя ряда метана (C 1–C 4) при обычных условиях — газы; следующие одиннадцать углеводородов (C 5–C 15) — жидкости; начиная с углеводорода C 16 H 34— твердые вещества. С увеличением относительной молекулярной массы в ряду углеводородов нормального строения наблюдается последовательное возрастание температур плавления и кипения, а так же увеличение плотности. 27
 ФИЗИЧЕСКИЕ СВОЙСТВА Алканы с разветвлённой цепью углеродных атомов кипят при более низких температурах по сравнению с алканами нормального строения. И чем выше степень разветвленности молекулы, тем ниже температура плавления. 28
ФИЗИЧЕСКИЕ СВОЙСТВА Алканы с разветвлённой цепью углеродных атомов кипят при более низких температурах по сравнению с алканами нормального строения. И чем выше степень разветвленности молекулы, тем ниже температура плавления. 28
 ФИЗИЧЕСКИЕ СВОЙСТВА • 29
ФИЗИЧЕСКИЕ СВОЙСТВА • 29
 ИЗОМЕРИЯ Существование нескольких соединений с одинаковым качественным и количественным составом и одинаковой молекулярной массой, но различными физическими и химическими свойствами называют изомерией. изобутан Такой вид изомерии называют структурной изомерией (в данном случае – изомерия углеродного скелета). 30
ИЗОМЕРИЯ Существование нескольких соединений с одинаковым качественным и количественным составом и одинаковой молекулярной массой, но различными физическими и химическими свойствами называют изомерией. изобутан Такой вид изомерии называют структурной изомерией (в данном случае – изомерия углеродного скелета). 30
 ИЗОМЕРИЯ Ø Наиболее характерна для алканов изомерия углеродного скелета (структурная изомерия); Ø Кроме того алканы могут быть хиральными, то есть оптически активными. Например 3 -метилгексан 31
ИЗОМЕРИЯ Ø Наиболее характерна для алканов изомерия углеродного скелета (структурная изомерия); Ø Кроме того алканы могут быть хиральными, то есть оптически активными. Например 3 -метилгексан 31
 В молекуле изооктана имеются четыре типа углеродных атомов: атомы 1, 5, 6, 7, 8 связаны только с одним углеродным атомом – такие атомы углерода называют первичными, атом 3 (связан с двумя другими углеродными атомами) – вторичным, атом 4 (с тремя) – третичным, 2 (с четырьмя) – четвертичным. 32
В молекуле изооктана имеются четыре типа углеродных атомов: атомы 1, 5, 6, 7, 8 связаны только с одним углеродным атомом – такие атомы углерода называют первичными, атом 3 (связан с двумя другими углеродными атомами) – вторичным, атом 4 (с тремя) – третичным, 2 (с четырьмя) – четвертичным. 32
 СПОСОБЫ ПОЛУЧЕНИЯ Ø Промышленные: • Синтез газа (метод Фишера – Тропша) • Крекинг (расщепление) подробно рассмотрим в химических свойствах алканов. 33
СПОСОБЫ ПОЛУЧЕНИЯ Ø Промышленные: • Синтез газа (метод Фишера – Тропша) • Крекинг (расщепление) подробно рассмотрим в химических свойствах алканов. 33
 СПОСОБЫ ПОЛУЧЕНИЯ Ø Лабораторные: • Восстановление галогеналканов • Взаимодействием галогеналканов с активными металлами (реакция Вюрца) 34
СПОСОБЫ ПОЛУЧЕНИЯ Ø Лабораторные: • Восстановление галогеналканов • Взаимодействием галогеналканов с активными металлами (реакция Вюрца) 34
 СПОСОБЫ ПОЛУЧЕНИЯ Ø Лабораторные: • Сплавлением натриевых солей карбоновых кислот со щелочами в присутствии натронной извести 35
СПОСОБЫ ПОЛУЧЕНИЯ Ø Лабораторные: • Сплавлением натриевых солей карбоновых кислот со щелочами в присутствии натронной извести 35
 ХИМИЧЕСКИЕ СВОЙСТВА Алканы долгое время считались химически инертными, поэтому получили второе название – парафины (parum – «мало» + affinis – «находиться в сродстве» ). При обычных условиях алканы малоактивны. Все химические свойства алканов можно разделить на группы: ØПо принципу радикального замещения: • Галогенирование h h 36
ХИМИЧЕСКИЕ СВОЙСТВА Алканы долгое время считались химически инертными, поэтому получили второе название – парафины (parum – «мало» + affinis – «находиться в сродстве» ). При обычных условиях алканы малоактивны. Все химические свойства алканов можно разделить на группы: ØПо принципу радикального замещения: • Галогенирование h h 36
 ХИМИЧЕСКИЕ СВОЙСТВА ØПо принципу радикального замещения: • Галогенирование h Преимущественно галогенирование протекает у вторичного атома углерода. От фтора к йоду активность галогенов в этой реакции падает. Так фтор взаимодействует с алканами даже в темноте, для взаимодействия с хлором требуется освещение, для взаимодействия с бромом – еще и нагревание, а йод с алканами вовсе не реагирует. Активность алканов увеличивается с ростом числа атомов углерода в молекуле. 37
ХИМИЧЕСКИЕ СВОЙСТВА ØПо принципу радикального замещения: • Галогенирование h Преимущественно галогенирование протекает у вторичного атома углерода. От фтора к йоду активность галогенов в этой реакции падает. Так фтор взаимодействует с алканами даже в темноте, для взаимодействия с хлором требуется освещение, для взаимодействия с бромом – еще и нагревание, а йод с алканами вовсе не реагирует. Активность алканов увеличивается с ростом числа атомов углерода в молекуле. 37
 ХИМИЧЕСКИЕ СВОЙСТВА ØПо принципу радикального замещения: • Сульфохлорирование Протекает под действием ультрафиолета, при этом образуются хлорангедриды алкансульфоновых кислот. Хлорангидрид пропансульфоновой кислот 38
ХИМИЧЕСКИЕ СВОЙСТВА ØПо принципу радикального замещения: • Сульфохлорирование Протекает под действием ультрафиолета, при этом образуются хлорангедриды алкансульфоновых кислот. Хлорангидрид пропансульфоновой кислот 38
 ХИМИЧЕСКИЕ СВОЙСТВА ØПо принципу радикального замещения: • Сульфоокисление – взаимодействие со смесью SO 2 и O 2. Протекает под действием постоянного ультрафиолетового излучения. Пропанпероксисульфоновая кислота 39
ХИМИЧЕСКИЕ СВОЙСТВА ØПо принципу радикального замещения: • Сульфоокисление – взаимодействие со смесью SO 2 и O 2. Протекает под действием постоянного ультрафиолетового излучения. Пропанпероксисульфоновая кислота 39
 ХИМИЧЕСКИЕ СВОЙСТВА ØПо принципу радикального замещения: • Сульфоокисление Пропансульфоновая кислота 40
ХИМИЧЕСКИЕ СВОЙСТВА ØПо принципу радикального замещения: • Сульфоокисление Пропансульфоновая кислота 40
 ХИМИЧЕСКИЕ СВОЙСТВА ØПо принципу радикального замещения: • Нитрование (реакция Коновалова) – взаимодействие с 12÷ 15%-ным раствором HNO 3 или оксидами азота при 150ºС. 2 -нитропропан 41
ХИМИЧЕСКИЕ СВОЙСТВА ØПо принципу радикального замещения: • Нитрование (реакция Коновалова) – взаимодействие с 12÷ 15%-ным раствором HNO 3 или оксидами азота при 150ºС. 2 -нитропропан 41
 ХИМИЧЕСКИЕ СВОЙСТВА ØПо принципу радикального замещения: • Окисление § При температуре свыше 300ºС в присутствии кислорода легко сгорают. Смеси алканов с кислородом взрывоопасны. § При температуре около 200ºС в присутствии марганцевого катализатора могут быть получены продукты частичного окисления, в основном карбоновые кислоты. 42
ХИМИЧЕСКИЕ СВОЙСТВА ØПо принципу радикального замещения: • Окисление § При температуре свыше 300ºС в присутствии кислорода легко сгорают. Смеси алканов с кислородом взрывоопасны. § При температуре около 200ºС в присутствии марганцевого катализатора могут быть получены продукты частичного окисления, в основном карбоновые кислоты. 42
 ХИМИЧЕСКИЕ СВОЙСТВА ØПо принципу радикального замещения: • Окисление 43
ХИМИЧЕСКИЕ СВОЙСТВА ØПо принципу радикального замещения: • Окисление 43
 ХИМИЧЕСКИЕ СВОЙСТВА ØРазрушение или крекинг: При температуре выше 500ºС алканы становятся нестабильными и распадаются с образованием углеводородов с меньшей молекулярной массой и водорода. Распад алканов называют крекингом. Катализатор уменьшает температуру распада. Различают термический и каталитический крекинг. 44
ХИМИЧЕСКИЕ СВОЙСТВА ØРазрушение или крекинг: При температуре выше 500ºС алканы становятся нестабильными и распадаются с образованием углеводородов с меньшей молекулярной массой и водорода. Распад алканов называют крекингом. Катализатор уменьшает температуру распада. Различают термический и каталитический крекинг. 44
 ХИМИЧЕСКИЕ СВОЙСТВА ØРазрушение или крекинг: Труднее всего протекают термические превращения метана и этана 45
ХИМИЧЕСКИЕ СВОЙСТВА ØРазрушение или крекинг: Труднее всего протекают термические превращения метана и этана 45
 ХИМИЧЕСКИЕ СВОЙСТВА ØРазрушение или крекинг: Неразветвленные алканы с шестью и более атомами углерода в цепи в присутствии катализатора подвергаются дегидроциклизации или ароматизации. 46
ХИМИЧЕСКИЕ СВОЙСТВА ØРазрушение или крекинг: Неразветвленные алканы с шестью и более атомами углерода в цепи в присутствии катализатора подвергаются дегидроциклизации или ароматизации. 46
 ХИМИЧЕСКИЕ СВОЙСТВА ØИзомеризация: Под действием сильных электрофильных реагентов (Al. Cl 3, Al. Br 3, BF 3 + HF) алканы изомеризуются. Чем длиннее цепь углеродных атомов тем легче протекает изомеризация. 47
ХИМИЧЕСКИЕ СВОЙСТВА ØИзомеризация: Под действием сильных электрофильных реагентов (Al. Cl 3, Al. Br 3, BF 3 + HF) алканы изомеризуются. Чем длиннее цепь углеродных атомов тем легче протекает изомеризация. 47
 ХИМИЧЕСКИЕ СВОЙСТВА Реакционная активность алканов начиная с бутана при переходе на неразветвленные, а особенно на разветвленные, увеличивается. В реакциях радикального замещения и термического расщепления промежуточными частицами являются свободные алкильные радикалы, стабильность которых возрастает с увеличением длины и ещё больше с увеличением степени разветвленности цепи. 48
ХИМИЧЕСКИЕ СВОЙСТВА Реакционная активность алканов начиная с бутана при переходе на неразветвленные, а особенно на разветвленные, увеличивается. В реакциях радикального замещения и термического расщепления промежуточными частицами являются свободные алкильные радикалы, стабильность которых возрастает с увеличением длины и ещё больше с увеличением степени разветвленности цепи. 48
 ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Циклические предельные углеводороды
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Циклические предельные углеводороды
 НОМЕНКЛАТУРА 50
НОМЕНКЛАТУРА 50
 ГОМОЛОГИЧЕСКИЙ РЯД 51
ГОМОЛОГИЧЕСКИЙ РЯД 51
 ФИЗИЧЕСКИЕ СВОЙСТВА 52
ФИЗИЧЕСКИЕ СВОЙСТВА 52
 СТРОЕНИЕ МОЛЕКУЛ. ИЗОМЕРИЯ 53
СТРОЕНИЕ МОЛЕКУЛ. ИЗОМЕРИЯ 53
 54
54
 СТРОЕНИЕ МОЛЕКУЛ. ИЗОМЕРИЯ 55
СТРОЕНИЕ МОЛЕКУЛ. ИЗОМЕРИЯ 55
 СПОСОБЫ ПОЛУЧЕНИЯ Ø Промышленные: 56
СПОСОБЫ ПОЛУЧЕНИЯ Ø Промышленные: 56
 СПОСОБЫ ПОЛУЧЕНИЯ Ø Лабораторные: 57
СПОСОБЫ ПОЛУЧЕНИЯ Ø Лабораторные: 57
 ХИМИЧЕСКИЕ СВОЙСТВА 58
ХИМИЧЕСКИЕ СВОЙСТВА 58
 НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Ациклические непредельные углеводороды с одной двойной связью
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Ациклические непредельные углеводороды с одной двойной связью
 НОМЕНКЛАТУРА • 60
НОМЕНКЛАТУРА • 60
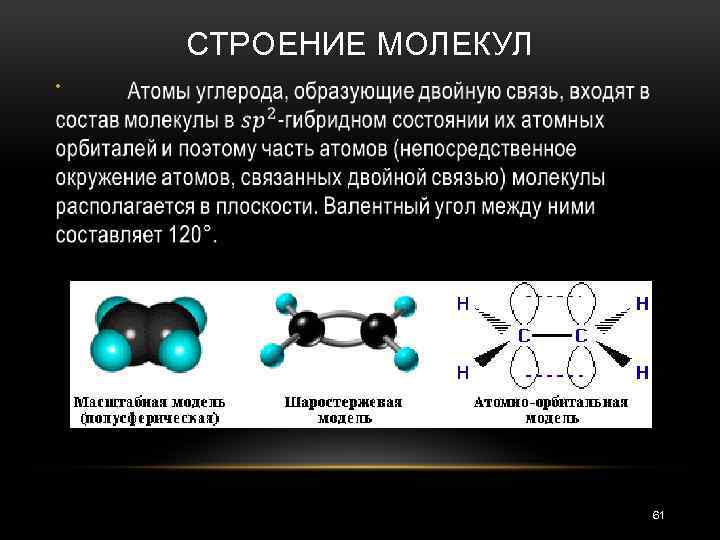 СТРОЕНИЕ МОЛЕКУЛ • 61
СТРОЕНИЕ МОЛЕКУЛ • 61
 СТРОЕНИЕ МОЛЕКУЛ 62
СТРОЕНИЕ МОЛЕКУЛ 62
 СТРОЕНИЕ МОЛЕКУЛ Двойная связь намного прочнее и короче одинарной. 63
СТРОЕНИЕ МОЛЕКУЛ Двойная связь намного прочнее и короче одинарной. 63
 ГОМОЛОГИЧЕСКИЙ РЯД Этен этилен Пропен пропилен Бутен-1 Цис-бутен-2 Транс-бутен-2 2 -метилпропен изобутилен 64
ГОМОЛОГИЧЕСКИЙ РЯД Этен этилен Пропен пропилен Бутен-1 Цис-бутен-2 Транс-бутен-2 2 -метилпропен изобутилен 64
 ГОМОЛОГИЧЕСКИЙ РЯД Пентен-1 Гексен-1 Гептен-1 Октен-1 Нанен-1 Декен-1 65
ГОМОЛОГИЧЕСКИЙ РЯД Пентен-1 Гексен-1 Гептен-1 Октен-1 Нанен-1 Декен-1 65
 НАЗВАНИЯ ОДНОВАЛЕНТНЫХ РАДИКАЛОВ Этенил Винил Пропенил-2 Аллил Пропенил-1 Метилэтенил Изопропенил Бутенил-1 Бутенил-2 Бутенил-3 66
НАЗВАНИЯ ОДНОВАЛЕНТНЫХ РАДИКАЛОВ Этенил Винил Пропенил-2 Аллил Пропенил-1 Метилэтенил Изопропенил Бутенил-1 Бутенил-2 Бутенил-3 66
 ИЗОМЕРИЯ Ø Отличительной чертой является изомерия положения кратной (двойной) связи. Ø Кроме того структурная (строения углеродного скелета) Ø Для симметрично построенных алкенов характерна пространственная (геометрическая) изомерия. Такие изомеры различаются положением атомов или атомных группировок относительно оси двойной связи. 67
ИЗОМЕРИЯ Ø Отличительной чертой является изомерия положения кратной (двойной) связи. Ø Кроме того структурная (строения углеродного скелета) Ø Для симметрично построенных алкенов характерна пространственная (геометрическая) изомерия. Такие изомеры различаются положением атомов или атомных группировок относительно оси двойной связи. 67
 ФИЗИЧЕСКИЕ СВОЙСТВА • 68
ФИЗИЧЕСКИЕ СВОЙСТВА • 68
 ФИЗИЧЕСКИЕ СВОЙСТВА Плотность алкенов выше, чем у алканов с тем же числом атомов углерода в молекуле, но меньше плотности воды (то есть единицы) и возрастает с увеличением молекулярной массы. Так же алкены характеризуются большим значением (чем алканы с тем же числом атомов углерода в молекуле) коэффициента преломления света и молекулярной рефракции. 69
ФИЗИЧЕСКИЕ СВОЙСТВА Плотность алкенов выше, чем у алканов с тем же числом атомов углерода в молекуле, но меньше плотности воды (то есть единицы) и возрастает с увеличением молекулярной массы. Так же алкены характеризуются большим значением (чем алканы с тем же числом атомов углерода в молекуле) коэффициента преломления света и молекулярной рефракции. 69
 СПОСОБЫ ПОЛУЧЕНИЯ Ø Промышленные: • Крекинг алканов (см. химические свойства алканов) • Дегидрирование алканов (см. химические свойства алканов) Ø Лабораторные: • Дегидратацией спиртов 70
СПОСОБЫ ПОЛУЧЕНИЯ Ø Промышленные: • Крекинг алканов (см. химические свойства алканов) • Дегидрирование алканов (см. химические свойства алканов) Ø Лабораторные: • Дегидратацией спиртов 70
 СПОСОБЫ ПОЛУЧЕНИЯ Ø Лабораторные: • Дегидрогалогенирование галогенпроизводных алканов (взаимодействие галогеналканов со спиртовым раствором щелочи) • Дегалогенирование дигалогенпроизводных алканов (взаимодействие дигалогеналканов с металлическим цинком) 71
СПОСОБЫ ПОЛУЧЕНИЯ Ø Лабораторные: • Дегидрогалогенирование галогенпроизводных алканов (взаимодействие галогеналканов со спиртовым раствором щелочи) • Дегалогенирование дигалогенпроизводных алканов (взаимодействие дигалогеналканов с металлическим цинком) 71
 ХИМИЧЕСКИЕ СВОЙСТВА Реакции алкенов обусловлены наличием двойной связи, которая легко поляризуется и обладает электроннодонорными свойствами и значительно влияет на реакционную активность расположенных рядом связей C-H (аллильное положение). Для алкенов характерны следующие свойства: Ø Гидрирование. 72
ХИМИЧЕСКИЕ СВОЙСТВА Реакции алкенов обусловлены наличием двойной связи, которая легко поляризуется и обладает электроннодонорными свойствами и значительно влияет на реакционную активность расположенных рядом связей C-H (аллильное положение). Для алкенов характерны следующие свойства: Ø Гидрирование. 72
 ХИМИЧЕСКИЕ СВОЙСТВА Ø Взаимодействие с электрофильными реагентами. • Гидрогалогенирование (присоединение галогеноводородов). Реакция катализируется серной кислотой. В случае несимметричных алкенов в большинстве случаев протон присоединяется к «более гидрированному» атому углерода – правило В. В. Марковникова. 73
ХИМИЧЕСКИЕ СВОЙСТВА Ø Взаимодействие с электрофильными реагентами. • Гидрогалогенирование (присоединение галогеноводородов). Реакция катализируется серной кислотой. В случае несимметричных алкенов в большинстве случаев протон присоединяется к «более гидрированному» атому углерода – правило В. В. Марковникова. 73
 ХИМИЧЕСКИЕ СВОЙСТВА Ø Взаимодействие с электрофильными реагентами. • Гидротация (присоединение воды). Реакция катализируется серной кислотой. В случае несимметричных алкенов реакция идет по правилу В. В. Марковникова. 74
ХИМИЧЕСКИЕ СВОЙСТВА Ø Взаимодействие с электрофильными реагентами. • Гидротация (присоединение воды). Реакция катализируется серной кислотой. В случае несимметричных алкенов реакция идет по правилу В. В. Марковникова. 74
 ХИМИЧЕСКИЕ СВОЙСТВА • Галогенирование (присоединение галогенов). Энергично, даже со взрывом и без доступа света, реагирует фтор, менее энергично реакция идет с хлором и бромом, а йод реагирует очень медленно. В результате образуются транс-дигалогеналканы. Если же реакция протекает на свету, то имеет место свободно радикальный механизм протекания и образуются как транс- так и цис- изомеры. 75
ХИМИЧЕСКИЕ СВОЙСТВА • Галогенирование (присоединение галогенов). Энергично, даже со взрывом и без доступа света, реагирует фтор, менее энергично реакция идет с хлором и бромом, а йод реагирует очень медленно. В результате образуются транс-дигалогеналканы. Если же реакция протекает на свету, то имеет место свободно радикальный механизм протекания и образуются как транс- так и цис- изомеры. 75
 ХИМИЧЕСКИЕ СВОЙСТВА • Взаимодействие с ионами металлов, имеющими незаполненные орбитали. 76
ХИМИЧЕСКИЕ СВОЙСТВА • Взаимодействие с ионами металлов, имеющими незаполненные орбитали. 76
 ХИМИЧЕСКИЕ СВОЙСТВА Ø Гидрофилирование алкенов (оксосинтез). Алкены при температуре от 90°С до 150°С и давлении от 10 МПа до 30 МПа в присутствии катализаторов (соли кобальта или металлический кобальт, осаждённый на пористом носителе) взаимодействуют со смесью угарного газа и водорода. Ø Окисление. • При высоких температурах под действием кислорода алкены полностью окисляются, то есть сгорают. 77
ХИМИЧЕСКИЕ СВОЙСТВА Ø Гидрофилирование алкенов (оксосинтез). Алкены при температуре от 90°С до 150°С и давлении от 10 МПа до 30 МПа в присутствии катализаторов (соли кобальта или металлический кобальт, осаждённый на пористом носителе) взаимодействуют со смесью угарного газа и водорода. Ø Окисление. • При высоких температурах под действием кислорода алкены полностью окисляются, то есть сгорают. 77
 ХИМИЧЕСКИЕ СВОЙСТВА • Перманганатом калия в водных растворах алкены окисляются по разному 78
ХИМИЧЕСКИЕ СВОЙСТВА • Перманганатом калия в водных растворах алкены окисляются по разному 78
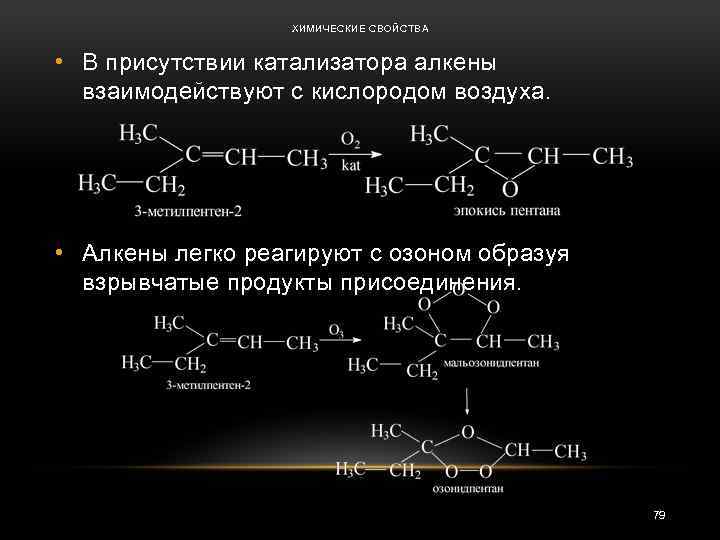 ХИМИЧЕСКИЕ СВОЙСТВА • В присутствии катализатора алкены взаимодействуют с кислородом воздуха. • Алкены легко реагируют с озоном образуя взрывчатые продукты присоединения. 79
ХИМИЧЕСКИЕ СВОЙСТВА • В присутствии катализатора алкены взаимодействуют с кислородом воздуха. • Алкены легко реагируют с озоном образуя взрывчатые продукты присоединения. 79
 ХИМИЧЕСКИЕ СВОЙСТВА Ø Полимеризация. Алкены проявляют большую склонность. Различают: • Катионная полимеризация (катализируется кислотой) 80
ХИМИЧЕСКИЕ СВОЙСТВА Ø Полимеризация. Алкены проявляют большую склонность. Различают: • Катионная полимеризация (катализируется кислотой) 80
 ХИМИЧЕСКИЕ СВОЙСТВА Дальнейшая полимеризация приводит к полиизобутилену. • Анионная полимеризация 81
ХИМИЧЕСКИЕ СВОЙСТВА Дальнейшая полимеризация приводит к полиизобутилену. • Анионная полимеризация 81
 ХИМИЧЕСКИЕ СВОЙСТВА В общем виде такая полимеризация может быть вырожена следующим уравнением • Свободнорадикальная полимеризация 82
ХИМИЧЕСКИЕ СВОЙСТВА В общем виде такая полимеризация может быть вырожена следующим уравнением • Свободнорадикальная полимеризация 82
 ХИМИЧЕСКИЕ СВОЙСТВА Обрыв цепи • Сополимеризация 83
ХИМИЧЕСКИЕ СВОЙСТВА Обрыв цепи • Сополимеризация 83
 ХИМИЧЕСКИЕ СВОЙСТВА Ø Циклоприсоединение • 2+1 • 2+2 84
ХИМИЧЕСКИЕ СВОЙСТВА Ø Циклоприсоединение • 2+1 • 2+2 84
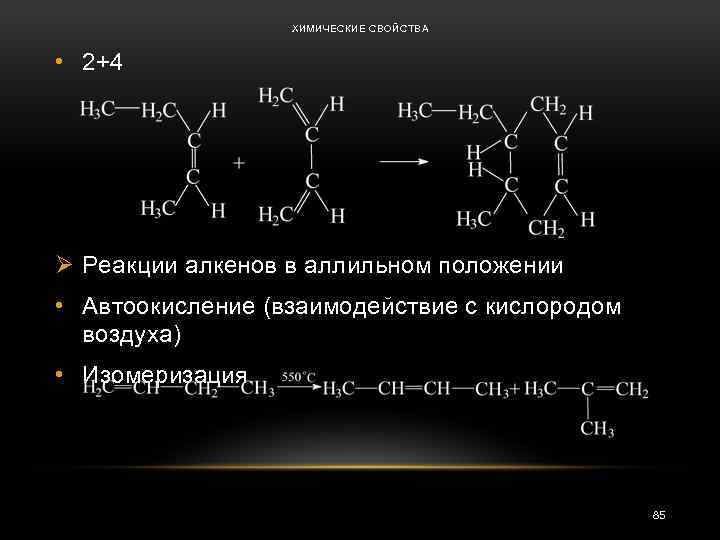 ХИМИЧЕСКИЕ СВОЙСТВА • 2+4 Ø Реакции алкенов в аллильном положении • Автоокисление (взаимодействие с кислородом воздуха) • Изомеризация. 85
ХИМИЧЕСКИЕ СВОЙСТВА • 2+4 Ø Реакции алкенов в аллильном положении • Автоокисление (взаимодействие с кислородом воздуха) • Изомеризация. 85
 ХИМИЧЕСКИЕ СВОЙСТВА • Аллильное галогенирование При высокотемпературном взаимодействии гомологов этилена с хлором и бромом могут происходить оба процесса – присоединение и замещение 86
ХИМИЧЕСКИЕ СВОЙСТВА • Аллильное галогенирование При высокотемпературном взаимодействии гомологов этилена с хлором и бромом могут происходить оба процесса – присоединение и замещение 86
 ХИМИЧЕСКИЕ СВОЙСТВА Атомы водорода, расположенные у различных углеродных атомов замещаются с неодинаковой легкостью и могу быть поэтому признаку расположены в такой последовательности: аллильный > третичный > вторичный > первичный > > винильный 87
ХИМИЧЕСКИЕ СВОЙСТВА Атомы водорода, расположенные у различных углеродных атомов замещаются с неодинаковой легкостью и могу быть поэтому признаку расположены в такой последовательности: аллильный > третичный > вторичный > первичный > > винильный 87
 ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ Из большого числа олефинов особую ценность представляют: 88
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ Из большого числа олефинов особую ценность представляют: 88
 НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Ациклические непредельные углеводороды с двумя двойными связями
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Ациклические непредельные углеводороды с двумя двойными связями
 90
90
 КЛАССИФИКАЦИЯ По взаимному расположению двойных связей различают диеновые углероды трех типов: • Диены с кумулированными или алленовыми связями (диены-1, 2) • Диены с сопряженными или коньюгированными связями (диены-1, 3) • Диены с изолированными связями 91
КЛАССИФИКАЦИЯ По взаимному расположению двойных связей различают диеновые углероды трех типов: • Диены с кумулированными или алленовыми связями (диены-1, 2) • Диены с сопряженными или коньюгированными связями (диены-1, 3) • Диены с изолированными связями 91
 НОМЕНКЛАТУРА • 92
НОМЕНКЛАТУРА • 92
 ГОМОЛОГИЧЕСКИЙ РЯД Диены с кумулированными или алленовыми связями (диены-1, 2) Пропадиен аллен Бутадиен-1, 2 метилаллен Диены с сопряженными или коньюгированными связями (диены-1, 3) Бутадин-1, 3 дивинил 2 -метилбутадиен -1, 3 изопрен 93
ГОМОЛОГИЧЕСКИЙ РЯД Диены с кумулированными или алленовыми связями (диены-1, 2) Пропадиен аллен Бутадиен-1, 2 метилаллен Диены с сопряженными или коньюгированными связями (диены-1, 3) Бутадин-1, 3 дивинил 2 -метилбутадиен -1, 3 изопрен 93
 ГОМОЛОГИЧЕСКИЙ РЯД Диены с изолированными связями Пентадиен-1, 4 дивенилметан Гександиен-1, 5 диаллил 94
ГОМОЛОГИЧЕСКИЙ РЯД Диены с изолированными связями Пентадиен-1, 4 дивенилметан Гександиен-1, 5 диаллил 94
 ФИЗИЧЕСКИЕ СВОЙСТВА • 95
ФИЗИЧЕСКИЕ СВОЙСТВА • 95
 ФИЗИЧЕСКИЕ СВОЙСТВА • 96
ФИЗИЧЕСКИЕ СВОЙСТВА • 96
 ИЗОМЕРИЯ 97
ИЗОМЕРИЯ 97
 СПОСОБЫ ПОЛУЧЕНИЯ Ø Алкадиены-1, 2: • Из галогеналкенов • Из производных ацетилена 98
СПОСОБЫ ПОЛУЧЕНИЯ Ø Алкадиены-1, 2: • Из галогеналкенов • Из производных ацетилена 98
 СПОСОБЫ ПОЛУЧЕНИЯ Ø Алкадиены-1, 3: получают по средствам различных реакций отщепления как из алканов или алкенов, так и из одноатомных спиртов, гликолей и галогенпроизводных углеводородов. Рассмотрим на примере наиболее важных. Бутадиен-1, 3. Бесцветный газ с резким запахом, один из основных мономеров для получения каучука и латексов, а так же для синтеза других промышленных продуктов, в том числе перхлордивинила - средства для борьбы филлоксерой на виноградных плантациях. • Из этилового спирта Бутадиен-1, 3 99
СПОСОБЫ ПОЛУЧЕНИЯ Ø Алкадиены-1, 3: получают по средствам различных реакций отщепления как из алканов или алкенов, так и из одноатомных спиртов, гликолей и галогенпроизводных углеводородов. Рассмотрим на примере наиболее важных. Бутадиен-1, 3. Бесцветный газ с резким запахом, один из основных мономеров для получения каучука и латексов, а так же для синтеза других промышленных продуктов, в том числе перхлордивинила - средства для борьбы филлоксерой на виноградных плантациях. • Из этилового спирта Бутадиен-1, 3 99
 СПОСОБЫ ПОЛУЧЕНИЯ БУТАДИЕН-1, 3. • Дегидрированием бутана • Из гликолей или 100
СПОСОБЫ ПОЛУЧЕНИЯ БУТАДИЕН-1, 3. • Дегидрированием бутана • Из гликолей или 100
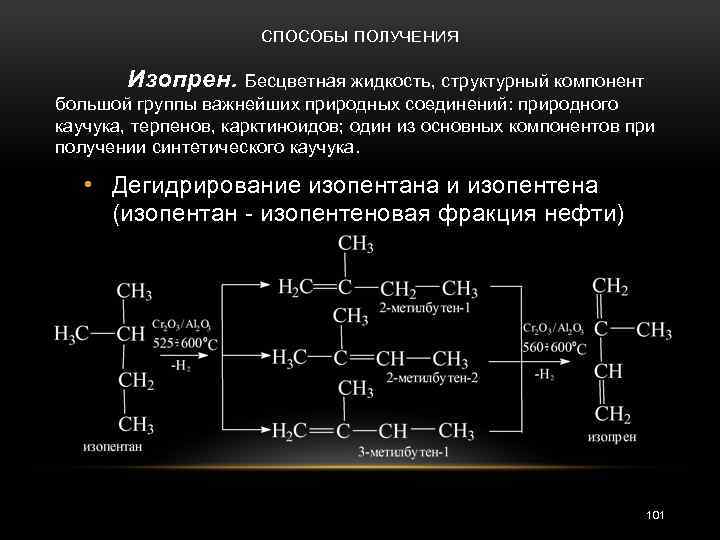 СПОСОБЫ ПОЛУЧЕНИЯ Изопрен. Бесцветная жидкость, структурный компонент большой группы важнейших природных соединений: природного каучука, терпенов, карктиноидов; один из основных компонентов при получении синтетического каучука. • Дегидрирование изопентана и изопентена (изопентан - изопентеновая фракция нефти) 101
СПОСОБЫ ПОЛУЧЕНИЯ Изопрен. Бесцветная жидкость, структурный компонент большой группы важнейших природных соединений: природного каучука, терпенов, карктиноидов; один из основных компонентов при получении синтетического каучука. • Дегидрирование изопентана и изопентена (изопентан - изопентеновая фракция нефти) 101
 СПОСОБЫ ПОЛУЧЕНИЯ ИЗОПРЕН. • синтез из пропилена 1) Алкилирование 2) Изомеризация 3) Деметанирование 102
СПОСОБЫ ПОЛУЧЕНИЯ ИЗОПРЕН. • синтез из пропилена 1) Алкилирование 2) Изомеризация 3) Деметанирование 102
 ХИМИЧЕСКИЕ СВОЙСТВА Ø Аллены активны главным образом в реакциях присоединения и полимеризации. • Гидрирование • Гидрогалогенирование 103
ХИМИЧЕСКИЕ СВОЙСТВА Ø Аллены активны главным образом в реакциях присоединения и полимеризации. • Гидрирование • Гидрогалогенирование 103
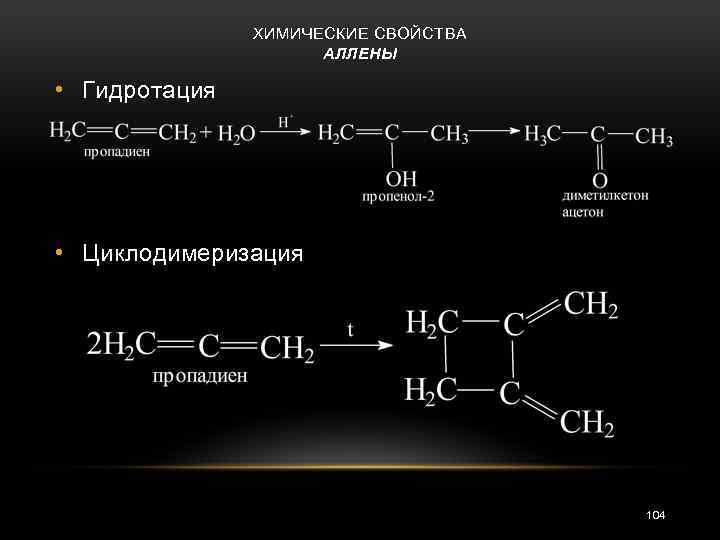 ХИМИЧЕСКИЕ СВОЙСТВА АЛЛЕНЫ • Гидротация • Циклодимеризация 104
ХИМИЧЕСКИЕ СВОЙСТВА АЛЛЕНЫ • Гидротация • Циклодимеризация 104
 ХИМИЧЕСКИЕ СВОЙСТВА Ø Алкадиены-1, 3 • Гидрирование • Галогенирование 105
ХИМИЧЕСКИЕ СВОЙСТВА Ø Алкадиены-1, 3 • Гидрирование • Галогенирование 105
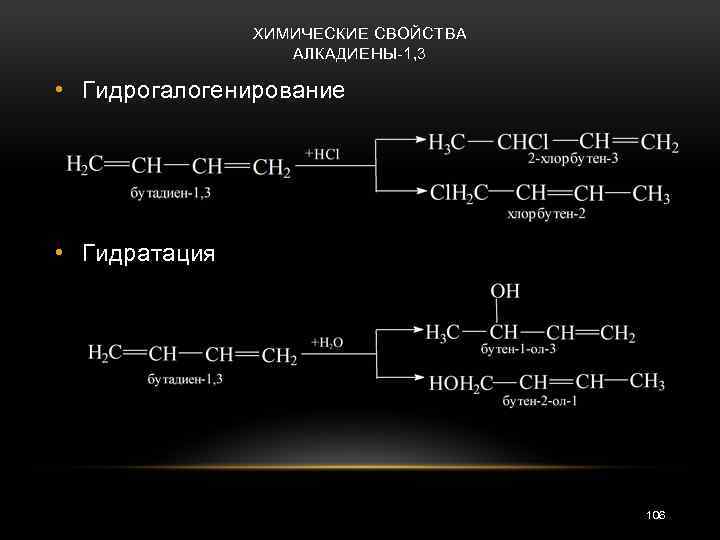 ХИМИЧЕСКИЕ СВОЙСТВА АЛКАДИЕНЫ-1, 3 • Гидрогалогенирование • Гидратация 106
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАДИЕНЫ-1, 3 • Гидрогалогенирование • Гидратация 106
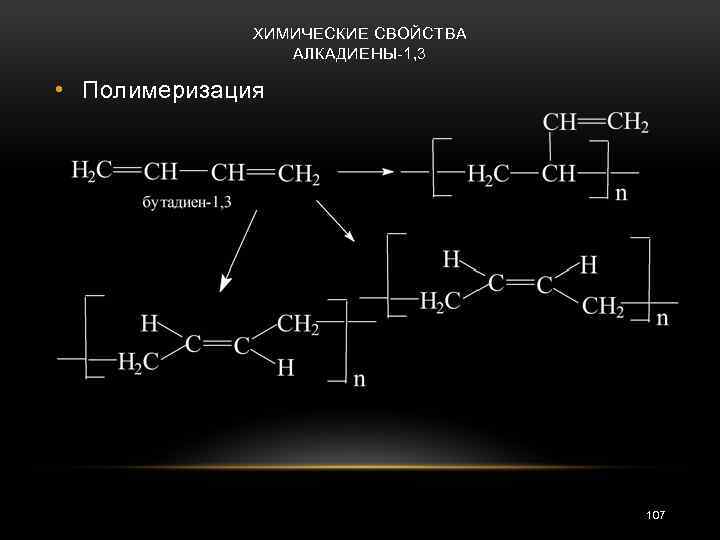 ХИМИЧЕСКИЕ СВОЙСТВА АЛКАДИЕНЫ-1, 3 • Полимеризация 107
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАДИЕНЫ-1, 3 • Полимеризация 107
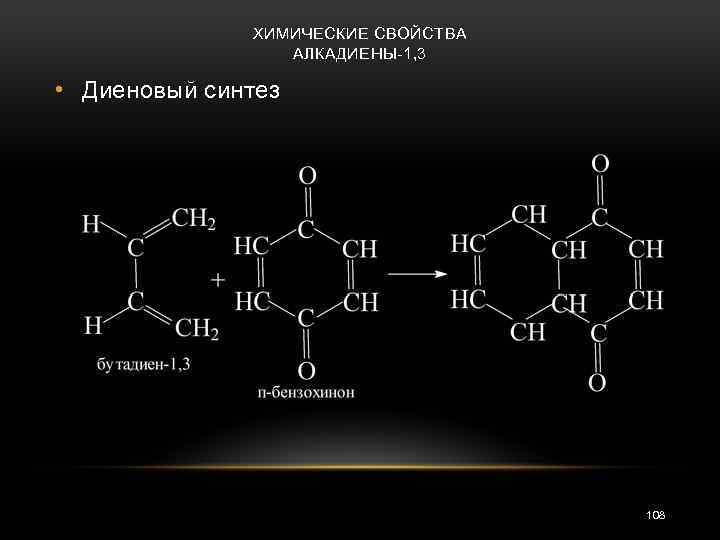 ХИМИЧЕСКИЕ СВОЙСТВА АЛКАДИЕНЫ-1, 3 • Диеновый синтез 108
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАДИЕНЫ-1, 3 • Диеновый синтез 108
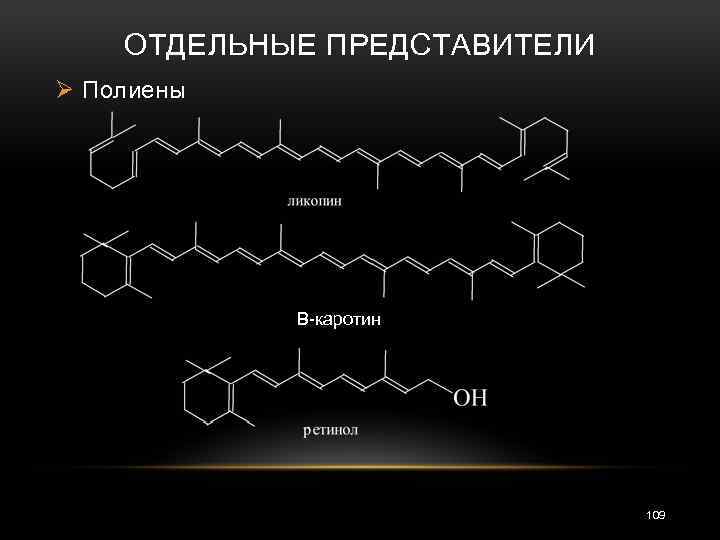 ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ Ø Полиены Β-каротин 109
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ Ø Полиены Β-каротин 109
 НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Нециклические непредельные углеводороды с тройной связью
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Нециклические непредельные углеводороды с тройной связью
 ФИЗИЧЕСКИЕ СВОЙСТВА 111
ФИЗИЧЕСКИЕ СВОЙСТВА 111
 ФИЗИЧЕСКИЕ СВОЙСТВА 112
ФИЗИЧЕСКИЕ СВОЙСТВА 112
 ФИЗИЧЕСКИЕ СВОЙСТВА • 113
ФИЗИЧЕСКИЕ СВОЙСТВА • 113
 ФИЗИЧЕСКИЕ СВОЙСТВА Все алкины бесцветны. Низкомолекулярные алкины в газообразном состоянии обладают легким эфирным ароматом, жидкие пахнут бензином или керосином, твердые – запахом не обладают. Все алкины ядовиты! В воде растворяются очень плохо, практически никак. Очень хорошо растворяются друг в друге и других углеводородах. Плотность всех алкинов меньше плотности воды. В сжатом виде без растворителя ацетилен взрывается от удара. 114
ФИЗИЧЕСКИЕ СВОЙСТВА Все алкины бесцветны. Низкомолекулярные алкины в газообразном состоянии обладают легким эфирным ароматом, жидкие пахнут бензином или керосином, твердые – запахом не обладают. Все алкины ядовиты! В воде растворяются очень плохо, практически никак. Очень хорошо растворяются друг в друге и других углеводородах. Плотность всех алкинов меньше плотности воды. В сжатом виде без растворителя ацетилен взрывается от удара. 114
 НОМЕНКЛАТУРА • 115
НОМЕНКЛАТУРА • 115
 ГОМОЛОГИЧЕСКИЙ РЯД Этин Ацетилен Пропин Метилацетилен Бутин-1 Этилацетилен Бутин-2 Диметилацетилен Пентин-1 Пропилацетилен Пентин-2 метилэтилацетилен 116
ГОМОЛОГИЧЕСКИЙ РЯД Этин Ацетилен Пропин Метилацетилен Бутин-1 Этилацетилен Бутин-2 Диметилацетилен Пентин-1 Пропилацетилен Пентин-2 метилэтилацетилен 116
 ГОМОЛОГИЧЕСКИЙ РЯД Этинил Пропинил-1 Пропинил-2 Пропаргил 117
ГОМОЛОГИЧЕСКИЙ РЯД Этинил Пропинил-1 Пропинил-2 Пропаргил 117
 ИЗОМЕРИЯ Ø Структурная изомерия углеродного скелета Ø Изомерия положения тройной связи. 118
ИЗОМЕРИЯ Ø Структурная изомерия углеродного скелета Ø Изомерия положения тройной связи. 118
 СПОСОБЫ ПОЛУЧЕНИЯ Ø Пиролиз Ø Из карбидов 119
СПОСОБЫ ПОЛУЧЕНИЯ Ø Пиролиз Ø Из карбидов 119
 СПОСОБЫ ПОЛУЧЕНИЯ Ø Из галогенпроизводных Ø Алкилирование алкинов 120
СПОСОБЫ ПОЛУЧЕНИЯ Ø Из галогенпроизводных Ø Алкилирование алкинов 120
 ХИМИЧЕСКИЕ СВОЙСТВА Ø Реакции присоединения • Гидрирование • Галогенирование 121
ХИМИЧЕСКИЕ СВОЙСТВА Ø Реакции присоединения • Гидрирование • Галогенирование 121
 ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ПРИСОЕДИНЕНИЯ • Гидрироглогенирование • Гидратация 122
ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ПРИСОЕДИНЕНИЯ • Гидрироглогенирование • Гидратация 122
 ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ПРИСОЕДИНЕНИЯ • Взаимодействие со спиртами • Взаимодействие с карбоновыми кислотами 123
ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ПРИСОЕДИНЕНИЯ • Взаимодействие со спиртами • Взаимодействие с карбоновыми кислотами 123
 ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ПРИСОЕДИНЕНИЯ • Взаимодействие с синильной кислотой (характерно только для ацетилена) • Карбонилирование (характерно только для ацетилена) 124
ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ПРИСОЕДИНЕНИЯ • Взаимодействие с синильной кислотой (характерно только для ацетилена) • Карбонилирование (характерно только для ацетилена) 124
 ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ПРИСОЕДИНЕНИЯ • 125
ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ПРИСОЕДИНЕНИЯ • 125
 ХИМИЧЕСКИЕ СВОЙСТВА. ПОЛИМЕРИЗАЦИЯ 126
ХИМИЧЕСКИЕ СВОЙСТВА. ПОЛИМЕРИЗАЦИЯ 126
 ХИМИЧЕСКИЕ СВОЙСТВА. ПОЛИМЕРИЗАЦИЯ 127
ХИМИЧЕСКИЕ СВОЙСТВА. ПОЛИМЕРИЗАЦИЯ 127
 ХИМИЧЕСКИЕ СВОЙСТВА. • 128
ХИМИЧЕСКИЕ СВОЙСТВА. • 128
 ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ 129
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ 129
 НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Циклические непредельные углеводороды
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Циклические непредельные углеводороды
 КЛАССИФИКАЦИИ Ø Циклоалкены с одной двойной связью Ø Циклоалкены с двумя двойными связями Ø Циклоалкены с тремя двойными связями 131
КЛАССИФИКАЦИИ Ø Циклоалкены с одной двойной связью Ø Циклоалкены с двумя двойными связями Ø Циклоалкены с тремя двойными связями 131
 НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Непредельные циклические углеводороды с сопряженными двойными связями. Арены.
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Непредельные циклические углеводороды с сопряженными двойными связями. Арены.
 КЛАССИФИКАЦИИ Ø Одноядерные 133
КЛАССИФИКАЦИИ Ø Одноядерные 133
 КЛАССИФИКАЦИИ Ø Двуядерные 134
КЛАССИФИКАЦИИ Ø Двуядерные 134
 КЛАССИФИКАЦИИ Ø Полиядерные 135
КЛАССИФИКАЦИИ Ø Полиядерные 135
 СТРОЕНИЕ МОЛЕКУЛ 136
СТРОЕНИЕ МОЛЕКУЛ 136
 СТРОЕНИЕ МОЛЕКУЛ 137
СТРОЕНИЕ МОЛЕКУЛ 137
 СТРОЕНИЕ МОЛЕКУЛ 138
СТРОЕНИЕ МОЛЕКУЛ 138
 НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Одноядерные ароматические углеводороды
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Одноядерные ароматические углеводороды
 СТРОЕНИЕ МОЛЕКУЛ 140
СТРОЕНИЕ МОЛЕКУЛ 140
 СТРОЕНИЕ МОЛЕКУЛ 141
СТРОЕНИЕ МОЛЕКУЛ 141
 СТРОЕНИЕ МОЛЕКУЛ Системы замещенных бензолов имеют меньшую симметрию, чем бензол, химические связи в их молекул имеют неодинаковую длину, изменяются порядки π-связей. Как показывают расчеты молекулярных орбиталей, заместители вызывают изменения πэлектронной плотности на углеродных атомах бензольного кольца. Заместители различают электронно-донорные и электронно-акцепторные. К электронно-донорным заместителям относят: алькильные группы, атомы с не поделёнными парами электронов. Такие заместители увеличивают электронную плотность на орто- и пара-углеродных атомах бензольного кольца. 142
СТРОЕНИЕ МОЛЕКУЛ Системы замещенных бензолов имеют меньшую симметрию, чем бензол, химические связи в их молекул имеют неодинаковую длину, изменяются порядки π-связей. Как показывают расчеты молекулярных орбиталей, заместители вызывают изменения πэлектронной плотности на углеродных атомах бензольного кольца. Заместители различают электронно-донорные и электронно-акцепторные. К электронно-донорным заместителям относят: алькильные группы, атомы с не поделёнными парами электронов. Такие заместители увеличивают электронную плотность на орто- и пара-углеродных атомах бензольного кольца. 142
 СТРОЕНИЕ МОЛЕКУЛ δ - δ - δ + δ - δ+ δ - δ δ δ + δ - δ - δ + 143
СТРОЕНИЕ МОЛЕКУЛ δ - δ - δ + δ - δ+ δ - δ δ δ + δ - δ - δ + 143
 СТРОЕНИЕ МОЛЕКУЛ К электронно-акцепторным заместителям относят: группировки с гетероатомами, содержащие двойные и тройные связи. Такие заместители уменьшают электронную плотность на орто- и парауглеродных атомах бензольного кольца. δ + δ - δ δ + δ - δ + δ + δ - δ - δ + δ + δ + δ - 144
СТРОЕНИЕ МОЛЕКУЛ К электронно-акцепторным заместителям относят: группировки с гетероатомами, содержащие двойные и тройные связи. Такие заместители уменьшают электронную плотность на орто- и парауглеродных атомах бензольного кольца. δ + δ - δ δ + δ - δ + δ + δ - δ - δ + δ + δ + δ - 144
 НОМЕНКЛАТУРА По IUPAK ароматические углеводороды рассматриваются как производные бензола. Положения заместителей указывают цифрами, так чтобы номера атомов углерода, у которых расположены заместители, были наименьшими. В случае двух одинаковых заместителей вместо цифр можно пользоваться приставками: 1, 2 Орто- о- 1, 3 Мета- м- 1, 4 Пара- п- 145
НОМЕНКЛАТУРА По IUPAK ароматические углеводороды рассматриваются как производные бензола. Положения заместителей указывают цифрами, так чтобы номера атомов углерода, у которых расположены заместители, были наименьшими. В случае двух одинаковых заместителей вместо цифр можно пользоваться приставками: 1, 2 Орто- о- 1, 3 Мета- м- 1, 4 Пара- п- 145
 НОМЕНКЛАТУРА Для наименования ароматических углеводородов , имеющих сложную боковую цепь или несколько бензольных ядер, их рассматривают как производные алифатических (нециклических), содержащих соответствующие ароатические радикалы: Фенил п-фенилен о-толил м-фенилен м-толил 146
НОМЕНКЛАТУРА Для наименования ароматических углеводородов , имеющих сложную боковую цепь или несколько бензольных ядер, их рассматривают как производные алифатических (нециклических), содержащих соответствующие ароатические радикалы: Фенил п-фенилен о-толил м-фенилен м-толил 146
 НОМЕНКЛАТУРА п-толил Бензенил Бензилиден 147
НОМЕНКЛАТУРА п-толил Бензенил Бензилиден 147
 ГОМОЛОГИЧЕСКИЙ РЯД 148
ГОМОЛОГИЧЕСКИЙ РЯД 148
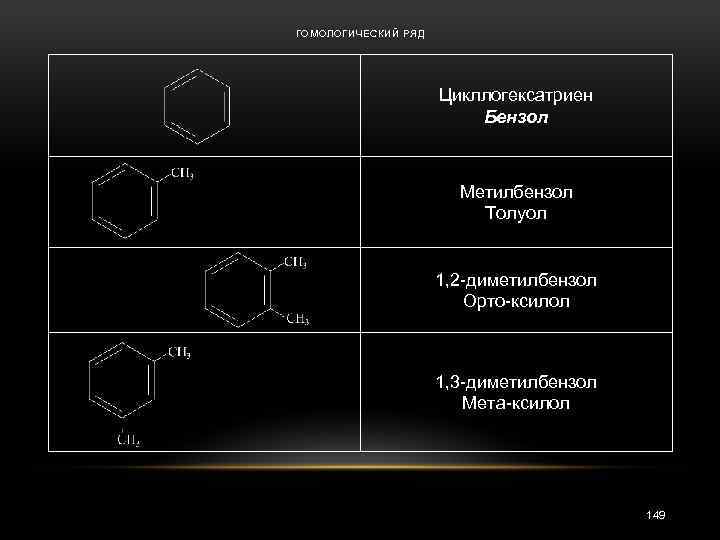 ГОМОЛОГИЧЕСКИЙ РЯД Цикллогексатриен Бензол Метилбензол Толуол 1, 2 -диметилбензол Орто-ксилол 1, 3 -диметилбензол Мета-ксилол 149
ГОМОЛОГИЧЕСКИЙ РЯД Цикллогексатриен Бензол Метилбензол Толуол 1, 2 -диметилбензол Орто-ксилол 1, 3 -диметилбензол Мета-ксилол 149
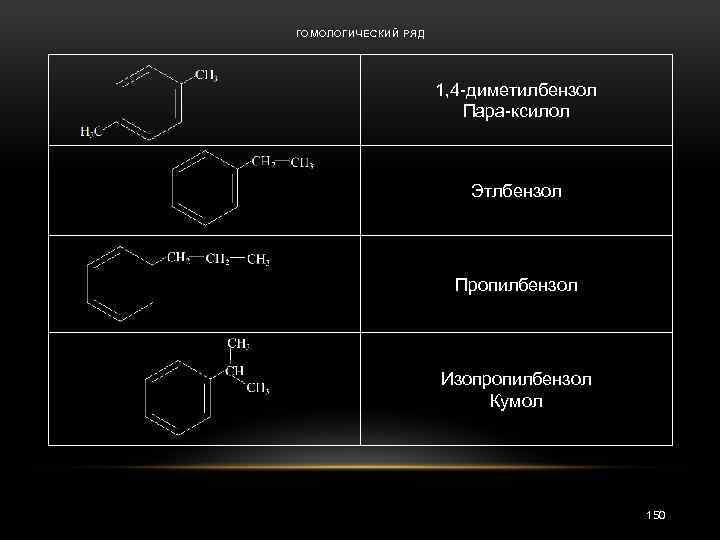 ГОМОЛОГИЧЕСКИЙ РЯД 1, 4 -диметилбензол Пара-ксилол Этлбензол Пропилбензол Изопропилбензол Кумол 150
ГОМОЛОГИЧЕСКИЙ РЯД 1, 4 -диметилбензол Пара-ксилол Этлбензол Пропилбензол Изопропилбензол Кумол 150
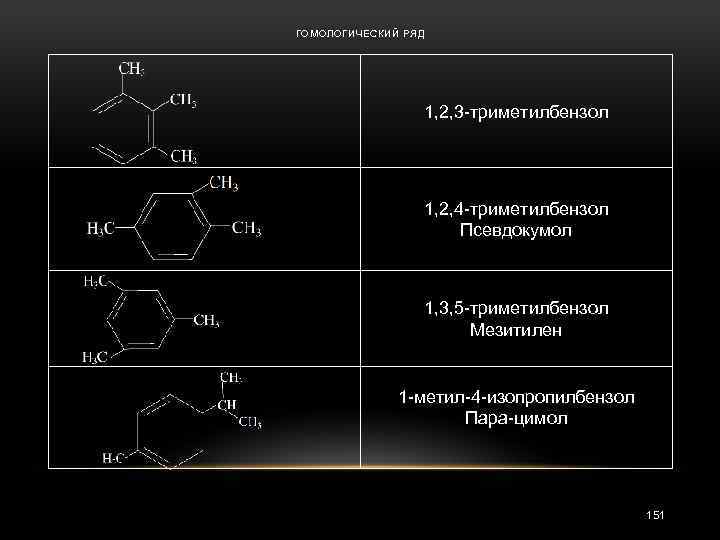 ГОМОЛОГИЧЕСКИЙ РЯД 1, 2, 3 -триметилбензол 1, 2, 4 -триметилбензол Псевдокумол 1, 3, 5 -триметилбензол Мезитилен 1 -метил-4 -изопропилбензол Пара-цимол 151
ГОМОЛОГИЧЕСКИЙ РЯД 1, 2, 3 -триметилбензол 1, 2, 4 -триметилбензол Псевдокумол 1, 3, 5 -триметилбензол Мезитилен 1 -метил-4 -изопропилбензол Пара-цимол 151
 ГОМОЛОГИЧЕСКИЙ РЯД 1, 2, 4, 5 -тетраметилбензол Дурол Венилбензол Стирол Этинилбензол Фенилацетилен 1, 4 -дивинилбензол 152
ГОМОЛОГИЧЕСКИЙ РЯД 1, 2, 4, 5 -тетраметилбензол Дурол Венилбензол Стирол Этинилбензол Фенилацетилен 1, 4 -дивинилбензол 152
 ФИЗИЧЕСКИЕ СВОЙСТВА При обычных условиях арены представляют собой бесцветные жидкости или твердые вещества со своеобразным запахом. Характеризуются высоким показателем преломления света, плотностью меньшей, чем у воды и практически в ней нерастворимостью. Хорошо растворяются в органических растворителях. Горят ярким коптящим пламенем. Температуры плавления и кипения сильно зависят от строения. В большинстве случаев токсичны. 153
ФИЗИЧЕСКИЕ СВОЙСТВА При обычных условиях арены представляют собой бесцветные жидкости или твердые вещества со своеобразным запахом. Характеризуются высоким показателем преломления света, плотностью меньшей, чем у воды и практически в ней нерастворимостью. Хорошо растворяются в органических растворителях. Горят ярким коптящим пламенем. Температуры плавления и кипения сильно зависят от строения. В большинстве случаев токсичны. 153
 ИЗОМЕРИЯ Бензол и его однозамещенные производные не имеют изомеров. Изомерия ди- и полизамещенных бензолов связана с различным расположением заместителей (орто-, мета-, пара-) и их строением. 154
ИЗОМЕРИЯ Бензол и его однозамещенные производные не имеют изомеров. Изомерия ди- и полизамещенных бензолов связана с различным расположением заместителей (орто-, мета-, пара-) и их строением. 154
 СПОСОБЫ ПОЛУЧЕНИЯ Ø Из природных источников • Сухая перегонка каменного угля 900÷ 1000°С Каменный уголь Без доступа воздуха Кокс+ Газ + Смола (бензол + Толуол + Ксило + Полициклические арены + Фенолы + Гетероциклические соединения) (бензол + толуол) Бензол, толуол и другие простые арены встречаются в некоторых сортах нефти, из которой их получают каталитическим крекингом. 155
СПОСОБЫ ПОЛУЧЕНИЯ Ø Из природных источников • Сухая перегонка каменного угля 900÷ 1000°С Каменный уголь Без доступа воздуха Кокс+ Газ + Смола (бензол + Толуол + Ксило + Полициклические арены + Фенолы + Гетероциклические соединения) (бензол + толуол) Бензол, толуол и другие простые арены встречаются в некоторых сортах нефти, из которой их получают каталитическим крекингом. 155
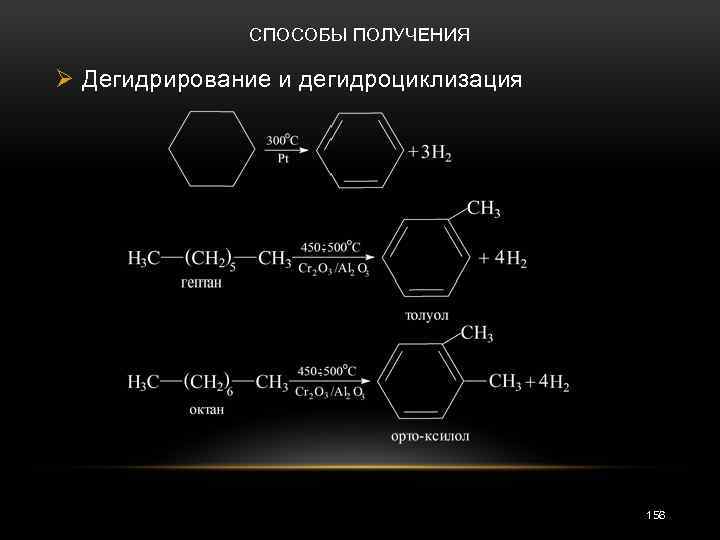 СПОСОБЫ ПОЛУЧЕНИЯ Ø Дегидрирование и дегидроциклизация 156
СПОСОБЫ ПОЛУЧЕНИЯ Ø Дегидрирование и дегидроциклизация 156
 СПОСОБЫ ПОЛУЧЕНИЯ Ø Циклотримеризация В арены легко превращаются алкины (см. химические свойства алкинов). Ø Алкилирование ароматических углеводородов В результате реакций алкилирования бензола образуются алкилбензолы (см. химические свойства бензола). 157
СПОСОБЫ ПОЛУЧЕНИЯ Ø Циклотримеризация В арены легко превращаются алкины (см. химические свойства алкинов). Ø Алкилирование ароматических углеводородов В результате реакций алкилирования бензола образуются алкилбензолы (см. химические свойства бензола). 157
 СПОСОБЫ ПОЛУЧЕНИЯ Ø Из кислородсодержащих производных • Восстановлением арилкетонов • Декарбоксилированием аренкарбоновых кислот 158
СПОСОБЫ ПОЛУЧЕНИЯ Ø Из кислородсодержащих производных • Восстановлением арилкетонов • Декарбоксилированием аренкарбоновых кислот 158
 ХИМИЧЕСКИЕ СВОЙСТВА Ø Реакции электрофильного замещения • Алкилирование Галогеналканы в присутствии галогенидов алюминия, так же можно использовать и Fe. Cl 3, Sn. Cl 4, Ti. Cl 4, BF 3, легко реагируют с бензолом и его гомологами. Реакция Фриделя – Крафтса. 159
ХИМИЧЕСКИЕ СВОЙСТВА Ø Реакции электрофильного замещения • Алкилирование Галогеналканы в присутствии галогенидов алюминия, так же можно использовать и Fe. Cl 3, Sn. Cl 4, Ti. Cl 4, BF 3, легко реагируют с бензолом и его гомологами. Реакция Фриделя – Крафтса. 159
 ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ. АЛКИЛИРОВАНИЕ 160
ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ. АЛКИЛИРОВАНИЕ 160
 ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ • Ацилирование Ацилхлориды реагируют с бензолом и его гомологами в присутствии катализаторов Фриделя - Крафтса. 161
ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ • Ацилирование Ацилхлориды реагируют с бензолом и его гомологами в присутствии катализаторов Фриделя - Крафтса. 161
 ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ. АЦИЛИРОВАНИЕ Наиболее вероятный 162
ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ. АЦИЛИРОВАНИЕ Наиболее вероятный 162
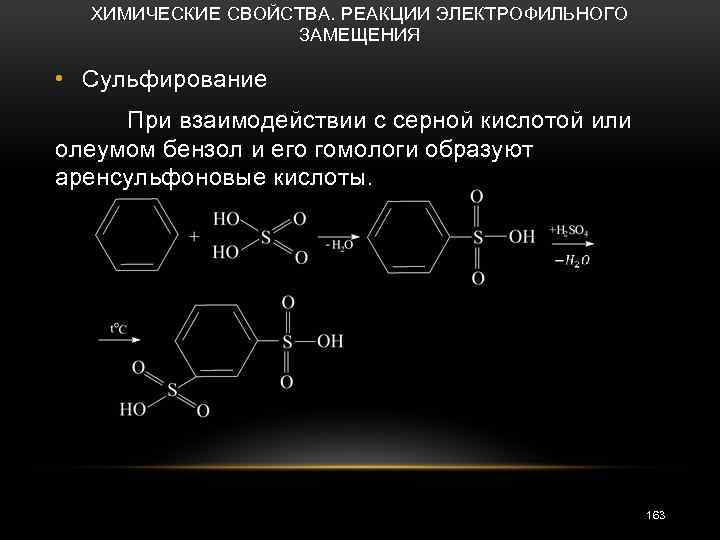 ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ • Сульфирование При взаимодействии с серной кислотой или олеумом бензол и его гомологи образуют аренсульфоновые кислоты. 163
ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ • Сульфирование При взаимодействии с серной кислотой или олеумом бензол и его гомологи образуют аренсульфоновые кислоты. 163
 ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ. СУЛЬФИРОВАНИЕ Сульфирование гомологов бензола протекает легче. 164
ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ. СУЛЬФИРОВАНИЕ Сульфирование гомологов бензола протекает легче. 164
 ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ • 165
ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ • 165
 ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ • Нитрование Гомологи нитруются легче. 166
ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ • Нитрование Гомологи нитруются легче. 166
 ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ • Галогенирование Бензол и его гомологи хлорируются, бромируются и иодируются. Реакции способствуют катализаторы: галогениды железа, алюминия и другие кислоты Льюиса, или просто железные опилки. Хлорирование протекает легче, чем бромирование, которое в свою очередь протекает легче иодирования. 167
ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ • Галогенирование Бензол и его гомологи хлорируются, бромируются и иодируются. Реакции способствуют катализаторы: галогениды железа, алюминия и другие кислоты Льюиса, или просто железные опилки. Хлорирование протекает легче, чем бромирование, которое в свою очередь протекает легче иодирования. 167
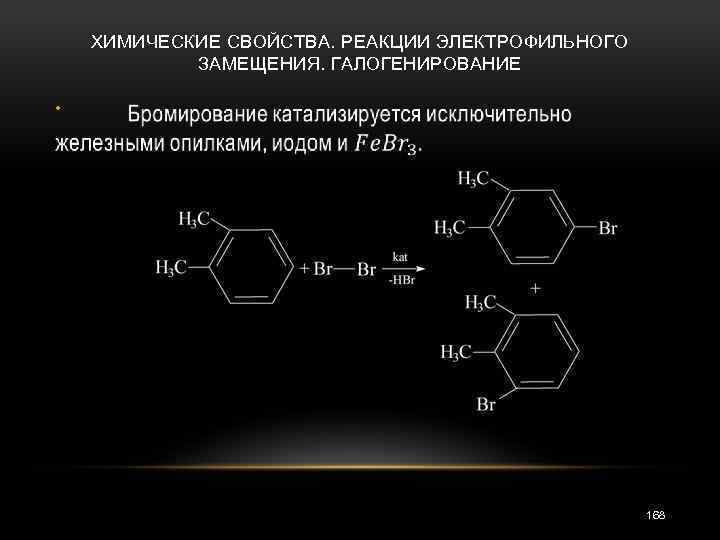 ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ. ГАЛОГЕНИРОВАНИЕ • 168
ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ. ГАЛОГЕНИРОВАНИЕ • 168
 ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ. ГАЛОГЕНИРОВАНИЕ При нагревании и интенсивном освещении гомологи бензола взаимодействуют с галогенами и без участия катализаторов. В такие реакции вступает атом углерода, непосредственно связанный с бензольным циклом. Обычно эти реакции относят к свободнорадикальным. hν hν hν 169
ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ. ГАЛОГЕНИРОВАНИЕ При нагревании и интенсивном освещении гомологи бензола взаимодействуют с галогенами и без участия катализаторов. В такие реакции вступает атом углерода, непосредственно связанный с бензольным циклом. Обычно эти реакции относят к свободнорадикальным. hν hν hν 169
 ХИМИЧЕСКИЕ СВОЙСТВА Ø Реакции присоединения • Гидрирование Гидрируются арены трудно, при повышенной температуре (180°С) и давлении и в присутствии катализаторов, например пористого никеля. В реакции удается выделить только конечный продукт, так как циклогексен и циклогексадиены гидрируются легче безола 170
ХИМИЧЕСКИЕ СВОЙСТВА Ø Реакции присоединения • Гидрирование Гидрируются арены трудно, при повышенной температуре (180°С) и давлении и в присутствии катализаторов, например пористого никеля. В реакции удается выделить только конечный продукт, так как циклогексен и циклогексадиены гидрируются легче безола 170
 ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ПРИСОЕДИНЕНИЯ • Присоединение галогенов Хлор присоединяется к бензолу интенсивном освещении, лучше всего ультрафиолетовым излучением. 171
ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ПРИСОЕДИНЕНИЯ • Присоединение галогенов Хлор присоединяется к бензолу интенсивном освещении, лучше всего ультрафиолетовым излучением. 171
 ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ПРИСОЕДИНЕНИЯ • Присоединение озона 172
ХИМИЧЕСКИЕ СВОЙСТВА. РЕАКЦИИ ПРИСОЕДИНЕНИЯ • Присоединение озона 172
 ХИМИЧЕСКИЕ СВОЙСТВА. Ø Окисление • Окисление «жесткое» 173
ХИМИЧЕСКИЕ СВОЙСТВА. Ø Окисление • Окисление «жесткое» 173
 ХИМИЧЕСКИЕ СВОЙСТВА. ОКИСЛЕНИЕ • 174
ХИМИЧЕСКИЕ СВОЙСТВА. ОКИСЛЕНИЕ • 174
 ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ Бензол – жидкость с характерным запахом, почти нерастворим в воде, используется как растворитель и сырье для химической промышленности. Толуол – метилбензол, применяется для получения бензойной кислоты, сахарина, как растворитель при производстве пластических масс, лаков, типографских красок, резины, компонент высокооктановых бензинов. 175
ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ Бензол – жидкость с характерным запахом, почти нерастворим в воде, используется как растворитель и сырье для химической промышленности. Толуол – метилбензол, применяется для получения бензойной кислоты, сахарина, как растворитель при производстве пластических масс, лаков, типографских красок, резины, компонент высокооктановых бензинов. 175
 ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ Орто-ксилол – 1, 2 диметилбензол. Применяют как растворитель в производстве лаков и красок. Мета-ксилол – 1, 3 диметилбензол, применяется для получения бензолдикарбоновых кислот. Кумол – изопропилбензол. Важнейший промежуточный продукт для получения фенола и ацетона. 176
ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ Орто-ксилол – 1, 2 диметилбензол. Применяют как растворитель в производстве лаков и красок. Мета-ксилол – 1, 3 диметилбензол, применяется для получения бензолдикарбоновых кислот. Кумол – изопропилбензол. Важнейший промежуточный продукт для получения фенола и ацетона. 176
 ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ Орто-ксилол – 1, 2 диметилбензол. Применяют как растворитель в производстве лаков и красок. Мета-ксилол – 1, 3 диметилбензол, применяется для получения бензолдикарбоновых кислот. Кумол – изопропилбензол. Важнейший промежуточный продукт для получения фенола и ацетона. 177
ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ Орто-ксилол – 1, 2 диметилбензол. Применяют как растворитель в производстве лаков и красок. Мета-ксилол – 1, 3 диметилбензол, применяется для получения бензолдикарбоновых кислот. Кумол – изопропилбензол. Важнейший промежуточный продукт для получения фенола и ацетона. 177
 178
178
 179
179


