Углерод_Крошкина_Анна.pptx
- Количество слайдов: 17
 Углерод • Кристаллическая решетка: гексагональная sp 2 (графит), кубическая sp 3 (алмаз) • Углерод – хороший восстановитель, но соединяясь с металлами и образуя карбиды, он выступает окислителем
Углерод • Кристаллическая решетка: гексагональная sp 2 (графит), кубическая sp 3 (алмаз) • Углерод – хороший восстановитель, но соединяясь с металлами и образуя карбиды, он выступает окислителем
 Химические свойства • Взаимодействие с Неметаллами: При повышенной температуре углерод взаимодействует с отдельными неметаллами (O 2, H 2, F 2, S, Si, N 2). Относительно легко протекают реакции взаимодействия с O 2 и S • Взаимодействие с фтором: Углерод обладает низкой реакционной способностью, из галогенов реагирует только с фтором: С + 2 F 2 = CF 4 Взаимодействие с кислородом: При нагревании взаимодействует с кислородом: 2 С + О 2 = 2 СО, С + О 2 = СО 2, Взаимодействие с Серой: С + 2 S = CS 2. При температуре электрической дуги углерод соединяется с азотом, образуя ядовитый газ дициан: 2 С + N 2 = С 2 N 2 Реагирует с водородом в присутствии никелевого катализатора, образуя метан: C + 2 H 2 = CH 4. • •
Химические свойства • Взаимодействие с Неметаллами: При повышенной температуре углерод взаимодействует с отдельными неметаллами (O 2, H 2, F 2, S, Si, N 2). Относительно легко протекают реакции взаимодействия с O 2 и S • Взаимодействие с фтором: Углерод обладает низкой реакционной способностью, из галогенов реагирует только с фтором: С + 2 F 2 = CF 4 Взаимодействие с кислородом: При нагревании взаимодействует с кислородом: 2 С + О 2 = 2 СО, С + О 2 = СО 2, Взаимодействие с Серой: С + 2 S = CS 2. При температуре электрической дуги углерод соединяется с азотом, образуя ядовитый газ дициан: 2 С + N 2 = С 2 N 2 Реагирует с водородом в присутствии никелевого катализатора, образуя метан: C + 2 H 2 = CH 4. • •
 • • При 2000 °C в электропечи углерод соединяется с кремнием, образуя карборунд: Si + C = Si. C. Взаимодействие с водой: При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород: C + H 2 O = CO + H 2 Восстановительные свойства: Углерод способен восстанавливать многие металлы из их оксидов: 2 Zn. O + C = 2 Zn + CO 2 Концентрированные серная и азотная кислоты при нагревании окисляют углерод до оксида углерода (IV): C + 2 H 2 SO 4 = CO 2 + 2 SO 2 + 2 H 2 O C + 4 HNO 3 = CO 2 + 4 NO 2 + 2 H 2 O • Взаимодействие с металлами: Способен взаимодействовать с металлами, образуя карбиды: Ca + 2 C = Ca. C 2. 3 Fe+C=Fe 3 C 4 Al+3 C=Al 4 C 3
• • При 2000 °C в электропечи углерод соединяется с кремнием, образуя карборунд: Si + C = Si. C. Взаимодействие с водой: При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород: C + H 2 O = CO + H 2 Восстановительные свойства: Углерод способен восстанавливать многие металлы из их оксидов: 2 Zn. O + C = 2 Zn + CO 2 Концентрированные серная и азотная кислоты при нагревании окисляют углерод до оксида углерода (IV): C + 2 H 2 SO 4 = CO 2 + 2 SO 2 + 2 H 2 O C + 4 HNO 3 = CO 2 + 4 NO 2 + 2 H 2 O • Взаимодействие с металлами: Способен взаимодействовать с металлами, образуя карбиды: Ca + 2 C = Ca. C 2. 3 Fe+C=Fe 3 C 4 Al+3 C=Al 4 C 3
 Аллотропные Модификации Больше всего аллотропных мод. у углерода, их более 8. • • Алмаз Графит Карбин Кокс Техуглерод Фулереит Сажа
Аллотропные Модификации Больше всего аллотропных мод. у углерода, их более 8. • • Алмаз Графит Карбин Кокс Техуглерод Фулереит Сажа
 Алмаз • Твердость: 10 по шкале эталонных минералов твёрдости Мооса. • Высокая теплопроводность • Атомы углерода в алмазе находятся в состоянии sp³-гибридизации. Именно прочная связь атомов углерода объясняет высокую твёрдость алмаза. • Применение: в промышленность(покрытие ножей, сверл), микроэлектроника.
Алмаз • Твердость: 10 по шкале эталонных минералов твёрдости Мооса. • Высокая теплопроводность • Атомы углерода в алмазе находятся в состоянии sp³-гибридизации. Именно прочная связь атомов углерода объясняет высокую твёрдость алмаза. • Применение: в промышленность(покрытие ножей, сверл), микроэлектроника.
 Графит Цвет: серый, черный, стальной Блеск: металловидный Твердость: 1 -2 по шкале эталонных минералов твёрдости Мооса. Хорошо проводит электрический ток. Находится в состоянии sp 2 -гибридизации. Три равноценные σ-связи, расположенные в одной плоскости под углом 120° друг к другу. • В тонко измельченном состоянии способен поглощать газы и растворенные вещества из растворов. • Активированные угли пропитанные металлами широко используются как катализаторы • Применение: изготовление плавильных печей, электродов, смазки, получение синт. алмазов, стержни карандашей. • • •
Графит Цвет: серый, черный, стальной Блеск: металловидный Твердость: 1 -2 по шкале эталонных минералов твёрдости Мооса. Хорошо проводит электрический ток. Находится в состоянии sp 2 -гибридизации. Три равноценные σ-связи, расположенные в одной плоскости под углом 120° друг к другу. • В тонко измельченном состоянии способен поглощать газы и растворенные вещества из растворов. • Активированные угли пропитанные металлами широко используются как катализаторы • Применение: изготовление плавильных печей, электродов, смазки, получение синт. алмазов, стержни карандашей. • • •
 Карбин При прямом воздействии С с Ме или оксидами Ме при высоких температурах образуются соединения, имеющие общее название «карбины» . Карбины электроположительных Ме ведут себя как в-ва содержащие иона С-4 и реагируют с Н 2 О, образуя углеводороды. Например: Al 4 C 3+12 H 2 O=4 Al(OH)3+3 CH 4 Ca 2+C 22 -+2 H 2 O=Ca(OH)2+HC≡СH Ме с малыми атомными радиусами (Cr, Mn, Fe, Co, Ni) образуют карбины, которые гидролизуются водой или разбавленными кислотами Fe 4 C 3 + 6 H 2 O = 2 Fe 2 O 3 + 3 CH 4 Кремний и бор образуют карбиды CSI и B 4 C, которые обладают чрезвычайной твердостью и химически инертны. Карбин кремния имеет алмазоподобную структуру – карборунд. Находится в состоянии sp-гибридизации. Линейной.
Карбин При прямом воздействии С с Ме или оксидами Ме при высоких температурах образуются соединения, имеющие общее название «карбины» . Карбины электроположительных Ме ведут себя как в-ва содержащие иона С-4 и реагируют с Н 2 О, образуя углеводороды. Например: Al 4 C 3+12 H 2 O=4 Al(OH)3+3 CH 4 Ca 2+C 22 -+2 H 2 O=Ca(OH)2+HC≡СH Ме с малыми атомными радиусами (Cr, Mn, Fe, Co, Ni) образуют карбины, которые гидролизуются водой или разбавленными кислотами Fe 4 C 3 + 6 H 2 O = 2 Fe 2 O 3 + 3 CH 4 Кремний и бор образуют карбиды CSI и B 4 C, которые обладают чрезвычайной твердостью и химически инертны. Карбин кремния имеет алмазоподобную структуру – карборунд. Находится в состоянии sp-гибридизации. Линейной.
 Окись Углерода C≡O • • Бесцветный газ. Образуется при сжигании С в условиях недостатка О 2. При любых температурах существует равновесие: 2 CO(г)=С(тв)+СO 2(г) Еще одно получение (CO): CO 2+C=2 CO (CO) получают в промышленности вместе с Н 2 при неполном сжигании углеводородов: CO 2+H 2=CO+H 2 O (СО) используется в качестве восстановителя в процессах получения фосфора из фосфатных пород. Оксид углерода реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором: CO+Cl 2=COCl 2 Оксид углерода(II) реагирует с халькогенами. С серой образует сероксид углерода COS CO+S=COS Реакцией с аммиаком при высоких температурах можно получить — циановодород HCN. Реакция идёт в присутствии катализатора (Th. O 2) СO+NH 3=H 2 O+HCN
Окись Углерода C≡O • • Бесцветный газ. Образуется при сжигании С в условиях недостатка О 2. При любых температурах существует равновесие: 2 CO(г)=С(тв)+СO 2(г) Еще одно получение (CO): CO 2+C=2 CO (CO) получают в промышленности вместе с Н 2 при неполном сжигании углеводородов: CO 2+H 2=CO+H 2 O (СО) используется в качестве восстановителя в процессах получения фосфора из фосфатных пород. Оксид углерода реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором: CO+Cl 2=COCl 2 Оксид углерода(II) реагирует с халькогенами. С серой образует сероксид углерода COS CO+S=COS Реакцией с аммиаком при высоких температурах можно получить — циановодород HCN. Реакция идёт в присутствии катализатора (Th. O 2) СO+NH 3=H 2 O+HCN
 Диоксид Углерода • бесцветный газ, без запаха, со слегка кисловатым вкусом. • Твёрдый (СO 2) называют сухим льдом • Выделяется при любом обжиге углерода и его соединений • В лабораториях (СO 2) получают при термическом разложении к-ты H 2 CO 3=+t H 2 O+CO 2 • Оксид углерода(IV) не поддерживает горения. В нём горят только некоторые активные металлы: Mg+CO 2=2 Mg. O+C • Взаимодействие с оксидом активного металла: Ca. O+CO 2=Ca. CO 3 • Применение: используется в системах пожаротушения
Диоксид Углерода • бесцветный газ, без запаха, со слегка кисловатым вкусом. • Твёрдый (СO 2) называют сухим льдом • Выделяется при любом обжиге углерода и его соединений • В лабораториях (СO 2) получают при термическом разложении к-ты H 2 CO 3=+t H 2 O+CO 2 • Оксид углерода(IV) не поддерживает горения. В нём горят только некоторые активные металлы: Mg+CO 2=2 Mg. O+C • Взаимодействие с оксидом активного металла: Ca. O+CO 2=Ca. CO 3 • Применение: используется в системах пожаротушения
 • Но есть у этих оксидов третий собрат –оксид С 3 О 2 – недоокись углерода. Также встречается оксид следующего состава: С 6 О 6, носящий название трихинона. • Включить еще С 5 О 2, С 12 О 9, С 2 О 3.
• Но есть у этих оксидов третий собрат –оксид С 3 О 2 – недоокись углерода. Также встречается оксид следующего состава: С 6 О 6, носящий название трихинона. • Включить еще С 5 О 2, С 12 О 9, С 2 О 3.
 С−N Цианиды Получают в промышленности каталитическим окислением синильной кислоты: o с кислородом в присутствии серебряного катализатора: 4 HCN+O 2=2(CN)2+2 H 2 O o с хлором на активированном угле: 2 HCN+CL 2=(CN)2+2 HCL o с диоксидом азота: 2 HCN+NO 2=(CN)2+NO+H 2 O NO+1/2 O 2=NO 2 • • Подобно галогенам (хлор, бром) он взаимодействует с водными растворами щелочей: (CN)2+2 KOH=KCN+KCNO+H 2 O • Цианид натрия получают сплавлением цианамида кальция с углеродом и карбонатом натрия: Ca. CN 2+C+Na 2 CO 3=Ca. CO 3+2 Na. CN • Цианиды электроположительных металлов растворимы в воде. • Цианиды Ag(1), Hg(1), Pb(2) – нерастворимы
С−N Цианиды Получают в промышленности каталитическим окислением синильной кислоты: o с кислородом в присутствии серебряного катализатора: 4 HCN+O 2=2(CN)2+2 H 2 O o с хлором на активированном угле: 2 HCN+CL 2=(CN)2+2 HCL o с диоксидом азота: 2 HCN+NO 2=(CN)2+NO+H 2 O NO+1/2 O 2=NO 2 • • Подобно галогенам (хлор, бром) он взаимодействует с водными растворами щелочей: (CN)2+2 KOH=KCN+KCNO+H 2 O • Цианид натрия получают сплавлением цианамида кальция с углеродом и карбонатом натрия: Ca. CN 2+C+Na 2 CO 3=Ca. CO 3+2 Na. CN • Цианиды электроположительных металлов растворимы в воде. • Цианиды Ag(1), Hg(1), Pb(2) – нерастворимы
![КОМПЛЕКСНЫЕ ЦИАНИДЫ Комплекс Центральный ион металла М [M(CN)2]- Cu(I), Ag(I) [М(СN)3]n- Cu(I), Ag(I), Mn(I), КОМПЛЕКСНЫЕ ЦИАНИДЫ Комплекс Центральный ион металла М [M(CN)2]- Cu(I), Ag(I) [М(СN)3]n- Cu(I), Ag(I), Mn(I),](https://present5.com/presentation/263505795_376338318/image-12.jpg) КОМПЛЕКСНЫЕ ЦИАНИДЫ Комплекс Центральный ион металла М [M(CN)2]- Cu(I), Ag(I) [М(СN)3]n- Cu(I), Ag(I), Mn(I), Ni(I), n=2; Zn(II), Hg(II), Cd(II), n=l [M(CN)4]n- Си(I), Ag(I), n=3; Zn(II), Cd(II), Mg(II), Cu(II), Ni(II), Pd(II), Pt(II), n=2; Fе(III), Au(III), n=1 [М(СN)5]n- Mo(IV), n=l [M(CN)6]n- Mn(I), n=5; Cd(II), V(II), Cr(II), Мn(II), Fe(II), Со(II), Ru(II), Os(II), n=4; V(III), Cr(III), Мn(III), Fe(III), Rh(III), Ir(III), Co(III), n=3; V(IV), Pt(IV), n=2 [M(CN)8]n- Mo(IV), W(IV), n=4; Mo(V), W(V), n=3
КОМПЛЕКСНЫЕ ЦИАНИДЫ Комплекс Центральный ион металла М [M(CN)2]- Cu(I), Ag(I) [М(СN)3]n- Cu(I), Ag(I), Mn(I), Ni(I), n=2; Zn(II), Hg(II), Cd(II), n=l [M(CN)4]n- Си(I), Ag(I), n=3; Zn(II), Cd(II), Mg(II), Cu(II), Ni(II), Pd(II), Pt(II), n=2; Fе(III), Au(III), n=1 [М(СN)5]n- Mo(IV), n=l [M(CN)6]n- Mn(I), n=5; Cd(II), V(II), Cr(II), Мn(II), Fe(II), Со(II), Ru(II), Os(II), n=4; V(III), Cr(III), Мn(III), Fe(III), Rh(III), Ir(III), Co(III), n=3; V(IV), Pt(IV), n=2 [M(CN)8]n- Mo(IV), W(IV), n=4; Mo(V), W(V), n=3
 Синильная к-та. • Ядовитый бесцветный газ, который выделяется при действии кислоты на цианиды. • В водном растворе HCN является очень слабой к-той. Но в чистой жидкости HCN – сильная к-та. В промышленности HCN производят из метана и аммиака: 2 CH 4+3 O 2+2 NH 3=kat 2 HCN+6 H 2 O. CH 4+NH 3=kat. HCN+3 H 2 • Безводный цианистый водород является сильно ионизирующим растворителем, растворенные в нём электролиты хорошо диссоциируют на ионы. • Очень слабая одноосновная кислота. Образует с металлами соли — цианиды. Взаимодействует с оксидами и гидроксидами щелочных и щёлочноземельных металлов. HCN+KOH=H 2 O+KCN • С хлором, бромом и йодом прямо образует циангалогениды: X 2+HCN=XCN+HX
Синильная к-та. • Ядовитый бесцветный газ, который выделяется при действии кислоты на цианиды. • В водном растворе HCN является очень слабой к-той. Но в чистой жидкости HCN – сильная к-та. В промышленности HCN производят из метана и аммиака: 2 CH 4+3 O 2+2 NH 3=kat 2 HCN+6 H 2 O. CH 4+NH 3=kat. HCN+3 H 2 • Безводный цианистый водород является сильно ионизирующим растворителем, растворенные в нём электролиты хорошо диссоциируют на ионы. • Очень слабая одноосновная кислота. Образует с металлами соли — цианиды. Взаимодействует с оксидами и гидроксидами щелочных и щёлочноземельных металлов. HCN+KOH=H 2 O+KCN • С хлором, бромом и йодом прямо образует циангалогениды: X 2+HCN=XCN+HX
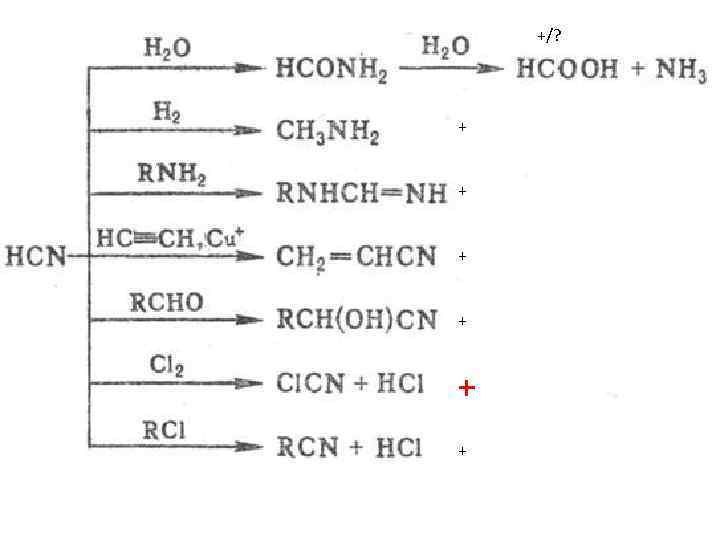 +/? + + +
+/? + + +
 Реакция образования берлинской лазури • От прибавления сульфата железа (II) к щелочному раствору цианидов, образуется цианид железа (II), который при взаимодействии с избытком цианидов, а затем с сульфатом или хлоридом железа (III) образует берлинскую лазурь:
Реакция образования берлинской лазури • От прибавления сульфата железа (II) к щелочному раствору цианидов, образуется цианид железа (II), который при взаимодействии с избытком цианидов, а затем с сульфатом или хлоридом железа (III) образует берлинскую лазурь:
 Реакция образования роданида железа. • Эта реакция основана на том, что при нагревании цианидов с раствором полисульфида аммония образуется роданид, от прибавления к которому раствора хлорида железа появляется кроваво-красная окраска:
Реакция образования роданида железа. • Эта реакция основана на том, что при нагревании цианидов с раствором полисульфида аммония образуется роданид, от прибавления к которому раствора хлорида железа появляется кроваво-красная окраска:
 Соединения со связями C-S • Сероуглерод CS 2 – токсичная жидкость светло-желтого цвета. Получается в больших количествах при взаимодействии метана с серой над оксидом алюминия, как катализатором при 1000 о С CH 4+4 S=CS 2+2 H 2 S • Сероуглерод очень легко загорается на воздухе. Очень активное соединение, вступающее во многие реакции, в основном относящиеся к орг. химии. В промышленности используется для получения CCL 4: CS 2+3 CL 2=CCl 4+S 2 CL 2
Соединения со связями C-S • Сероуглерод CS 2 – токсичная жидкость светло-желтого цвета. Получается в больших количествах при взаимодействии метана с серой над оксидом алюминия, как катализатором при 1000 о С CH 4+4 S=CS 2+2 H 2 S • Сероуглерод очень легко загорается на воздухе. Очень активное соединение, вступающее во многие реакции, в основном относящиеся к орг. химии. В промышленности используется для получения CCL 4: CS 2+3 CL 2=CCl 4+S 2 CL 2


