Углерод.pptx
- Количество слайдов: 24
 Углерод Кремний. Элементы Ivгруппы Автор: Юшковец Е. Н.
Углерод Кремний. Элементы Ivгруппы Автор: Юшковец Е. Н.


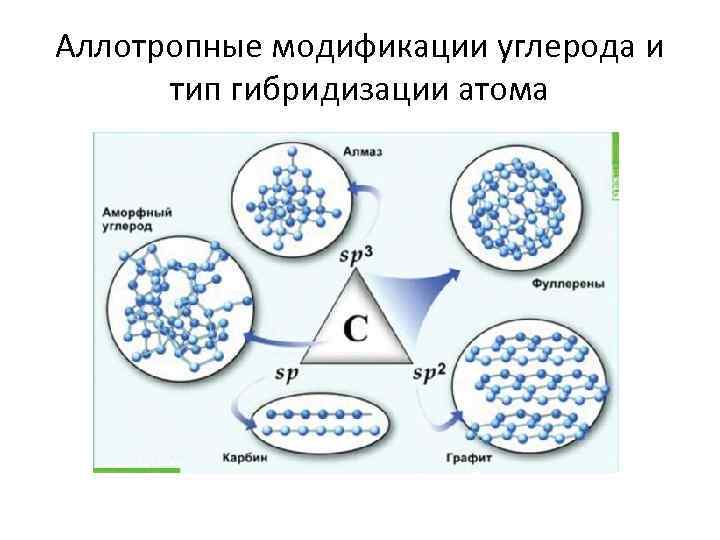 Аллотропные модификации углерода и тип гибридизации атома
Аллотропные модификации углерода и тип гибридизации атома
 (Неактивных и малоактивных) (При определенных условиях могут получиться и другие углеводороды)
(Неактивных и малоактивных) (При определенных условиях могут получиться и другие углеводороды)
 • С оксидами активных металлов диспропорционирует Ca. O + 3 C(кокс) → Ca. C 2 + CO • В отличие от кремния, углерод не реагирует со щелочами, но взаимодействует с некоторыми концентрированными кислотами C(графит) + 2 H 2 SO 4(конц. ) → 2 SO 2↑ + CO 2↑ + 2 H 2 O C + 4 HNO 3(конц. , гор. ) → CO 2↑ + 4 NO 2↑ + 2 H 2 O • При высоких температурах реагирует с другими простыми веществами с серой – образуется жидкость сероуглерод C + 2 S + 15 ккал = CS 2 Его пары легко воспламеняются CS 2 + ЗО 2 = СО 2 + 2 SO 2 с азотом – образуется дициан 2 C + N 2 → C 2 N 2
• С оксидами активных металлов диспропорционирует Ca. O + 3 C(кокс) → Ca. C 2 + CO • В отличие от кремния, углерод не реагирует со щелочами, но взаимодействует с некоторыми концентрированными кислотами C(графит) + 2 H 2 SO 4(конц. ) → 2 SO 2↑ + CO 2↑ + 2 H 2 O C + 4 HNO 3(конц. , гор. ) → CO 2↑ + 4 NO 2↑ + 2 H 2 O • При высоких температурах реагирует с другими простыми веществами с серой – образуется жидкость сероуглерод C + 2 S + 15 ккал = CS 2 Его пары легко воспламеняются CS 2 + ЗО 2 = СО 2 + 2 SO 2 с азотом – образуется дициан 2 C + N 2 → C 2 N 2


 Разлагается водой СОСl 2 + 2 Н 2 О = Н 2 СО 3 + 2 НСl 3) Реагирует с металлами (Fe, Ni, Cr), в результате образуются летучие карбонилы Fe(CO)5 , Ni(CO)4 , Cr(CO)3 4) Является ангидридом муравьиной кислоты: CO+ Na. OH= HCOONa
Разлагается водой СОСl 2 + 2 Н 2 О = Н 2 СО 3 + 2 НСl 3) Реагирует с металлами (Fe, Ni, Cr), в результате образуются летучие карбонилы Fe(CO)5 , Ni(CO)4 , Cr(CO)3 4) Является ангидридом муравьиной кислоты: CO+ Na. OH= HCOONa
 Угольная кислота и ее соли • • • При растворении углекислого газа в воде образуется очень слабая угольная кислота Н 2 СО 3. Углекислый газ в воде находится преимущественно в виде гидратированных молекул СО 2 и лишь в незначительной степени в форме угольной кислоты. При этом в растворе устанавливается равновесие: СО 2 (г) + Н 2 О СО 2 · Н 2 О (раствор) Н 2 СО 3 Так кислота двухосновная, то может давать 2 типа солей: Карбонаты двухвалентных металлов трудно растворимы в воде, но их растворимость повышается в присутствии углекислого газа за счет образования гидрокарбонатов: Са. СО 3 + СО 2 + Н 2 О = Са(НСО 3)2. При нагревании гидрокарбонаты разлагаются до карбонатов: 2 Na. HCO 3 = Na 2 CO 3 + H 2 O + CO 2. Карбонаты металлов (кроме щелочных металлов) при нагревании декарбоксилируются с образованием оксида: Cu. CO 3 = Cu. O + CO 2. Качественной реакцией на карбонат и гидрокарбонат ионы является их взаимодействие с сильной кислотой, наблюдается образование углекислого газа с характерным вскипанием: Na 2 CO 3 + 2 HCl = 2 Na. Cl + H 2 O + CO 2↑
Угольная кислота и ее соли • • • При растворении углекислого газа в воде образуется очень слабая угольная кислота Н 2 СО 3. Углекислый газ в воде находится преимущественно в виде гидратированных молекул СО 2 и лишь в незначительной степени в форме угольной кислоты. При этом в растворе устанавливается равновесие: СО 2 (г) + Н 2 О СО 2 · Н 2 О (раствор) Н 2 СО 3 Так кислота двухосновная, то может давать 2 типа солей: Карбонаты двухвалентных металлов трудно растворимы в воде, но их растворимость повышается в присутствии углекислого газа за счет образования гидрокарбонатов: Са. СО 3 + СО 2 + Н 2 О = Са(НСО 3)2. При нагревании гидрокарбонаты разлагаются до карбонатов: 2 Na. HCO 3 = Na 2 CO 3 + H 2 O + CO 2. Карбонаты металлов (кроме щелочных металлов) при нагревании декарбоксилируются с образованием оксида: Cu. CO 3 = Cu. O + CO 2. Качественной реакцией на карбонат и гидрокарбонат ионы является их взаимодействие с сильной кислотой, наблюдается образование углекислого газа с характерным вскипанием: Na 2 CO 3 + 2 HCl = 2 Na. Cl + H 2 O + CO 2↑
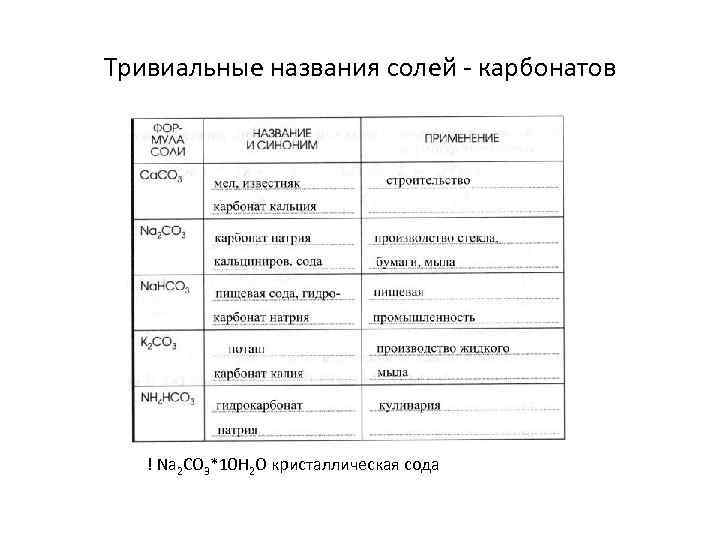 Тривиальные названия солей - карбонатов ! Na 2 CO 3*10 H 2 O кристаллическая сода
Тривиальные названия солей - карбонатов ! Na 2 CO 3*10 H 2 O кристаллическая сода

 Получение • В лаборатории Восстановлением из оксида магнием или алюминием: Si. O 2 + 2 Mg = Si + 2 Mg. O; 3 Si. O 2 + 4 Al = 3 Si + 2 Al 2 O 3. • В промышленности Восстановлением из оксида коксом в электрических печах: Si. O 2 + 2 C = Si + 2 CO. При таком процессе кремний довольно сильно загрязнен карбидами кремния. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С: Si. Cl 4 + 2 H 2 = Si + 4 HCl, или цинком: Si. Cl 4 + 2 Zn = Si + 2 Zn. Cl 2. Также чистый кремний получается при термическом разложении силана: Si. H 4 = Si + 2 H 2.
Получение • В лаборатории Восстановлением из оксида магнием или алюминием: Si. O 2 + 2 Mg = Si + 2 Mg. O; 3 Si. O 2 + 4 Al = 3 Si + 2 Al 2 O 3. • В промышленности Восстановлением из оксида коксом в электрических печах: Si. O 2 + 2 C = Si + 2 CO. При таком процессе кремний довольно сильно загрязнен карбидами кремния. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С: Si. Cl 4 + 2 H 2 = Si + 4 HCl, или цинком: Si. Cl 4 + 2 Zn = Si + 2 Zn. Cl 2. Также чистый кремний получается при термическом разложении силана: Si. H 4 = Si + 2 H 2.

 7) Si + 4 HF = Si. F 4 + 2 H 2 Кремний в отличие от углерода НЕ РЕАГИРУЕТ с концентрированными кислотами, но взаимодействует со смесью плавиковой и азотной кислот: 3 Si + 4 HNO 3 + 18 HF = 3 H 2[Si. F 6] + 4 NO + 8 H 2 O
7) Si + 4 HF = Si. F 4 + 2 H 2 Кремний в отличие от углерода НЕ РЕАГИРУЕТ с концентрированными кислотами, но взаимодействует со смесью плавиковой и азотной кислот: 3 Si + 4 HNO 3 + 18 HF = 3 H 2[Si. F 6] + 4 NO + 8 H 2 O

 CO 2 + H 2 O + Na 2 Si. O 3 = Na 2 CO 3 + H 2 Si. O 3 Г) В водном растворе реакция протекает подругому: CO 2 + H 2 O + Na 2 Si. O 3 = Na 2 CO 3 + H 2 Si. O 3
CO 2 + H 2 O + Na 2 Si. O 3 = Na 2 CO 3 + H 2 Si. O 3 Г) В водном растворе реакция протекает подругому: CO 2 + H 2 O + Na 2 Si. O 3 = Na 2 CO 3 + H 2 Si. O 3
 Сравнение свойств оксидов кремния и углерода (Травление стекла)
Сравнение свойств оксидов кремния и углерода (Травление стекла)


 Силан • • Характерное свойство силанов - их чрезвычайно легкое окисление. Моносилан в присутствии О 2 окисляется со вспышкой. В зависимости от условий реакции продуктом окисления является либо Si. O 2, либо промежуточные вещества. Силаны - хорошие восстановители, они переводят КМn. О 4 в Mn. O 2, Hg(II) в Hg(I), Fe(III) в Fe(II) и т. д. Другое характерное свойство силанов - легкость гидролиза, особенно в щелочной среде Si. H 4 + 2 Н 2 О = Si. O 2 + 4 Н 2 Si. H 4 + 2 Na. OH + Н 2 О = Na 2 Si. O 3 + 4 Н 2
Силан • • Характерное свойство силанов - их чрезвычайно легкое окисление. Моносилан в присутствии О 2 окисляется со вспышкой. В зависимости от условий реакции продуктом окисления является либо Si. O 2, либо промежуточные вещества. Силаны - хорошие восстановители, они переводят КМn. О 4 в Mn. O 2, Hg(II) в Hg(I), Fe(III) в Fe(II) и т. д. Другое характерное свойство силанов - легкость гидролиза, особенно в щелочной среде Si. H 4 + 2 Н 2 О = Si. O 2 + 4 Н 2 Si. H 4 + 2 Na. OH + Н 2 О = Na 2 Si. O 3 + 4 Н 2
 Задания 37 1. Смесь бария и кремния сплавляли без доступа воздуха в течение длительного времени. Полученное кристаллическое вещество растворили в воде. Выделившийся газ самовоспламеняется на воздухе, а продукты его сгорания реагируют с полученным раствором. В результате образуется осадок белого цвета. 2. Через известковую воду был пропущен углекислый газ, в результате чего образовался осадок, который растворился и при дальнейшем пропускании этого газа. Полученный прозрачный раствор нагрели, при этом наблюдали помутнение раствора. Через некоторое время отстоявшийся осадок отфильтровали, высушили и прокалили. 3. Порошкообразный кремний добавили в концентрированный раствор гидроксида цезия. Через полученный прозрачный раствор пропустили углекислый газ, при этом наблюдали помутнение раствора и образование студенистого осадка. Осадок отделили и прокалили, а полученное твердое вещество сплавили с карбонатом натрия. 4. Поташ добавили в раствор хлорида меди, при этом наблюдали выпадение осадка. Осадок отфильтровали и прокалили. Полученное вещество черного цвета нагрели и прокалили с коксом, и цвет вещества стал красным. Полученный газ прореагировал с хлором. 5. Пищевую соду нагрели. Полученный газ прореагировал с магнием, в результате образовалось кристаллическое вещество и аморфное простое вещество. Это простое вещество может реагировать как с оксидом меди, так и с оксидом кальция.
Задания 37 1. Смесь бария и кремния сплавляли без доступа воздуха в течение длительного времени. Полученное кристаллическое вещество растворили в воде. Выделившийся газ самовоспламеняется на воздухе, а продукты его сгорания реагируют с полученным раствором. В результате образуется осадок белого цвета. 2. Через известковую воду был пропущен углекислый газ, в результате чего образовался осадок, который растворился и при дальнейшем пропускании этого газа. Полученный прозрачный раствор нагрели, при этом наблюдали помутнение раствора. Через некоторое время отстоявшийся осадок отфильтровали, высушили и прокалили. 3. Порошкообразный кремний добавили в концентрированный раствор гидроксида цезия. Через полученный прозрачный раствор пропустили углекислый газ, при этом наблюдали помутнение раствора и образование студенистого осадка. Осадок отделили и прокалили, а полученное твердое вещество сплавили с карбонатом натрия. 4. Поташ добавили в раствор хлорида меди, при этом наблюдали выпадение осадка. Осадок отфильтровали и прокалили. Полученное вещество черного цвета нагрели и прокалили с коксом, и цвет вещества стал красным. Полученный газ прореагировал с хлором. 5. Пищевую соду нагрели. Полученный газ прореагировал с магнием, в результате образовалось кристаллическое вещество и аморфное простое вещество. Это простое вещество может реагировать как с оксидом меди, так и с оксидом кальция.
 Задания 39 1. Смесь гидрокарбоната и карбоната кальция массой 31, 2 г подвергли полному разложению при нагревании, получив углекислый газ объемом 7, 84 л (н. у. ). Определите состав исходной смеси в массовых долях. (Ответ: 51, 9% и 48, 1% соответственно). 2. Карбонат натрия массой 21, 2 сплавили с оксидом кремния массой 6 г. Весь плав растворили в 150 г 36, 5% соляной кислоты. Определите массовую долю поваренной соли в полученном растворе. (Ответ 14, 57%). 3. Навеску песка массой 50 г нагрели с магнием, затем продукты растворили в избытке соляной кислоты. Нерастворившийся осадок отфильтровали, просушили и славили с эквимолярным количеством кальция. Полученное кристаллическое вещество растворили в воде, а выделившийся при этом газ собрали и пропустили через избыток гидроксида калия. В результате получили 92, 4 г соли силиката калия. Определите массовую долю оксида кремния в песке, если массовая доля выхода в первой реакции составила 75%, а остальные реакции протекают количественно. ( Ответ 96%). 4. Порошок кремния массой 5, 6 г полностью растворили в 200 г 14% раствора гидроксида калия. Затем через полученный прозрачный раствор пропустили 11 г углекислого газа, при этом наблюдали помутнение раствора и образование осадка. Определите массовую долю соли в полученном растворе. (Ответ 17, 23%). 5. Смесь угля и кремния массой 9, 2 г растворили в растворе плавиковой кислоты, при этом выделилось 8, 96 л (н. у. ) газа, а часть смеси не растворилась. Определите объем 95% (ƥ=1, 495 г/мл) раствора серной кислоты, способный прореагировать с исходной смесью. (Ответ: 41, 4 мл).
Задания 39 1. Смесь гидрокарбоната и карбоната кальция массой 31, 2 г подвергли полному разложению при нагревании, получив углекислый газ объемом 7, 84 л (н. у. ). Определите состав исходной смеси в массовых долях. (Ответ: 51, 9% и 48, 1% соответственно). 2. Карбонат натрия массой 21, 2 сплавили с оксидом кремния массой 6 г. Весь плав растворили в 150 г 36, 5% соляной кислоты. Определите массовую долю поваренной соли в полученном растворе. (Ответ 14, 57%). 3. Навеску песка массой 50 г нагрели с магнием, затем продукты растворили в избытке соляной кислоты. Нерастворившийся осадок отфильтровали, просушили и славили с эквимолярным количеством кальция. Полученное кристаллическое вещество растворили в воде, а выделившийся при этом газ собрали и пропустили через избыток гидроксида калия. В результате получили 92, 4 г соли силиката калия. Определите массовую долю оксида кремния в песке, если массовая доля выхода в первой реакции составила 75%, а остальные реакции протекают количественно. ( Ответ 96%). 4. Порошок кремния массой 5, 6 г полностью растворили в 200 г 14% раствора гидроксида калия. Затем через полученный прозрачный раствор пропустили 11 г углекислого газа, при этом наблюдали помутнение раствора и образование осадка. Определите массовую долю соли в полученном растворе. (Ответ 17, 23%). 5. Смесь угля и кремния массой 9, 2 г растворили в растворе плавиковой кислоты, при этом выделилось 8, 96 л (н. у. ) газа, а часть смеси не растворилась. Определите объем 95% (ƥ=1, 495 г/мл) раствора серной кислоты, способный прореагировать с исходной смесью. (Ответ: 41, 4 мл).


