Презентация1.ppt
- Количество слайдов: 45

Учебная дисциплина: Основы биохимии Лекция 1

Биохимия – наука о химическом составе живых клеток и организмов и о химических процессах, лежащих в основе их жизнедеятельности.

Задачи биохимии 1. Исследование структуры веществ, входящих в состав живых систем 2. Изучение преобразований энергии в живых системах 3. Изучение регуляции процессов в клетках

История возникновения и развития биохимии v Первый период: с древних времен и до эпохи Возрождения (XV в. ). v Второй период: продлился до середины XIX в. . немецкий врач и естествоиспытатель Парацельс

История возникновения и развития биохимии v Первый период: с древних времен и до эпохи Возрождения (XV в. ). v Второй период: продлился до середины XIX в. . немецкий врач и естествоиспытатель Парацельс

М. В. Ломоносов, «Медик без довольных познаний химии совершенен, быть не может» . Антуа н Лора н Лавуазье Р. Реомюра и Л. Спалланцани

История возникновения и развития биохимии v Третий период: с середины XIX до 40 – 50–х годов XX в. v Четвертый период: продолжается по настоящее время.

1901 -1902 гг. - полипептидная теория строения белков, Э. Фишер В. А. Энгельга рдт , 30 -е годы 20 века, разработка теории окислительного фосфорилирования 1953 - Ф. Крик и Д. Уотсон предложили модель двойной спирали строения ДНК.

История возникновения и развития биохимии v Третий период: с середины XIX до 40 – 50–х годов XX в. v Четвертый период: продолжается по настоящее время.

1953 - Ф. Сэнгер впервые расшифровал аминокислотную последовательность белка инсулина, состоящего из 51 аминокислотного остатка. 1955 1960 - А. Н. Белозерский и его сотрудники, исследовав нуклеотидный состав ДНК огромного числа представителей животных, растений и бактерий, охарактеризовали таксономическое и эволюционное значение количественного соотношения отдельных азотистых оснований в ДНК. 1959, 1960 - А. С. Спирин и П. Доти установили вторичную и третичную структуру рибосомальной РНК. 1965 1967 - Р. Холли и независимо от него А. А. Баев определили нуклеотидную последовательность транспортных РНК. 1966 - П. Митчелл сформулировал хемиосмотическую теорию сопряжения окисления и фосфорилирования. 1969 - Р. Мерифильд химическим путем синтезировал фермент рибонуклеазу. 1970 - Г. Корана синтезировал ген (транспортной РНК), а в 1976 г. присоединил его к ДНК мутантного штамма бактериофага К, дефектного по данному гену, после чего этот бактериофаг стал нормально размножаться. 1971 - в совместной работе двух лабораторий, руководимых Ю. А. Овчинниковым и А. Е. Браунштейном, установлена первичная структура аспартатаминотрансферазы -- белка из 412 аминокислот. 1977 - Ф. Сэнгер и сотрудники впервые полностью расшифровали первичную структуру молекулы ДНК.
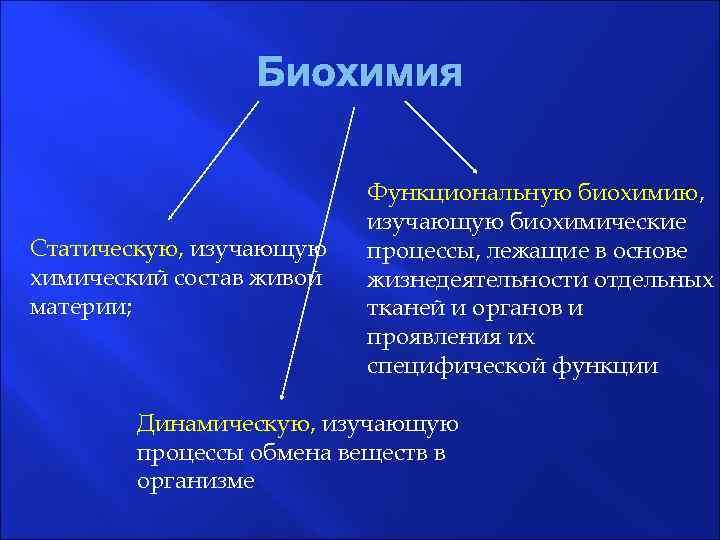
Биохимия Статическую, изучающую химический состав живой материи; Функциональную биохимию, изучающую биохимические процессы, лежащие в основе жизнедеятельности отдельных тканей и органов и проявления их специфической функции Динамическую, изучающую процессы обмена веществ в организме

Основные признаки живой материи 1. 2. 3. 4. 5. Высокая многоуровневая организация Эффективное преобразование и использование энергии Обмен с окружающей средой веществом и энергией Способность к саморегуляции Способность в самопроизводству
Клетка – структурная и функциональная единица живых организмов

Клетка


Химический состав клетки

Белки (протеины) –это природные полипептиды с высокими значениями молекулярной массы (от 10 000 до десятков миллионов). Они входят в состав всех живых организмов и выполняют разнообраз ные биологические функции.

Классификация белков • • • по форме молекул (глобулярные или фибриллярные); по молекулярной массе (низкомолекулярные, высокомолекулярные и др. ); по химическому строению (наличие или отсутствие небелковой части); по выполняемым функциям (транспортные, защитные, структурные белки и др. ); по локализации в клетке (ядерные, цитоплазматические, лизосомальные и др. ); по локализации в организме (белки крови, печени, сердца и др. ); по возможности адаптивно регулировать количество данных белков: белки, синтезирующиеся с постоянной скоростью (конститутивные), и белки, синтез которых может усиливаться при воздействии факторов среды (индуцибельные); по продолжительности жизни в клетке (от очень быстро обновляющихся белков, с Т 1/2 менее 1 ч, до очень медленно обновляющихся белков, Т 1/2 которых исчисляют неделями и месяцами); по схожим участкам первичной структуры и родственным функциям (семейства белков).

Характерные признаки белков 1. 2. 3. 4. 5. 6. Постоянная доля N=16% от сухой массы Наличие постоянных структурных звеньев аминокислот Аминокислоты соединены пептидной связью Большая молекулярная масса Сложная многоуровневая организация, которая определяет физико-химические и биологические свойства Четко прослеживается связь структурафункции

Функции белков v Каталитическая (ферментативная) v Транспортная
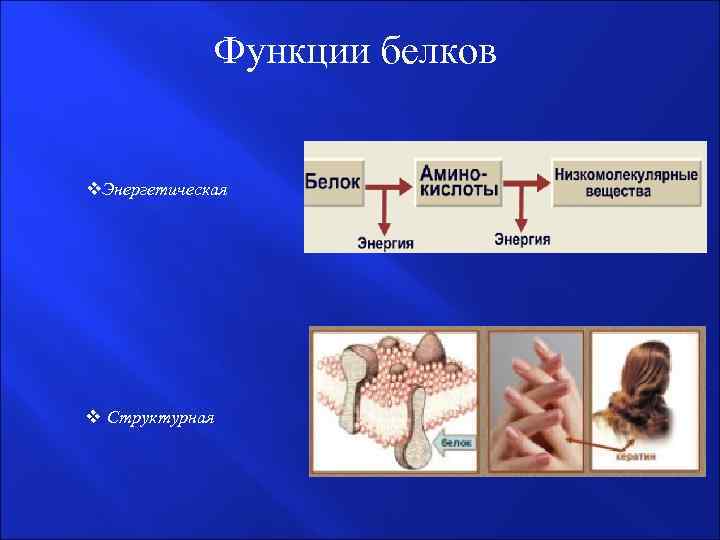
Функции белков v. Энергетическая v Структурная
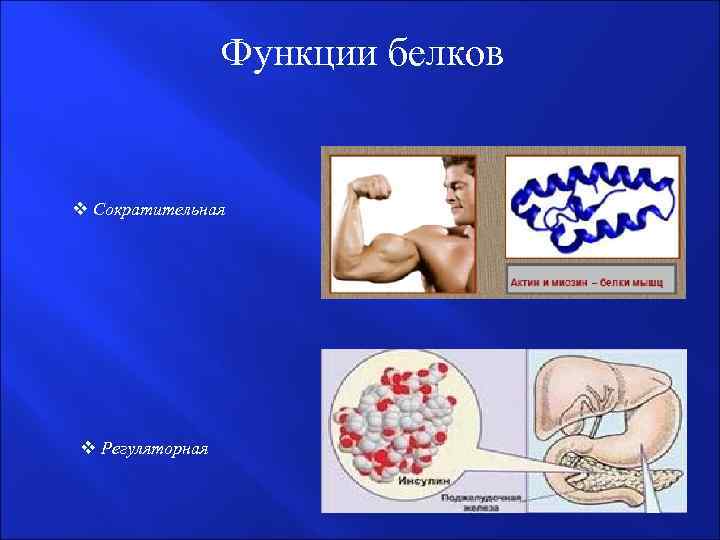
Функции белков v Сократительная v Регуляторная

Функции белков v. Защитная v. Участие белков в процессах наследственности, т. е. хранении и передачи генетической информации. Эта функции выполняется сложными белками – нуклеопротеидами. v. Гемостатическая функция

Аминокислота – это аминопроизводное класса карбоновых кислот.
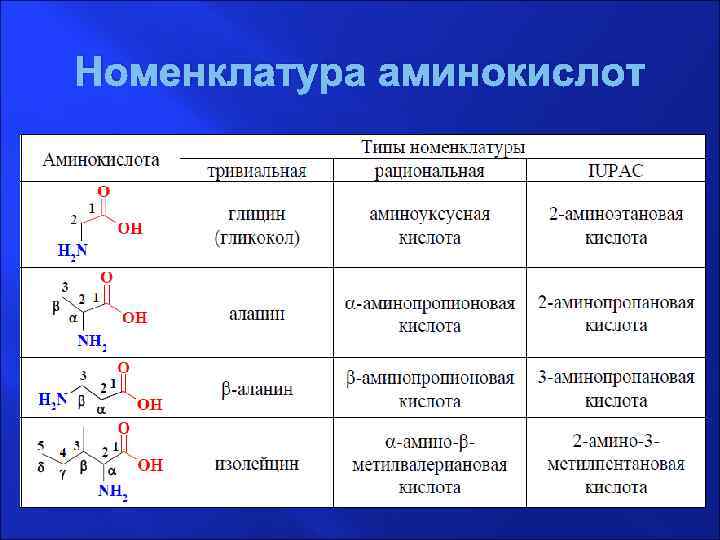
Номенклатура аминокислот

Классификация основных аминокислот белков по их химическому строению

Аминокислоты 1. Незаменимые аминокислоты (не синтезируются организмом) 2. Полузаменимые аминокислоты (синтезируются, но в недостаточном количестве, частично восполняются с пищей) 3. Заменимые аминокислоты (синтезируются в организме)

Классификация основных аминокислот белков по их химическому строению


Химические реакции, используемые для обнаружения аминокислот Способность аминокислот вступать в те или иные химические реакции определяется наличием в их составе функциональных групп. Так как все аминокислоты, входящие в состав белков, содержат у α углеродного атома амино- и карбоксильную группы, они могут вступать в характерные для всех аминокислот химические реакции. Наличие каких-либо функциональных групп в радикалах индивидуальных аминокислот определяет их способность вступать в специфичные для данных аминокислот реакции. Нингидриновая реакция на α аминокислоты

Специфические реакции на отдельные аминокислоты Качественное и количественное определение отдельных аминокислот возможно благодаря наличию в их радикалах особенных функциональных групп. Аргинин определяют с помощью качественной реакции на гуанидиновую группу (реакция Сакагучи), а цистеин выявляют реакцией Фоля, специфичной на SH-группу данной аминокислоты. Наличие ароматических аминокислот в растворе определяют ксантопротеиновой реакцией (реакция нитрования), а наличие гидроксильной группы в ароматическом кольце тирозина - с помощью реакции Миллона.
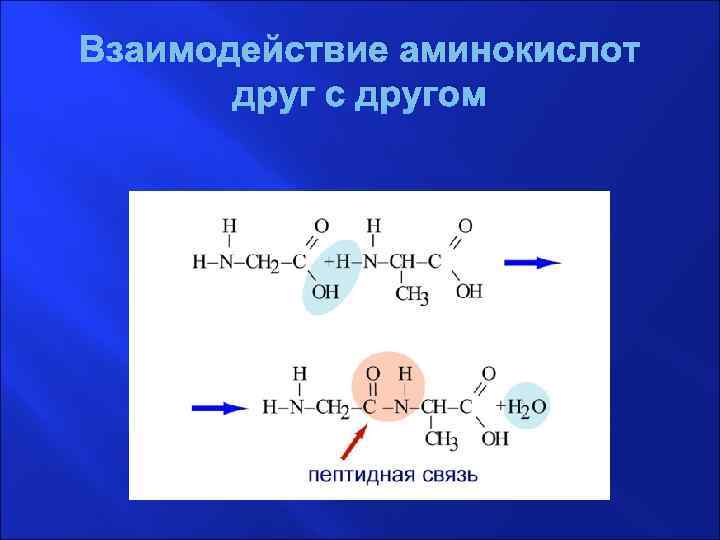
Взаимодействие аминокислот друг с другом
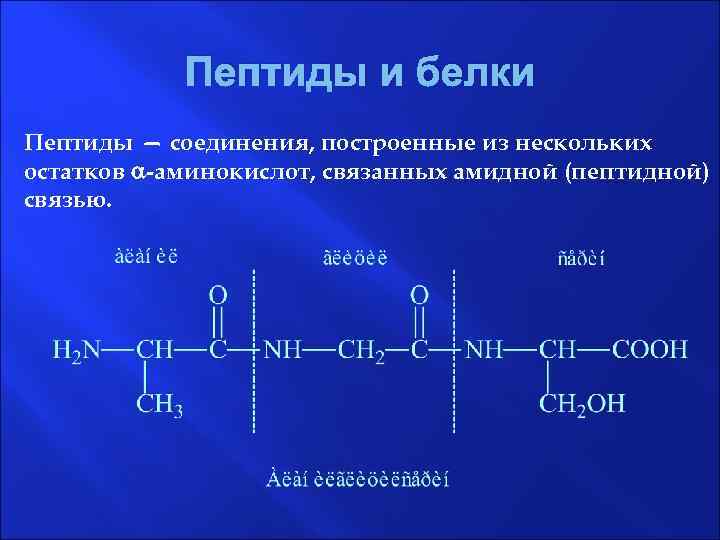
Пептиды и белки Пептиды — соединения, построенные из нескольких остатков -аминокислот, связанных амидной (пептидной) связью.
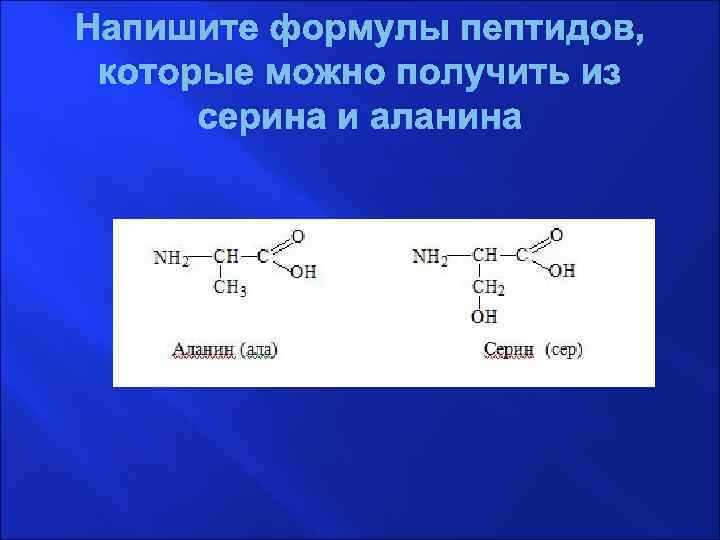
Напишите формулы пептидов, которые можно получить из серина и аланина


Первичная структура белка инсулина

Вторичная структура белка — это более высокий уровень структурной организации, в котором закрепление конформации происходит за счет водородных связей между пептидными группами.

Ограничения на спирализацию 1. 2. 3. 4. Наличие пролина и оксипролина Близкое расположение громоздких радикалов Жесткая плоскостная организация пептидных фрагментов Электростатическое отталкивание одноименно заряженных боковых радикалов
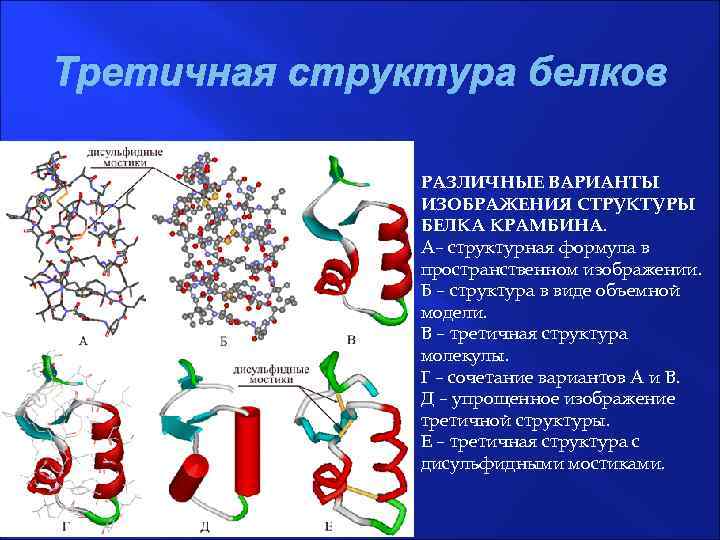
Третичная структура белков РАЗЛИЧНЫЕ ВАРИАНТЫ ИЗОБРАЖЕНИЯ СТРУКТУРЫ БЕЛКА КРАМБИНА. А– структурная формула в пространственном изображении. Б – структура в виде объемной модели. В – третичная структура молекулы. Г – сочетание вариантов А и В. Д – упрощенное изображение третичной структуры. Е – третичная структура с дисульфидными мостиками.

Пептиды и белки Глобулярные белки ГЛОБУЛЯРНАЯ СТРУКТУРА АЛЬБУМИНА 40

Пептиды и белки Фибриллярные белки ФИБРИЛЛЯРНЫЙ БЕЛОК ФИБРОИН 41
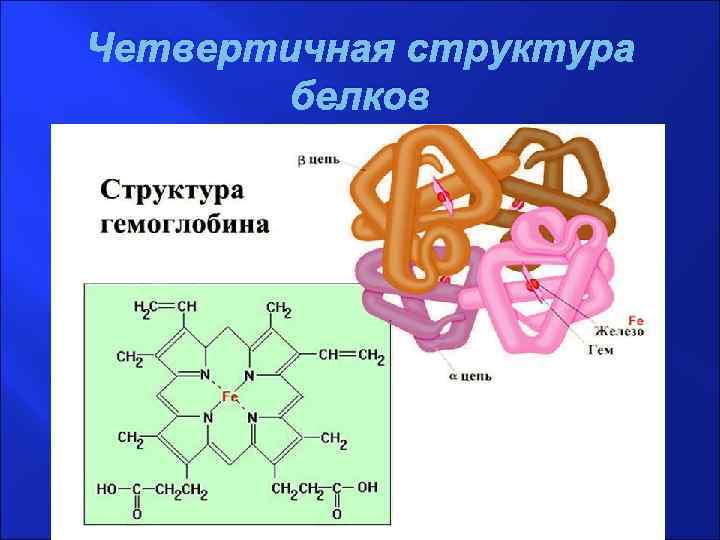
Четвертичная структура белков
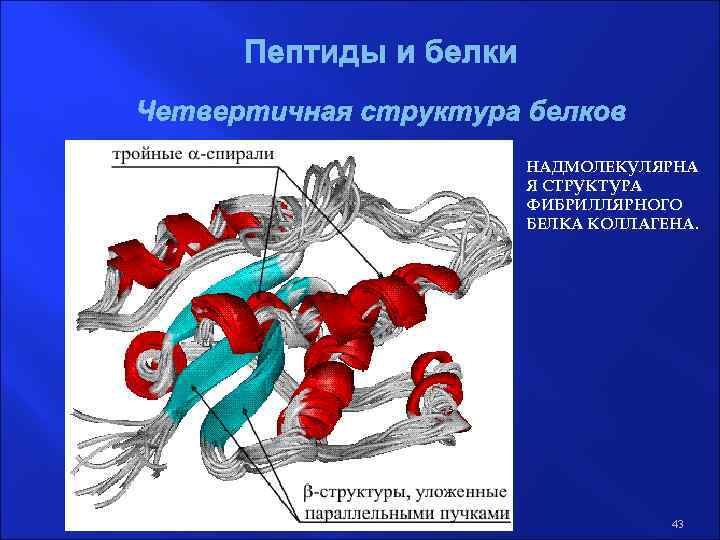
Пептиды и белки Четвертичная структура белков НАДМОЛЕКУЛЯРНА Я СТРУКТУРА ФИБРИЛЛЯРНОГО БЕЛКА КОЛЛАГЕНА. 43

Простые белки 1. 2. 3. 4. Протамины и гистоны Проламины и глютелины Альбумины и глобулины Протеноиды

Сложные белки 1. 2. 3. 4. 5. 6. 7. Металлопротеиды (трансферрин, ферритин, церулоплазмин) Липопротеиды (ЛПНП, ЛПВП, ЛПОНП, хиломикроны) Нуклеопротеиды Фосфопротеиды Гликопротеиды Хромопротеиды Гемопротеиды
Презентация1.ppt