Семинар_2_2015_Простые_белки.ppt
- Количество слайдов: 38
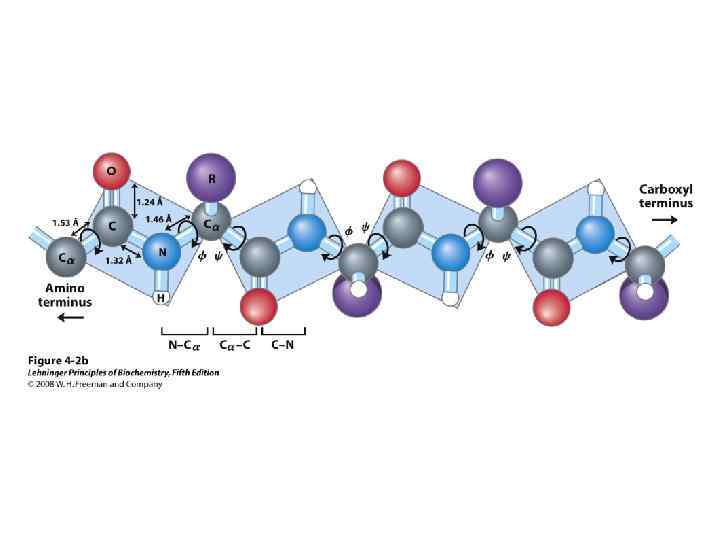
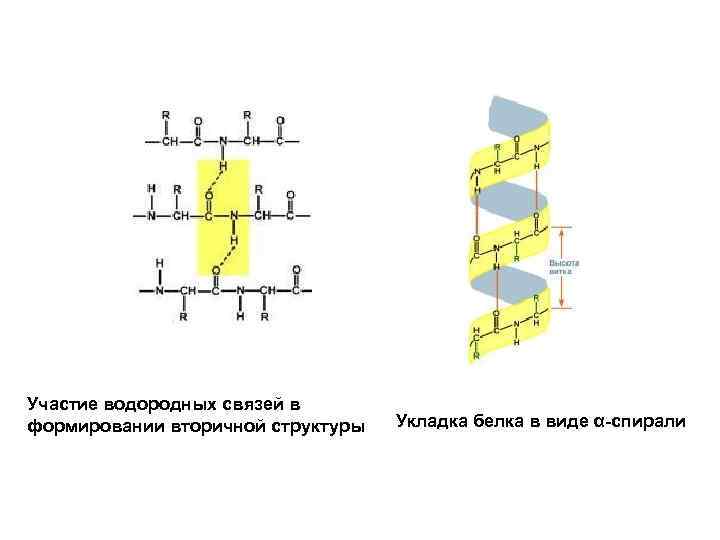 Участие водородных связей в формировании вторичной структуры Укладка белка в виде α-спирали
Участие водородных связей в формировании вторичной структуры Укладка белка в виде α-спирали
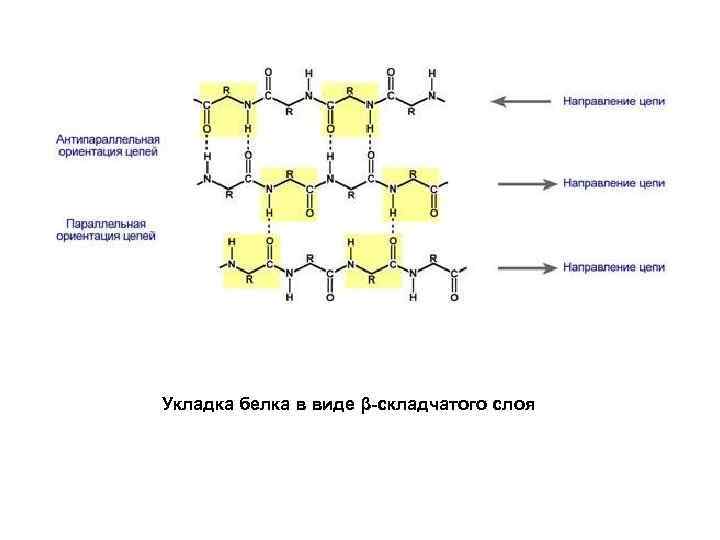 Укладка белка в виде β-складчатого слоя
Укладка белка в виде β-складчатого слоя
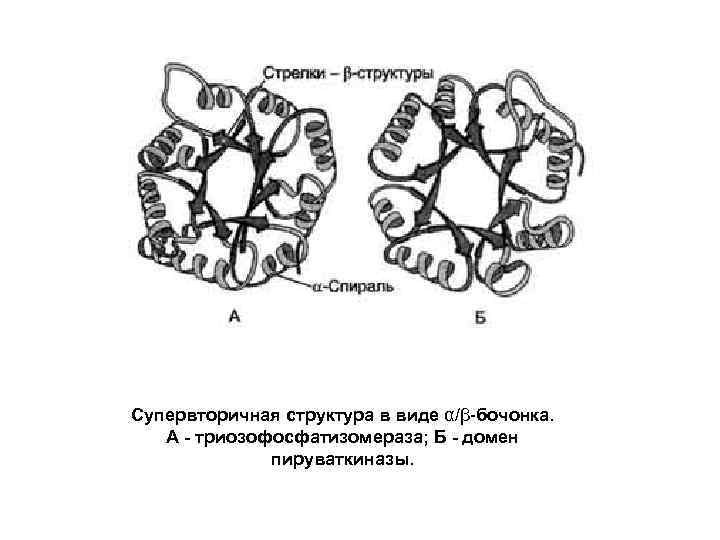 Супервторичная структура в виде α/β-бочонка. А - триозофосфатизомераза; Б - домен пируваткиназы.
Супервторичная структура в виде α/β-бочонка. А - триозофосфатизомераза; Б - домен пируваткиназы.
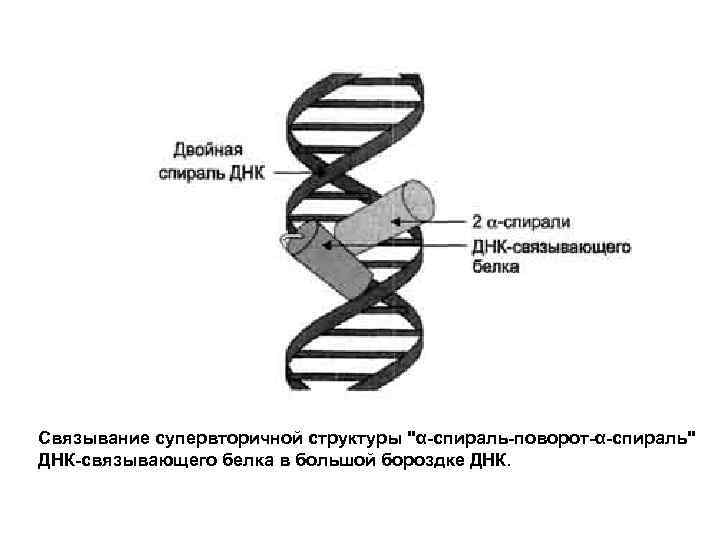 Связывание супервторичной структуры "α-спираль-поворот-α-спираль" ДНК-связывающего белка в большой бороздке ДНК.
Связывание супервторичной структуры "α-спираль-поворот-α-спираль" ДНК-связывающего белка в большой бороздке ДНК.
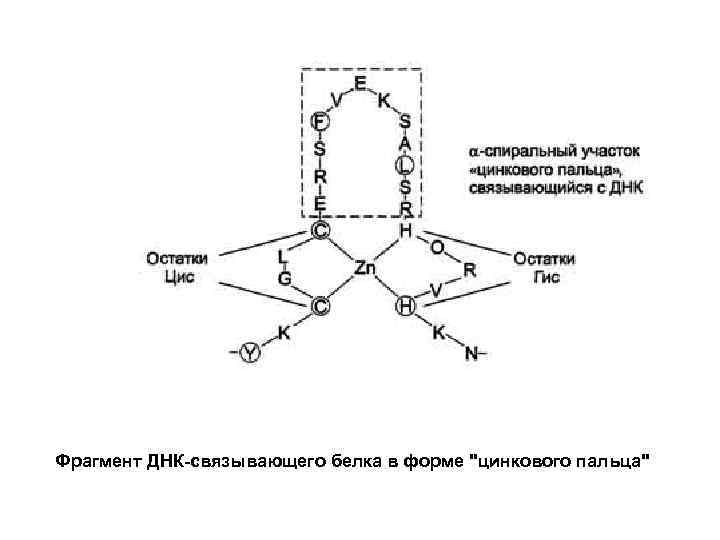 Фрагмент ДНК-связывающего белка в форме "цинкового пальца"
Фрагмент ДНК-связывающего белка в форме "цинкового пальца"
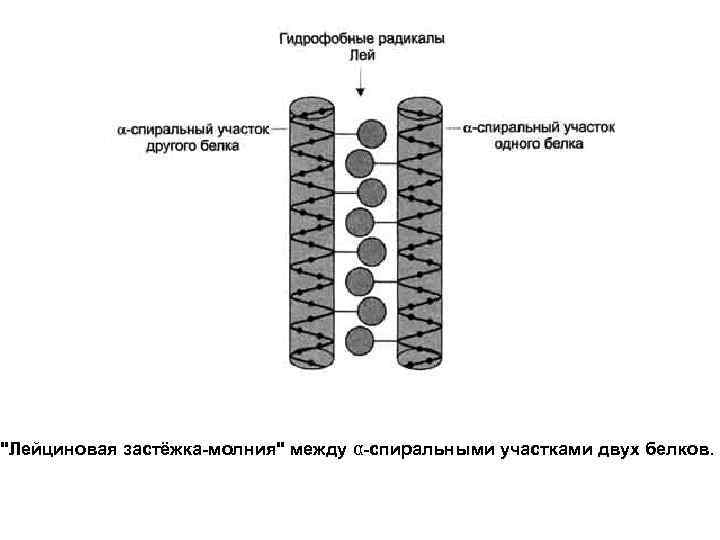 "Лейциновая застёжка-молния" между α-спиральными участками двух белков.
"Лейциновая застёжка-молния" между α-спиральными участками двух белков.
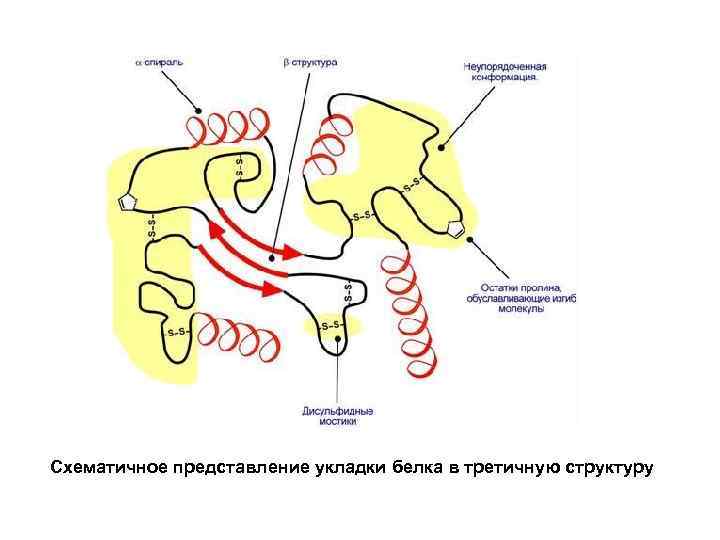 Схематичное представление укладки белка в третичную структуру
Схематичное представление укладки белка в третичную структуру
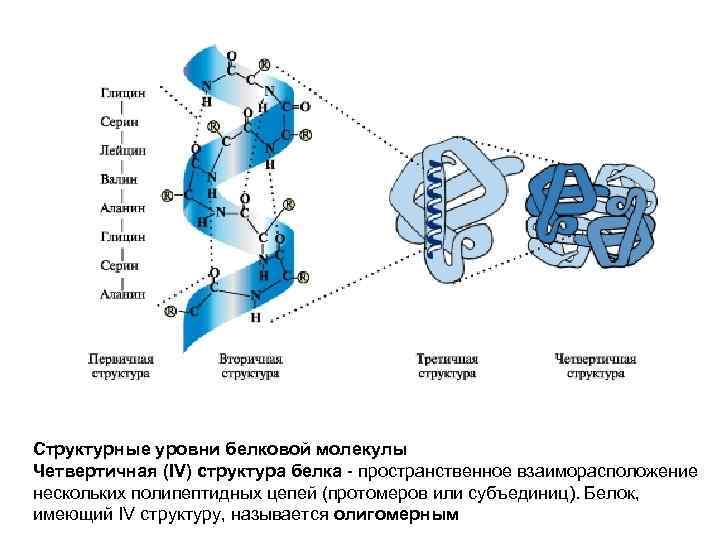 Структурные уровни белковой молекулы Четвертичная (IV) структура белка - пространственное взаиморасположение нескольких полипептидных цепей (протомеров или субъединиц). Белок, имеющий IV структуру, называется олигомерным
Структурные уровни белковой молекулы Четвертичная (IV) структура белка - пространственное взаиморасположение нескольких полипептидных цепей (протомеров или субъединиц). Белок, имеющий IV структуру, называется олигомерным
 Доме н белка – элемент третичной структуры белка, представляющий собой достаточно стабильную и независимую подструктуру белка, чей фолдинг проходит независимо от остальных частей. В состав домена обычно входит несколько элементов вторичной структуры. В белке домены выполняют какую-либо его функцию (например, цитоплазматический домен, трансмембранный домен и т. п. ).
Доме н белка – элемент третичной структуры белка, представляющий собой достаточно стабильную и независимую подструктуру белка, чей фолдинг проходит независимо от остальных частей. В состав домена обычно входит несколько элементов вторичной структуры. В белке домены выполняют какую-либо его функцию (например, цитоплазматический домен, трансмембранный домен и т. п. ).
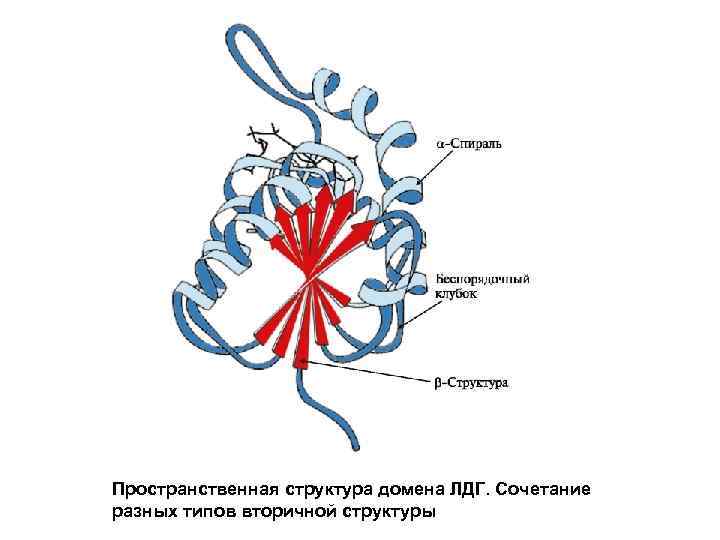 Пространственная структура домена ЛДГ. Сочетание разных типов вторичной структуры
Пространственная структура домена ЛДГ. Сочетание разных типов вторичной структуры
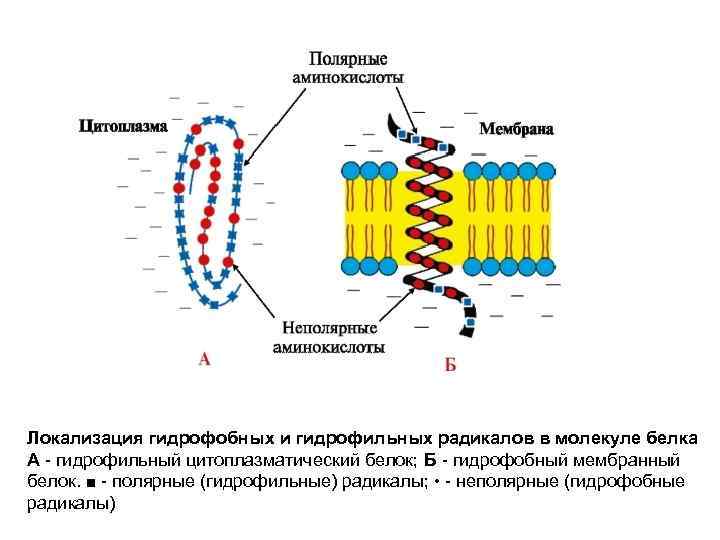 Локализация гидрофобных и гидрофильных радикалов в молекуле белка А - гидрофильный цитоплазматический белок; Б - гидрофобный мембранный белок. ■ - полярные (гидрофильные) радикалы; • - неполярные (гидрофобные радикалы)
Локализация гидрофобных и гидрофильных радикалов в молекуле белка А - гидрофильный цитоплазматический белок; Б - гидрофобный мембранный белок. ■ - полярные (гидрофильные) радикалы; • - неполярные (гидрофобные радикалы)
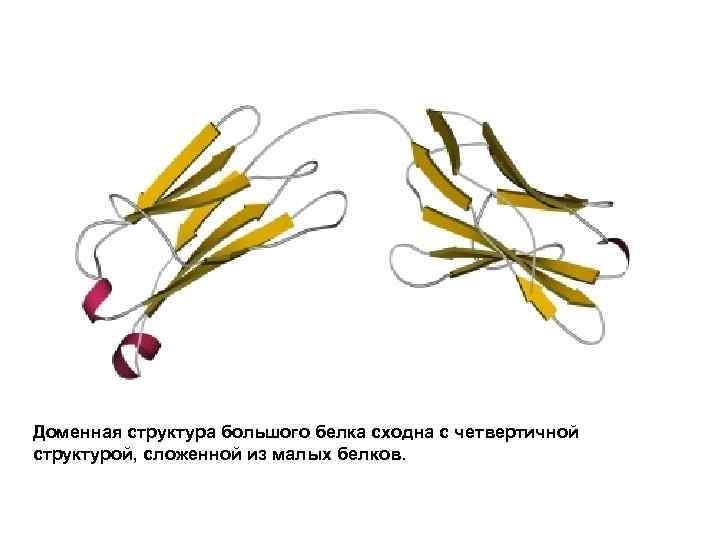 Доменная структура большого белка сходна с четвертичной структурой, сложенной из малых белков.
Доменная структура большого белка сходна с четвертичной структурой, сложенной из малых белков.
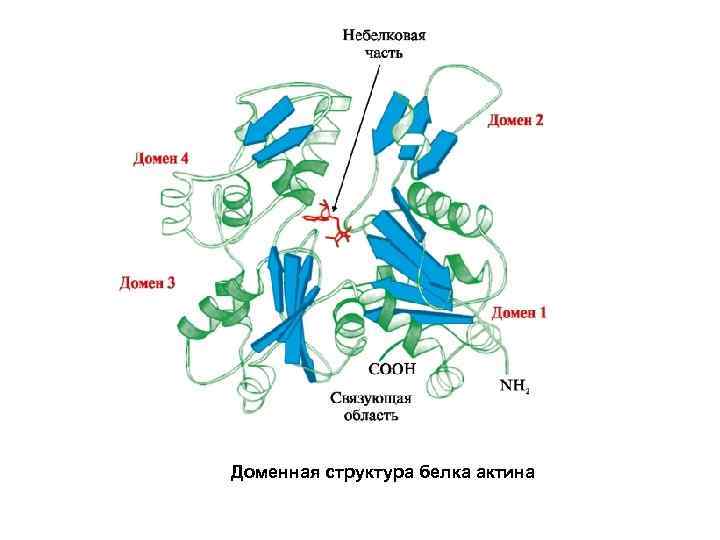 Доменная структура белка актина
Доменная структура белка актина



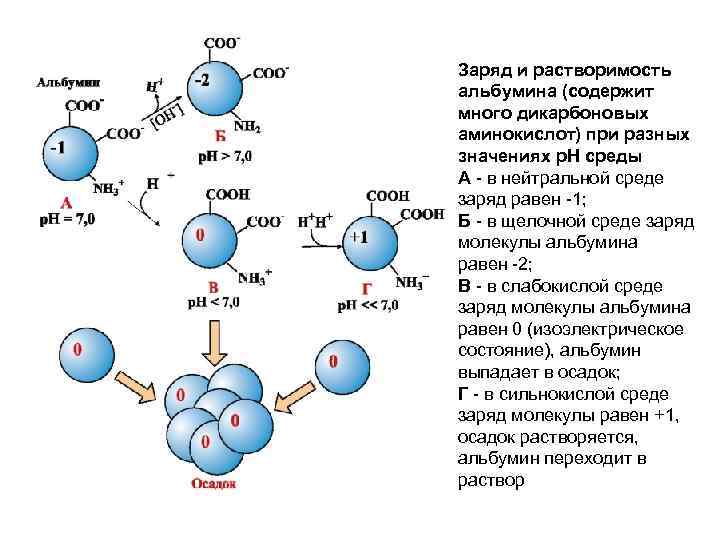 Заряд и растворимость альбумина (содержит много дикарбоновых аминокислот) при разных значениях р. Н среды А - в нейтральной среде заряд равен -1; Б - в щелочной среде заряд молекулы альбумина равен -2; В - в слабокислой среде заряд молекулы альбумина равен 0 (изоэлектрическое состояние), альбумин выпадает в осадок; Г - в сильнокислой среде заряд молекулы равен +1, осадок растворяется, альбумин переходит в раствор
Заряд и растворимость альбумина (содержит много дикарбоновых аминокислот) при разных значениях р. Н среды А - в нейтральной среде заряд равен -1; Б - в щелочной среде заряд молекулы альбумина равен -2; В - в слабокислой среде заряд молекулы альбумина равен 0 (изоэлектрическое состояние), альбумин выпадает в осадок; Г - в сильнокислой среде заряд молекулы равен +1, осадок растворяется, альбумин переходит в раствор
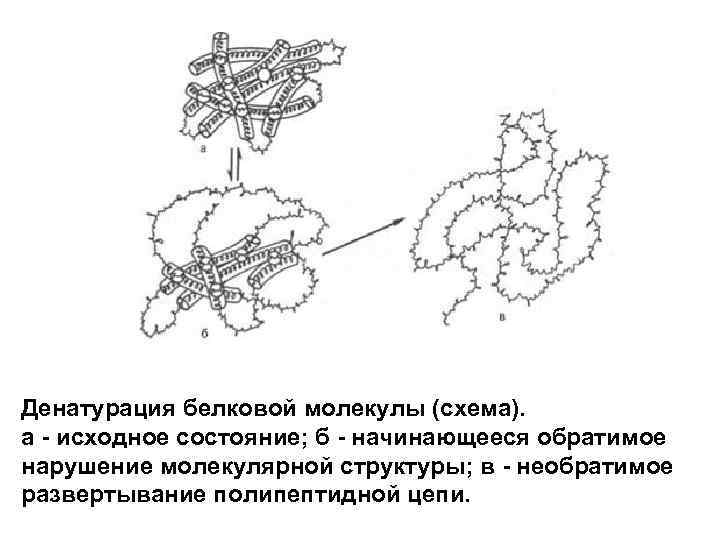 Денатурация белковой молекулы (схема). а - исходное состояние; б - начинающееся обратимое нарушение молекулярной структуры; в - необратимое развертывание полипептидной цепи.
Денатурация белковой молекулы (схема). а - исходное состояние; б - начинающееся обратимое нарушение молекулярной структуры; в - необратимое развертывание полипептидной цепи.
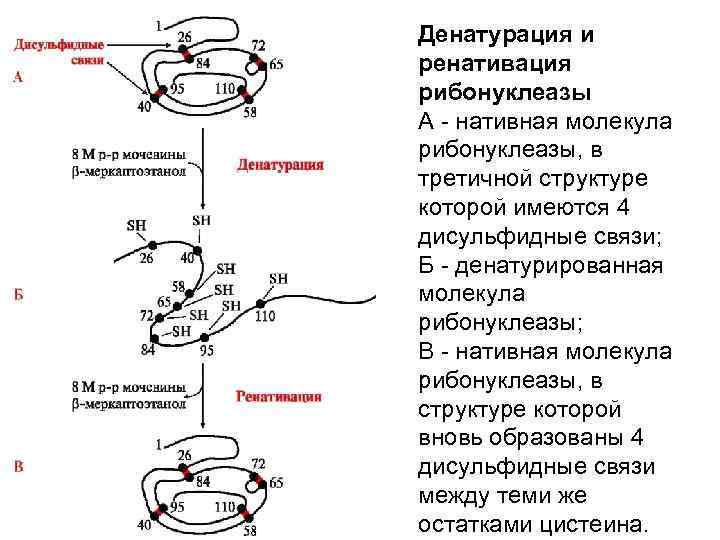 Денатурация и ренативация рибонуклеазы А - нативная молекула рибонуклеазы, в третичной структуре которой имеются 4 дисульфидные связи; Б - денатурированная молекула рибонуклеазы; В - нативная молекула рибонуклеазы, в структуре которой вновь образованы 4 дисульфидные связи между теми же остатками цистеина.
Денатурация и ренативация рибонуклеазы А - нативная молекула рибонуклеазы, в третичной структуре которой имеются 4 дисульфидные связи; Б - денатурированная молекула рибонуклеазы; В - нативная молекула рибонуклеазы, в структуре которой вновь образованы 4 дисульфидные связи между теми же остатками цистеина.
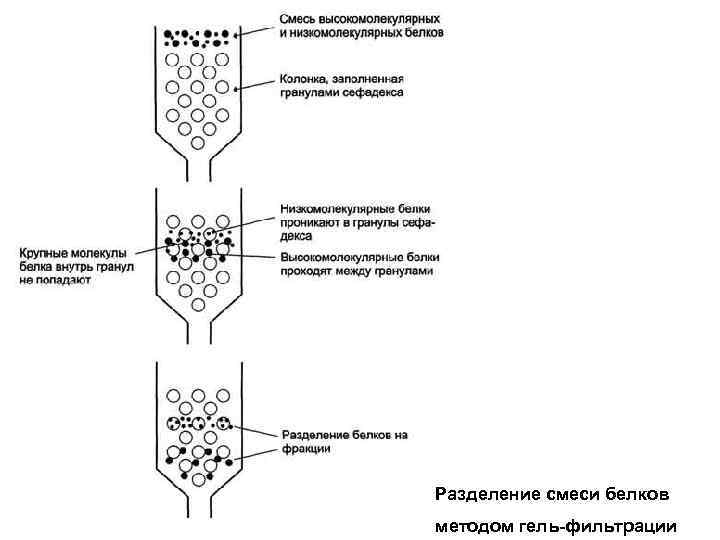 Разделение смеси белков методом гель-фильтрации
Разделение смеси белков методом гель-фильтрации
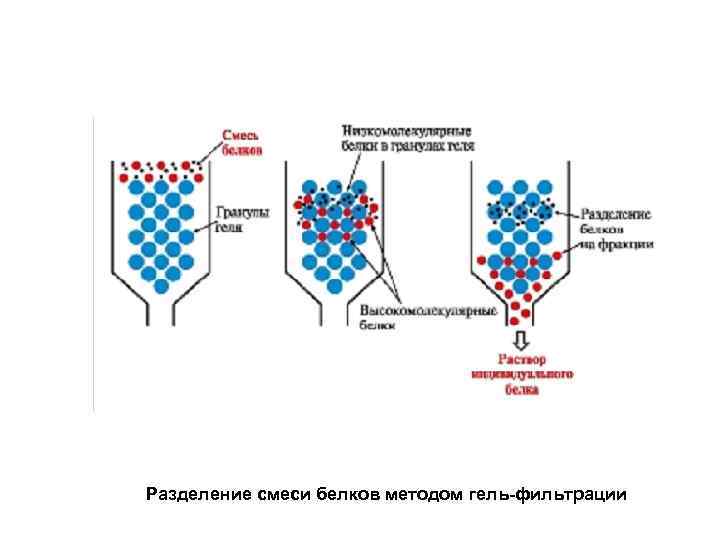 Разделение смеси белков методом гель-фильтрации
Разделение смеси белков методом гель-фильтрации
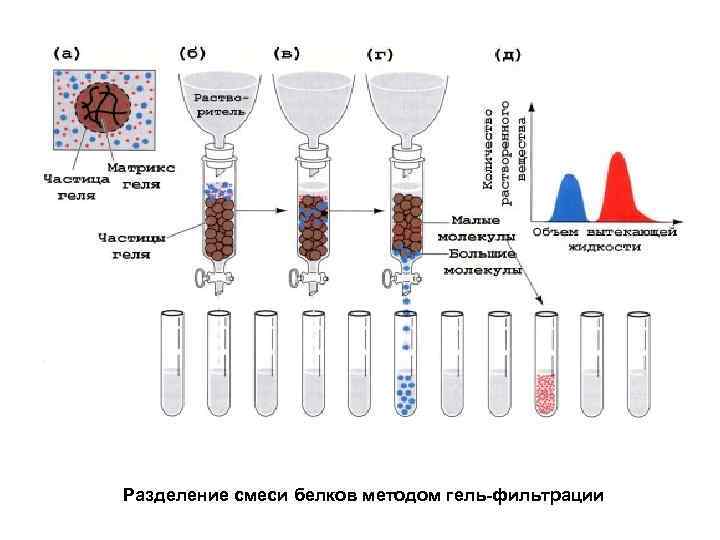 Разделение смеси белков методом гель-фильтрации
Разделение смеси белков методом гель-фильтрации
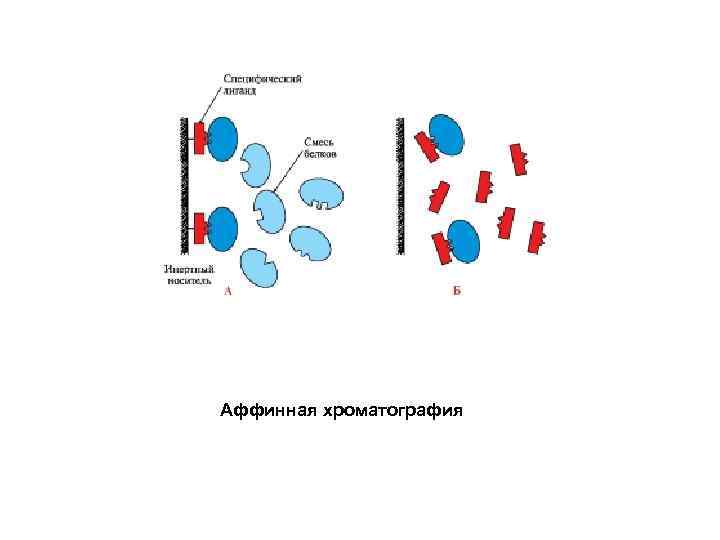 Аффинная хроматография
Аффинная хроматография
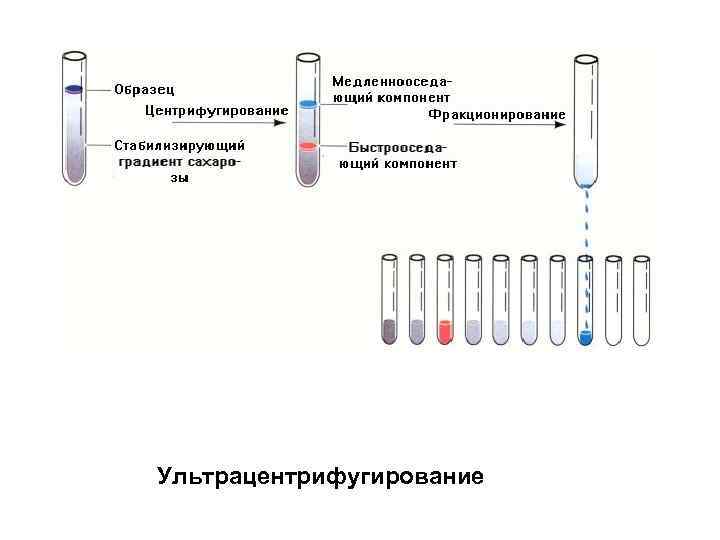 Ультрацентрифугирование
Ультрацентрифугирование
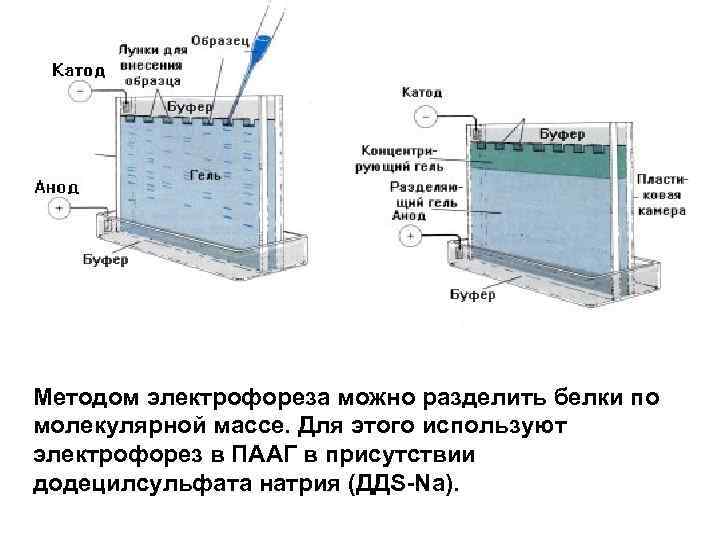 Методом электрофореза можно разделить белки по молекулярной массе. Для этого используют электрофорез в ПААГ в присутствии додецилсульфата натрия (ДДS-Na).
Методом электрофореза можно разделить белки по молекулярной массе. Для этого используют электрофорез в ПААГ в присутствии додецилсульфата натрия (ДДS-Na).
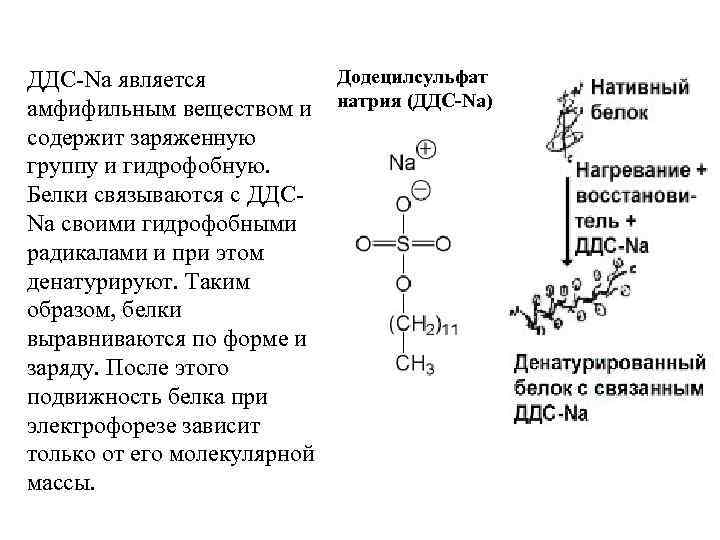 Додецилсульфат ДДС-Na является амфифильным веществом и натрия (ДДС-Na) содержит заряженную группу и гидрофобную. Белки связываются с ДДСNa своими гидрофобными радикалами и при этом денатурируют. Таким образом, белки выравниваются по форме и заряду. После этого подвижность белка при электрофорезе зависит только от его молекулярной массы.
Додецилсульфат ДДС-Na является амфифильным веществом и натрия (ДДС-Na) содержит заряженную группу и гидрофобную. Белки связываются с ДДСNa своими гидрофобными радикалами и при этом денатурируют. Таким образом, белки выравниваются по форме и заряду. После этого подвижность белка при электрофорезе зависит только от его молекулярной массы.
 В клетках в процессе синтеза полипептидных цепей, их транспорта через мембраны в соответствующие отделы клетки, в процессе фолдинга (процесс сворачивания полипептидной цепи в правильную пространственную структуру) и при сборке олигомерных белков, а также в период их функционирования в структуре белков возникают промежуточные, склонные к агрегации, нестабильные конформации. Гидрофобные радикалы, в нативной конформации обычно спрятанные внутри белковой молекулы, в нестабильной конформации оказываются на поверхности и стремятся к объединению с такими же плохо растворимыми в воде группами других белков. В клетках всех известных организмов обнаружены специальные белки, которые обеспечивают оптимальный фолдинг белков клетки, стабилизируют их нативную конформацию при функционировании и, что особенно важно, поддерживают структуру и функции внутриклеточных белков при нарушении гомеостаза. Эти белки получили название «шапероны» (Hsp 70), что в переводе с французского обозначает «няня» .
В клетках в процессе синтеза полипептидных цепей, их транспорта через мембраны в соответствующие отделы клетки, в процессе фолдинга (процесс сворачивания полипептидной цепи в правильную пространственную структуру) и при сборке олигомерных белков, а также в период их функционирования в структуре белков возникают промежуточные, склонные к агрегации, нестабильные конформации. Гидрофобные радикалы, в нативной конформации обычно спрятанные внутри белковой молекулы, в нестабильной конформации оказываются на поверхности и стремятся к объединению с такими же плохо растворимыми в воде группами других белков. В клетках всех известных организмов обнаружены специальные белки, которые обеспечивают оптимальный фолдинг белков клетки, стабилизируют их нативную конформацию при функционировании и, что особенно важно, поддерживают структуру и функции внутриклеточных белков при нарушении гомеостаза. Эти белки получили название «шапероны» (Hsp 70), что в переводе с французского обозначает «няня» .
 Процессинг белков. Большинство белков синтезируется в виде предшественников, не обладающих нативной структурой. Процесс превращения белка-предшественника в структурно и функционально зрелый белок называется созреванием или процессингом. У разных белков процессинг протекает различно, однако можно выделить отдельные этапы процессинга: Образование дисульфидных связей между боковыми радикалами остатков цистеина, стоящих на разных участках полипептидной цепи. Расщепление одной или большего числа определенных пептидных связей и превращение полипептида-предшественника в конечный продукт (ограниченный протеолиз, прицельный протеолиз). Присоединение простетических групп (углеводов, липидов, коферментов и др. ), приводящее к образованию сложных белков и ферментов. Химическая модификация боковых радикалов некоторых аминокислотных остатков в определенных белках (фосфорилирование, метилирование, гидроксилирование, карбоксилирование, йодирование и т. д. ). Ассоциация субъединиц как необходимый этап для белков, обладающих четвертичной структурой.
Процессинг белков. Большинство белков синтезируется в виде предшественников, не обладающих нативной структурой. Процесс превращения белка-предшественника в структурно и функционально зрелый белок называется созреванием или процессингом. У разных белков процессинг протекает различно, однако можно выделить отдельные этапы процессинга: Образование дисульфидных связей между боковыми радикалами остатков цистеина, стоящих на разных участках полипептидной цепи. Расщепление одной или большего числа определенных пептидных связей и превращение полипептида-предшественника в конечный продукт (ограниченный протеолиз, прицельный протеолиз). Присоединение простетических групп (углеводов, липидов, коферментов и др. ), приводящее к образованию сложных белков и ферментов. Химическая модификация боковых радикалов некоторых аминокислотных остатков в определенных белках (фосфорилирование, метилирование, гидроксилирование, карбоксилирование, йодирование и т. д. ). Ассоциация субъединиц как необходимый этап для белков, обладающих четвертичной структурой.
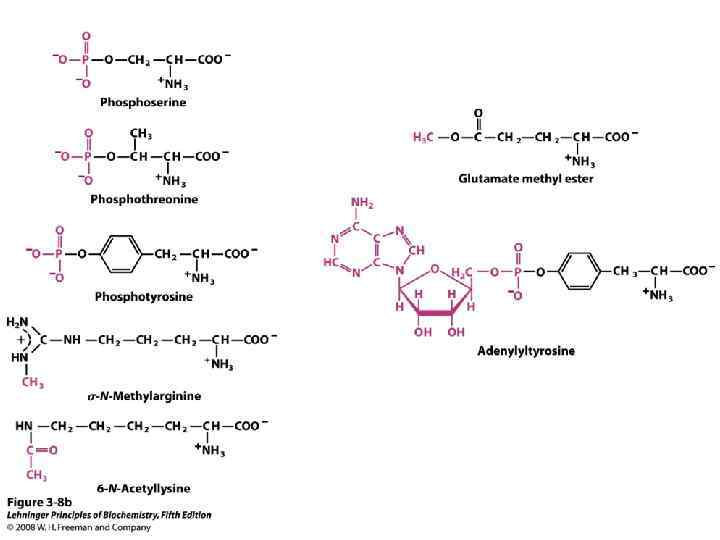
 КЛАССИФИКАЦИЯ БЕЛКОВ 1. Простые белки состоят только из аминокислот. 2. Сложные белки (холопротеины) содержат белковую часть (апопротеин) и небелковую (простетическую) группу.
КЛАССИФИКАЦИЯ БЕЛКОВ 1. Простые белки состоят только из аминокислот. 2. Сложные белки (холопротеины) содержат белковую часть (апопротеин) и небелковую (простетическую) группу.
 Классификация простых белков Белки в зависимости от химического строения делят на простые и сложные. Простые белки при гидролизе распадаются только на аминокислоты. Классификация простых белков основана на их растворимости. Альбумины – водорастворимые белки с высокой гидрофильностью, выпадают в осадок при 100%-ом насыщении сульфатом аммония. Это группа схожих белков плазмы крови с молекулярной массой около 40 -70 к. Да, содержат много глутаминовой кислоты и поэтому имеют кислые свойства и высокий отрицательный заряд при физиологических р. Н. Легко адсорбируют полярные и неполярные молекулы, являются, белком-транспортером в крови для многих веществ, в первую очередь для билирубина и длинноцепочечных жирных кислот. К этим белкам относятся белок куриного яйца, белки зародыша семян злаковых и бобовых культур. Альбумины содержат все незаменимые аминокислоты.
Классификация простых белков Белки в зависимости от химического строения делят на простые и сложные. Простые белки при гидролизе распадаются только на аминокислоты. Классификация простых белков основана на их растворимости. Альбумины – водорастворимые белки с высокой гидрофильностью, выпадают в осадок при 100%-ом насыщении сульфатом аммония. Это группа схожих белков плазмы крови с молекулярной массой около 40 -70 к. Да, содержат много глутаминовой кислоты и поэтому имеют кислые свойства и высокий отрицательный заряд при физиологических р. Н. Легко адсорбируют полярные и неполярные молекулы, являются, белком-транспортером в крови для многих веществ, в первую очередь для билирубина и длинноцепочечных жирных кислот. К этим белкам относятся белок куриного яйца, белки зародыша семян злаковых и бобовых культур. Альбумины содержат все незаменимые аминокислоты.
 Глобулины – растворяются в солевых растворах, чаще всего для извлечения глобулинов используют 2 – 10%-ый раствор хлорида натрия. Они осаждаются 50%-ым раствором сульфата аммония. Это группа разнообразных белков плазмы крови с молекулярной массой 100 -150 и более к. Да, слабокислые или нейтральные. Они слабо гидратированы, по сравнению с альбуминами меньше устойчивы в растворе и легче осаждаются, Белки семян бобовых и масличных культур в основном представлены глобулинами; легумин – гороха и чечевицы, фазеолин – фасоли; глицин – соевых бобов. Они составляют почти половину белков крови человека, определяют иммунные свойства организма (иммуноглобулины), свертываемость крови (протромбин, фибриноген), участвуют в переносе железа к тканям и других процессах. Многие альбумины и глобулины обладают ферментативным действием.
Глобулины – растворяются в солевых растворах, чаще всего для извлечения глобулинов используют 2 – 10%-ый раствор хлорида натрия. Они осаждаются 50%-ым раствором сульфата аммония. Это группа разнообразных белков плазмы крови с молекулярной массой 100 -150 и более к. Да, слабокислые или нейтральные. Они слабо гидратированы, по сравнению с альбуминами меньше устойчивы в растворе и легче осаждаются, Белки семян бобовых и масличных культур в основном представлены глобулинами; легумин – гороха и чечевицы, фазеолин – фасоли; глицин – соевых бобов. Они составляют почти половину белков крови человека, определяют иммунные свойства организма (иммуноглобулины), свертываемость крови (протромбин, фибриноген), участвуют в переносе железа к тканям и других процессах. Многие альбумины и глобулины обладают ферментативным действием.
 Проламины. Эта группа белков характерна исключительно для семян злаков. Характерной особенностью проламинов является растворимость в 60– 80% водном растворе этанола, в то время как все остальные простые белки в этих условиях обычно выпадают в осадок. Эти белки содержат значительные количества пролина и глютаминовой кислот. Лизина они не содержат или содержат его в следовых количествах. Хорошо изучены проламины пшеницы – глиадины, ячменя – гордеин, кукурузы – зеин. Проламины – это комплексы белков различающиеся по составу и молекулярной массе. Глутелины находятся, как правило, с проламинами. Эти белки тоже содержат значительные количества глютаминовой кислот, а значит относятся к кислым белкам. Растворяются они в щелочах (чаще 0, 2%-ым Na. OH). Глутелины не однородные белки, а смеси разных белков со сходными свойствами. Наиболее исследованы глутелин пшеницы, орезенин риса. Глутенин и глиадин пшеницы образуют комплекс, который называют клейковиной. Клейковина муки влияет на структурно-механические свойства теста, а следовательно на качество хлеба. Протамины – самые низкомолекулярные белки. Встречаются эти белки в молоках рыб. На 2/3 эти белки состоят из аргинина, поэтому имеют основной характер. Протамины не содержат серы. Гистоны также являются белками основного характера. В их состав входят лизин и аргинин, содержание которых, однако, не превышает 20– 30%. Гистоны – содержаться в хромосомах клеточных ядер, они участвуют в стабилизации пространственной структуры ДНК. Из растворов их осаждают аммиаком.
Проламины. Эта группа белков характерна исключительно для семян злаков. Характерной особенностью проламинов является растворимость в 60– 80% водном растворе этанола, в то время как все остальные простые белки в этих условиях обычно выпадают в осадок. Эти белки содержат значительные количества пролина и глютаминовой кислот. Лизина они не содержат или содержат его в следовых количествах. Хорошо изучены проламины пшеницы – глиадины, ячменя – гордеин, кукурузы – зеин. Проламины – это комплексы белков различающиеся по составу и молекулярной массе. Глутелины находятся, как правило, с проламинами. Эти белки тоже содержат значительные количества глютаминовой кислот, а значит относятся к кислым белкам. Растворяются они в щелочах (чаще 0, 2%-ым Na. OH). Глутелины не однородные белки, а смеси разных белков со сходными свойствами. Наиболее исследованы глутелин пшеницы, орезенин риса. Глутенин и глиадин пшеницы образуют комплекс, который называют клейковиной. Клейковина муки влияет на структурно-механические свойства теста, а следовательно на качество хлеба. Протамины – самые низкомолекулярные белки. Встречаются эти белки в молоках рыб. На 2/3 эти белки состоят из аргинина, поэтому имеют основной характер. Протамины не содержат серы. Гистоны также являются белками основного характера. В их состав входят лизин и аргинин, содержание которых, однако, не превышает 20– 30%. Гистоны – содержаться в хромосомах клеточных ядер, они участвуют в стабилизации пространственной структуры ДНК. Из растворов их осаждают аммиаком.


