Везикулярный транспорт Lecture5- Ubiquitination & ADP-ribosylation.ppt
- Количество слайдов: 34
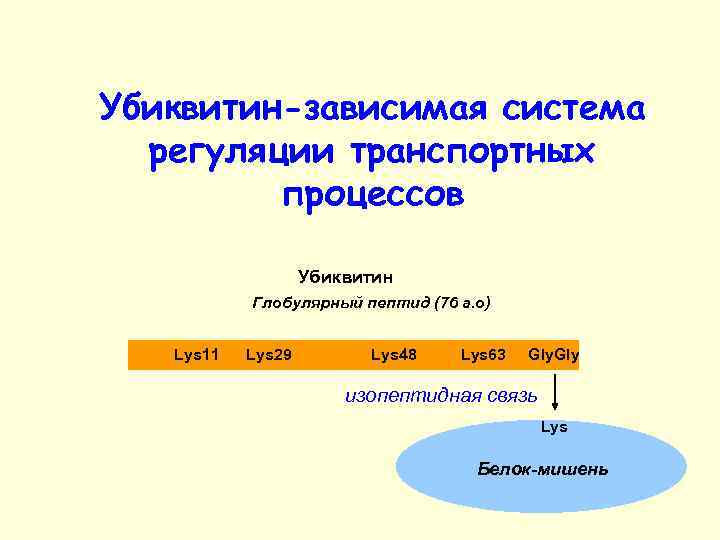
Убиквитин-зависимая система регуляции транспортных процессов Убиквитин Глобулярный пептид (76 а. o) Lys 11 Lys 29 Lys 48 Lys 63 Gly изопептидная связь Lys Белок-мишень
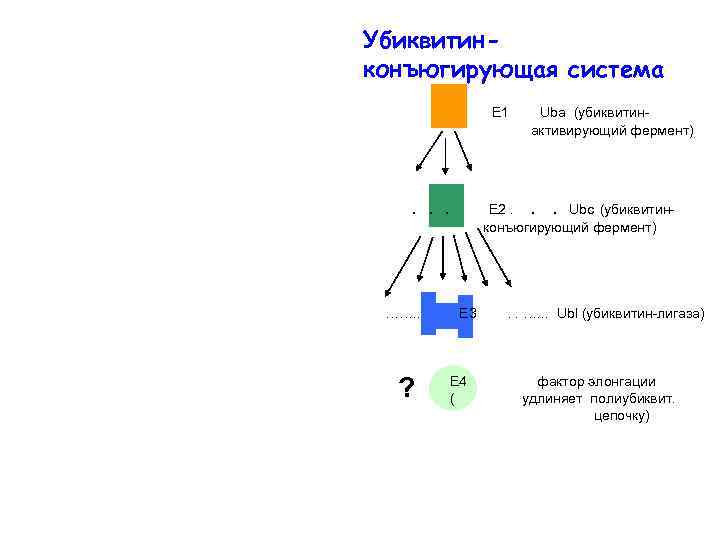
Убиквитинконъюгирующая система Е 1 . . . ……. . ? Uba (убиквитинактивирующий фермент) Е 2. . . Ubc (убиквитинконъюгирующий фермент) Е 3 E 4 ( . . …. . . Ubl (yбиквитин-лигаза) фактор элонгации удлиняет полиубиквит. цепочку)
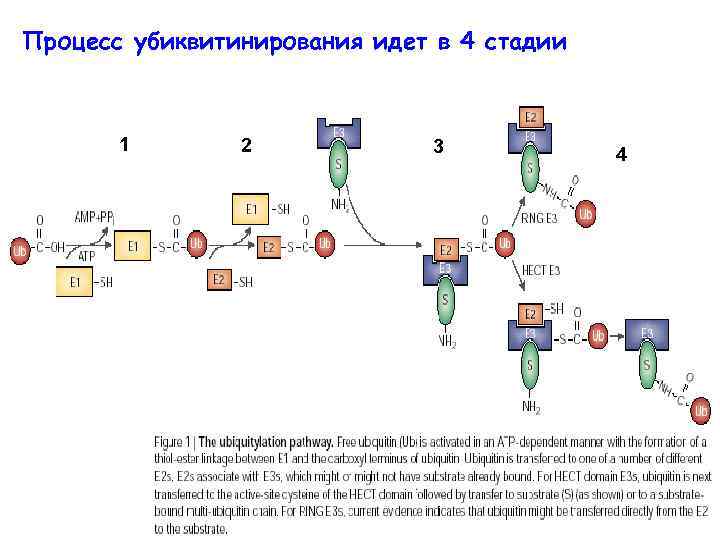
Процесс убиквитинирования идет в 4 стадии 1 2 3 4
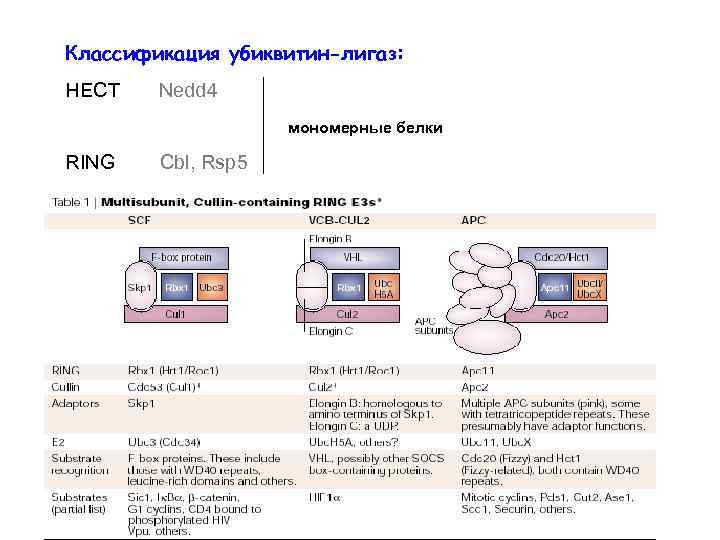
Классификация убиквитин-лигаз: HECT Nedd 4 мономерные белки RING Cbl, Rsp 5

Существует также ряд деубиквитинирующих ферментов (DUBs), как свободных, так и ассоциированных с протеасомами и эндосомами
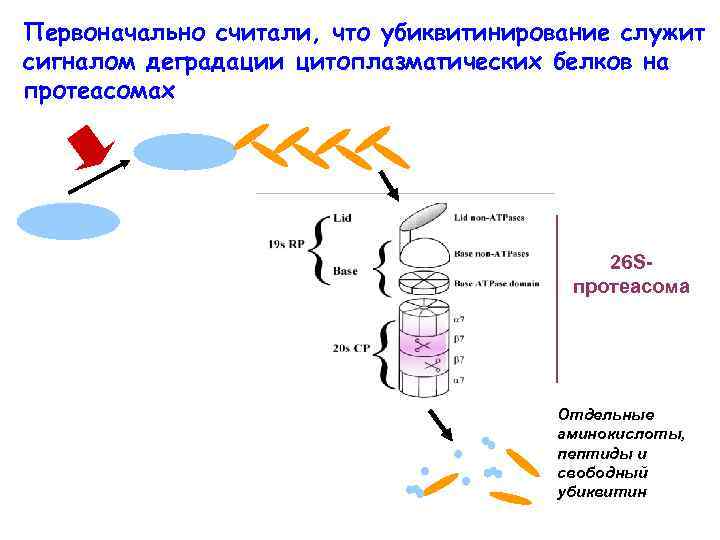
Первоначально считали, что убиквитинирование служит сигналом деградации цитоплазматических белков на протеасомах 26 Sпротеасома Отдельные аминокислоты, пептиды и свободный убиквитин

В дальнейшем оказалось, что роль убиквитинирования гораздо шире
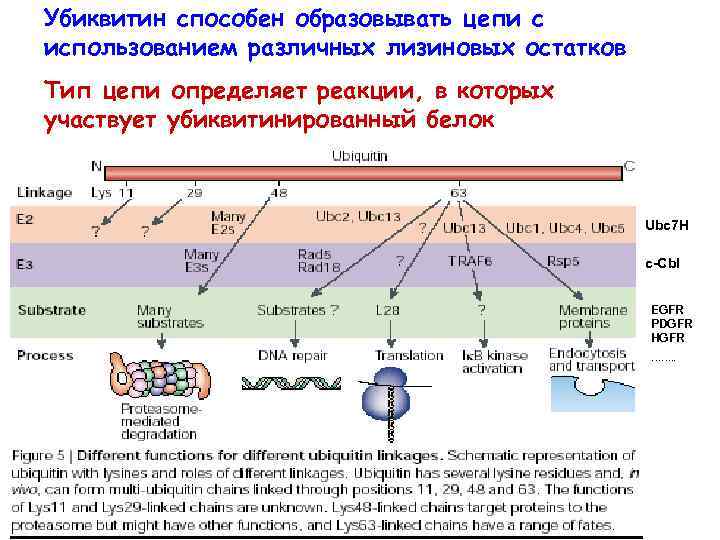
Убиквитин способен образовывать цепи с использованием различных лизиновых остатков Тип цепи определяет реакции, в которых участвует убиквитинированный белок Ubc 7 H c-Сbl EGFR PDGFR HGFR ……. .
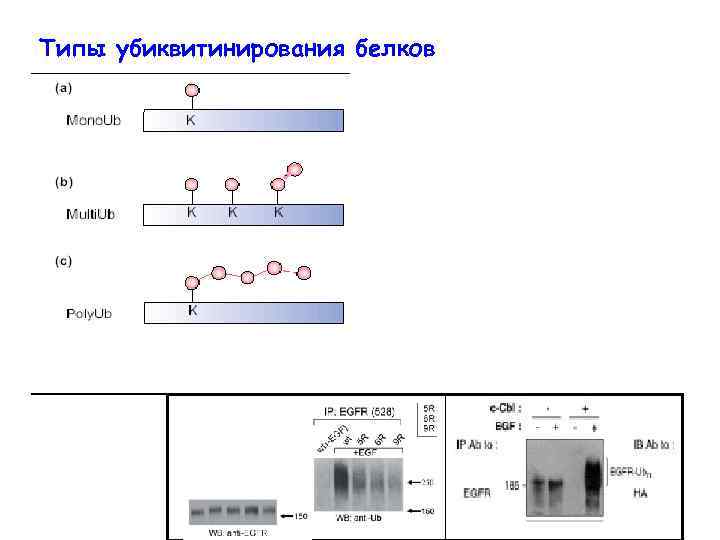
Типы убиквитинирования белков Accessory proteins Cargo proteins ?

Предположения о полиубиквитинировании тирозинкиназных рецепторов были основаны на том факте, что их деградация блокируется ингибиторами протеасом А протеасомы узнают полиубиквитированные белки Следовательно, рецепторы полиубиквитинируются, а протеасомы участвуют в регуляции эндоцитоза (опосредуют переход из ранних эндосом в поздние)
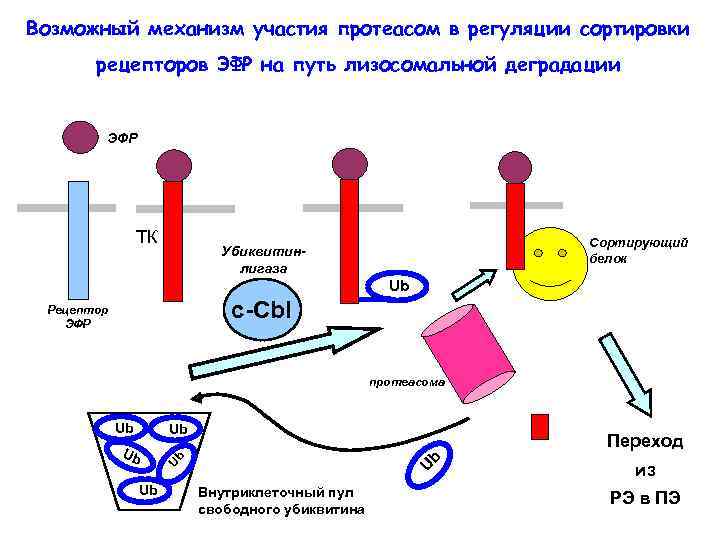
Возможный механизм участия протеасом в регуляции сортировки рецепторов ЭФР на путь лизосомальной деградации ЭФР ТК Сортирующий белок Убиквитинлигаза Ub c-Сbl Рецептор ЭФР протеасома Ub Ub Ub Переход Ub Ub Ub Внутриклеточный пул свободного убиквитина из РЭ в ПЭ
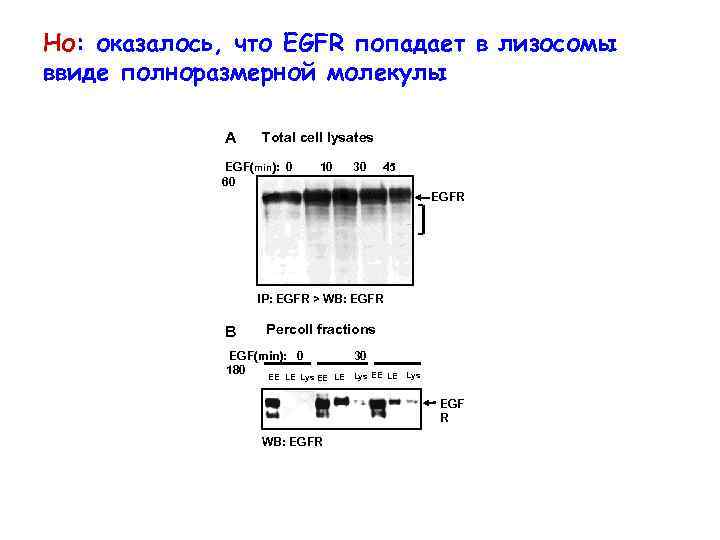
Но: оказалось, что EGFR попадает в лизосомы ввиде полноразмерной молекулы A Total cell lysates EGF(min): 0 60 10 30 45 EGFR IP: EGFR > WB: EGFR B Percoll fractions EGF(min): 0 180 EE LE Lys 30 EE LE Lys EGF R WB: EGFR
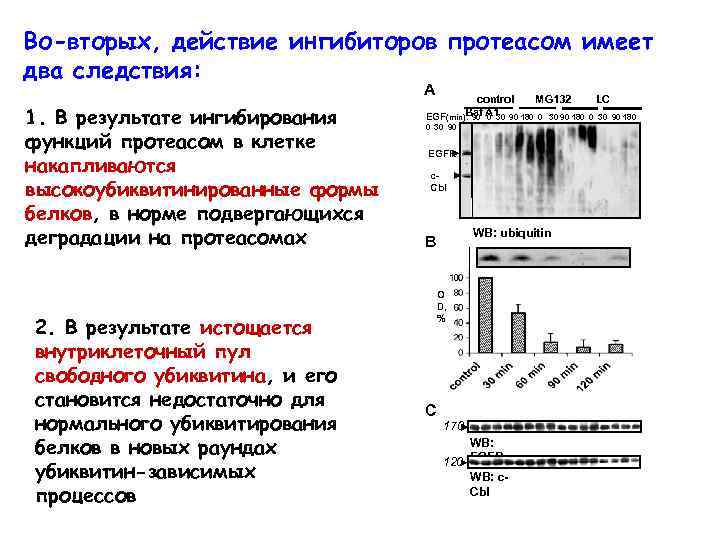
Во-вторых, действие ингибиторов протеасом имеет два следствия: A 1. В результате ингибирования функций протеасом в клетке накапливаются высокоубиквитинированные формы белков, в норме подвергающихся деградации на протеасомах 2. В результате истощается внутриклеточный пул свободного убиквитина, и его становится недостаточно для нормального убиквитирования белков в новых раундах убиквитин-зависимых процессов control MG 132 LC Baf A 1 90 180 0 30 90 180 EGF(min): 90 0 30 90 180 EGFR c. Cbl WB: ubiquitin B O D, % C 170 WB: 120 EGFR WB: c. Cbl

Таким образом, протеасомы напрямую не участвуют в регуляции эндоцитоза В дальнейшем было показано, что рецепторы (также как и другие трансмембранные белки, деградирующие в лизосомах) подвергаются мультиубиквитированию; Моноубиквитирования трансмембранных белков достаточно для интернализации, по крайней мере в искусственных системах


Многие мембранные белки, подвергающиеся эндоцитозу, и белки, регулирующие разные стадии эндоцитозного пути, либо сами убиквитинированы, либо имеют домены, способные узнавать убиквитинированные белки
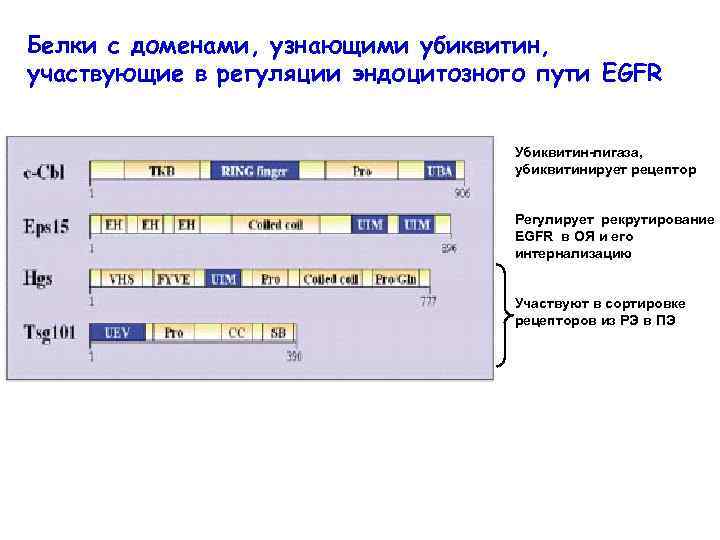
Белки с доменами, узнающими убиквитин, участвующие в регуляции эндоцитозного пути EGFR Убиквитин-лигаза, убиквитинирует рецептор Регулирует рекрутирование EGFR в ОЯ и его интернализацию Участвуют в сортировке рецепторов из РЭ в ПЭ
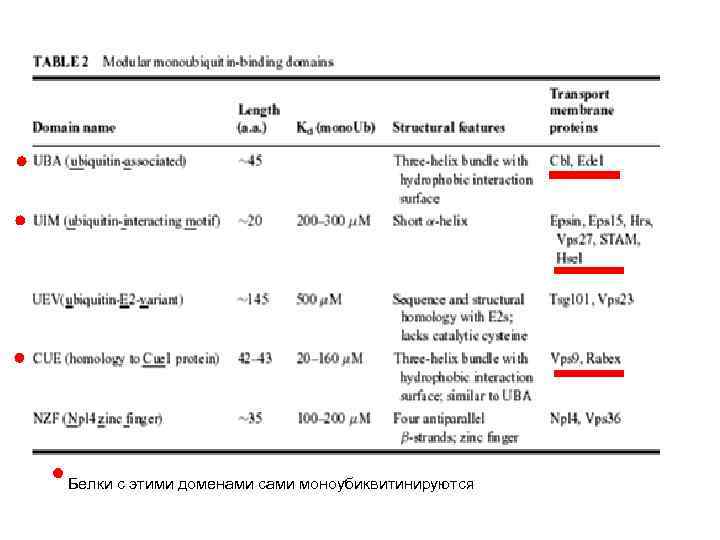
Белки с этими доменами сами моноубиквитинируются

Какова же роль убиквитинирования трансмембранных белков в их эндоцитозе?
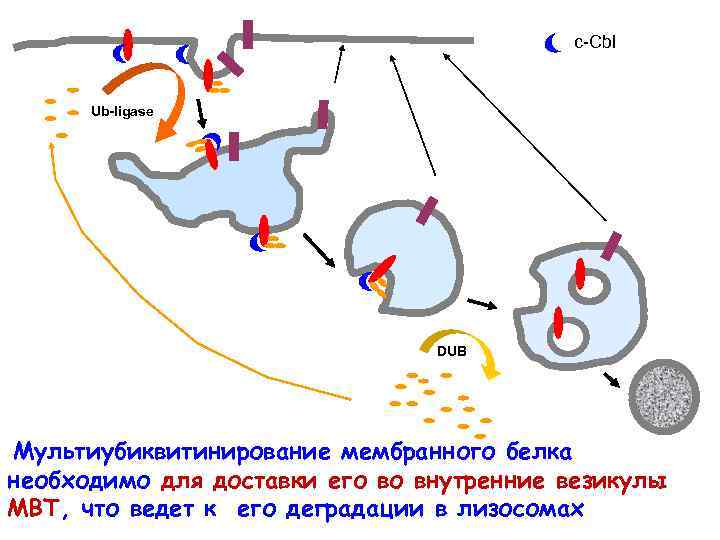
c-Cbl Ub-ligase DUB Мультиубиквитинирование мембранного белка необходимо для доставки его во внутренние везикулы МВТ, что ведет к его деградации в лизосомах
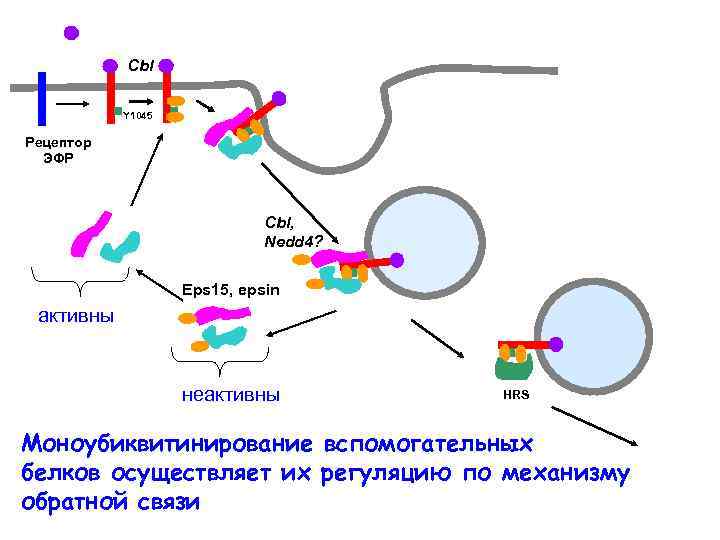
Cbl Y 1045 Рецептор ЭФР Cbl, Nedd 4? Eps 15, epsin активны неактивны HRS Моноубиквитинирование вспомогательных белков осуществляет их регуляцию по механизму обратной связи
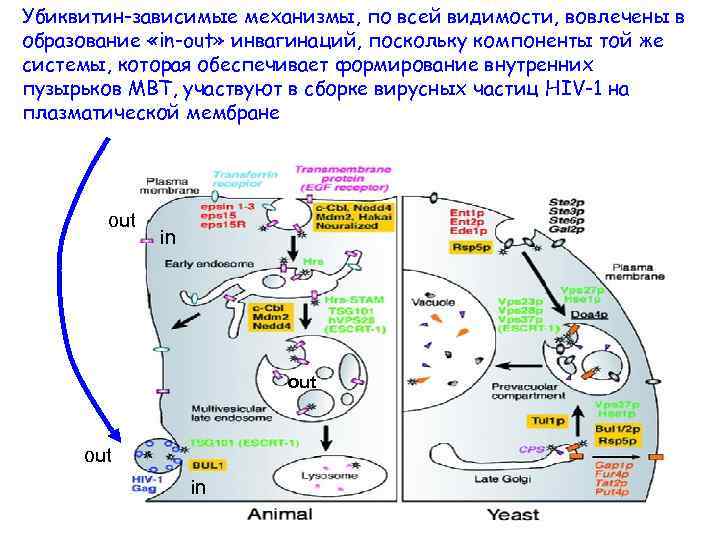
Убиквитин-зависимые механизмы, по всей видимости, вовлечены в образование «in-out» инвагинаций, поскольку компоненты той же системы, которая обеспечивает формирование внутренних пузырьков МВТ, участвуют в сборке вирусных частиц HIV-1 на плазматической мембране out in
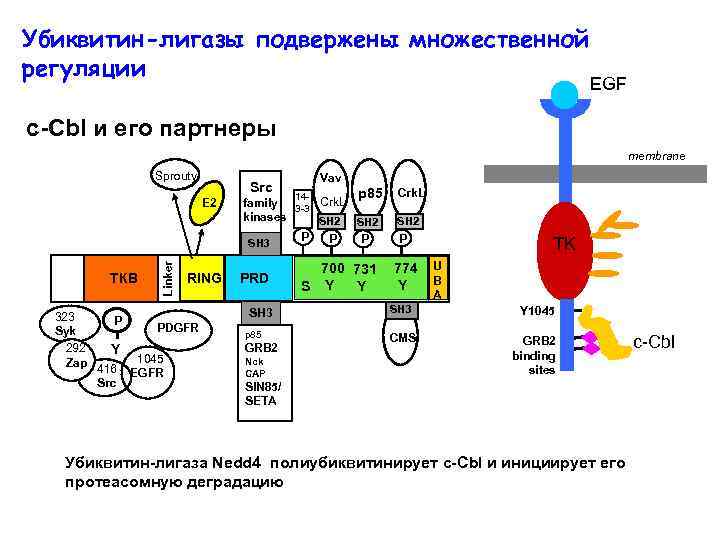
Убиквитин-лигазы подвержены множественной регуляции EGF c-Cbl и его партнеры membrane Sprouty Src ТКВ 323 Syk 292 Zap P Y 416 Src Linker E 2 RING 1045 EGFR p 85 Crk. L 14 family 3 -3 Crk. L kinases SH 2 P P P SH 3 SH 2 700 731 S Y Y 774 Y PRD SH 3 PDGFR Vav p 85 GRB 2 Nck CAP P SH 3 CMS TK U B A Y 1045 GRB 2 binding sites SIN 85/ SETA Убиквитин-лигаза Nedd 4 полиубиквитинирует с-Cbl и инициирует его протеасомную деградацию c-Cbl
Существуют и другие убиквитин-подобные системы (UBLs): Sumo 1, 2 Nedd 8 – Ubl в этом случае может быть и c-Cbl Белки семейства Apg, участвующие в аутофагии (34)^^ Убиквитин-подобный белок - Apg 8 (117 a. o) в дрожжах, LC 3 A, LC 3 B, LC 3 C, GABARAP-L 1, GABARAP-L 2/GATE-16, GABARAP-L 3 – у млекопитающих Система Е 1, Е 2 и Е 3 тоже есть, работает по тому же принципу, но гомологии с соответствующими убиквитинирующими ферментами также отсутствует. ЕЕ
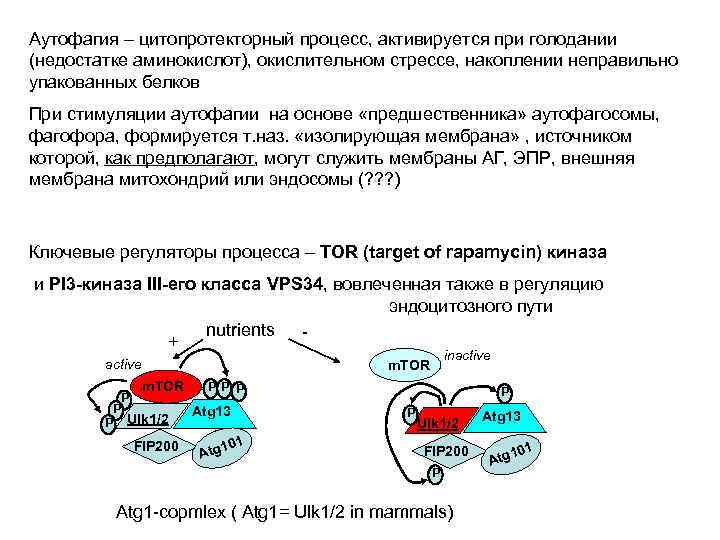
Аутофагия – цитопротекторный процесс, активируется при голодании (недостатке аминокислот), окислительном стрессе, накоплении неправильно упакованных белков При стимуляции аутофагии на основе «предшественника» аутофагосомы, фагофора, формируется т. наз. «изолирующая мембрана» , источником которой, как предполагают, могут служить мембраны АГ, ЭПР, внешняя мембрана митохондрий или эндосомы (? ? ? ) Ключевые регуляторы процесса – TOR (target of rapamycin) киназа и PI 3 -киназа III-его класса VPS 34, вовлеченная также в регуляцию эндоцитозного пути nutrients + active P inactive m. TOR P P Ulk 1/2 FIP 200 P P P Atg 13 101 Atg P P Ulk 1/2 FIP 200 P Atg 1 -copmlex ( Atg 1= Ulk 1/2 in mammals) Atg 13 101 Atg
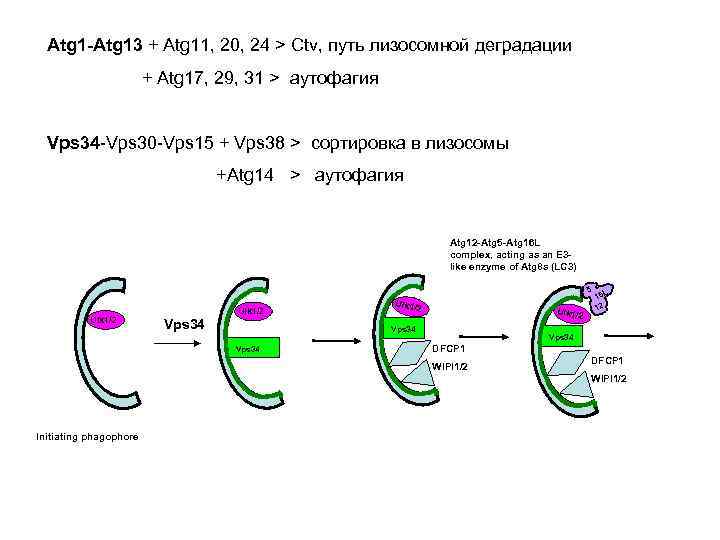
Atg 1 -Atg 13 + Atg 11, 20, 24 > Ctv, путь лизосомной деградации + Atg 17, 29, 31 > аутофагия Vps 34 -Vps 30 -Vps 15 + Vps 38 > сортировка в лизосомы +Atg 14 > аутофагия Atg 12 -Atg 5 -Atg 16 L complex, acting as an E 3 like enzyme of Atg 8 s (LC 3) 5 Ulk 1/2 Vps 34 L 16 12 Vps 34 DFCP 1 WIPI 1/2 Initiating phagophore
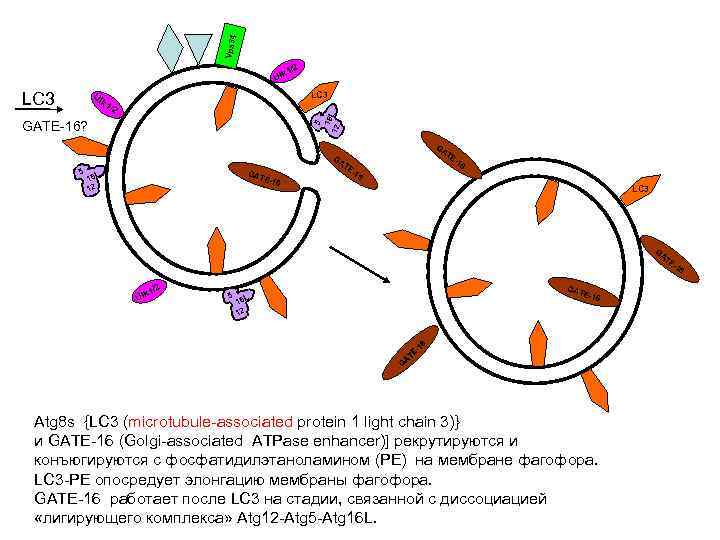
4 Vps 3 1/2 Ulk LC 3 Ul LC 3 k 1 5 16 L /2 12 GATE-16? GA TE GA 5 GAT L 16 2 1 E-16 TE -1 -1 6 6 LC 3 GA TE -1 1/2 Ulk 5 GAT E-16 L 16 12 6 -1 TE A G Atg 8 s {LC 3 (microtubule-associated protein 1 light chain 3)} и GATE-16 (Golgi-associated ATPase enhancer)] рекрутируются и конъюгируются с фосфатидилэтаноламином (PE) на мембране фагофора. LC 3 -PE опосредует элонгацию мембраны фагофора. GATE-16 работает после LC 3 на стадии, связанной с диссоциацией «лигирующего комплекса» Atg 12 -Atg 5 -Atg 16 L. 6
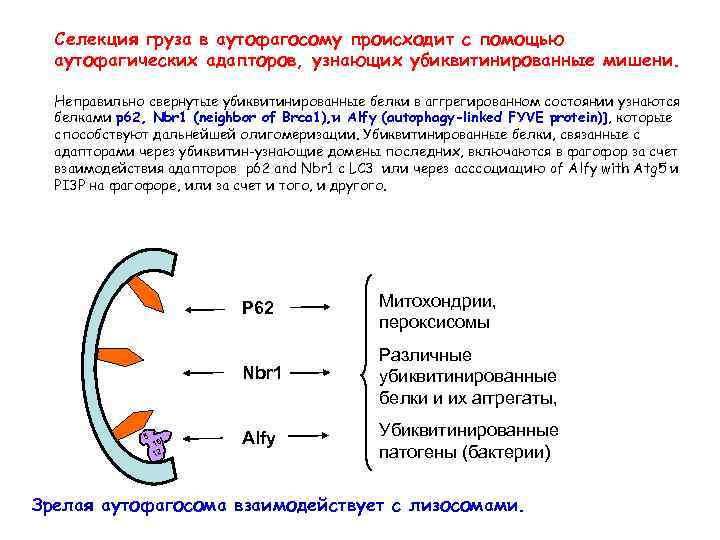
Селекция груза в аутофагосому происходит с помощью аутофагических адапторов, узнающих убиквитинированные мишени. Неправильно свернутые убиквитинированные белки в аггрегированном состоянии узнаются белками p 62, Nbr 1 (neighbor of Brca 1), и Alfy (autophagy-linked FYVE protein)], которые способствуют дальнейшей олигомеризации. Убиквитинированные белки, связанные с адапторами через убиквитин-узнающие домены последних, включаются в фагофор за счет взаимодействия адапторов p 62 and Nbr 1 с LC 3 или через асссоциацию of Alfy with Atg 5 и PI 3 P на фагофоре, или за счет и того, и другого. P 62 Nbr 1 5 L 16 2 1 Митохондрии, пероксисомы Различные убиквитинированные белки и их аггрегаты, Alfy Убиквитинированные патогены (бактерии) Зрелая аутофагосома взаимодействует с лизосомами.

Но: Возможен и убиквитин-независимый механизм доставки белков в лизосомы: в дрожжах найдено несколько белков, которые деградируют в лизосомах, не подвергаясь убиквитированию

Вопросы без ответа • 1. Каковы молекулярные механизмы, с помощью которых клетка «чувствует « недостаток аминокислот, индуцирующий аутофагию? • 2. Как формируются фагосомы? Существует ли специфическое окаймление, участвующее в искривлении мембраны при формировании аутофагосомы? • Каким образом различные аутофагические комплексы рекрутируются к специфическим сайтам формирования аутофагосом? Участвует ли в процессе увеличения мембраны секреторная машинерия? • 3. Действительно ли аутофагосомы формируются из различных источников? Отличаются ли фагосомы, сформированные из мембран ЭПР, от фагосом, возникших из митохондрии или плазматической мембраны? • Есть ли разница между аутофагосомами, сфорированными в обычных условиях роста и при воздействии стресса? • 4. Как элонгируются АФ: за счет синтеза новых фосфолипидов или за счет слияния уже существующих везикул? Каков механизм замыкания АФ? Является ли этот процесс спонтанным, или результатом увеличения мембраны, или опосредуется специальными молекулами? Что стимулирует диссоциацию комплекса Atg 12 -Atg 5 -Atg 16 с фагофора перед замыканием мембраны? • 5. Как транспортная машинерия ( например, белки слияния SNAREs) доставляются к фагофору перед его слиянием с лизосомами? Участвует ли в этом процессе амфисомы ( гибридные органеллы аутофагосомы и эндосомы)? • 6. Насколько селективно включается в АФ груз при стрессе? Действительно ли ЭПР и АГ подвержены неселективной аутофагии?

АДФ-рибозилирование
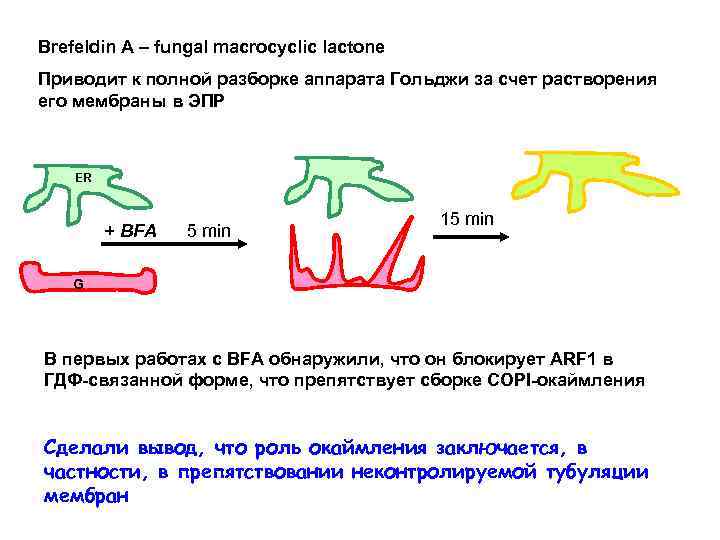
Brefeldin A – fungal macrocyclic lactone Приводит к полной разборке аппарата Гольджи за счет растворения его мембраны в ЭПР ER + BFA 5 min 15 min G В первых работах с BFA обнаружили, что он блокирует ARF 1 в ГДФ-связанной форме, что препятствует сборке СОРI-окаймления Сделали вывод, что роль окаймления заключается, в частности, в препятствовании неконтролируемой тубуляции мембран

Дальнейшие исследования эффекта BFA показали: 1. эндосомы и транс-Гольджи коллапсируют в области ЦОМТ 2. Лизосомы медленно (в течение часов) тубулируются Но на лизосомах нет ARF 1 и COPI !!! 3. Кроме того, были обнаружены клетки Ptk 1, в которых Гольджи не разбирается в ответ на добавление BFA, хотя COPI снимается с мембран Следовательно, поведение ARF 1 и COPI не являются причиной эффекта BFA

Оказалось, что в клетках, истощенных по NAD+ (источнику АДФ-рибозы), ARF 1 и COPI уходят с мембран при действии BFA, а Гольджи остается интактным Обнаружили, что BFA стимулирует АДФ-рибозилирование двух белков – BARS 50 и глицерофосфатдегидрогеназы GAPDH В норме они блокируют тубуляцию, а после АДФрибозилирования эта их функция нарушается Механизм : BARS способен ацилировать LPA, т. е. модифицировать мембранные липиды, У него есть Bar-домен, способный поддерживать высокую кривизну мембраны в тубуле а GAPDH способна взаимодействовать с микротрубочками
Везикулярный транспорт Lecture5- Ubiquitination & ADP-ribosylation.ppt