 ТЫ ИЙ ЕК КЦ Ф ЕА ЭФ Р Е ИХ ВЫ СК ЛО ЧЕ ЕП МИЯ 6 Т ИКЦИ ХЕ Л
ТЫ ИЙ ЕК КЦ Ф ЕА ЭФ Р Е ИХ ВЫ СК ЛО ЧЕ ЕП МИЯ 6 Т ИКЦИ ХЕ Л



 ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ Термодинамика изучает законы, которые описывают обмен энергией между изучаемой системой и внешней средой. Системой называют вещество или совокупность веществ, которые подвергаются теоретическому или экспериментальному изучению. Внешняя среда – вещества, окружающие систему. Переменные величины, определяющие состояние системы, называются параметрами состояния: давление, температура, объем, состав системы. Состояние системы и происходящие в ней изменения характеризуются также с помощью функций состояния, зависящих от параметров состояния и не зависящих от пути перехода системы из одного состояния в другое: внутренняя энергия, энтальпия, энтропия, свободная энергия Гиббса и др. Процессы, протекающие при постоянном давлении, - изобарные, при постоянном объеме – изохорные, при постоянной температуре – изотермические.
ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ Термодинамика изучает законы, которые описывают обмен энергией между изучаемой системой и внешней средой. Системой называют вещество или совокупность веществ, которые подвергаются теоретическому или экспериментальному изучению. Внешняя среда – вещества, окружающие систему. Переменные величины, определяющие состояние системы, называются параметрами состояния: давление, температура, объем, состав системы. Состояние системы и происходящие в ней изменения характеризуются также с помощью функций состояния, зависящих от параметров состояния и не зависящих от пути перехода системы из одного состояния в другое: внутренняя энергия, энтальпия, энтропия, свободная энергия Гиббса и др. Процессы, протекающие при постоянном давлении, - изобарные, при постоянном объеме – изохорные, при постоянной температуре – изотермические.


 ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ Энергия не возникает из ничего и не исчезает бесследно, а только переходит из одной формы в другую. Первый закон термодинамики также называют законом сохранения энергии.
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ Энергия не возникает из ничего и не исчезает бесследно, а только переходит из одной формы в другую. Первый закон термодинамики также называют законом сохранения энергии.

 Может обмениваться с окружающей средой массой и энергией.
Может обмениваться с окружающей средой массой и энергией.
 Может обмениваться с окружающей средой энергией, но не массой.
Может обмениваться с окружающей средой энергией, но не массой.
 Не может обмениваться с окружающей средой ни массой, ни энергией.
Не может обмениваться с окружающей средой ни массой, ни энергией.



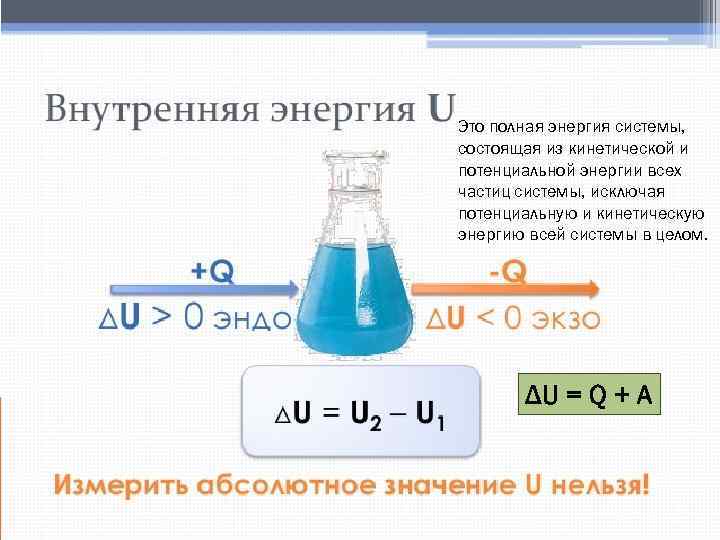 Это полная энергия системы, состоящая из кинетической и потенциальной энергии всех частиц системы, исключая потенциальную и кинетическую энергию всей системы в целом. ΔU = Q + A
Это полная энергия системы, состоящая из кинетической и потенциальной энергии всех частиц системы, исключая потенциальную и кинетическую энергию всей системы в целом. ΔU = Q + A

 ИЗМЕРЕНИЕ ТЕПЛОВЫХ ЭФФЕКТОВ Для экспериментального определения тепловых эффектов реакций используют калориметры. О количестве выделившейся теплоты судят по повышению температуры жидкости. Количество теплоты Q = mc(t 2 - t 1), где m – масса воды в калориметре, c – её удельная теплоемкость, t 1 – температура воды до начала реакции и t 2 – температура воды по окончании реакции.
ИЗМЕРЕНИЕ ТЕПЛОВЫХ ЭФФЕКТОВ Для экспериментального определения тепловых эффектов реакций используют калориметры. О количестве выделившейся теплоты судят по повышению температуры жидкости. Количество теплоты Q = mc(t 2 - t 1), где m – масса воды в калориметре, c – её удельная теплоемкость, t 1 – температура воды до начала реакции и t 2 – температура воды по окончании реакции.



 ЗАКОН ЛАВУАЗЬЕ-ЛАПЛАСА Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком. 2 H 2(г) + O 2(г) 2 H 2 О(ж) + 572 к. Дж (горение водорода в кислороде) 2 H 2 О(ж) + 572 к. Дж = 2 H 2(г) + O 2(г) (разложение воды электрическим током) 2 H 2 О(ж) = 2 H 2(г) + O 2(г) - 572 к. Дж Тепловой эффект зависит от природы реагирующих веществ и от их количества: 2 H 2(г) + O 2(г) 2 H 2 О(ж) + 572 к. Дж H 2 + 1/2 O 2 = H 2 O + 286 к. Дж
ЗАКОН ЛАВУАЗЬЕ-ЛАПЛАСА Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком. 2 H 2(г) + O 2(г) 2 H 2 О(ж) + 572 к. Дж (горение водорода в кислороде) 2 H 2 О(ж) + 572 к. Дж = 2 H 2(г) + O 2(г) (разложение воды электрическим током) 2 H 2 О(ж) = 2 H 2(г) + O 2(г) - 572 к. Дж Тепловой эффект зависит от природы реагирующих веществ и от их количества: 2 H 2(г) + O 2(г) 2 H 2 О(ж) + 572 к. Дж H 2 + 1/2 O 2 = H 2 O + 286 к. Дж

 ТЕПЛОТА И ЭНТАЛЬПИЯ Энтальпия (теплосодержание) — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении. Энтальпия характеризует запас энергии в веществе. H = U + p. V ΔH = ΔU + p ΔV Теплота и энтальпия реакции равны по модулю, но противоположны по знаку (при постоянном давлении). ΔН = - Qр Термохимические уравнения можно записывать двумя способами:
ТЕПЛОТА И ЭНТАЛЬПИЯ Энтальпия (теплосодержание) — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении. Энтальпия характеризует запас энергии в веществе. H = U + p. V ΔH = ΔU + p ΔV Теплота и энтальпия реакции равны по модулю, но противоположны по знаку (при постоянном давлении). ΔН = - Qр Термохимические уравнения можно записывать двумя способами:

 ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ
ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ






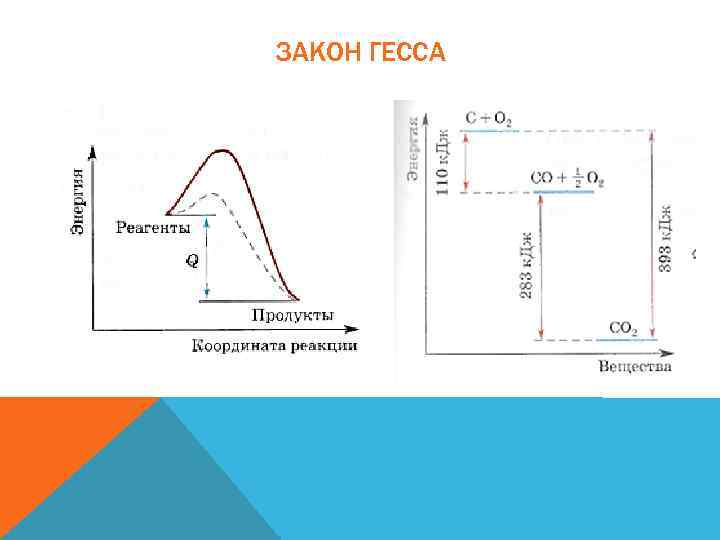 ЗАКОН ГЕССА
ЗАКОН ГЕССА


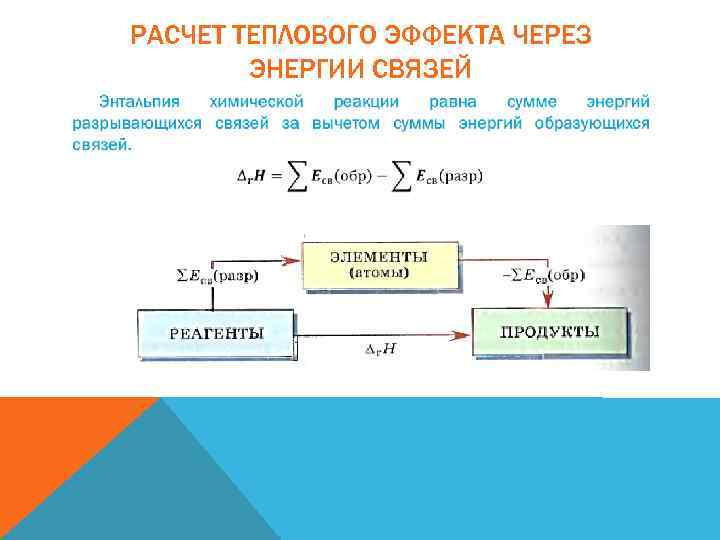 РАСЧЕТ ТЕПЛОВОГО ЭФФЕКТА ЧЕРЕЗ ЭНЕРГИИ СВЯЗЕЙ
РАСЧЕТ ТЕПЛОВОГО ЭФФЕКТА ЧЕРЕЗ ЭНЕРГИИ СВЯЗЕЙ
 А! К ТИ К А ЕП Т РЬ Е РА П
А! К ТИ К А ЕП Т РЬ Е РА П


