01-Кристаллы-53.pptx
- Количество слайдов: 60
 Твердые тела
Твердые тела
 Твердые тела: АМОРФНЫЕ и КРИСТАЛЛИЧЕСКИЕ
Твердые тела: АМОРФНЫЕ и КРИСТАЛЛИЧЕСКИЕ
 Свойства аморфных тел
Свойства аморфных тел
 • Аморфные тела образуются при быстром остывании расплава.
• Аморфные тела образуются при быстром остывании расплава.
 • Есть ближний порядок, нет дальнего;
• Есть ближний порядок, нет дальнего;
 • Нет точки плавления.
• Нет точки плавления.
 • Физические свойства аморфных тел одинаковы по всем направлениям, это называется изотропия;
• Физические свойства аморфных тел одинаковы по всем направлениям, это называется изотропия;
 • Механические свойства - вязкоупругие: при ударах ведут себя как твёрдые вещества и раскалываются на куски; при очень продолжительном воздействии аморфные вещества текут.
• Механические свойства - вязкоупругие: при ударах ведут себя как твёрдые вещества и раскалываются на куски; при очень продолжительном воздействии аморфные вещества текут.
 Свойства кристаллов
Свойства кристаллов
 Кристаллическая решетка – это математическая абстракция Кристаллическая структура – это физический объект
Кристаллическая решетка – это математическая абстракция Кристаллическая структура – это физический объект
 Кристаллы разделяют на 2 группы: Поликристаллы и монокристаллы
Кристаллы разделяют на 2 группы: Поликристаллы и монокристаллы
 Поликристаллы
Поликристаллы
 Поликристаллы состоят из множества монокристаллических зерен: Поликристаллы изотропны.
Поликристаллы состоят из множества монокристаллических зерен: Поликристаллы изотропны.
 Монокристаллы
Монокристаллы
 • Монокристаллы – единая кристаллическая решетка. • Монокристаллы анизотропны:
• Монокристаллы – единая кристаллическая решетка. • Монокристаллы анизотропны:
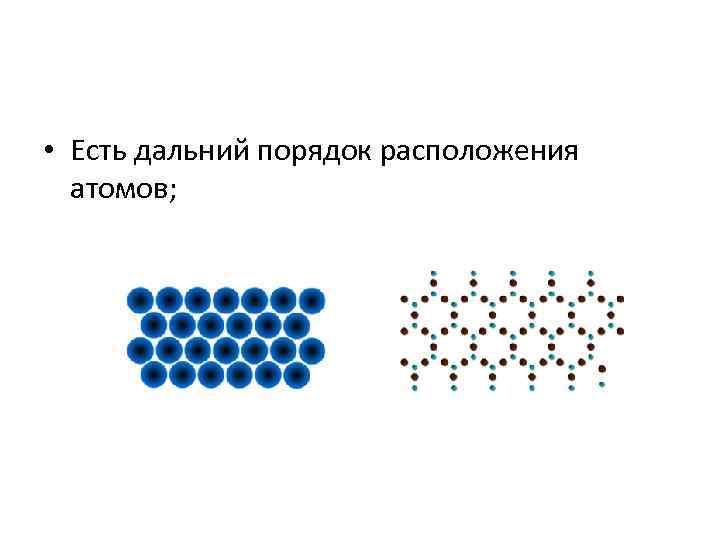 • Есть дальний порядок расположения атомов;
• Есть дальний порядок расположения атомов;
 • Симметрия кристаллической решетки — свойство совмещаться с собой при пространственных перемещениях • Идеальный кристалл - периодически повторяющиеся в пространстве элементарные ячейки
• Симметрия кристаллической решетки — свойство совмещаться с собой при пространственных перемещениях • Идеальный кристалл - периодически повторяющиеся в пространстве элементарные ячейки
 • Существует 14 типов кристаллических решеток, называемых «решетки Бравэ» , они группируются в 7 систем, называемых «сингонии» .
• Существует 14 типов кристаллических решеток, называемых «решетки Бравэ» , они группируются в 7 систем, называемых «сингонии» .
 • Каждая система имеет свои соотношения между сторонами элементарной ячейки a, b и c и кристаллографическими углами α, β и γ.
• Каждая система имеет свои соотношения между сторонами элементарной ячейки a, b и c и кристаллографическими углами α, β и γ.
 Решетки Бравэ • Разновидности: примитивная – (П), объемноцентрированная (ОЦ), гранецентрированная (ГЦ):
Решетки Бравэ • Разновидности: примитивная – (П), объемноцентрированная (ОЦ), гранецентрированная (ГЦ):
 Соотношение между сторонами и углами для решеток Браве система Соотношение между сторонами Соотношение между углами Триклинная а≠b≠с α≠β≠γ Моноклинная а≠b≠с α=γ=90°≠β Ромбическая а≠b≠с α=β=γ=90° Тетрагональная а=b≠с α=β=γ=90° Кубическая а=b=с α=β=γ=90° Тригональная а=b=с α=β=γ<120°, ≠ 90° Гексагональная а=b≠с α=β=90°, γ=120°
Соотношение между сторонами и углами для решеток Браве система Соотношение между сторонами Соотношение между углами Триклинная а≠b≠с α≠β≠γ Моноклинная а≠b≠с α=γ=90°≠β Ромбическая а≠b≠с α=β=γ=90° Тетрагональная а=b≠с α=β=γ=90° Кубическая а=b=с α=β=γ=90° Тригональная а=b=с α=β=γ<120°, ≠ 90° Гексагональная а=b≠с α=β=90°, γ=120°
 Пример формы решеток Бравэ:
Пример формы решеток Бравэ:
 Индексы Миллера (кристаллографические индексы)
Индексы Миллера (кристаллографические индексы)
 • Служат для обозначения атомных плоскостей; • Выражаются простыми числами в круглых скобках; • Общее обозначение плоскости: (hkl)
• Служат для обозначения атомных плоскостей; • Выражаются простыми числами в круглых скобках; • Общее обозначение плоскости: (hkl)
 • Совокупность симметричных граней кристалла обозначается: {h k l}
• Совокупность симметричных граней кристалла обозначается: {h k l}
 • Равенство нулю индексов Миллера означает, что плоскости параллельны осям.
• Равенство нулю индексов Миллера означает, что плоскости параллельны осям.
 Координационное число • Это число ближайших однотипных соседних атомов. • Модели - система плотной упаковки шаров.
Координационное число • Это число ближайших однотипных соседних атомов. • Модели - система плотной упаковки шаров.

 По физическим признакам кристаллы разделяются на четыре типа: • ионные, • атомные, • металлические, • молекулярные.
По физическим признакам кристаллы разделяются на четыре типа: • ионные, • атомные, • металлические, • молекулярные.
 Ионные кристаллы
Ионные кристаллы
 • Na. Cl, Cs. Cl, KBr и т. д. , а также Mg. O, Ca. O и т. д. • Силы взаимодействия между ионами – кулоновские. • Связь – ионная. • Кристалл представляет собой одну гигантскую молекулу.
• Na. Cl, Cs. Cl, KBr и т. д. , а также Mg. O, Ca. O и т. д. • Силы взаимодействия между ионами – кулоновские. • Связь – ионная. • Кристалл представляет собой одну гигантскую молекулу.

 Металлические кристаллы
Металлические кристаллы
 • В узлах решетки - положительные ионы металла. • Валентные электроны отделяются от атомов и коллективизируются.
• В узлах решетки - положительные ионы металла. • Валентные электроны отделяются от атомов и коллективизируются.
 • Между положительными ионами , подобно молекулам газа, движутся «свободные» электроны
• Между положительными ионами , подобно молекулам газа, движутся «свободные» электроны
 • Большинство металлов (Li, Na, К, Rb, Cs, Си, Ag, Pt, Аu) имеют кубическую решетку.
• Большинство металлов (Li, Na, К, Rb, Cs, Си, Ag, Pt, Аu) имеют кубическую решетку.
 • Чаще всего металлы встречаются в виде поликристаллов.
• Чаще всего металлы встречаются в виде поликристаллов.
 Молекулярные кристаллы
Молекулярные кристаллы
 Парафин, спирт; инертные газы (Ne, Аг, Кг, Хе) ; газы СО 2, N 2 твердом состоянии; лед; кристаллы брома Вг, иода I.
Парафин, спирт; инертные газы (Ne, Аг, Кг, Хе) ; газы СО 2, N 2 твердом состоянии; лед; кристаллы брома Вг, иода I.
 • Связь - ван-дер-ваальсовыми силами (обусловлены незначительным взаимным смещением электронов в электронных оболочках атомов. )
• Связь - ван-дер-ваальсовыми силами (обусловлены незначительным взаимным смещением электронов в электронных оболочках атомов. )
 • Силы слабые, поэтому молекулярные кристаллы легко деформируются.
• Силы слабые, поэтому молекулярные кристаллы легко деформируются.
 Атомные кристаллы
Атомные кристаллы
 • Zn. S, Be. O и т. д. , Полупроводники — германий Ge и кремний Si, Алмаз, графит, графен, фуллерены. • В узлах кристаллической решетки - нейтральные атомы. • Связь – ковалентная.
• Zn. S, Be. O и т. д. , Полупроводники — германий Ge и кремний Si, Алмаз, графит, графен, фуллерены. • В узлах кристаллической решетки - нейтральные атомы. • Связь – ковалентная.
 Структурные формы углерода
Структурные формы углерода



 Структура графена
Структура графена





 Солитон
Солитон


 • СОЛИТОН - структурно устойчивая уединённая волна. • Солитоны ведут себя подобно частицам: при взаимодействии между собой или с другими возмущениями они не разрушаются, а расходятся, сохраняя свою структуру неизменной.
• СОЛИТОН - структурно устойчивая уединённая волна. • Солитоны ведут себя подобно частицам: при взаимодействии между собой или с другими возмущениями они не разрушаются, а расходятся, сохраняя свою структуру неизменной.

 • Квантовая электронная волна, полученная путем генерации ультракоротких электрических импульсов, была названа левитоном. • Она распространяется без генерации шума или деформации, таким же способом, как и другие одиночные оптические и гидродинамические волны (солитоны).
• Квантовая электронная волна, полученная путем генерации ультракоротких электрических импульсов, была названа левитоном. • Она распространяется без генерации шума или деформации, таким же способом, как и другие одиночные оптические и гидродинамические волны (солитоны).



