 Триада железа Fe, Co, Ni
Триада железа Fe, Co, Ni
![Fe Co Ni [Ar]3 d 64 s 2 [Ar]3 d 74 s 2 [Ar]3 Fe Co Ni [Ar]3 d 64 s 2 [Ar]3 d 74 s 2 [Ar]3](https://present5.com/presentation/1/32530824_185376688.pdf-img/32530824_185376688.pdf-2.jpg) Fe Co Ni [Ar]3 d 64 s 2 [Ar]3 d 74 s 2 [Ar]3 d 84 s 2 АР, нм 0. 126 0. 125 0. 124 ИР, нм 0. 080 0. 078 0. 076 7. 89 7. 87 7. 63 4 1 5 Электронная конфигирация I, э. В Число стабильных изотопов
Fe Co Ni [Ar]3 d 64 s 2 [Ar]3 d 74 s 2 [Ar]3 d 84 s 2 АР, нм 0. 126 0. 125 0. 124 ИР, нм 0. 080 0. 078 0. 076 7. 89 7. 87 7. 63 4 1 5 Электронная конфигирация I, э. В Число стабильных изотопов
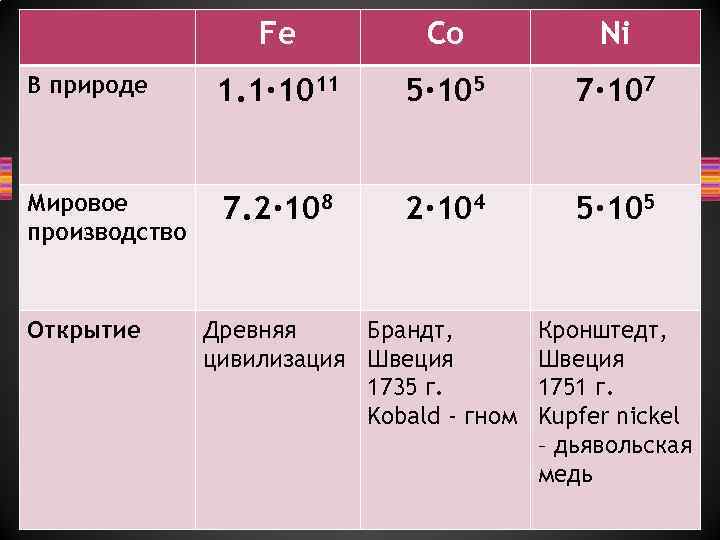 Fe Co Ni В природе 1. 1∙ 1011 5∙ 105 7∙ 107 Мировое производство 7. 2∙ 108 2∙ 104 5∙ 105 Открытие Древняя Брандт, цивилизация Швеция 1735 г. Kobald - гном Кронштедт, Швеция 1751 г. Kupfer nickel – дьявольская медь
Fe Co Ni В природе 1. 1∙ 1011 5∙ 105 7∙ 107 Мировое производство 7. 2∙ 108 2∙ 104 5∙ 105 Открытие Древняя Брандт, цивилизация Швеция 1735 г. Kobald - гном Кронштедт, Швеция 1751 г. Kupfer nickel – дьявольская медь
 Fe Руды Магнетит Fe 3 O 4 Гематит – Fe 2 O 3 Сидерит Fe. CO 3 Пирит - Fe. S 2 Оливин – (Mg, Fe)2 Si. O 4 Co Ni Кобальтин – Никелин Со. As. S Ni. As Скуттерудит – Co. As 3
Fe Руды Магнетит Fe 3 O 4 Гематит – Fe 2 O 3 Сидерит Fe. CO 3 Пирит - Fe. S 2 Оливин – (Mg, Fe)2 Si. O 4 Co Ni Кобальтин – Никелин Со. As. S Ni. As Скуттерудит – Co. As 3
 • • • Сплавы железа Чугун(2 -5% углерода) tплавления 11001200 0 С. Белый чугун (хрупкий) –цементит Fe 3 C (6, 68% С) Серый чугун –углерод в виде пластинок графита Ковкий чугун –углерод в виде зерен графита Ковкое железо (0, 04 -1, 5% углерода) Сталь(0, 5 -1, 7% углерода)
• • • Сплавы железа Чугун(2 -5% углерода) tплавления 11001200 0 С. Белый чугун (хрупкий) –цементит Fe 3 C (6, 68% С) Серый чугун –углерод в виде пластинок графита Ковкий чугун –углерод в виде зерен графита Ковкое железо (0, 04 -1, 5% углерода) Сталь(0, 5 -1, 7% углерода)
 Дамасская сталь (булат)
Дамасская сталь (булат)
 ПОЛУЧЕНИЕ ЖЕЛЕЗА ДОМЕННАЯ ПЕЧЬ
ПОЛУЧЕНИЕ ЖЕЛЕЗА ДОМЕННАЯ ПЕЧЬ
 В печи углерод кокса окисляется до монооксида углерода (угарного газа) кислородом воздуха: 2 C + O 2 = 2 CO↑ Угарный газ восстанавливает железо из руды: 3 CO + Fe 2 O 3 = 2 Fe + 3 CO 2↑ Действие флюса: карбонат кальция под действием тепла разлагается до оксида кальция (негашёная известь): Ca. CO 3 = Ca. O + CO 2↑ Оксид кальция соединяется с диоксидом кремния, образуя шлак: Ca. O + Si. O 2 = Ca. Si. O 3 МАРТЕНОВСКАЯ ПЕЧЬ Fe 3 O 4 + CH 4 = 3 Fe + CO 2 + 2 H 2 O
В печи углерод кокса окисляется до монооксида углерода (угарного газа) кислородом воздуха: 2 C + O 2 = 2 CO↑ Угарный газ восстанавливает железо из руды: 3 CO + Fe 2 O 3 = 2 Fe + 3 CO 2↑ Действие флюса: карбонат кальция под действием тепла разлагается до оксида кальция (негашёная известь): Ca. CO 3 = Ca. O + CO 2↑ Оксид кальция соединяется с диоксидом кремния, образуя шлак: Ca. O + Si. O 2 = Ca. Si. O 3 МАРТЕНОВСКАЯ ПЕЧЬ Fe 3 O 4 + CH 4 = 3 Fe + CO 2 + 2 H 2 O
 ХИМИЧЕСКИЕ СВОЙСТВА • Характерная степень окисления +3, соединения со степенью окисления +2, менее стойки. Железо взаимодействует практически со всеми неметаллами, кроме азота: 2 Fe + 3 Cl 2 = 2 Fe. Cl 3 4 Fe + 3 O 2 = 2 Fe 2 O 3 Fe + S = Fe. S • Под действием воды и кислорода образуется гидроксид железа: 4 Fe + 3 O 2 + 6 H 2 O = 4 Fe(OH)3
ХИМИЧЕСКИЕ СВОЙСТВА • Характерная степень окисления +3, соединения со степенью окисления +2, менее стойки. Железо взаимодействует практически со всеми неметаллами, кроме азота: 2 Fe + 3 Cl 2 = 2 Fe. Cl 3 4 Fe + 3 O 2 = 2 Fe 2 O 3 Fe + S = Fe. S • Под действием воды и кислорода образуется гидроксид железа: 4 Fe + 3 O 2 + 6 H 2 O = 4 Fe(OH)3
 • Легко идут реакции с разбавленными кислотами: Fe + 2 HCl = Fe. Cl 2 + H 2 8 Fe + 30 HNO 3 = 8 Fe(NO 3)3 + 3 NH 4 NO 3 + + 9 H 2 O Концентрированные HNO 3 и холодная H 2 SO 4 пассивируют железо. Горячая серная кислота растворяет железо: 2 Fe + 6 H 2 SO 4(к) = Fe 2(SO 4)3 + 3 SO 2 + 6 H 2 O
• Легко идут реакции с разбавленными кислотами: Fe + 2 HCl = Fe. Cl 2 + H 2 8 Fe + 30 HNO 3 = 8 Fe(NO 3)3 + 3 NH 4 NO 3 + + 9 H 2 O Концентрированные HNO 3 и холодная H 2 SO 4 пассивируют железо. Горячая серная кислота растворяет железо: 2 Fe + 6 H 2 SO 4(к) = Fe 2(SO 4)3 + 3 SO 2 + 6 H 2 O
 Кислородные соединения железа: • а) Fe. O - получается косвенным путем: Fe 2 O 3 + CO = 2 Fe. O + CO 2 • это основной оксид, которому соответствует гидроксид Fe(OH)2 - соединение зеленого цвета, плохо диссоциирующее основание, легко окисляющееся на воздухе: 4 Fe(OH)2 + O 2 + 2 H 2 O = 4 Fe(OH)3 • Соли Fe+2 тоже неустойчивы и являются сильными восстановителями: 4 Fe. SO 4 + O 2 + 2 H 2 O = 4 Fe. OHSO 4 10 Fe. SO 4 + 2 KMn. O 4 + 8 H 2 SO 4 = 5 Fe 2(SO 4)3 + 2 Mn. SO 4 + K 2 SO 4 + 8 H 2 O
Кислородные соединения железа: • а) Fe. O - получается косвенным путем: Fe 2 O 3 + CO = 2 Fe. O + CO 2 • это основной оксид, которому соответствует гидроксид Fe(OH)2 - соединение зеленого цвета, плохо диссоциирующее основание, легко окисляющееся на воздухе: 4 Fe(OH)2 + O 2 + 2 H 2 O = 4 Fe(OH)3 • Соли Fe+2 тоже неустойчивы и являются сильными восстановителями: 4 Fe. SO 4 + O 2 + 2 H 2 O = 4 Fe. OHSO 4 10 Fe. SO 4 + 2 KMn. O 4 + 8 H 2 SO 4 = 5 Fe 2(SO 4)3 + 2 Mn. SO 4 + K 2 SO 4 + 8 H 2 O
 • б) Fe 2 O 3 - получается прямым окислением кислородом, проявляет амфотерные свойства: Fe 2 O 3 + 6 HCl = 2 Fe. Cl 3 + 3 H 2 O Fe 2 O 3 + Na 2 CO 3 = 2 Na. Fe. O 2 + CO 2 (сплавление) • Na. Fe. O 2 (феррит натрия) - соль несуществующей железистой кислоты, нацело гидролизуется: 2 Na. Fe. O 2 + H 2 O = Fe 2 O 3 + 2 Na. OH
• б) Fe 2 O 3 - получается прямым окислением кислородом, проявляет амфотерные свойства: Fe 2 O 3 + 6 HCl = 2 Fe. Cl 3 + 3 H 2 O Fe 2 O 3 + Na 2 CO 3 = 2 Na. Fe. O 2 + CO 2 (сплавление) • Na. Fe. O 2 (феррит натрия) - соль несуществующей железистой кислоты, нацело гидролизуется: 2 Na. Fe. O 2 + H 2 O = Fe 2 O 3 + 2 Na. OH
 • Можно получить железо и в более высокой степени окисления: Fe 2 O 3 + 3 KNO 3 + 4 Na. OH = 2 Na 2 Fe. O 4 + 3 KNO 2 + 2 H 2 O • Na 2 Fe. O 4(феррат натрия) - соль неполученной железной кислоты, сильнейший окислитель, даже при взаимодействии с водой вытесняет кислород: 4 Na 2 Fe. O 4 + 10 H 2 O = 4 Fe(OH)3 + 8 Na. OH + 3 O 2
• Можно получить железо и в более высокой степени окисления: Fe 2 O 3 + 3 KNO 3 + 4 Na. OH = 2 Na 2 Fe. O 4 + 3 KNO 2 + 2 H 2 O • Na 2 Fe. O 4(феррат натрия) - соль неполученной железной кислоты, сильнейший окислитель, даже при взаимодействии с водой вытесняет кислород: 4 Na 2 Fe. O 4 + 10 H 2 O = 4 Fe(OH)3 + 8 Na. OH + 3 O 2
 • В виде порошка Fe 2 O 3 используется как краска (железный сурик, мумия, охра), входит в состав термитной смеси (2 Al+Fe 2 O 3), которая применяется для сварки рельс, стальных и чугунных станин и т. д. , а также для начинки термитных авиабомб и снарядов, так как при реакции восстановления железа алюминием освобождается большое количество энергии и температура в зоне реакции достигает 3000 о. С: 2 Al + Fe 2 O 3 = Al 2 O 3 + 2 Fe + 847, 3 кдж/моль
• В виде порошка Fe 2 O 3 используется как краска (железный сурик, мумия, охра), входит в состав термитной смеси (2 Al+Fe 2 O 3), которая применяется для сварки рельс, стальных и чугунных станин и т. д. , а также для начинки термитных авиабомб и снарядов, так как при реакции восстановления железа алюминием освобождается большое количество энергии и температура в зоне реакции достигает 3000 о. С: 2 Al + Fe 2 O 3 = Al 2 O 3 + 2 Fe + 847, 3 кдж/моль
 • Гидроксид железа III в виде хлопьевидного бурого осадка получается под действием щелочей или углекислых солей щелочных металлов на растворы солей трехвалентного железа: 3 Na 2 CO 3 + 2 Fe. Cl 3 + 3 H 2 O = 2 Fe(OH)3 + 6 Na. Cl + 3 CO 2 • Обладает амфотерными свойствами. Основные его свойства выражаются в более трудной растворимости в щелочах, чем в кислотах и в способности образовывать соли типа квасцов K 2 SO 4. Fe 2(SO 4)3. 24 H 2 O.
• Гидроксид железа III в виде хлопьевидного бурого осадка получается под действием щелочей или углекислых солей щелочных металлов на растворы солей трехвалентного железа: 3 Na 2 CO 3 + 2 Fe. Cl 3 + 3 H 2 O = 2 Fe(OH)3 + 6 Na. Cl + 3 CO 2 • Обладает амфотерными свойствами. Основные его свойства выражаются в более трудной растворимости в щелочах, чем в кислотах и в способности образовывать соли типа квасцов K 2 SO 4. Fe 2(SO 4)3. 24 H 2 O.
 • в) Fe 3 O 4 (Fe. O. Fe 2 O 3) - в лабораторных условиях может быть получена нагреванием железа на воздухе или окислением его водяным паром, в технике образуется при ковке железа. Синевато-черного цвета вещество, магнитно, проводит электрический ток. Кислород и хлор на него не действуют даже при нагревании. В сильных кислотах Fe 3 O 4 растворяется при нагревании, причем сначала растворяется оксид железа II, а после этого, оксид железа III.
• в) Fe 3 O 4 (Fe. O. Fe 2 O 3) - в лабораторных условиях может быть получена нагреванием железа на воздухе или окислением его водяным паром, в технике образуется при ковке железа. Синевато-черного цвета вещество, магнитно, проводит электрический ток. Кислород и хлор на него не действуют даже при нагревании. В сильных кислотах Fe 3 O 4 растворяется при нагревании, причем сначала растворяется оксид железа II, а после этого, оксид железа III.
 • С оксидом углерода II железо образует карбонилы. Их получают непосредственным взаимодействием мелкораздробленного, свежевосстановленного водородом железа из Fe 2 O 3 с СО при нагревании и повышенном давлении. Полученный таким способом пентакарбонил железа отвечает формуле [Fe(CO)5]. При обычной температуре - жидкость, желтоватого цвета. На свету пентакарбонил железа разлагается по уравнению: 2[Fe(CO)5] = [Fe 2(CO)9] + CO • В темноте [Fe 2(CO)9] снова переходит в [Fe(CO)5]. Тетракарбонил железа [Fe(CO)4]3, получается при нагревании железа в толуоле в атмосфере СО.
• С оксидом углерода II железо образует карбонилы. Их получают непосредственным взаимодействием мелкораздробленного, свежевосстановленного водородом железа из Fe 2 O 3 с СО при нагревании и повышенном давлении. Полученный таким способом пентакарбонил железа отвечает формуле [Fe(CO)5]. При обычной температуре - жидкость, желтоватого цвета. На свету пентакарбонил железа разлагается по уравнению: 2[Fe(CO)5] = [Fe 2(CO)9] + CO • В темноте [Fe 2(CO)9] снова переходит в [Fe(CO)5]. Тетракарбонил железа [Fe(CO)4]3, получается при нагревании железа в толуоле в атмосфере СО.
![• Из других комплексных соединений железа наиболее важными являются: K 4[Fe(CN)6] – гексацианоферрат(II) • Из других комплексных соединений железа наиболее важными являются: K 4[Fe(CN)6] – гексацианоферрат(II)](https://present5.com/presentation/1/32530824_185376688.pdf-img/32530824_185376688.pdf-18.jpg) • Из других комплексных соединений железа наиболее важными являются: K 4[Fe(CN)6] – гексацианоферрат(II) калия (желтая кровяная соль) и K 3[Fe(CN)6] – гексацианоферрат(III) калия (красная кровяная соль). Эти соединения являются индикаторами на ионы Fe+2 и Fe+3: 4 Fe. Cl 3 + 3 K 4[Fe(CN)6] = Fe 4[Fe(CN)6]3 + 12 KCl • Fe 4[Fe(CN)6]3 - темно-синий осадок, называемый "берлинской лазурью". 3 Fe. Cl 2 + 2 K 3[Fe(CN)6] = Fe 3[Fe(CN)6]2 + 6 KCl • Fe 3[Fe(CN)6]2 - синий осадок, называемый "турнбулевой синью".
• Из других комплексных соединений железа наиболее важными являются: K 4[Fe(CN)6] – гексацианоферрат(II) калия (желтая кровяная соль) и K 3[Fe(CN)6] – гексацианоферрат(III) калия (красная кровяная соль). Эти соединения являются индикаторами на ионы Fe+2 и Fe+3: 4 Fe. Cl 3 + 3 K 4[Fe(CN)6] = Fe 4[Fe(CN)6]3 + 12 KCl • Fe 4[Fe(CN)6]3 - темно-синий осадок, называемый "берлинской лазурью". 3 Fe. Cl 2 + 2 K 3[Fe(CN)6] = Fe 3[Fe(CN)6]2 + 6 KCl • Fe 3[Fe(CN)6]2 - синий осадок, называемый "турнбулевой синью".
 Магнитореологическая жидкость
Магнитореологическая жидкость
![• Fe 3+ + [Fe. II(CN)6]4 - = Fe. III[Fe. II(CN)6]31 • берлинская • Fe 3+ + [Fe. II(CN)6]4 - = Fe. III[Fe. II(CN)6]31 • берлинская](https://present5.com/presentation/1/32530824_185376688.pdf-img/32530824_185376688.pdf-20.jpg) • Fe 3+ + [Fe. II(CN)6]4 - = Fe. III[Fe. II(CN)6]31 • берлинская лазурь • Fe 2+ + [Fe. III(CN)6]3 - = Fe. II[Fe. III(CN)6]21 • турнбулева синь
• Fe 3+ + [Fe. II(CN)6]4 - = Fe. III[Fe. II(CN)6]31 • берлинская лазурь • Fe 2+ + [Fe. III(CN)6]3 - = Fe. II[Fe. III(CN)6]21 • турнбулева синь
 Кобальт, никель
Кобальт, никель
 ХИМИЧЕСКИЕ СВОЙСТВА • Наиболее характерная степень окисления +2, подобно железу взаимодействуют с галогенами, серой, фосфором. Не вступают в реакции с углеродом, азотом, водородом. • Кислородные соединения в низшей степени окисления можно получить либо непосредственным окислением, либо термическим разложением гидроксидов: 2 Co + O 2 = 2 Co. O Ni(OH)2 = Ni. O + H 2 O
ХИМИЧЕСКИЕ СВОЙСТВА • Наиболее характерная степень окисления +2, подобно железу взаимодействуют с галогенами, серой, фосфором. Не вступают в реакции с углеродом, азотом, водородом. • Кислородные соединения в низшей степени окисления можно получить либо непосредственным окислением, либо термическим разложением гидроксидов: 2 Co + O 2 = 2 Co. O Ni(OH)2 = Ni. O + H 2 O
 Гжель – синий цвет эмали и глазури Co. Cl 2∙ 6 H 2 O Co. Cl 2∙ 4 H 2 O розово-малиновый о 49 С Co. Cl 2∙ 2 H 2 O сине-фиолетовый розовый Co. Cl 2∙H 2 O о 90 С голубой Co. Cl 2
Гжель – синий цвет эмали и глазури Co. Cl 2∙ 6 H 2 O Co. Cl 2∙ 4 H 2 O розово-малиновый о 49 С Co. Cl 2∙ 2 H 2 O сине-фиолетовый розовый Co. Cl 2∙H 2 O о 90 С голубой Co. Cl 2
 • Co. O и Ni. O - вещества черного цвета, основного характера, соответствующие им гидроксиды Co(OH)2 - розо-серого цвета и Ni(OH)2 - зеленого цвета - слабые основания, нерастворимые в воде. • Двухвалентные соединения кобальта и никеля можно перевести в трехвалентные действием окислителей: 2 Co(OH)2 + H 2 O 2 = 2 Co(OH)3 2 Ni(OH)2 + Br 2 + 2 Na. OH = 2 Ni(OH)3 + 2 Na. Br
• Co. O и Ni. O - вещества черного цвета, основного характера, соответствующие им гидроксиды Co(OH)2 - розо-серого цвета и Ni(OH)2 - зеленого цвета - слабые основания, нерастворимые в воде. • Двухвалентные соединения кобальта и никеля можно перевести в трехвалентные действием окислителей: 2 Co(OH)2 + H 2 O 2 = 2 Co(OH)3 2 Ni(OH)2 + Br 2 + 2 Na. OH = 2 Ni(OH)3 + 2 Na. Br
 • При прокаливании полученных гидроксидов образуются оксиды в высшей степени окисления Co 2 O 3 и Ni 2 O 3 - вещества черного цвета, при их взаимодействии с кислотами не получаются соли трехвалентных элементов, т. к. они выступают как сильнейшие окислители: Co 2 O 3 + 6 HCl = 2 Co. Cl 2 + 3 H 2 O 2 Ni 2 O 3 + 4 H 2 SO 4 = 4 Ni. SO 4 + O 2 + 4 H 2 O
• При прокаливании полученных гидроксидов образуются оксиды в высшей степени окисления Co 2 O 3 и Ni 2 O 3 - вещества черного цвета, при их взаимодействии с кислотами не получаются соли трехвалентных элементов, т. к. они выступают как сильнейшие окислители: Co 2 O 3 + 6 HCl = 2 Co. Cl 2 + 3 H 2 O 2 Ni 2 O 3 + 4 H 2 SO 4 = 4 Ni. SO 4 + O 2 + 4 H 2 O
 • На окислительных свойствах Ni+3 основана работа железо-никелевого щелочного аккумулятора, который состоит из двух пластин, одна из которых заполнена Ni 2 O 3 или Ni(OH)3, а вторая порошком железа. Процессы, протекающие на электродах следующие: • Эти аккумуляторы стабильнее свинцовых, но их ЭДС не превышает 1, 5 в.
• На окислительных свойствах Ni+3 основана работа железо-никелевого щелочного аккумулятора, который состоит из двух пластин, одна из которых заполнена Ni 2 O 3 или Ni(OH)3, а вторая порошком железа. Процессы, протекающие на электродах следующие: • Эти аккумуляторы стабильнее свинцовых, но их ЭДС не превышает 1, 5 в.


