Трансплонтация почки у больных СД.pptx
- Количество слайдов: 59

Трансплантация почки, особенности посттрансплантационного периода у больных СД. Подготовила студентка VI курса лечебного факультета Первого МГМУ им. Сеченова Казиева Марианна Магомедовна Руководитель: к. м. н. Подзолков Андрей Валерьевич

Основные вопросы трансплантации органов человека 1) Юридические и морально-этические вопросы трансплантации органов человека 2) Иммунологические аспекты клинической трансплантации почки 3) Доноры почек -живые доноры -трупные доноры

Преимущества живого донорства • Результаты трансплантации лучше, чем от трупного донора • Уменьшается продолжительность нахождения на диализе • Возможность додиализной трансплантации • Менее агрессивные режимы иммуносупрессии • Плановость процедуры

Противопоказания к живому донорству • • • Гематурия, инфекция мочевых путей Мочекаменная болезнь Ишемическая болезнь сердца Артериальная гипертензия выше 140/90 мм. рт. ст. Сахарный диабет или пониженная толерантность к глюкозе Тромбоэмболическая болезнь в анамнезе Злокачественные новообразования Системные болезни Психические заболевания Алкоголизм, курение

Хирургические аспекты трансплантации почки • На какую сторону делать трансплантацию? 1. Ранее считалось, что трансплантация почки должна быть гетеротопической, т. е. левая пересаживается в правую подвздошную ямку, правая-в левую. 2. Сейчас- при родственной трансплантации правая подвздошная область –преимущественное место для операции, т. к. почечные сосуды довольно короткие. 3. Исключение-пациенты с СД, которым планируется последующая, либо совместная трансплантация поджелудочной железы с почкой. В этом случае правую подвздошную область оставляют для размещения ПЖ. «Хроническая болезнь почек. Методы заместительной почечной терапии» В. С. Пилотович, О. В. Калачик- 2009.
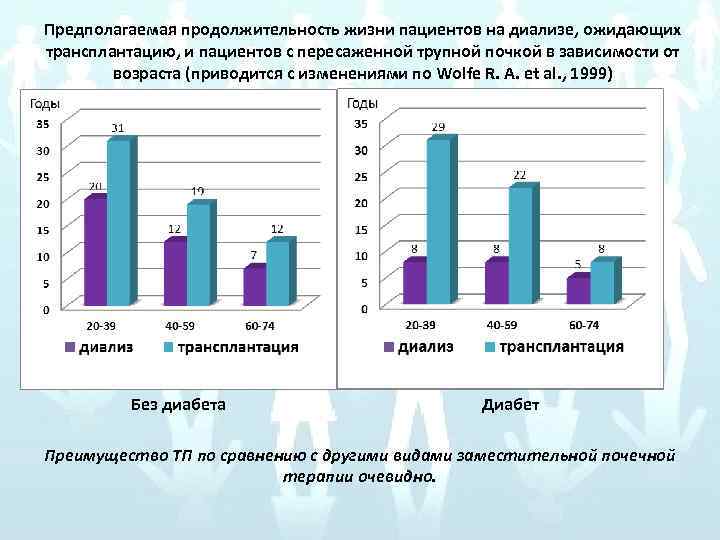
Предполагаемая продолжительность жизни пациентов на диализе, ожидающих трансплантацию, и пациентов с пересаженной трупной почкой в зависимости от возраста (приводится с изменениями по Wolfe R. A. et al. , 1999) Без диабета Диабет Преимущество ТП по сравнению с другими видами заместительной почечной терапии очевидно.

Выживаемость пересаженной почки у больных СД зависит от: • Частоты и скорости развития хронической трансплантационной нефропатии • Возвратного заболевания-рецидива диабетической нефропатии • Смерти больного по другим причинам с функционирующим трансплантатом
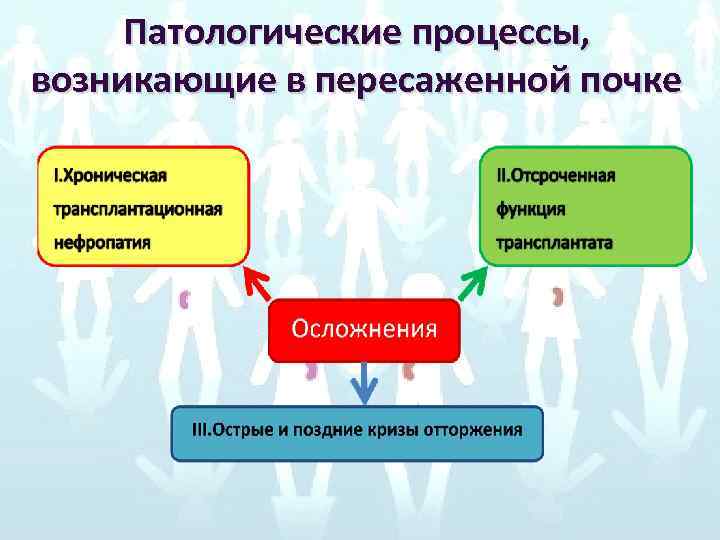
Патологические процессы, возникающие в пересаженной почке

I. Хроническая трансплантационная нефропатия (ХТН) Это необратимо прогрессирующее поражение трансплантированной почки, основным проявлением которого является постепенно прогрессирующее снижение почечных функций с исходом в ХПН, если при этом исключаются все остальные причины ренальной дисфункции. Морфологически: фибропролиферативный эндартериит в сочетании с тубулоинтерстициальным фиброзом и гломерулосклерозом.

Факторы риска ХТН -Антигензависимые Острая реакция отторжения Степень совместимости по АГ Пресенсиблизация Неадекватная иммунодепрессия Лекарственная несовместимость -Антигеннезависимые Ишемия и отсроченная функция Преклонный возраст донора Анатомическая несовместимость Нефротоксичность ингибиторов кальциневрина Гиперлипидемия АГ Курение Инфекция (в т. ч. вирусная) Протеинурия
«Хроническая болезнь почек. Методы заместительной почечной терапии» В. С. Пилотович, О. В. Калачик- 2009.

ХТН у больных СД • Д. Пирш и Г. Цоллингер-частота отторжения у больных СД не отличается от таковой у реципиентов с другими заболеваниями почек. • M. C. Thomas (2001) –у больных СД ХТН встречается чаще Пункционная биопсия трансплантата- «золотой стандарт» диагностики.

Псевдоотторжение • У пациентов с плохо контролируемой гликемией гиповолемия может привести к повышению уровня мочевины и креатинина, что может быть расценено как эпизод отторжения. • Отторжение может симулировать функциональная обструкция при нейрогенном мочевом пузыре.

По данным B. Nankivell (2003), ХТН имеет две фазы: 1. Тубулоинтерстициальное повреждение вследствие ишемических нарушений и действия иммунных фактороввыраженного острого отторжения и персистирующего субклинического отторжения. через год ХТН I степени (минимальная) -94, 2% ХТН II степени (средняя)-25, 6% 2. Через год после пересадки нарастает повреждение микроциркуляторного русла и гломерулосклероз, и в дальнейшем интерстициальный фиброз, ассоциированный с длительным токсическим действием ингибиторов кальцийнейрина (циклоспорин, програф) Через 10 лет ХТН III степени (выраженная) -58, 4%. Собственно хроническое отторжение -5, 8%

II. Отсроченная функция трансплантата • Необходимость в диализе в течение первой недели после трансплантации • Немедленная функция трансплантатаадекватный диурез и отсутствие потребности в послеоперационном диализе. Уровень креатинина нормализуется в течение 7 -12 сут. Почти у всех реципиентов от живого донора и от 30 до 50% от трупного донора функция трансплантата немедленная

Отсроченная функция трансплантата: Потенциальные причины: -острый канальцевый склероз(!) -сокращение внутрисосудистого объема (гиповолемия) -артериальная окклюзия -венозный тромбоз -обструкция мочеточника -обструкция катетера -мочевой затек -сверхострое отторжение -нефротоксичность -гемолитико-уремический синдром

Отсроченная функция-самый высокий фактор риска увеличения периода первичной госпитализации-самого экономически затратного периода- для больных с пересаженной трупной почкой, опережая другие: возраст старше 55 лет и диабет. «Сахарный диабет и хроническая болезнь почек» Шестакова М. В. , Дедов И. И. , 2009
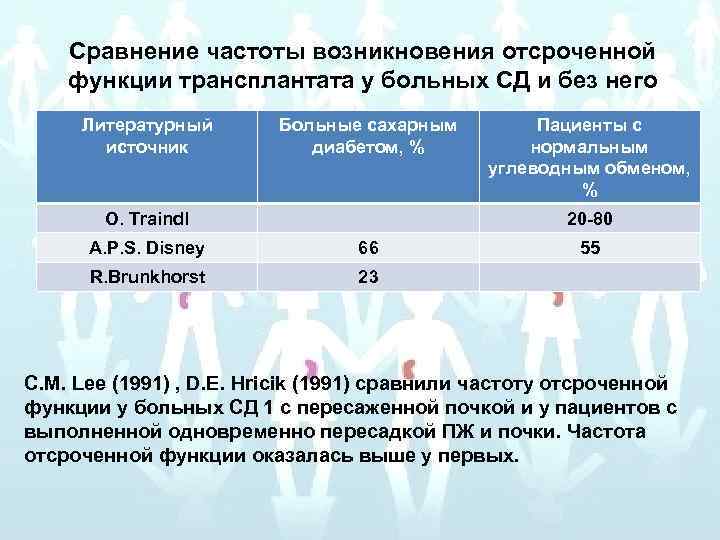
Сравнение частоты возникновения отсроченной функции трансплантата у больных СД и без него Литературный источник Больные сахарным диабетом, % O. Traindl Пациенты с нормальным углеводным обменом, % 20 -80 A. P. S. Disney 66 R. Brunkhorst 55 23 С. M. Lee (1991) , D. E. Hricik (1991) сравнили частоту отсроченной функции у больных СД 1 с пересаженной почкой и у пациентов с выполненной одновременно пересадкой ПЖ и почки. Частота отсроченной функции оказалась выше у первых.

M. F. Perez (1996) сравнил частоту возникновения отсроченной функции трансплантата у пациентов с пересаженной почкой, получавших различный вид диализа: -Пациенты, получавшие перитонеальный диализ (n=92), имели отсроченную функцию-22, 5% немедленную функцию-68, 5% отсутствие функции-9% -Пациенты, получавшие гемодиализ (n=587), имели отсроченную функцию-39, 5% немедленную функцию-46, 5% отсутствие функции-14% Объяснение остается неясным. Кроме различия в виде диализа, группы сопоставимы по другим факторам риска возникновения отсроченной функции.

III. Острые и поздние кризы отторжения • Ранние-в течение первых 3 мес после аллотрансплантации почки • Поздние-по истечении 3 мес. • Обратимые-заканчиваются снижением креатинина сыворотки до 130 мкмоль/л и менее • Частично обратимыезавершаются стабилизацией уровня креатинина более 130 мкмоль/л

Кризы отторжения, возникшие в первые 6 мес. После трансплантации, увеличивают риск поздних потерь трансплантатов до 50% Период полужизни трансплантированной почки Исследован ие Количество трансплантац ий почек Острый криз отторжения с клиническими проявлениями, годы отсутствие р 1 эпизод S. Hariharah, 2000 93 937 17, 9 8, 8 <0, 0001 A. Lindholm, 1993 951 12, 5 6, 6 <0, 0001 *Период полужизни-это интервал времени, в течение которого «погибает» (прекращает работу) 50% общего числа трансплантатов, «переживших» 1 год после операции.
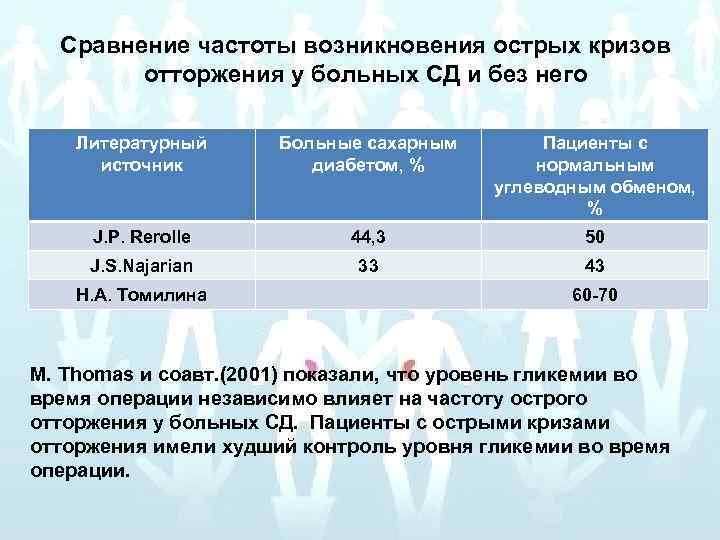
Сравнение частоты возникновения острых кризов отторжения у больных СД и без него Литературный источник Больные сахарным диабетом, % Пациенты с нормальным углеводным обменом, % J. P. Rerolle 44, 3 50 J. S. Najarian 33 43 H. A. Томилина 60 -70 M. Thomas и соавт. (2001) показали, что уровень гликемии во время операции независимо влияет на частоту острого отторжения у больных СД. Пациенты с острыми кризами отторжения имели худший контроль уровня гликемии во время операции.

Субклиническое отторжение- имеются гистопатологические черты острого тубулита при пункционной биопсии при клинически стабильной функции трансплантата. R. Shapiro и соавт. (2001) при биопсии в срок через неделю после пересадки, при хорошей функции трансплантата нашли пограничные признаки отторжения в 21% случаев, а в 25%-острый тубулит. Rush и соавт-через 3 мес. После трансплантации почки они нашли пограничные изменения в 21% или признаки острого отторжения в 33% случаев при стабильной функции пересаженной почки.
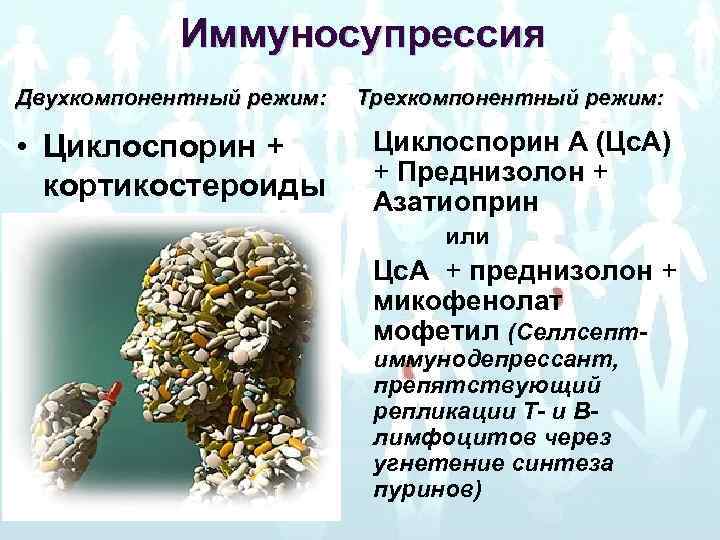
Иммуносупрессия Двухкомпонентный режим: Трехкомпонентный режим: • Циклоспорин + кортикостероиды Циклоспорин А (Цс. А) + Преднизолон + Азатиоприн или Цс. А + преднизолон + микофенолат мофетил (Селлсептиммунодепрессант, препятствующий репликации Т- и Влимфоцитов через угнетение синтеза пуринов)

Доля пациентов с сохраненной азотовыделительной функцией почек через 5 лет после трансплантации на фоне трехкомпонентной иммуносупрессии-48%, а применении двухкомпонентного режима 21% «Сахарный диабет и хроническая болезнь почек» Шестакова М. В. , Дедов И. И. , 2009

Дозу Цс. А подбирают по его концентрации в кровине менее 100 нг/мл, оптимально -120 -170 нг/мл. Концентрацию Цс. А определяют в пробах крови, взятых натощак, через 12 часов после предыдущего и непосредственно перед очередным приемом препарата при использовании моноклонального радиоиммунного теста. В течение 5 лет хроническая дисфункция трансплантата-у 48%реципиентов, у которых дозировка Цс. А обеспечивала стабилизацию его концентрации в крови в пределах 100 -120 нг/мл. При концентрации< 100 нг/мл - 91% случаев дисфункции, 5 -летняя доля трансплантатов, обеспечивающих нормальный уровень креатинина плазмы крови-9% «Сахарный диабет и хроническая болезнь почек» Шестакова М. В. , Дедов И. И. , 2009

Минусы ингибиторов кальцийнейрина: Цс. А и програф (такролимус) при длительном применении вызывают гиалиноз артериол и прогрессирующий ишемический гломерулосклероз. Наблюдаются в 100% случаев через 10 лет «Сахарный диабет и хроническая болезнь почек» Шестакова М. В. , Дедов И. И. , 2009

Гистосовместимость- специфический, Гистосовместимость антигензависимый механизм хронического отторжения трансплантированной почки. В исследовании G. Opelz (1997) на материале 100 000 трансплантаций почки установлена корреляция между числом несовпадений по HLA-A, -B, -DR и 20 -летней выживаемостью первичного трупного трансплантата и периодом его полужизни. При полном совпадении по всем 6 антигенам HLA (A, B, DR) выживаемость трансплантата через 20 лет после операции-32%, период полужизни-13, 1 года. Несовпадение по 1 антигену-23% и 10, 1 года; по 2 -22% и 10, 2 года; по 3 -19% и 9, 1 года; по 4 -18% и 8, 8 года по 5 -15% и 7, 9 года; по 6 -12% и 7 лет.
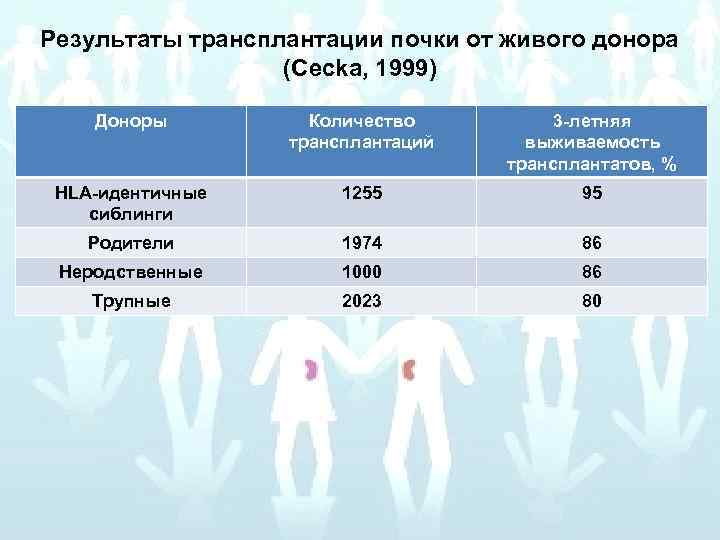
Результаты трансплантации почки от живого донора (Cecka, 1999) Доноры Количество трансплантаций 3 -летняя выживаемость трансплантатов, % HLA-идентичные сиблинги 1255 95 Родители 1974 86 Неродственные 1000 86 Трупные 2023 80

Неиммунные факторы риска посттрансплантационных осложнений. • • Гипергликемия Курение Гипергомоцистеинемия Инфекции Анемия Артериальная гипертензия Дислипидемия Протеинурия

Артериальная гипертензия • У пациентов с пересаженной почкой АГ> 130/80 мм. рт. ст. • Целевой уровень АД<130/80 мм. рт. ст без ПУ • АД<120/75 мм. рт. ст. –с ПУ АГ-один из самых важных факторов риска гломерулосклероза пересаженной почки и имеет четкую корреляцию с отдаленной выживаемостью пересаженной почки и пациента.

Признанные препараты выбора для лечения АГ у больных СД- и. АПФ и антагонисты рецепторов ангиотензина II. и. АПФ конкурентно блокируют РАС, снижают внутриклубочковое давление, замедляя прогрессирование МАУ в ПУ. и. АПФ замедляют прогрессирование ДН в трансплантированной почке независимо от снижения АД.

У пациентов с неконтролируемой АГ и/или снижением почечной функции следует исключить стеноз почечной артерии (2 -6, 6%). В некоторых случаях неконтролируемой ренинзависимой АГ рекомендуется билатеральная нефрэктомия собственных почек.

Дислипидемия • Может быть следствием: – ПУ – СД – Иммуносупрессивной терапии – Антигипертензивной терапии – Пожилого возраста – Ожирения – Генетических факторов – Употребления алкоголя У пациентов с пересаженной почкой липидный профиль (уровень ОХ, ЛПВП, ЛПНП, ТГ) рекомендуется проверять не менее 1 раза в год.

Протеинурия • До и во время операции в начальном периоде после пересадки почкитранзиторная ПУ. • Ранняя ПУ коррелирует с отсроченной функцией траснплантата, острым отторжением, использование органа пожилого донора. • Больные СД и пациенты без диабета не отличаются по развитию ПУ после трансплантации почки «Сахарный диабет и хроническая болезнь почек» Шестакова М. В. , Дедов И. И. , 2009

Протеинурия • Причины: – АГ – Недостаток действующей массы нефронов – Качество трансплантата – Активация интраренальной РАС • Лечение: – и. АПФ – АРА
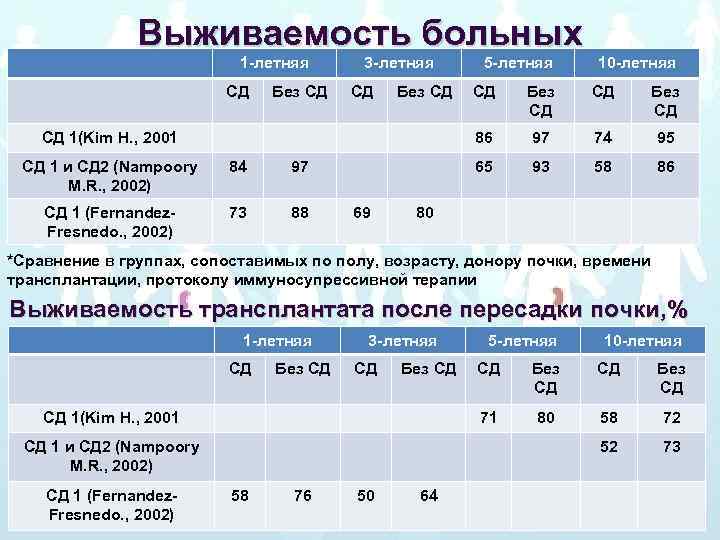
Выживаемость больных 1 -летняя СД Без СД 3 -летняя СД Без СД 5 -летняя 10 -летняя CД 1 и СД 2 (Nampoory M. R. , 2002) 84 СД 1 (Fernandez. Fresnedo. , 2002) 73 88 69 СД Без СД 97 74 95 65 97 Без СД 86 СД 1(Kim H. , 2001 СД 93 58 86 80 *Сравнение в группах, сопоставимых по полу, возрасту, донору почки, времени трансплантации, протоколу иммуносупрессивной терапии Выживаемость трансплантата после пересадки почки, % 1 -летняя СД Без СД 3 -летняя СД Без СД 10 -летняя 58 76 50 64 Без СД СД Без СД 80 58 72 52 CД 1 и СД 2 (Nampoory M. R. , 2002) СД 71 СД 1(Kim H. , 2001 СД 1 (Fernandez. Fresnedo. , 2002) 5 -летняя 73
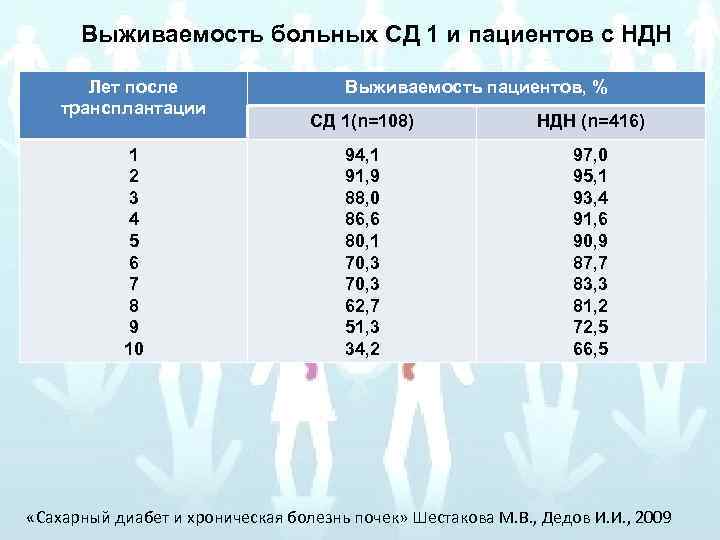
Выживаемость больных СД 1 и пациентов с НДН Лет после трансплантации 1 2 3 4 5 6 7 8 9 10 Выживаемость пациентов, % СД 1(n=108) НДН (n=416) 94, 1 91, 9 88, 0 86, 6 80, 1 70, 3 62, 7 51, 3 34, 2 97, 0 95, 1 93, 4 91, 6 90, 9 87, 7 83, 3 81, 2 72, 5 66, 5 «Сахарный диабет и хроническая болезнь почек» Шестакова М. В. , Дедов И. И. , 2009

Причины смерти Причина смерти НДН (n=44) СД( n=26) Сердечно-сосудистая патология (в том числе гангрена нижних конечностей) 17 (38, 7%) 12 (46, 2%) 0 4 -15% Инфекция 7 (15, 9%) 9 (34, 6%) Онкологические заболевания 4 (9, 1%) - Печеночная недостаточность 10 (22, 7%) 1 (3, 8%) Неизвестная 6 (13, 6%) 4 (15, 4%) «Сахарный диабет и хроническая болезнь почек» Шестакова М. В. , Дедов И. И. , 2009

Спасибо за внимание!

Клинический случай Пациентка С. , 49 лет, длительно наблюдается в отделении диабетической нефропатии ФГБУ ЭНЦ с диаг нозом: «Сахарный диабет 1 типа. Состояние после АТП (1996 г. ), диабетическая нефропатия трансплантата на стадии ХПН. Хроническая болезнь почек (ХБП) IV. Артериальная гипертония 2 ст. Нормохромная анемия. Вторичный гиперпаратиреоз. Системный остеопороз. Диабетическая пролиферативная ретинопатия. Состояние после лазерной коагуляции сетчатки обоих глаз (1994, 1998, 2000 гг. ) и витрэктомии на правом глазу. Диабетическая кардиопатия. Диабетическая дистальная полинейропатия, сенсомоторный тип. Синдром диабетической стопы, нейропатическая форма. Диабетическая остео артропатия, хроническая стадия. Диабетическая автономная нейропатия, гастроинтестинальная форма» , поступила планово с целью обследования в динамике и коррекции терапии.

Жалобы при поступлении: • На повышение сахара в крови до 15 ммоль/л, частые гипогликемии в разное время суток, • Повышение АД до 160/90 мм рт. ст. на фоне постоянной терапии, • Периодически головные боли в височной области, • Снижение остроты зрения, появление «плавающих точек» перед глазами, слезотечение, • Ноющие боли в икроножных мышцах и стопах в покое, выделение 1– 2 капель молозива при надавливании на молочные железы.

Анамнез СД 1 был диагностирован в 1976 г. (с 14 лет, в течение 34 лет). В дебюте заболевания – кетоацидотическая кома, уровень гликемии >29 ммоль/л. Была назначена инсулинотерапия, до 1989 г. больная находилась на традиционной терапии инсулинами животного происхождения 2 раза в сутки, с 1989 г. на терапии человеческими инсулинами, показатели гликемии в пределах субкомпенсации. В дальнейшем, с 2006 г. , больная была переведена на терапию аналогами инсулина. На момент поступления получает: Лантус 9 Ед, Новорапид 5– 8 Ед перед основными приемами пищи 1– 2 Ед перед сном при дополнительном приеме углеводов. Пациентка обучена приемам и методам самоконтроля, регулярно проводит контроль гликемии, однако компенсация СД достигнута только в течение последних 2 лет.
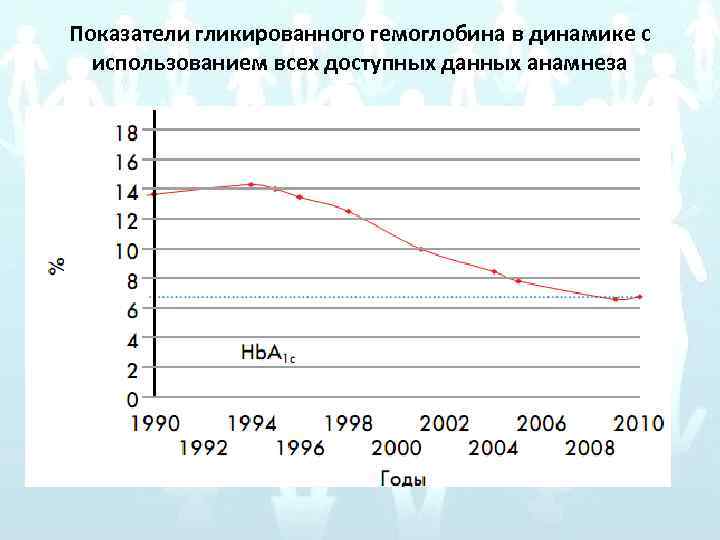
Показатели гликированного гемоглобина в динамике с использованием всех доступных данных анамнеза

Нефропатия: с 1976 г. в общеклиническом анализе мочи периодически (на фоне обострения инфекции мочевых путей) определялись следы белка в моче, с 1987 г. (через 11 лет от дебюта СД) выявлялась постоянная протеинурия (ПУ), однако прием и. АПФ (Капотен) осуществлялся только при повышении показателей АД. Уже с 1990– 1991 гг. (через 14 лет от дебюта СД) выявлена ХПН II ст. с уровнем креатинина 361 мкмоль/л и назначена постоянная терапия и. АПФ, достигнуты показатели АД 150– 170/90 мм рт. ст. С 1995 г. (через 19 лет от дебюта СД) диагностирована терминальная стадия ХПН (повышение креатинина до 1000 мкмоль/л), АД до 230/130 мм рт. ст. на фоне приема и. АПФ и блокаторов кальциевых каналов. В 1995– 1996 гг. проводилось лечение программным ГД в ЦКБ.

В 1996 г. (через 20 лет от манифестации СД) выполнена АТП в НИИ трансплантологии. При наблюдении в динамике: на 1 -е сутки – самостоятельный диурез, азотемия с положительной динамикой; на 5 -е сутки в связи с развитием острого криза отторжения трансплантата был проведен курс пульстерапии Метипредом 1, 0 г и 3 сеанса ГД с Лимфоглобулином 350 мг № 7. В послеоперационном периоде, на 30 -е сутки развился острый дакриоцистит и острый гастроэнтерит на фоне цитомегаловирусной инфекции, проведен курс Ганцикловира (Цимевен). На 46 -е сутки – азотемия в пределах нормы, через 2 месяца креатинин – 180 мкмоль/л. В 2004 г. после длительной пневмоцистной пневмонии (8 месяцев) отмечался вираж уровня креатинина до 210 мкмоль/л, СКФ – 22 мл/мин/1, 73 м 2. В дальнейшем на фоне проводимой терапии показатели функции почек стабильные, в рамках ХПН II, ХБП 4.

Иммуносупрессивная терапия: с 1996 г. по 2004 г. трехкомпонентная схема – Азатиоприн, Циклоспорин, Метипред (уровень креатинина 180 мкмоль/л). С 2006 г. получает Метипред 4 мг 3/4 таб/сут, Циклоспорин 175 мг– 150 мг через день. С 2004 по 2009 гг. функция почек стабильная в рамках ХПН I, ХБП 3 (уровень креатинина – 169– 177, 0 мкмоль/л, СКФ – 28– 21 мл/мин/1, 73 м 2). Регулярный прием и. АПФ (Моноприл 10– 20 мг/сут) возобновлен в течение первого года после трансплантации и далее продолжен в постоянном режиме с коррекцией дозы в сочетании с приемом Конкора 5 мг/сут, Плендила 2, 5– 5 мг/сут. На фоне гипотензивной терапии отмечает периодические подъемы АД до 160– 180/90 мм рт. ст. Последняя госпитализация в ЭНЦ в апреле 2009 г. , где прием Конкора был заменен на Соталекс 40 мг 1 раз в сутки в связи с выявлением суправентрикулярной экстрасистолии. К терапии добавлен Арифон-ретард, прием которого пациентка самостоятельно отменила через месяц.
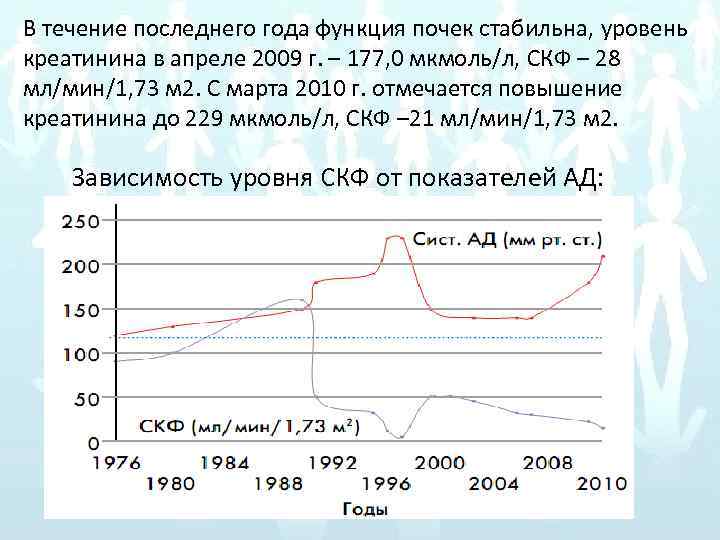
В течение последнего года функция почек стабильна, уровень креатинина в апреле 2009 г. – 177, 0 мкмоль/л, СКФ – 28 мл/мин/1, 73 м 2. С марта 2010 г. отмечается повышение креатинина до 229 мкмоль/л, СКФ – 21 мл/мин/1, 73 м 2. Зависимость уровня СКФ от показателей АД:

На момент поступления пациентка получала: Моноприл 10 мг/сут, Плендил 5 мг/сут, Соталекс 40 мг/сут, Зокор 10 мг/сут, на фоне проводимой терапии показатели АД до 160/90 мм рт. ст. При проведении пункционной биопсии в 2009 г. подтверждено наличие ДН трансплантата. Данные анамнеза по анемии до трансплантации документально не подтверждены. Через 12 лет (2008 г. ) после проведения АТП зафиксировано снижение общего гемоглобина крови до 98 г/л. Регулярно получает лечение препаратами эритропоэтина, последний курс лечения в феврале 2010 г. (Рекормон в сочетании с Венофером, с положительной динамикой показателей гемоглобина до 110 г/л). В 2001 г. перелом V плюсневой кости слева, в 2005 г. и 2006 г. два перелома V плюсневой кости справа.

В 2006 г. выявлен вторичный гиперпаратиреоз, по результатам денситометрии определяются признаки системного остеопороза. Постоянно получала Фоса макс 70 мг 1/2 таб/нед, альфа-D 3 Форте 1 таб/сут, с конца 2006 г. альфа-D 3 Форте 1 таб/1 раз в 3 дня. В 2009 г. по данным лабораторного исследования сыворотки крови: паратгормон 93, 8 пг/мл (15– 65), фосфор 50 ммоль/л (0, 87– 1, 45), кальций общий 2, 52 ммоль/л (2, 15– 2, 55), кальций ионизированный 1, 23 ммоль/л (1, 03– 1, 29), Рх. Са=3. 78. С 2009 г. постоянно принимает Са. D 3 -Никомед 1 таб/сут, Альфа-D 3 Тева 25 мкг 1 раз/сут. Пролиферативная диабетическая ретинопатия диагностирована в 1994 г. (через 18 лет от дебюта СД), проведено несколько сеансов панретинальной лазерной коагуляции сосудов сетчатки (1994, 1998, 2000 гг. ) и витрэктомия на правом глазу в 2003 г. в ГКБ № 15. При осмотре в 2009 г. без отрицательной динамики.

Сопутствующая патология Из перенесенных и сопутствующих заболеваний обращает на себя внимание наличие хронического пиелонефрита в анамнезе более 20 лет. Последнее обострение в августе 2009 г. , тогда же был проведен курс антибактериальной терапии. В 1990 г. у пациентки был выявлен аутоиммунный тиреоидит и гипотиреоз, назначен L-тироксин в дозе 25 мкг/сутки. При контроле в 2009 г. уровень ТТГ в динамике на фоне терапии в пределах нормы. С 2004 г. – гиперпролактинемия, в 2006 г. назначен агонист дофаминовых рецепторов Достинекс 0, 5 по 1/2 таб/сут в течение 6 недель. При контроле в динамике уровень пролактина в пределах референсных значений, в связи с чем с июня 2006 г. прием Достинекса был отменен. Далее с 2006 г. по 2009 г. – нормопролактинемия без терапии.

Объективно при поступлении Рост – 180 см, вес – 58, 6 кг, ИМТ – 18, 0 кг/м 2. Состояние удовлетворительное. Телосложение нормостеническое. Кожные покровы нормальной окраски, сухие. Подкожная жировая клетчатка развита недостаточно, распределена равномерно. Мышечный тонус снижен. Определяется пастозность нижних конечностей. Тоны сердца приглушены, ритм правильный. АД 140/90 мм рт. ст. , ЧСС 79 уд. в мин. Пульсация на периферических артериях стоп сохранена, умеренно снижена. Дыхание везикулярное, проводится во все отделы легких, хрипов нет.

Живот мягкий, безболезненный во всехотделах. В левой подвздошной области – рубец после проведения АТП. Печень не выступает из-под края реберной дуги. Симптом «поколачивания» отрицательный с обеих сторон. Дизурических явлений нет. Щитовидная железа не увеличена, при пальпации безболезненная, плотноэластической консистенции, узловых образований не выявлено, клинически – эутиреоз. При надавливании на молочные железы – появление 1– 2 капель молозива.

Данные лабораторных методов исследования: При поступлении в клиническом анализе крови были выявлены признаки нормохромной анемии: эритроциты – 3, 5 х1012/л (4, 0– 5, 3), Нb – 98 г/л, Ht – 31, 6% (36, 0– 42, 0), на фоне снижения трансферрина – 1, 0 г/л (2, 0– 3, 6), ферритин – 134, 4 нг/мл (15– 150) (насыщение трансферрина железом – 76, 4%); повышение СОЭ до 21 мм/час (2– 20), Hb. A 1 c – 7, 4%. В связи с наличием частых гипогликемий (до 3– 6 раз в неделю) с последующим компенсаторным повышением гликемии до 17– 20 ммоль/л проведена коррекция инсулинотерапии – уменьшена доза Новорапида до 2– 6 Ед в основные приемы пищи.

В биохимическом анализе крови отмечалось повышение показателей креатинина до 229, 0 мкмоль/л (44, 0– 80), мочевины до 21, 0 ммоль/л (1, 7– 8, 3); снижение СКФ (MDRD) до 21 мл/мин/1, 73 м 2 (90– 130), гиперкалиемия 5, 7 ммоль/л (3, 6– 5, 3). Показатели липидного обмена в пределах целевых значений. В общеклиническом анализе мочи – протеинурия, микрогематурия. В анализе мочи по Нечипоренко выявлены признаки мочевой инфекции (лейкоцитурия – 3500 в 1 мл (0– 2000)). Проведена антибактериальная терапия (Таваник 250 мг/сут № 6) с положительной динамикой мочевого осадка.

За время госпитализации основную клиническую проблему составила коррекция артериальной гипертензии и гиперкалиемии. В связи с прогрессирующим снижением СКФ и гиперкалиемией, доза ингибиторов АПФ (Моноприл) была уменьшена до 5 мг/сут. Пациентке были назначены: Фуросемид 40 мг/сут под контролем диуреза и уровня калия крови, Арифон ретард 1, 5 мг, Физиотенз 0, 2 мг 2 раза в сутки утром и в обед. Учитывая наличие стойкой гипертензии, к терапии был добавлен Плендил 5 мг вечером с последующим увеличением дозы до 10 мг/сут (2, 5 мг утром и 7, 5 мг вечером). На фоне проводимой терапии по результатам суточного мониторирования АД (СМАД) регистрировалось повышение показателей преимущественно в ночные часы, в связи с чем прием Плендила был перенесен на более позднее время (23: 00), доза Физиотенза увеличена до 0, 6 мг/сут. При повторном проведении СМАД регистрировались стабильные показатели АД в пределах 130/75 мм рт. ст. в течение суток.

При проведении суточного холтер-мониторирования регистрировалось около 40 одиночных суправентрикулярных сокращений, 4 куплета, ST-T без диагностически значимой динамики, что стало показанием для увеличения дозы Соталекса до 80 мг в сутки. По данным гормонального исследования: уровень ТТГ в пределах нормы, выявлено повышение уровня общего пролактина до 1158, 0 МЕ/л (90, 0– 540, 0) и его биоактивной фракции – 942, 0 м. МЕ/л (64, 0– 395, 0); паратгормона до 79, 3 пг/мл (15, 0– 65, 0). По данным рентгенографии черепа в боковой проекции форма и размеры турецкого седла обычные, эндоселлярное обызвествление в передней трети седла, сосудистый рисунок усилен в теменной зоне.

По результатам проведенного обследования был сформулирован следующий клинический диагноз. Основное заболевание: Сахарный диабет 1 типа. Осложнения основного заболевания: Состояние после АТП (1996 г. ), ДН трансплантата на стадии хронической почечной недостаточности. ХПН II. ХБП 4. Артериальная гипертония 2 ст. , IV риск. Нормохромная анемия. Минеральные костные нарушения при ХБП. Вторичный гиперпаратиреоз. Системный остеопороз. Диабетическая пролиферативная ретинопатия. Состояние после лазерной коагуляции сетчатки обоих глаз (1994, 1998, 2000 гг. ) и витрэктомии на правом глазу. Диабетическая кардиопатия. Диабетическая дистальная полинейропатия, сенсомоторный тип. Синдром диабетической стопы, нейропатическая форма. Диабетическая остеоартропатия, хроническая стадия. Диабетическая автономная нейропатия, гастроинтестинальная форма.

Сопутствующий диагноз: Нарушение сердечного ритма: суправентрикулярная экстрасистолия, постоянная форма. Атеросклероз аорты, брахиоцефальных артерий и артерий нижних конечностей (стеноз обеих передних большеберцовых, малоберцовых, задних большеберцовых артерий). Хронический пиелонефрит, обострение. Первичный гипотиреоз в исходе хронического аутоиммунного тиреоидита, медикаментозная компенсация. Левосторонний узловой зоб. Гиперпролактинемия. Миопия высокой степени справа, средней степени слева. Начальная катаракта обоих глаз. Хронический гастрит, обострение. Хронический бульбит, обострение.
Трансплонтация почки у больных СД.pptx