ТРАНСЛЯЦИЯ Резяпкин Виктор

































 ТРАНСЛЯЦИЯ Резяпкин Виктор Ильич доцент кафедры биохимии v. rezyapkin@grsu. by
ТРАНСЛЯЦИЯ Резяпкин Виктор Ильич доцент кафедры биохимии v. rezyapkin@grsu. by
 • В биосинтезе белка участвует очень большое число белков, и. РНК, т. РНК, р. РНК в составе рибосом и другие молекулы • При его протекании затрачивается большое количество энергии. • Различают несколько стадий биосинтеза белка: активация аминокислот, инициация, элонгация и терминация. • Синтез белка характеризуется тем, что между матрицей (и. РНК) и продуктом (белком) нет комплементарного соответствия.
• В биосинтезе белка участвует очень большое число белков, и. РНК, т. РНК, р. РНК в составе рибосом и другие молекулы • При его протекании затрачивается большое количество энергии. • Различают несколько стадий биосинтеза белка: активация аминокислот, инициация, элонгация и терминация. • Синтез белка характеризуется тем, что между матрицей (и. РНК) и продуктом (белком) нет комплементарного соответствия.
 • Для расшифровки нуклеотидной последовательности необходим генетический код • Он устанавливает соответствие между нуклеотидной последовательностью и. РНК и полипептидной цепью • Единицей генетического кода является кодон • Кодон представляет собой последовательность, состоящую из трех нуклеотидов, т. е. триплет • Существует 64 кодона. Из них 61 кодон используется для кодирования аминокислот • Три кодона служат сигналом для остановки синтеза полипептидной цепи - терминирующие, или нонсенс- кодоны.
• Для расшифровки нуклеотидной последовательности необходим генетический код • Он устанавливает соответствие между нуклеотидной последовательностью и. РНК и полипептидной цепью • Единицей генетического кода является кодон • Кодон представляет собой последовательность, состоящую из трех нуклеотидов, т. е. триплет • Существует 64 кодона. Из них 61 кодон используется для кодирования аминокислот • Три кодона служат сигналом для остановки синтеза полипептидной цепи - терминирующие, или нонсенс- кодоны.
 • Каждому кодону (61 из 64) соответствует строго определенная аминокислота
• Каждому кодону (61 из 64) соответствует строго определенная аминокислота
 • Трансляция и. РНК начинается с инициирующего триплета – АУГ • Далее расшифровывается каждый последующий триплет в направлении от 5’-конца молекулы и. РНК к 3’-концу • Заканчивается синтез полипептида на одном из трех терминирующих кодонов • Синтез полипептидной цепи начинается с N-конца.
• Трансляция и. РНК начинается с инициирующего триплета – АУГ • Далее расшифровывается каждый последующий триплет в направлении от 5’-конца молекулы и. РНК к 3’-концу • Заканчивается синтез полипептида на одном из трех терминирующих кодонов • Синтез полипептидной цепи начинается с N-конца.
 • 20 стандартным аминокислотам соответствует 61 кодон • Таким образом, почти каждой стандартной аминокислоте соответствует несколько кодонов • Т. о. нельзя однозначно перевести аминокислотную последовательность данного белка в нуклеотидную последовательность и. РНК.
• 20 стандартным аминокислотам соответствует 61 кодон • Таким образом, почти каждой стандартной аминокислоте соответствует несколько кодонов • Т. о. нельзя однозначно перевести аминокислотную последовательность данного белка в нуклеотидную последовательность и. РНК.
 Генетический код
Генетический код
 • Пирролизин — это природная аминокислота, кодируемая генами некоторых метаногенных архей. • Пирролизин входит в состав некоторых ферментов метаболизма метана. • Пирролизин является производным аминокислоты лизина и кодируется кодоном UAG (стоп-кодоном). • У археи Methanosarcina barkeri имеется ген pyl. T, который кодирует необычную т. РНК с антикодоном CUA. Соседний ген pyl. S кодирует аминоацил-т. РНК- синтетазу, которая присоединяет пирролизин к т. РНК-продукту.
• Пирролизин — это природная аминокислота, кодируемая генами некоторых метаногенных архей. • Пирролизин входит в состав некоторых ферментов метаболизма метана. • Пирролизин является производным аминокислоты лизина и кодируется кодоном UAG (стоп-кодоном). • У археи Methanosarcina barkeri имеется ген pyl. T, который кодирует необычную т. РНК с антикодоном CUA. Соседний ген pyl. S кодирует аминоацил-т. РНК- синтетазу, которая присоединяет пирролизин к т. РНК-продукту.
 • Селеноцистеи н — нестандартная аминокиcлота, входящая в состав активного центра фермента глутатионпероксидазы, а также в состав селенопротеинов, деиодаз и некоторых других белков. • На м. РНК селеноцистеин кодирует терминирующий кодон UGA при условии, что за ним следует особая стимулирующая последовательность нуклеотидов.
• Селеноцистеи н — нестандартная аминокиcлота, входящая в состав активного центра фермента глутатионпероксидазы, а также в состав селенопротеинов, деиодаз и некоторых других белков. • На м. РНК селеноцистеин кодирует терминирующий кодон UGA при условии, что за ним следует особая стимулирующая последовательность нуклеотидов.
 Свойства кода Триплетность • Кодон состоит из последовательности, состоящей из трех нуклеотидов. • Число кодирующих последовательностей из четырех нуклеотидов по три равно 43=64, из них 61 – смысловых кодонов, - 3 нонсен-кодона Вырожденность • Каждый из 61 смысловых триплетов кодирует включение в белок одну из 20 стандартных аминокислот. • Включение одной и той же аминокислоты в белок определяет несколько кодонов. • Одним кодоном зашифрованы только 2 аминокислоты – Мет и Три • Лей, Сер и Арг – шестью кодонами • Ала, Вал, Гли, Про, Тре – четырьмя кодонами. Специфичность (однозначность) • Каждому кодону соответствует только одна определенная аминокислота.
Свойства кода Триплетность • Кодон состоит из последовательности, состоящей из трех нуклеотидов. • Число кодирующих последовательностей из четырех нуклеотидов по три равно 43=64, из них 61 – смысловых кодонов, - 3 нонсен-кодона Вырожденность • Каждый из 61 смысловых триплетов кодирует включение в белок одну из 20 стандартных аминокислот. • Включение одной и той же аминокислоты в белок определяет несколько кодонов. • Одним кодоном зашифрованы только 2 аминокислоты – Мет и Три • Лей, Сер и Арг – шестью кодонами • Ала, Вал, Гли, Про, Тре – четырьмя кодонами. Специфичность (однозначность) • Каждому кодону соответствует только одна определенная аминокислота.
 Неперекрываемость кода • Следующие за инициирующим кодоном АУГ триплеты читаются последовательно не перекрываясь без каких либо пропусков вплоть до стоп-кодона, на котором синтез полипептидной цепи завершается.
Неперекрываемость кода • Следующие за инициирующим кодоном АУГ триплеты читаются последовательно не перекрываясь без каких либо пропусков вплоть до стоп-кодона, на котором синтез полипептидной цепи завершается.
 • Универсальность кода • Код универсален, т. е. смысл кодов одинаков для всех организмов • Существует исключение – митохондриальная м. РНК содержит триплеты, имеющих другое значение, чем в м. РНК ядерного происхождения • В м. РНК митохондрий триплет UGA кодирует Три, AUA – Мет, а AGA и AGG причитываются как дополнительные стоп-кодоны
• Универсальность кода • Код универсален, т. е. смысл кодов одинаков для всех организмов • Существует исключение – митохондриальная м. РНК содержит триплеты, имеющих другое значение, чем в м. РНК ядерного происхождения • В м. РНК митохондрий триплет UGA кодирует Три, AUA – Мет, а AGA и AGG причитываются как дополнительные стоп-кодоны
 Гипотеза неоднозначного соответствия • Главная задача т. РНК заключается в расшифровке генетической информации, закодированной в и. РНК. • т. РНК способна распознавать смысловые триплеты, благодаря спариванию оснований антикодона с кодоном.
Гипотеза неоднозначного соответствия • Главная задача т. РНК заключается в расшифровке генетической информации, закодированной в и. РНК. • т. РНК способна распознавать смысловые триплеты, благодаря спариванию оснований антикодона с кодоном.
 • Взаимодействие между антикодоном и кодоном происходит путем спаривания оснований, но не всегда по правилам комплементарности. • Определяющими в составе кодона являются два нуклеотида, третье основание имеет определенную степень свободы при образовании пары с соответствующим основанием антикодона (может спариваться с некомплементарным азотистым основанием) I – инозин, нуклеозид, содержащий основание гипоксантин (образуется в результате дезаминирования аденина), может узнавать A, G и C
• Взаимодействие между антикодоном и кодоном происходит путем спаривания оснований, но не всегда по правилам комплементарности. • Определяющими в составе кодона являются два нуклеотида, третье основание имеет определенную степень свободы при образовании пары с соответствующим основанием антикодона (может спариваться с некомплементарным азотистым основанием) I – инозин, нуклеозид, содержащий основание гипоксантин (образуется в результате дезаминирования аденина), может узнавать A, G и C
 • Крик сформулировал основные положения гипотизы 1. Два первых основания кодона всегда образуют прочные уотсон-криковские пары с соответствующими основаниями кодона 2. Первое основание ряда антикодонов (взаимодействует с третьем основанием кодона) позволяет им читать больше одного кодона для данной аминокислоты. 3. Кодоны для определенной аминокислоты, отличающиеся по любому из первых двух оснований, требуют разных т. РНК. 4. Для трансляции всех кодонов, соответствующих определенным аминокислотам (таких кодонов 61), требуется как минимум 32 различных т. РНК.
• Крик сформулировал основные положения гипотизы 1. Два первых основания кодона всегда образуют прочные уотсон-криковские пары с соответствующими основаниями кодона 2. Первое основание ряда антикодонов (взаимодействует с третьем основанием кодона) позволяет им читать больше одного кодона для данной аминокислоты. 3. Кодоны для определенной аминокислоты, отличающиеся по любому из первых двух оснований, требуют разных т. РНК. 4. Для трансляции всех кодонов, соответствующих определенным аминокислотам (таких кодонов 61), требуется как минимум 32 различных т. РНК.
 Активация аминокислот • На этой стадии каждая из 20 аминокислот присоединяется к определенной т. РНК. При этом используется энергия АТФ. • Эти реакции катализируются 20 различными аминоацил-т. РНК-синтетазами. • Аминоацил-т. РНК-синтетазы способны узнавать три различных субстрата: АТФ, аминокислоту и т. РНК. • Каждая аминоацил-т. РНК-синтетаза способна узнавать только одну определенную аминокислоту и соответствующие ей т. РНК, в клетке имеется, как правило, несколько изоакцепторных т. РНК • Они присоединяют аминокислотный остаток к 2’- или 3’-гидроксильной группе 3’- концевого нуклеотида. • Реакция протекает в две стадии
Активация аминокислот • На этой стадии каждая из 20 аминокислот присоединяется к определенной т. РНК. При этом используется энергия АТФ. • Эти реакции катализируются 20 различными аминоацил-т. РНК-синтетазами. • Аминоацил-т. РНК-синтетазы способны узнавать три различных субстрата: АТФ, аминокислоту и т. РНК. • Каждая аминоацил-т. РНК-синтетаза способна узнавать только одну определенную аминокислоту и соответствующие ей т. РНК, в клетке имеется, как правило, несколько изоакцепторных т. РНК • Они присоединяют аминокислотный остаток к 2’- или 3’-гидроксильной группе 3’- концевого нуклеотида. • Реакция протекает в две стадии
 Суммарная реакция активации аминокислоты выглядит так:
Суммарная реакция активации аминокислоты выглядит так:
 • На синтез аминоацил-т. РНК затрачиваются две богатые энергией фосфатные связи. • Одна из них расходуется на образование эфирной связи между аминокислотой и т. РНК, • а другая (при гидролизе пирофосфата) сдвигает равновесие всей реакции в сторону образования продукта. • Аминоацил-т. РНК содержит активированную сложноэфирную связь и энергии этой связи достаточно для формирования пептидной связи в процессе биосинтеза белка.
• На синтез аминоацил-т. РНК затрачиваются две богатые энергией фосфатные связи. • Одна из них расходуется на образование эфирной связи между аминокислотой и т. РНК, • а другая (при гидролизе пирофосфата) сдвигает равновесие всей реакции в сторону образования продукта. • Аминоацил-т. РНК содержит активированную сложноэфирную связь и энергии этой связи достаточно для формирования пептидной связи в процессе биосинтеза белка.
 • Аминоацил-т. РНК-синтетазы должны распознавать не только свою аминокислоту, но и набор своих т. РНК. • От точности этого распознавания зависит в конечном итоге правильность реализации генетической информации в процессе биосинтеза белка. • Аминоацил-т. РНК-синтетазы обладают корректирующей активностью – способны вырезать неправильно присоединенный остаток аминокислоты. • Аминоацил-т. РНК с ошибочно присоединенным аминокислотным остатком будет участвовать в биосинтезе белка и будет обеспечивать ошибочное встраивание аминокислотного остатка в растущую полипептидную цепь
• Аминоацил-т. РНК-синтетазы должны распознавать не только свою аминокислоту, но и набор своих т. РНК. • От точности этого распознавания зависит в конечном итоге правильность реализации генетической информации в процессе биосинтеза белка. • Аминоацил-т. РНК-синтетазы обладают корректирующей активностью – способны вырезать неправильно присоединенный остаток аминокислоты. • Аминоацил-т. РНК с ошибочно присоединенным аминокислотным остатком будет участвовать в биосинтезе белка и будет обеспечивать ошибочное встраивание аминокислотного остатка в растущую полипептидную цепь
 Метиониновая аминоацил-т. РНК-синтетаза кишечной палочки
Метиониновая аминоацил-т. РНК-синтетаза кишечной палочки
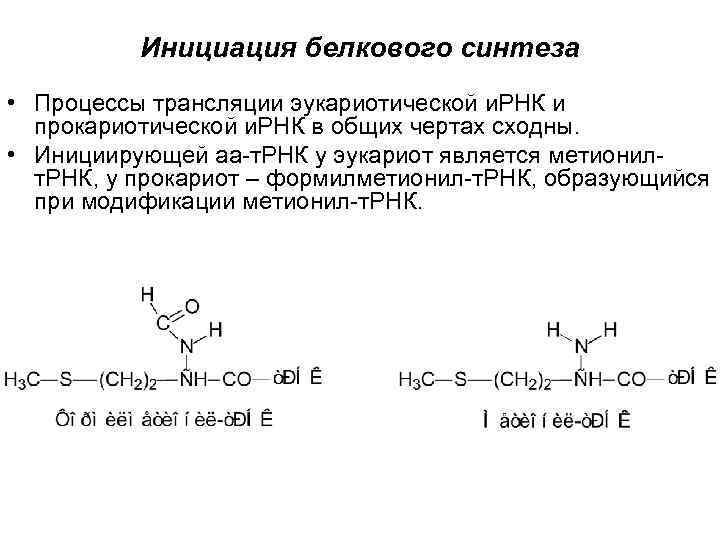
 Инициация белкового синтеза • Процессы трансляции эукариотической и. РНК и прокариотической и. РНК в общих чертах сходны. • Инициирующей аа-т. РНК у эукариот является метионил- т. РНК, у прокариот – формилметионил-т. РНК, образующийся при модификации метионил-т. РНК.
Инициация белкового синтеза • Процессы трансляции эукариотической и. РНК и прокариотической и. РНК в общих чертах сходны. • Инициирующей аа-т. РНК у эукариот является метионил- т. РНК, у прокариот – формилметионил-т. РНК, образующийся при модификации метионил-т. РНК.
 • Образование фмет-т. РНКфмет происходит в две стадии 1) мет + т. РНКфмет мет-т. РНКфмет 2) мет-т. РНКфмет + формилфенилтетрогидрофолат фмет-т. РНКфмет + фенилтетрогидрофолат • Для встраивания метионина внутрь цепи белка используется мет-т. РНКмет , узнающая тот же кодон • У эукариот для инициации синтеза белка используется специальная инициирующая мет-т. РНКмет • Инициирующей аминокислотой в митохондриях является формилметионин
• Образование фмет-т. РНКфмет происходит в две стадии 1) мет + т. РНКфмет мет-т. РНКфмет 2) мет-т. РНКфмет + формилфенилтетрогидрофолат фмет-т. РНКфмет + фенилтетрогидрофолат • Для встраивания метионина внутрь цепи белка используется мет-т. РНКмет , узнающая тот же кодон • У эукариот для инициации синтеза белка используется специальная инициирующая мет-т. РНКмет • Инициирующей аминокислотой в митохондриях является формилметионин
 • Инициация начинается с присоединения к малой субъединице рибосомы и. РНК и первой аминоацил-т. РНК (аа -т. РНК), антикодон которой комплементарен инициирующему кодону АУГ. • После связывания антикодона т. РНК с инициирующим кодоном происходит присоединение большой субъединицы рибосомы. • Образовался инициирующий комплекс, в котором инициирующая аа-т. РНК находится в Р (пептидильном)- центре, а А (аминоацильный) – центр свободен. • Для осуществления инициации трансляции необходима энергия. Ее поставляет ГТФ. Энергия высвобождается при гидролизе ГТФ до ГДФ и фосфата.
• Инициация начинается с присоединения к малой субъединице рибосомы и. РНК и первой аминоацил-т. РНК (аа -т. РНК), антикодон которой комплементарен инициирующему кодону АУГ. • После связывания антикодона т. РНК с инициирующим кодоном происходит присоединение большой субъединицы рибосомы. • Образовался инициирующий комплекс, в котором инициирующая аа-т. РНК находится в Р (пептидильном)- центре, а А (аминоацильный) – центр свободен. • Для осуществления инициации трансляции необходима энергия. Ее поставляет ГТФ. Энергия высвобождается при гидролизе ГТФ до ГДФ и фосфата.
 • Комплементарное взаимодействие актикодона инициирующей аминоацил-т. РНК c инициирующим кодоном определяет правильную рамку считывания полинуклеотидной последовательности и. РНК
• Комплементарное взаимодействие актикодона инициирующей аминоацил-т. РНК c инициирующим кодоном определяет правильную рамку считывания полинуклеотидной последовательности и. РНК
 • Правильная ориентация инициирующего кодона на малой субъединице рибосомы определяется последовательностью Шайна-Дальгарно, расположенной за 3 -8 нуклеотидов перед триплетом АУГ. • Последовательность Шайна-Дальгарно связывается комплементарно с 16 S р. РНК, обеспечивая тем самым начало синтеза белка с инициирующего кодона.
• Правильная ориентация инициирующего кодона на малой субъединице рибосомы определяется последовательностью Шайна-Дальгарно, расположенной за 3 -8 нуклеотидов перед триплетом АУГ. • Последовательность Шайна-Дальгарно связывается комплементарно с 16 S р. РНК, обеспечивая тем самым начало синтеза белка с инициирующего кодона.
 • В инициации трансляции прокариот участвуют белковые факторы инициации: IF-1, IF-2 и IF-3. • Факторы IF-1 и IF-3 влияют на организацию рибосомы в процессе инициации трансляции. • Фактор IF-2 в комплексе с ГТФ взаимодействует с инициирующей аминоацил-т. РНК, обеспечивая ее взаимодействие с инициирующим кодоном. • Этот фактор обладает ГТФазной активностью, т. е. он катализирует гидролиз ГТФ до ГДФ и фосфата. Высвобождаемая при этом энергия используется для осуществления инициации трансляции.
• В инициации трансляции прокариот участвуют белковые факторы инициации: IF-1, IF-2 и IF-3. • Факторы IF-1 и IF-3 влияют на организацию рибосомы в процессе инициации трансляции. • Фактор IF-2 в комплексе с ГТФ взаимодействует с инициирующей аминоацил-т. РНК, обеспечивая ее взаимодействие с инициирующим кодоном. • Этот фактор обладает ГТФазной активностью, т. е. он катализирует гидролиз ГТФ до ГДФ и фосфата. Высвобождаемая при этом энергия используется для осуществления инициации трансляции.
 • Инициация трансляции у эукариот обеспечивается большим числом факторов инициации. • Среди них выделяют собственно факторы инициации, обозначаемые e. IF 1 – e. IF 5. • Факторы e. IF 1 – e. IF 3 в комплексе с дополнительными факторами (e. IF-2 B и e. IF-S) обеспечивают присоединение инициирующей аминоацил-т. РНК и и. РНК к субъединицам рибосомы. • Факторы IF 4, e. IF 5 и некоторые дополнительные факторы осуществляют подготовку и. РНК к инициации трансляции.
• Инициация трансляции у эукариот обеспечивается большим числом факторов инициации. • Среди них выделяют собственно факторы инициации, обозначаемые e. IF 1 – e. IF 5. • Факторы e. IF 1 – e. IF 3 в комплексе с дополнительными факторами (e. IF-2 B и e. IF-S) обеспечивают присоединение инициирующей аминоацил-т. РНК и и. РНК к субъединицам рибосомы. • Факторы IF 4, e. IF 5 и некоторые дополнительные факторы осуществляют подготовку и. РНК к инициации трансляции.
 Элонгация белкового синтеза • В процессе элонгации происходит наращивание полипептидной цепи. • В А-центре происходит связывание следующей аа-т. РНК, антикодон которой комплементарен следующему кодону. • Далее происходит образование пептидной связи за счет пептидилтрансферазной реакции. В результате образуется дипетидил-т. РНК. • Катализирует этот процесс р. РНК большой субъединицы рибосомы. • Далее рибосома перемещается на один кодон в направлении от 5’- к 3’-концу м. РНК. • Дипептидил-т. РНК из А-центра перемещается в Р-центр • А-центр освобождается, здесь оказывается следующий кодон. • Инициирующая т. РНК покидает рибосому.
Элонгация белкового синтеза • В процессе элонгации происходит наращивание полипептидной цепи. • В А-центре происходит связывание следующей аа-т. РНК, антикодон которой комплементарен следующему кодону. • Далее происходит образование пептидной связи за счет пептидилтрансферазной реакции. В результате образуется дипетидил-т. РНК. • Катализирует этот процесс р. РНК большой субъединицы рибосомы. • Далее рибосома перемещается на один кодон в направлении от 5’- к 3’-концу м. РНК. • Дипептидил-т. РНК из А-центра перемещается в Р-центр • А-центр освобождается, здесь оказывается следующий кодон. • Инициирующая т. РНК покидает рибосому.
 • Рибосома готова к новому циклу элонгации. • Далее рибосома перемещается на один кодон в направлении от 5’- к 3’-концу и. РНК. • Инициирующая т. РНК покидает рибосому. Дипептидил-т. РНК перемещается из А-центра в Р-центр. • При этом А-центр освобождается, здесь оказывается следующий триплет. • Теперь рибосома готова к новому циклу элонгации. Дипептид с дипептидил-т. РНК переносится на следующую аминоацил-т. РНК, находящуюся в А-центре, что приводит к образованию трипептидил-т. РНК. • Последняя вступает в следующем цикл элонгации. Рассмотренные циклы продолжаются до тех пор, пока рибосома не достигнет терминирующих кодонов. • В процессе трансляции затрачивается энергия, освобождающаяся при гидролизе ГТФ до ГДФ и фосфата.
• Рибосома готова к новому циклу элонгации. • Далее рибосома перемещается на один кодон в направлении от 5’- к 3’-концу и. РНК. • Инициирующая т. РНК покидает рибосому. Дипептидил-т. РНК перемещается из А-центра в Р-центр. • При этом А-центр освобождается, здесь оказывается следующий триплет. • Теперь рибосома готова к новому циклу элонгации. Дипептид с дипептидил-т. РНК переносится на следующую аминоацил-т. РНК, находящуюся в А-центре, что приводит к образованию трипептидил-т. РНК. • Последняя вступает в следующем цикл элонгации. Рассмотренные циклы продолжаются до тех пор, пока рибосома не достигнет терминирующих кодонов. • В процессе трансляции затрачивается энергия, освобождающаяся при гидролизе ГТФ до ГДФ и фосфата.
 • Пептидилтрансферазная реакция:
• Пептидилтрансферазная реакция:
 Терминация • Терминация белового синтеза наступает, как только в А-центре окажется один из терминирующих кодонов: УАГ, УГА, УАА. • В этом процессе участвуют специфические белки – факторы терминации. У бактерий они обозначаются как RF-1, RF-2 и RF-3. У эукариот в терминации трансляции участвует один фактор – R • В результате терминации происходит гидролитическое отщепление полипептида от т. РНК, т. РНК отделяется от рибосомы, рибосома диссоциируют на субъединицы. • Поставщиком энергии для терминации синтеза белка так же, как и для инициации и элонгации, является ГТФ.
Терминация • Терминация белового синтеза наступает, как только в А-центре окажется один из терминирующих кодонов: УАГ, УГА, УАА. • В этом процессе участвуют специфические белки – факторы терминации. У бактерий они обозначаются как RF-1, RF-2 и RF-3. У эукариот в терминации трансляции участвует один фактор – R • В результате терминации происходит гидролитическое отщепление полипептида от т. РНК, т. РНК отделяется от рибосомы, рибосома диссоциируют на субъединицы. • Поставщиком энергии для терминации синтеза белка так же, как и для инициации и элонгации, является ГТФ.
 • Высокая скорость биосинтеза белка может быть обеспечена одновременным участием многих рибосом в трансляции одной и. РНК. Комплекс, состоящий из и. РНК и рибосом, называется полисомой. • Высокая точность трансляции обеспечивается большими затратами энергии. На включение одного аминокислотного остатка в полипептидную цепь расходуются 4 макроэргические связи, две при активации аминокислот и две при образовании пептидной связи. • Важную роль в формировании такой структуры играют особые белки шапероны. Они осуществляют укладку полипептидов сразу же после их выхода с рибосом. • Новосинтезированные белки в клетке могут подвергаться химическим модификациям, в результате которых они становятся биологически активными.
• Высокая скорость биосинтеза белка может быть обеспечена одновременным участием многих рибосом в трансляции одной и. РНК. Комплекс, состоящий из и. РНК и рибосом, называется полисомой. • Высокая точность трансляции обеспечивается большими затратами энергии. На включение одного аминокислотного остатка в полипептидную цепь расходуются 4 макроэргические связи, две при активации аминокислот и две при образовании пептидной связи. • Важную роль в формировании такой структуры играют особые белки шапероны. Они осуществляют укладку полипептидов сразу же после их выхода с рибосом. • Новосинтезированные белки в клетке могут подвергаться химическим модификациям, в результате которых они становятся биологически активными.
 Спасибо за внимание
Спасибо за внимание

