Translyatsia_ML-116_(2012-13).pptx
- Количество слайдов: 22
 Трансляция МЛ-110
Трансляция МЛ-110
 Трансляция (от лат. translatioперевод)- процесс биосинтеза полипептидных цепей белков в живых клетках
Трансляция (от лат. translatioперевод)- процесс биосинтеза полипептидных цепей белков в живых клетках
 План презентации: 1. Строение рибосомы 2. Принципы и условия трансляции 3. Образование аминоацил-т. РНК 4. Этапы трансляции: Ø Инициация Ø Элонгация Ø Терминация 5. Основные отличия и особенности трансляции у эукариот и прокариот 6. Биологическое значение Трансляции.
План презентации: 1. Строение рибосомы 2. Принципы и условия трансляции 3. Образование аминоацил-т. РНК 4. Этапы трансляции: Ø Инициация Ø Элонгация Ø Терминация 5. Основные отличия и особенности трансляции у эукариот и прокариот 6. Биологическое значение Трансляции.
 Строение рибосомы Рибосома — важнейший органоид живой клетки сферической или слегка эллипсоидной формы, диаметром 100— 200 ангстрем, состоящий из большой и малой субъединиц. Рибосомы служат для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК, или м. РНК. В эукариотических клетках рибосомы располагаются на мембранах эндоплазматического ретикулума, хотя могут быть локализованы и в неприкрепленной форме в цитоплазме. Нередко с одной молекулой м. РНК ассоциировано несколько рибосом, такая структура называется полирибосомой. Синтез рибосом у эукариот происходит в специальной внутриядерной структуре — ядрышке. Рибосомы эукариот включают четыре молекулы р. РНК, из них 18 S, 5. 8 S и 28 S р. РНК синтезируются в ядрышке РНК полимеразой I в виде единого предшественника (45 S), который затем подвергается модификациям и нарезанию. 5 S р. РНК синтезируется РНК полимеразой III в другой части генома и не нуждаются в дополнительных модификациях.
Строение рибосомы Рибосома — важнейший органоид живой клетки сферической или слегка эллипсоидной формы, диаметром 100— 200 ангстрем, состоящий из большой и малой субъединиц. Рибосомы служат для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК, или м. РНК. В эукариотических клетках рибосомы располагаются на мембранах эндоплазматического ретикулума, хотя могут быть локализованы и в неприкрепленной форме в цитоплазме. Нередко с одной молекулой м. РНК ассоциировано несколько рибосом, такая структура называется полирибосомой. Синтез рибосом у эукариот происходит в специальной внутриядерной структуре — ядрышке. Рибосомы эукариот включают четыре молекулы р. РНК, из них 18 S, 5. 8 S и 28 S р. РНК синтезируются в ядрышке РНК полимеразой I в виде единого предшественника (45 S), который затем подвергается модификациям и нарезанию. 5 S р. РНК синтезируется РНК полимеразой III в другой части генома и не нуждаются в дополнительных модификациях.
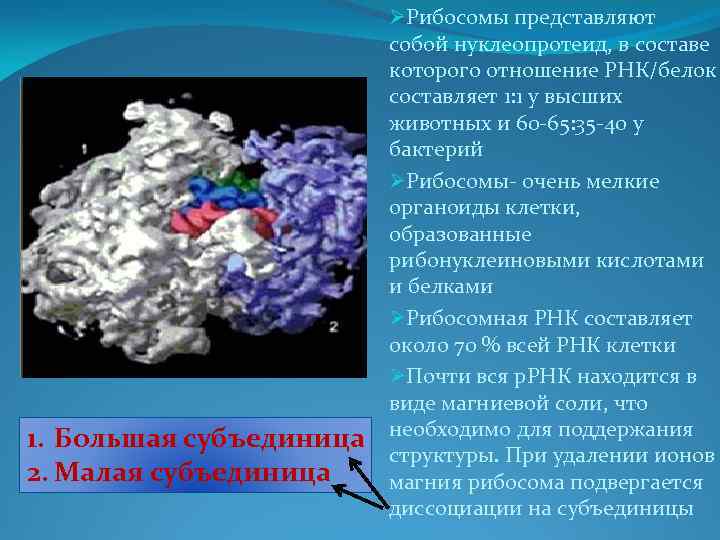 1. Большая субъединица 2. Малая субъединица ØРибосомы представляют собой нуклеопротеид, в составе которого отношение РНК/белок составляет 1: 1 у высших животных и 60 -65: 35 -40 у бактерий ØРибосомы- очень мелкие органоиды клетки, образованные рибонуклеиновыми кислотами и белками ØРибосомная РНК составляет около 70 % всей РНК клетки ØПочти вся р. РНК находится в виде магниевой соли, что необходимо для поддержания структуры. При удалении ионов магния рибосома подвергается диссоциации на субъединицы
1. Большая субъединица 2. Малая субъединица ØРибосомы представляют собой нуклеопротеид, в составе которого отношение РНК/белок составляет 1: 1 у высших животных и 60 -65: 35 -40 у бактерий ØРибосомы- очень мелкие органоиды клетки, образованные рибонуклеиновыми кислотами и белками ØРибосомная РНК составляет около 70 % всей РНК клетки ØПочти вся р. РНК находится в виде магниевой соли, что необходимо для поддержания структуры. При удалении ионов магния рибосома подвергается диссоциации на субъединицы
 Каждая рибосома состоит из двух частиц- малой и большой. Малая субъединица имеет два участка связывания: А-участок - аминоацил-т. РНК-связывающий (для поступающих аминокислот), Р-участок - аминоацилпептидил-т. РНК-связывающий (для синтезируемой полипептидной цепочки. На большой субъединице находится центр, катализирующий образование пептидной связи. Так как пептидная связь образуется путем переноса синтезируемого пептида на аминоацил-т. РНК, он носит название пептидилтрансферазного центра. На большой субъединице находится также участок, связывающий вспомогательные белки, называемыефакторами трансляции. Субъединицы рибосомы способны разделяться и объединяться при участии дополнительных белков. Основной функцией рибосом является синтез белков
Каждая рибосома состоит из двух частиц- малой и большой. Малая субъединица имеет два участка связывания: А-участок - аминоацил-т. РНК-связывающий (для поступающих аминокислот), Р-участок - аминоацилпептидил-т. РНК-связывающий (для синтезируемой полипептидной цепочки. На большой субъединице находится центр, катализирующий образование пептидной связи. Так как пептидная связь образуется путем переноса синтезируемого пептида на аминоацил-т. РНК, он носит название пептидилтрансферазного центра. На большой субъединице находится также участок, связывающий вспомогательные белки, называемыефакторами трансляции. Субъединицы рибосомы способны разделяться и объединяться при участии дополнительных белков. Основной функцией рибосом является синтез белков
 Трансляция Принципы : Условия: Ø Матричность Ø м. РНК Ø Рибосомы Ø Аминокислоты Ø т. РНК Ø Ферменты(факторы трансляции IF) Ø Энергия(АТФ; ГТФ) Ø Среда.
Трансляция Принципы : Условия: Ø Матричность Ø м. РНК Ø Рибосомы Ø Аминокислоты Ø т. РНК Ø Ферменты(факторы трансляции IF) Ø Энергия(АТФ; ГТФ) Ø Среда.
 Схема образования аминоацил-т. РНК ØНа первом этапе происходит активация аминокислоты АТРазой: аминокислота+ АТР→аминоацил-AMP +РР(пирофосфат). ØНа втором этапе активированная аминокислота соединяется с соответствующей т. РНК: аминоацил-AMP + т. РНК→аминоацил-т. РНК + АМР. ØСуммарное уравнение двух реакций: аминокислота + т. РНК + ATP →аминоацил-т. РНК + AMP + PPi
Схема образования аминоацил-т. РНК ØНа первом этапе происходит активация аминокислоты АТРазой: аминокислота+ АТР→аминоацил-AMP +РР(пирофосфат). ØНа втором этапе активированная аминокислота соединяется с соответствующей т. РНК: аминоацил-AMP + т. РНК→аминоацил-т. РНК + АМР. ØСуммарное уравнение двух реакций: аминокислота + т. РНК + ATP →аминоацил-т. РНК + AMP + PPi
 Этапы трансляции В сильно упрощённом виде трансляция включает следующие стадии. Синтезированная в клеточном ядре в ходе транскрипции молекула и. РНК поступает в цитоплазму, претерпевает ряд модификаций и соединяется с рибосомой (в клетках прокариот, не разделённых на ядро и цитоплазму, и. РНК связывается с рибосомой сразу). Находящиеся в цитоплазме аминокислоты активируются взаимодействием с богатым энергией соединением – АТФ. Поскольку аминокислоты и и. РНК в силу их химического строения «не соответствуют» другу (не могут взаимодействовать), между ними существует своего рода переходник – транспортные РНК (т. РНК). Активированные специальным ферментом аминокислоты с участием этого же фермента (для каждого вида аминокислоты – своего) соединяются т-РНК, также только со своей. Далее т. РНК, несущая аминокислоту, поступает на рибосому и своим антикодоном (тройкой нуклеотидов), узнав на и. РНК свой кодон (комплентарную тройку нуклеотидов), закрепляется на и. РНК на единственном свободном месте рядом со строящейся полипептидной цепью. Специальный фермент рибосомы образует пептидную связь между аминокислотой и синтезируемым полипептидом, а рибосома сдвигается по цепи и. РНК на один кодон, освобождая место для присоединения следующей т. РН К. Так происходит наращивание полипептидной цепи до тех пор, пока рибосома не дойдёт до «стоп-кодона» . Получив сигнал окончания синтеза, белковые факторы терминации освобождают полипептидную цепь от рибосомы. Таким образом кодоны и. РНК определяют последовательность аминокислот в белке, а следовательно, его строение, свойства и активность.
Этапы трансляции В сильно упрощённом виде трансляция включает следующие стадии. Синтезированная в клеточном ядре в ходе транскрипции молекула и. РНК поступает в цитоплазму, претерпевает ряд модификаций и соединяется с рибосомой (в клетках прокариот, не разделённых на ядро и цитоплазму, и. РНК связывается с рибосомой сразу). Находящиеся в цитоплазме аминокислоты активируются взаимодействием с богатым энергией соединением – АТФ. Поскольку аминокислоты и и. РНК в силу их химического строения «не соответствуют» другу (не могут взаимодействовать), между ними существует своего рода переходник – транспортные РНК (т. РНК). Активированные специальным ферментом аминокислоты с участием этого же фермента (для каждого вида аминокислоты – своего) соединяются т-РНК, также только со своей. Далее т. РНК, несущая аминокислоту, поступает на рибосому и своим антикодоном (тройкой нуклеотидов), узнав на и. РНК свой кодон (комплентарную тройку нуклеотидов), закрепляется на и. РНК на единственном свободном месте рядом со строящейся полипептидной цепью. Специальный фермент рибосомы образует пептидную связь между аминокислотой и синтезируемым полипептидом, а рибосома сдвигается по цепи и. РНК на один кодон, освобождая место для присоединения следующей т. РН К. Так происходит наращивание полипептидной цепи до тех пор, пока рибосома не дойдёт до «стоп-кодона» . Получив сигнал окончания синтеза, белковые факторы терминации освобождают полипептидную цепь от рибосомы. Таким образом кодоны и. РНК определяют последовательность аминокислот в белке, а следовательно, его строение, свойства и активность.
 Инициация Стадия инициации, являющаяся «точкой отсчета» начала синтеза белка, требует соблюдения ряда условий, в частности наличия в системе, помимо 70 S (или 80 S) рибосом, инициаторной амино-ацил-т. РНК (аа-т. РНК), инициирующих кодонов в составе м. РНК и белковых факторов инициации. Экспериментально доказано, что синтез белка инициирует единственная аминокислота – метионин. Соответственно эти т. РНК принято обозначать т. РНКф. Мет и т. РНКМет. Укажем также, что эукариотическая клетка не нуждается в формилировании метионина. У прокариот синтез N-формилметионил-т. РНК протекает в две стадии: Данную стадию катализирует метионил-т. РНК-синтетаза. Реакция нуждается в доставке энергии гидролиза АТФ.
Инициация Стадия инициации, являющаяся «точкой отсчета» начала синтеза белка, требует соблюдения ряда условий, в частности наличия в системе, помимо 70 S (или 80 S) рибосом, инициаторной амино-ацил-т. РНК (аа-т. РНК), инициирующих кодонов в составе м. РНК и белковых факторов инициации. Экспериментально доказано, что синтез белка инициирует единственная аминокислота – метионин. Соответственно эти т. РНК принято обозначать т. РНКф. Мет и т. РНКМет. Укажем также, что эукариотическая клетка не нуждается в формилировании метионина. У прокариот синтез N-формилметионил-т. РНК протекает в две стадии: Данную стадию катализирует метионил-т. РНК-синтетаза. Реакция нуждается в доставке энергии гидролиза АТФ.
 Катализирующая II стадию трансформилаза оказалась более специфичной, чем метионил-т. РНКсинтетаза: она не формилирует ни свободный метионин, ни метионин в комплексе с т. РНКМет. Таким образом, N-формилметионил-т. РНК является первой аа-т. РНК, которая определяет включение N-концевого остатка аминокислоты и тем самым начало трансляции. К настоящему времени выяснена природа белковых факторов инициации. У Е. coli открыты три таких инициирующих фактора, обозначаемых соответственно IF-1, IF-2, IF-3. Все они получены в высокоочищенном состоянии с примерными молекулярными массами 9000, 10000 и 22000 соответственно. IF-3 обеспечивает узнавание участка на молекуле м. РНК, к которому присоединяется формилметионил-т. РНК. Данный белковый фактор первым связывается со свободной 30 S субчастицей рибосомы и препятствует ассоциации 30 S и 50 S субчастиц в 70 S рибосому без молекулы м. РНК. IF-1 способствует связыванию инициатор-ной формилметионил-т. РНК с комплексом 30 S субчастицы и м. РНК. Белковый фактор IF-2, вероятнее всего, способствует объединению 30 S и 50 S субчастиц после того, как на первой субчастице уже присутствуют инициирующие кодоны м. РНК, N-формилметионил-т. РНК, IF-3, IF-1 и ГТФ. Этот белок рассматривают как фактор стабилизации всего инициаторного 70 S комплекса. Аналогичные белковые факторы инициации обнаружены также в эука-риотических клетках. Открыто около 10 эукариотических белковых факторов инициации, их принято обозначать e. IF. Все они, по-видимому, важны для инициации, однако только три из них абсолютно необходимы и существенны для белкового синтеза: e. IF-2, e. IF-3 и e. IF-5. Они получены в чистом виде: e. IF-2 состоит из α-, β- и γ-субъединиц (мол. масса 38000, 47000 и 50000 соответственно), e. IF-3 (мол. масса 500000– 700000) и e. IF-5 (мол. масса 125000).
Катализирующая II стадию трансформилаза оказалась более специфичной, чем метионил-т. РНКсинтетаза: она не формилирует ни свободный метионин, ни метионин в комплексе с т. РНКМет. Таким образом, N-формилметионил-т. РНК является первой аа-т. РНК, которая определяет включение N-концевого остатка аминокислоты и тем самым начало трансляции. К настоящему времени выяснена природа белковых факторов инициации. У Е. coli открыты три таких инициирующих фактора, обозначаемых соответственно IF-1, IF-2, IF-3. Все они получены в высокоочищенном состоянии с примерными молекулярными массами 9000, 10000 и 22000 соответственно. IF-3 обеспечивает узнавание участка на молекуле м. РНК, к которому присоединяется формилметионил-т. РНК. Данный белковый фактор первым связывается со свободной 30 S субчастицей рибосомы и препятствует ассоциации 30 S и 50 S субчастиц в 70 S рибосому без молекулы м. РНК. IF-1 способствует связыванию инициатор-ной формилметионил-т. РНК с комплексом 30 S субчастицы и м. РНК. Белковый фактор IF-2, вероятнее всего, способствует объединению 30 S и 50 S субчастиц после того, как на первой субчастице уже присутствуют инициирующие кодоны м. РНК, N-формилметионил-т. РНК, IF-3, IF-1 и ГТФ. Этот белок рассматривают как фактор стабилизации всего инициаторного 70 S комплекса. Аналогичные белковые факторы инициации обнаружены также в эука-риотических клетках. Открыто около 10 эукариотических белковых факторов инициации, их принято обозначать e. IF. Все они, по-видимому, важны для инициации, однако только три из них абсолютно необходимы и существенны для белкового синтеза: e. IF-2, e. IF-3 и e. IF-5. Они получены в чистом виде: e. IF-2 состоит из α-, β- и γ-субъединиц (мол. масса 38000, 47000 и 50000 соответственно), e. IF-3 (мол. масса 500000– 700000) и e. IF-5 (мол. масса 125000).
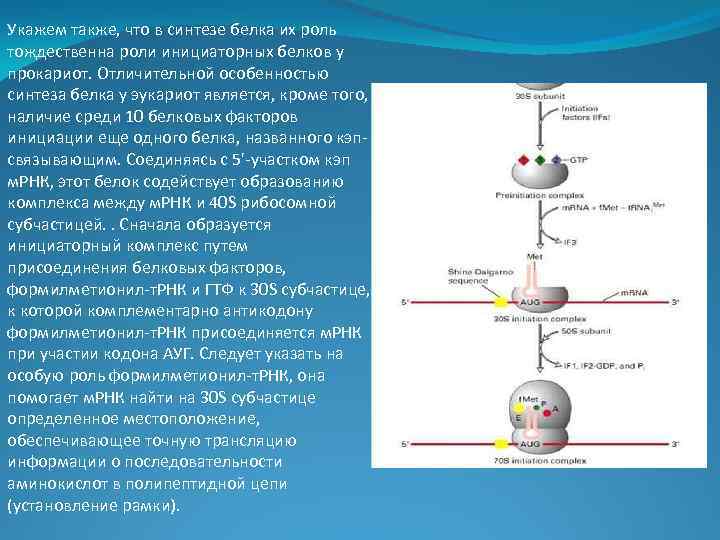 Укажем также, что в синтезе белка их роль тождественна роли инициаторных белков у прокариот. Отличительной особенностью синтеза белка у эукариот является, кроме того, наличие среди 10 белковых факторов инициации еще одного белка, названного кэпсвязывающим. Соединяясь с 5'-участком кэп м. РНК, этот белок содействует образованию комплекса между м. РНК и 40 S рибосомной субчастицей. . Сначала образуется инициаторный комплекс путем присоединения белковых факторов, формилметионил-т. РНК и ГТФ к 30 S субчастице, к которой комплементарно антикодону формилметионил-т. РНК присоединяется м. РНК при участии кодона АУГ. Следует указать на особую роль формилметионил-т. РНК, она помогает м. РНК найти на 30 S субчастице определенное местоположение, обеспечивающее точную трансляцию информации о последовательности аминокислот в полипептидной цепи (установление рамки).
Укажем также, что в синтезе белка их роль тождественна роли инициаторных белков у прокариот. Отличительной особенностью синтеза белка у эукариот является, кроме того, наличие среди 10 белковых факторов инициации еще одного белка, названного кэпсвязывающим. Соединяясь с 5'-участком кэп м. РНК, этот белок содействует образованию комплекса между м. РНК и 40 S рибосомной субчастицей. . Сначала образуется инициаторный комплекс путем присоединения белковых факторов, формилметионил-т. РНК и ГТФ к 30 S субчастице, к которой комплементарно антикодону формилметионил-т. РНК присоединяется м. РНК при участии кодона АУГ. Следует указать на особую роль формилметионил-т. РНК, она помогает м. РНК найти на 30 S субчастице определенное местоположение, обеспечивающее точную трансляцию информации о последовательности аминокислот в полипептидной цепи (установление рамки).
 Элонгация Процесс элонгации полипептидной цепи у Е. coli начинается с образования первой пептидной связи и непосредственно, точнее топографически, связан с большой субчастицей (50 S) рибосомы, содержащей два центра для связывания т. РНК, один из них называется аминоацильным (А), другой – пептидильным (П) В процессе элонгации у Е. coli также участвует три белковых фактора – элонгационные факторы трансляции, сокращенно обозначаемые Tu, Ts и G. У эукариот также открыты три таких фактора, названных эукариотическими элонгационными факторами трансляции и обозначаемых соответственно e. EF-1α, e. EF-1αβ и e. EF-2, почти все они получены в чистом виде, для ряда из них установлена первичная структура. Процесс элонгации принято делить на 3 стадии: узнавание кодона и связывание аминоацил-т. РНК, образование пептидной связи и транслокация.
Элонгация Процесс элонгации полипептидной цепи у Е. coli начинается с образования первой пептидной связи и непосредственно, точнее топографически, связан с большой субчастицей (50 S) рибосомы, содержащей два центра для связывания т. РНК, один из них называется аминоацильным (А), другой – пептидильным (П) В процессе элонгации у Е. coli также участвует три белковых фактора – элонгационные факторы трансляции, сокращенно обозначаемые Tu, Ts и G. У эукариот также открыты три таких фактора, названных эукариотическими элонгационными факторами трансляции и обозначаемых соответственно e. EF-1α, e. EF-1αβ и e. EF-2, почти все они получены в чистом виде, для ряда из них установлена первичная структура. Процесс элонгации принято делить на 3 стадии: узнавание кодона и связывание аминоацил-т. РНК, образование пептидной связи и транслокация.
 На I стадии в соответствии с природой кодона м. РНК в свободный А-участок рибосомы доставляется аминоацил-т. РНК при участии фактора элонгации Tu. Этот процесс требует затраты энергии и сопряжен с гидролизом ГТФ и образованием прочно связанного комплекса Тu–ГТФ. Образовавшийся комплекс подвергается диссоциации только в присутствии второго фактора элонгации Ts, при котором освободившийся фактор Tu может вновь, соединяясь с молекулой ГТФ, принять участие в доставке аа-т. РНК в рибосому. Таким образом, в транслирующей 70 S рибосоме в пептидильном центре располагается формилметионил-т. РНК, а в А-центре – аминоацил-т. РНК (первая аминокислота после метионина). С этого момента начинается II стадия элонгации – образование первой пептидной связи. Для этого в рибосоме осуществляется ферментативная реакция транспептидирования между формилметионил-т. РНК в П-центре и новой аа-т. РНК в А-центре. В процессе этой реакции остаток формилметионина переносится на свободную NH 2 -группу аа-т. РНК и замыкается первая пептидная связь в будущей полипептидной цепи. Параллельно из пептидильного центра освобождается т. РНКф. Мет в цитозоль. Фермент, катализирующий реакцию транспептирования, получил название пептидил-трансферазы. Таким образом, в процессе транспептидазной реакции в А-центре образуется дипептидил-т. РНК, а П-центр остается свободным ( «вакантным» ).
На I стадии в соответствии с природой кодона м. РНК в свободный А-участок рибосомы доставляется аминоацил-т. РНК при участии фактора элонгации Tu. Этот процесс требует затраты энергии и сопряжен с гидролизом ГТФ и образованием прочно связанного комплекса Тu–ГТФ. Образовавшийся комплекс подвергается диссоциации только в присутствии второго фактора элонгации Ts, при котором освободившийся фактор Tu может вновь, соединяясь с молекулой ГТФ, принять участие в доставке аа-т. РНК в рибосому. Таким образом, в транслирующей 70 S рибосоме в пептидильном центре располагается формилметионил-т. РНК, а в А-центре – аминоацил-т. РНК (первая аминокислота после метионина). С этого момента начинается II стадия элонгации – образование первой пептидной связи. Для этого в рибосоме осуществляется ферментативная реакция транспептидирования между формилметионил-т. РНК в П-центре и новой аа-т. РНК в А-центре. В процессе этой реакции остаток формилметионина переносится на свободную NH 2 -группу аа-т. РНК и замыкается первая пептидная связь в будущей полипептидной цепи. Параллельно из пептидильного центра освобождается т. РНКф. Мет в цитозоль. Фермент, катализирующий реакцию транспептирования, получил название пептидил-трансферазы. Таким образом, в процессе транспептидазной реакции в А-центре образуется дипептидил-т. РНК, а П-центр остается свободным ( «вакантным» ).
 На III стадии процесса элонгации необходимо иметь свободный аминоацильный центр для присоединения следующей аа-т. РНК. Для этого благодаря процессу транслокации образовавшийся фрагмент дипептидил-т. РНК переносится от аминоацильного на пептидильный центр. Достигается транслокация благодаря передвижению рибосомы относительно м. РНК при участии фермента транслоказы (функцию ее выполняет фактор элонгации G у Е. coli и e. EF-2 у эукариот) за счет использования энергии распада еще одной молекулы ГТФ. В результате транслокации дипептидил-т. РНК занимает место в пептидильном центре рибосомы, а аминоацильный центр освобождается для нового цикла узнавания и может присоединить новую следующую аа-т. РНК, соответствующую кодону м. РНК. В процессе транслокации рибосома перемещается вдоль м. РНК по направлению к ее 3'-концу на расстояние в один кодон, т. е. точно на один триплет. Таким образом, на стадии элонгации происходит последовательное наращивание полипептидной цепи по одной аминокислоте в строгом соответствии с последовательностью триплетов (кодонов) в молекуле м. РНК.
На III стадии процесса элонгации необходимо иметь свободный аминоацильный центр для присоединения следующей аа-т. РНК. Для этого благодаря процессу транслокации образовавшийся фрагмент дипептидил-т. РНК переносится от аминоацильного на пептидильный центр. Достигается транслокация благодаря передвижению рибосомы относительно м. РНК при участии фермента транслоказы (функцию ее выполняет фактор элонгации G у Е. coli и e. EF-2 у эукариот) за счет использования энергии распада еще одной молекулы ГТФ. В результате транслокации дипептидил-т. РНК занимает место в пептидильном центре рибосомы, а аминоацильный центр освобождается для нового цикла узнавания и может присоединить новую следующую аа-т. РНК, соответствующую кодону м. РНК. В процессе транслокации рибосома перемещается вдоль м. РНК по направлению к ее 3'-концу на расстояние в один кодон, т. е. точно на один триплет. Таким образом, на стадии элонгации происходит последовательное наращивание полипептидной цепи по одной аминокислоте в строгом соответствии с последовательностью триплетов (кодонов) в молекуле м. РНК.
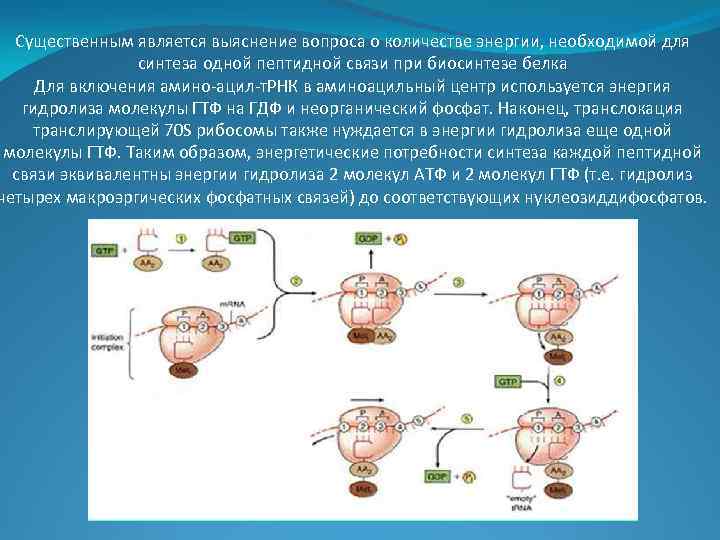 Существенным является выяснение вопроса о количестве энергии, необходимой для синтеза одной пептидной связи при биосинтезе белка Для включения амино-ацил-т. РНК в аминоацильный центр используется энергия гидролиза молекулы ГТФ на ГДФ и неорганический фосфат. Наконец, транслокация транслирующей 70 S рибосомы также нуждается в энергии гидролиза еще одной молекулы ГТФ. Таким образом, энергетические потребности синтеза каждой пептидной связи эквивалентны энергии гидролиза 2 молекул АТФ и 2 молекул ГТФ (т. е. гидролиз четырех макроэргических фосфатных связей) до соответствующих нуклеозиддифосфатов.
Существенным является выяснение вопроса о количестве энергии, необходимой для синтеза одной пептидной связи при биосинтезе белка Для включения амино-ацил-т. РНК в аминоацильный центр используется энергия гидролиза молекулы ГТФ на ГДФ и неорганический фосфат. Наконец, транслокация транслирующей 70 S рибосомы также нуждается в энергии гидролиза еще одной молекулы ГТФ. Таким образом, энергетические потребности синтеза каждой пептидной связи эквивалентны энергии гидролиза 2 молекул АТФ и 2 молекул ГТФ (т. е. гидролиз четырех макроэргических фосфатных связей) до соответствующих нуклеозиддифосфатов.
 Терминация - синтез полипептидной цепи в 70 S рибосоме при участии трех белковых факторов терминации (рилизинг-факторов). Эти белки обозначаются RF-1 (мол. масса 47000), RF-2 (мол. масса 35000– 48000) и RF-3 (мол. масса 46000) у прокариот. В клетках животных открыт один-единственный белок с аналогичным свойством – рилизингфактор R (e. RF, мол. масса 56000– 105000). У Е. coli RF-1 наделен свойством узнавания в молекуле м. РНК терминирующих кодонов УАГ и УАА , a RF-2 – соответственно УГА и УАА. Эукариотический рилизинг-фактор e. RF узнает все три терминирующих кодона (нонсенскодоны) и индуцирует освобождение синтезированного полипептида опосредованно через пептидил-трансферазу. После того как терминирующий кодон м. РНК занимает свое место в аминоацильном центре рибосомы, к нему присоединяется не т. РНК, поскольку отсутствуют соответствующие антикодоны т. РНК, узнающие этот терминальный сигнал, а один из белковых факторов терминации и блокируется дальнейшая элонгация цепи. Считают, что терминирующие кодоны и белковые факторы индуцируют изменение специфичности пеп-тидилтрансферазной активности таким образом, что она катализирует перенос растущей пептидной цепи, скорее, к молекуле воды, вызывая гидролиз, чем к аминогруппе аминокислоты.
Терминация - синтез полипептидной цепи в 70 S рибосоме при участии трех белковых факторов терминации (рилизинг-факторов). Эти белки обозначаются RF-1 (мол. масса 47000), RF-2 (мол. масса 35000– 48000) и RF-3 (мол. масса 46000) у прокариот. В клетках животных открыт один-единственный белок с аналогичным свойством – рилизингфактор R (e. RF, мол. масса 56000– 105000). У Е. coli RF-1 наделен свойством узнавания в молекуле м. РНК терминирующих кодонов УАГ и УАА , a RF-2 – соответственно УГА и УАА. Эукариотический рилизинг-фактор e. RF узнает все три терминирующих кодона (нонсенскодоны) и индуцирует освобождение синтезированного полипептида опосредованно через пептидил-трансферазу. После того как терминирующий кодон м. РНК занимает свое место в аминоацильном центре рибосомы, к нему присоединяется не т. РНК, поскольку отсутствуют соответствующие антикодоны т. РНК, узнающие этот терминальный сигнал, а один из белковых факторов терминации и блокируется дальнейшая элонгация цепи. Считают, что терминирующие кодоны и белковые факторы индуцируют изменение специфичности пеп-тидилтрансферазной активности таким образом, что она катализирует перенос растущей пептидной цепи, скорее, к молекуле воды, вызывая гидролиз, чем к аминогруппе аминокислоты.
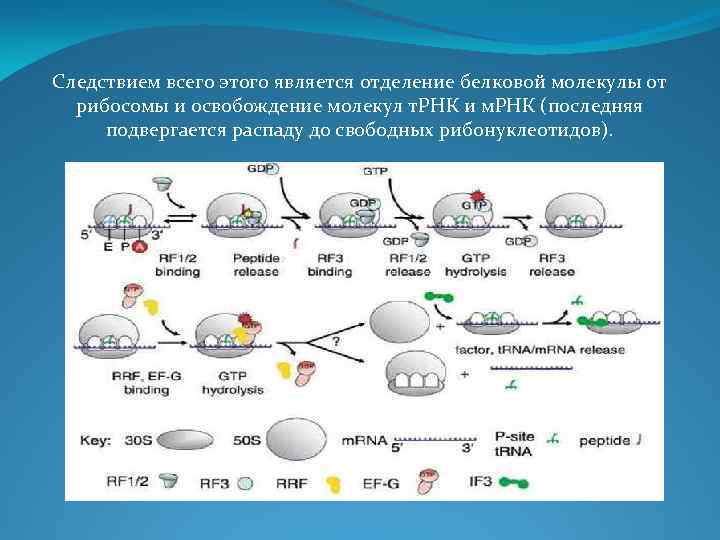 Следствием всего этого является отделение белковой молекулы от рибосомы и освобождение молекул т. РНК и м. РНК (последняя подвергается распаду до свободных рибонуклеотидов).
Следствием всего этого является отделение белковой молекулы от рибосомы и освобождение молекул т. РНК и м. РНК (последняя подвергается распаду до свободных рибонуклеотидов).
 Особенности трансляции у прокариот и эукариот Прокариоты. Синтез белка происходит на рибонуклеопротеиновом комплексе - рибосоме, в процессе трансляции m. RNA. Рибосома состоит из большой и малой субъединиц, которые соединены в области инициации трансляции (translation initiation region -TIR) m. RNA во время стадии инициации трансляции. Во время элонгации рибосома скользит вдоль m. RNA и синтезирует полипептидную цепь. Элонгация продолжается до тех пор, пока рибосома не достигает стоп-кодона на m. RNA - терминация трансляции. После терминации рибосома отделяется от синтезированного полипептида и способна снова повторить цикл трансляции m. RNA. Каждая стадия трансляции имеет свои регуляторные факторы, но у эукариот этих факторов гораздо больше, чем у прокариот.
Особенности трансляции у прокариот и эукариот Прокариоты. Синтез белка происходит на рибонуклеопротеиновом комплексе - рибосоме, в процессе трансляции m. RNA. Рибосома состоит из большой и малой субъединиц, которые соединены в области инициации трансляции (translation initiation region -TIR) m. RNA во время стадии инициации трансляции. Во время элонгации рибосома скользит вдоль m. RNA и синтезирует полипептидную цепь. Элонгация продолжается до тех пор, пока рибосома не достигает стоп-кодона на m. RNA - терминация трансляции. После терминации рибосома отделяется от синтезированного полипептида и способна снова повторить цикл трансляции m. RNA. Каждая стадия трансляции имеет свои регуляторные факторы, но у эукариот этих факторов гораздо больше, чем у прокариот.
 Эукариоты. Вместо комплементарного РНК-РНК узнавания, в которое вовлечена прединициирующая последовательность Шайна-Дальгарно прокариотических м. РНК, эукариотические м. РНК узнаются эукариотическими рибосомами по кэпированному 5'концу с обязательным участием белка, например, e. IF-4 F инициаторного фактора. Предполагается, что этот белок участвует в расплавлении вторичных структур 5'- областей м. РНК, облегчая их связывание с малыми субчастицами рибосом. В отличие от прокариот, эукариотическая м. РНК образует комплексы с белками , что обусловливает ее метаболическую стабильность. Вследствие этого у эукариот отсутствует постоянная интенсивная деградация и интенсивный ресинтез м. РНК, которые, как правило, моноцистронны и имеют специфически модифицированный (кэпированный) 5'конец. Все это обусловливает целый ряд особенностей инициации трансляции и ее регуляции у эукариотических организмов. Естественно, что метаболическая стабильность эукариотической м. РНК делает регуляцию на уровне трансляции особенно важной в общей картине регуляции биосинтеза белка.
Эукариоты. Вместо комплементарного РНК-РНК узнавания, в которое вовлечена прединициирующая последовательность Шайна-Дальгарно прокариотических м. РНК, эукариотические м. РНК узнаются эукариотическими рибосомами по кэпированному 5'концу с обязательным участием белка, например, e. IF-4 F инициаторного фактора. Предполагается, что этот белок участвует в расплавлении вторичных структур 5'- областей м. РНК, облегчая их связывание с малыми субчастицами рибосом. В отличие от прокариот, эукариотическая м. РНК образует комплексы с белками , что обусловливает ее метаболическую стабильность. Вследствие этого у эукариот отсутствует постоянная интенсивная деградация и интенсивный ресинтез м. РНК, которые, как правило, моноцистронны и имеют специфически модифицированный (кэпированный) 5'конец. Все это обусловливает целый ряд особенностей инициации трансляции и ее регуляции у эукариотических организмов. Естественно, что метаболическая стабильность эукариотической м. РНК делает регуляцию на уровне трансляции особенно важной в общей картине регуляции биосинтеза белка.
 Биологическое значение трансляции Трансляция крайне важный процесс, и нарушение или выпадение любого звена, участвующего в синтезе белка, почти всегда приводит к развитию патологии, причем клинические проявления болезни будут определяться природой и функцией белка, синтез которого оказывается нарушенным (структурный или функциональный белок). Иногда синтезируются так называемые аномальные белки как результат действия мутагенных факторов и, соответственно, изменения генетического кода (например, гемоглобин при серповидно-клеточной анемии). Последствия этих нарушений могут выражаться в развитии самых разнообразных синдромов или заканчиваться летально. Следует отметить, что организм располагает мощными механизмами защиты: подобные изменения генетического аппарата быстро распознаются специфическими ферментами — рестриктазами, измененные последовательности вырезаются и вновь замещаются соответствующими нуклеотидами при участии полимераз и лигаз.
Биологическое значение трансляции Трансляция крайне важный процесс, и нарушение или выпадение любого звена, участвующего в синтезе белка, почти всегда приводит к развитию патологии, причем клинические проявления болезни будут определяться природой и функцией белка, синтез которого оказывается нарушенным (структурный или функциональный белок). Иногда синтезируются так называемые аномальные белки как результат действия мутагенных факторов и, соответственно, изменения генетического кода (например, гемоглобин при серповидно-клеточной анемии). Последствия этих нарушений могут выражаться в развитии самых разнообразных синдромов или заканчиваться летально. Следует отметить, что организм располагает мощными механизмами защиты: подобные изменения генетического аппарата быстро распознаются специфическими ферментами — рестриктазами, измененные последовательности вырезаются и вновь замещаются соответствующими нуклеотидами при участии полимераз и лигаз.



