lecture_10.ppt
- Количество слайдов: 51

Транскрипция «через» нуклеосомы

• Каким образом РНК полимераза осуществляет транскрипцию «через нуклеосомы? • две возможности 1. частичное разворачивание нуклеосом и продвижение по ДНК, которая находится на поверхности. или 2. полное удаление нуклеосом.
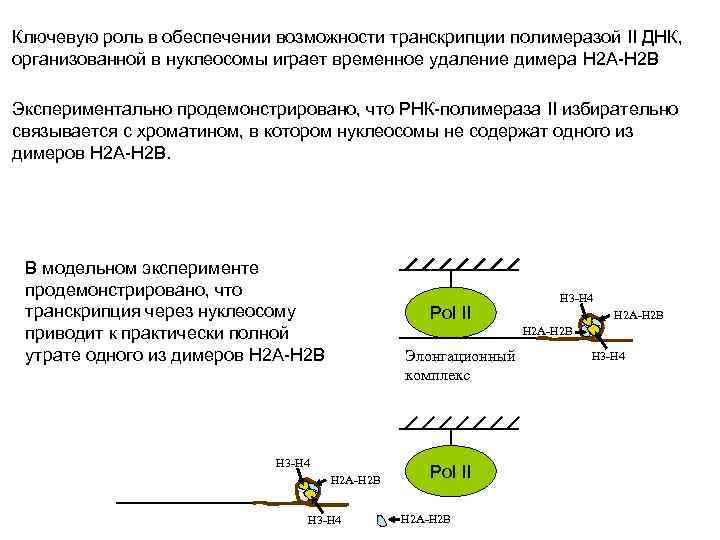
Ключевую роль в обеспечении возможности транскрипции полимеразой II ДНК, организованной в нуклеосомы играет временное удаление димера H 2 A-H 2 B Экспериментально продемонстрировано, что РНК-полимераза II избирательно связывается с хроматином, в котором нуклеосомы не содержат одного из димеров H 2 A-H 2 B. В модельном эксперименте продемонстрировано, что транскрипция через нуклеосому приводит к практически полной утрате одного из димеров Н 2 A-H 2 B Pol II H 3 -H 4 H 2 A-H 2 B Элонгационный комплекс H 3 -H 4 H 2 A-H 2 B H 3 -H 4 Pol II H 2 A-H 2 B H 3 -H 4
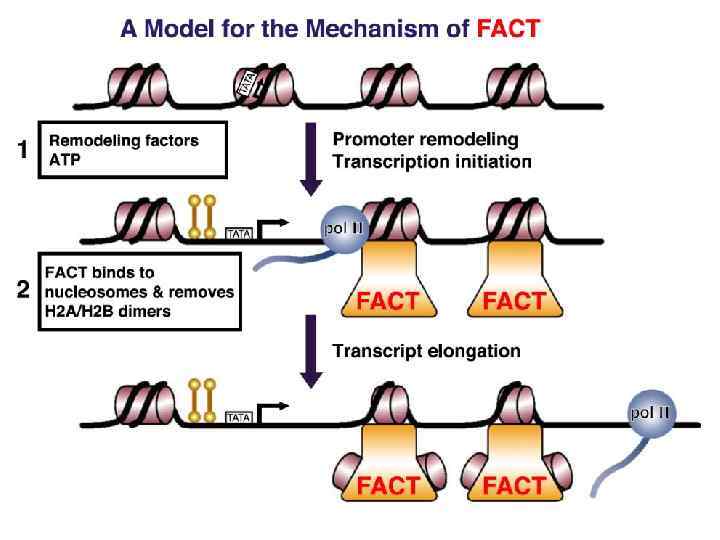
Главную роль в удалении димера H 2 A-H 2 B (H 2 A. Z-H 2 B) играет фактор элонгации транскрипции FACT, выполняющий функцию шаперона FACT SSRP 1 (HMG-box-containing protein p 140/h. Spt 16 (человеческий гомолог дрожжевого Spt 16. /Cdc 68) С-концевая часть Spt 16 обогащена кислыми аминокислотами, что является характерной особенностью всех переносчиков гистонов) FACT физически взаимодействует с нуклеосомами. Для оптимальной эффективности транскрипции FACT должен присутствовать в эквимолярном количестве по отношению к нуклеосомам (в модельной системе)

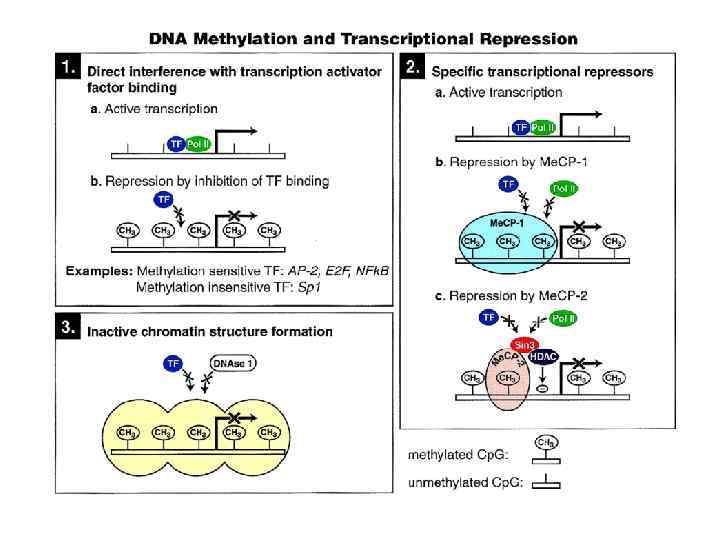
Инактивация генов 1. Метилирование ДНК 2 Создание неактивных хроматиновых доменов
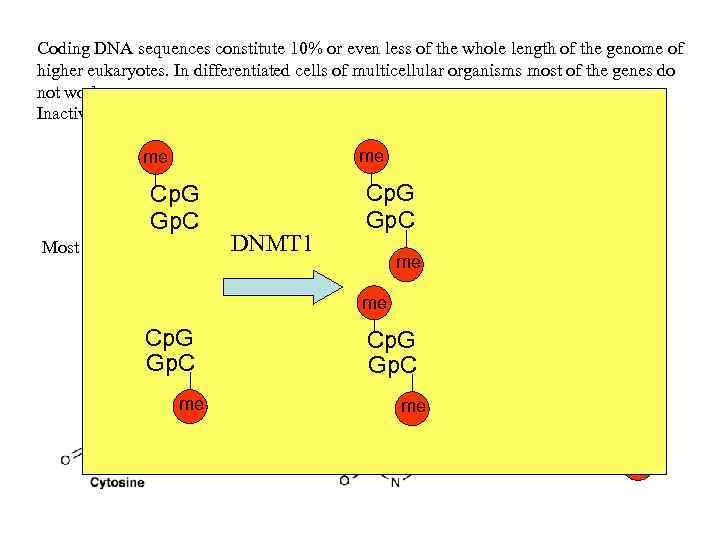
Coding DNA sequences constitute 10% or even less of the whole length of the genome of higher eukaryotes. In differentiated cells of multicellular organisms most of the genes do not work. Inactivation (repression) of genes is as important as their activation me me Cp. G Gp. C DNMT 1 Most of vertebrates use Cp. G methylation to maintain repression of genes me me Cp. G Gp. C me
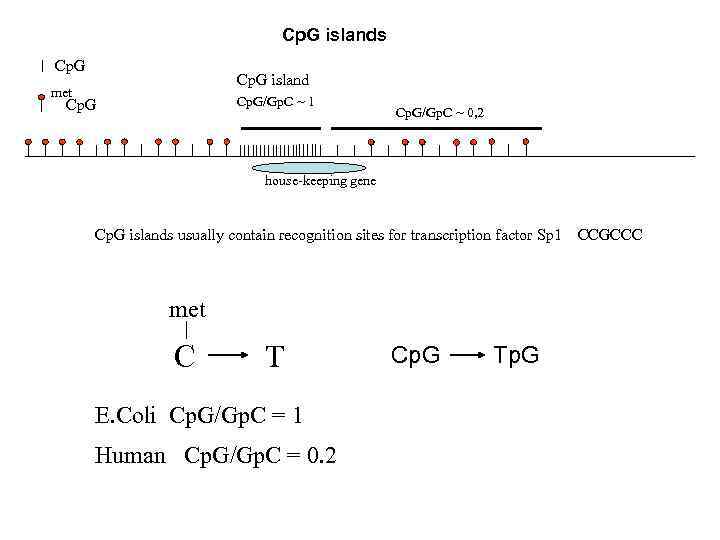
Cp. G islands Cp. G island met Cp. G/Gp. C ~ 1 Cp. G/Gp. C ~ 0, 2 house-keeping gene Cp. G islands usually contain recognition sites for transcription factor Sp 1 met C T E. Coli Cp. G/Gp. C = 1 Human Cp. G/Gp. C = 0. 2 Сp. G Tp. G CCGCCC
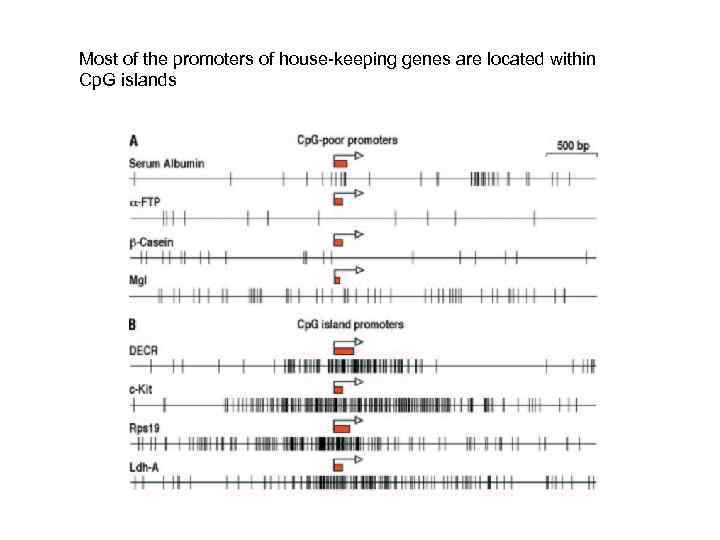
Most of the promoters of house-keeping genes are located within Cp. G islands

Неактивный хроматин
Долгое время считалось, что активные домены в хроматине создаются в результате действия определенных регуляторных систем, тогда как пассивное (т. е. препятствующее транскриции) состояние “задано по умолчанию” В последние годы стало очевидным, что репрессивные домены также создаются под действием определенных регуляторных механизмов. Большую роль в осознании этого факта сыграло изучение феномена мозаичной экспрессии генов (“variegated expression”, PEV)
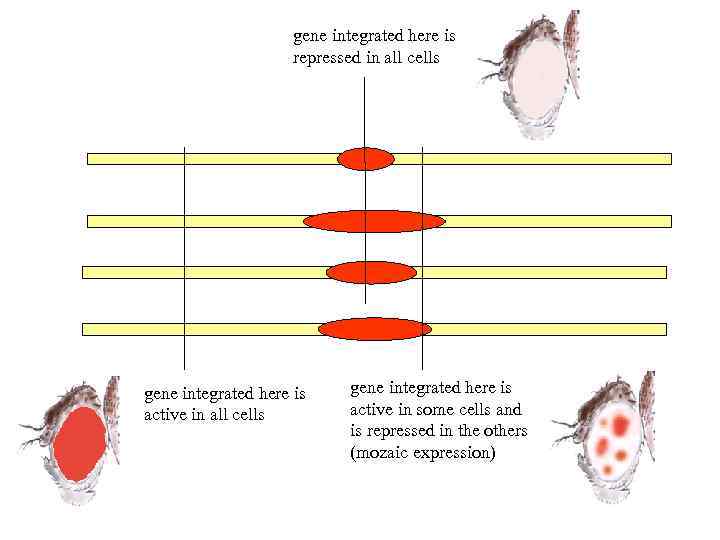
gene integrated here is repressed in all cells gene integrated here is active in some cells and is repressed in the others (mozaic expression)
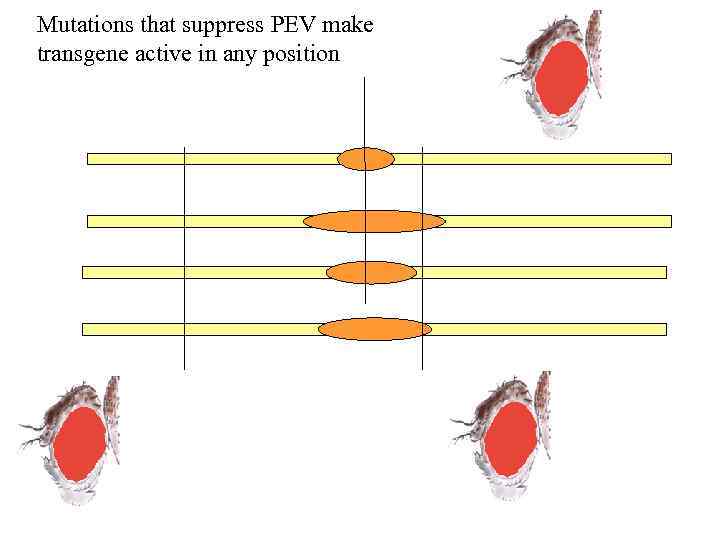
Mutations that suppress PEV make transgene active in any position
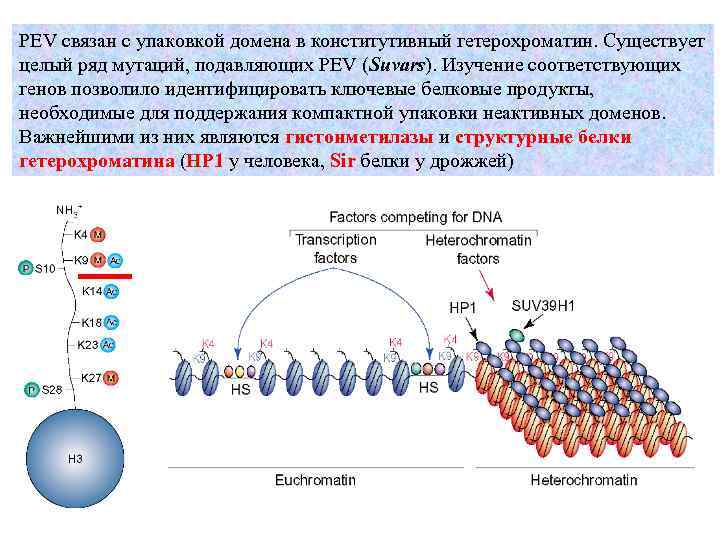
PEV связан с упаковкой домена в конститутивный гетерохроматин. Существует целый ряд мутаций, подавляющих PEV (Suvars). Изучение соответствующих генов позволило идентифицировать ключевые белковые продукты, необходимые для поддержания компактной упаковки неактивных доменов. Важнейшими из них являются гистонметилазы и структурные белки гетерохроматина (HP 1 у человека, Sir белки у дрожжей)
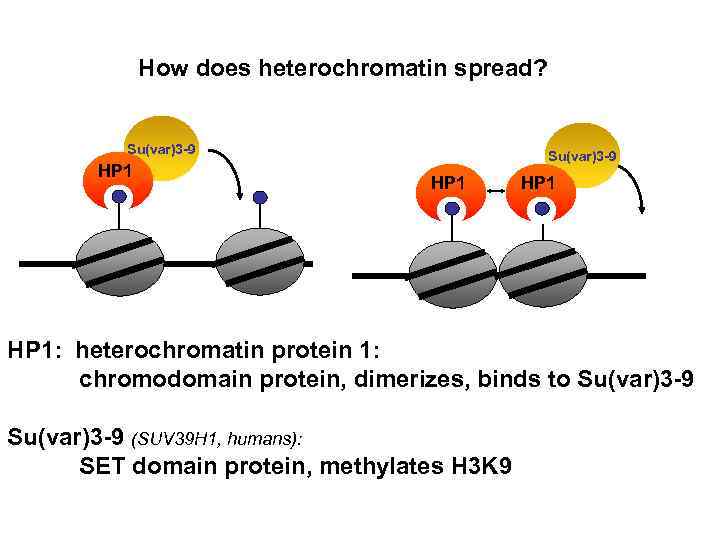
How does heterochromatin spread? Su(var)3 -9 HP 1: heterochromatin protein 1: chromodomain protein, dimerizes, binds to Su(var)3 -9 (SUV 39 H 1, humans): SET domain protein, methylates H 3 K 9


Что инициирует создание гетерохроматинового домена?
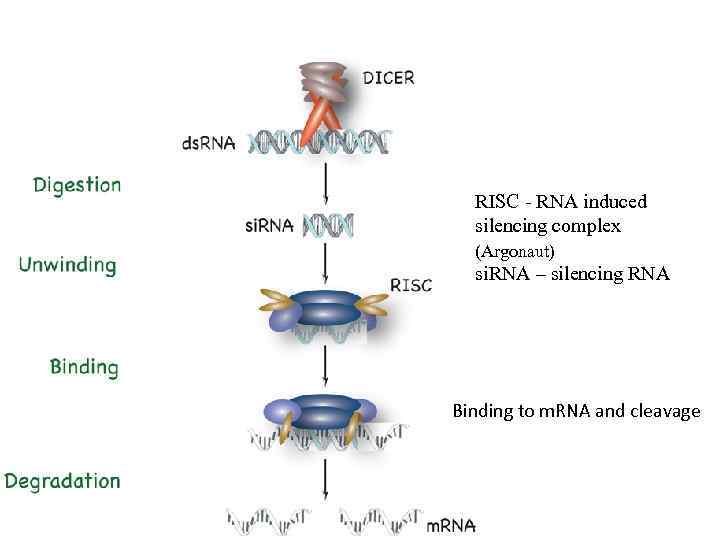
RISC - RNA induced silencing complex (Argonaut) si. RNA – silencing RNA Binding to m. RNA and cleavage

ДАЙСЕР Цитоплазматический фермент, обладающий активностью РНКазы III Расщепляет ds. RNA, в том числе микро. РНК на короткие фрагменты (20 -25 п. н. ) Функциональные домены: -РНКаза III (два активных центра, делающих симметричные разрывы в двух цепях ds. РНК на расстоянии ~ двух оборотов спирали от места посадки фермента. При этом образуются выступающие на 2 н. с выступающим 2 н. 3’ концом) -РНК хеликаза? -PAZ домен (связывает концы РНК, особенно ds. РНК с выступающим 2 н. 3’ концом Кооперативная работа РНКазного домена и PAZ домена приводит к тому, что с конца ds. РНК отшеплаются фрагменты размером 20 -25 н. п. н. У человека и млекопитающих есть только 1 дайсер У дрозофилы два дайсера , участвующих в биогенезе si. RNA и mi. RNA У растений есть несколько разных дайсеров ДРОША Ядерный фермент, обладающий активностью РНКазы III. Осуществляет Первичный процессинг микро. РНК
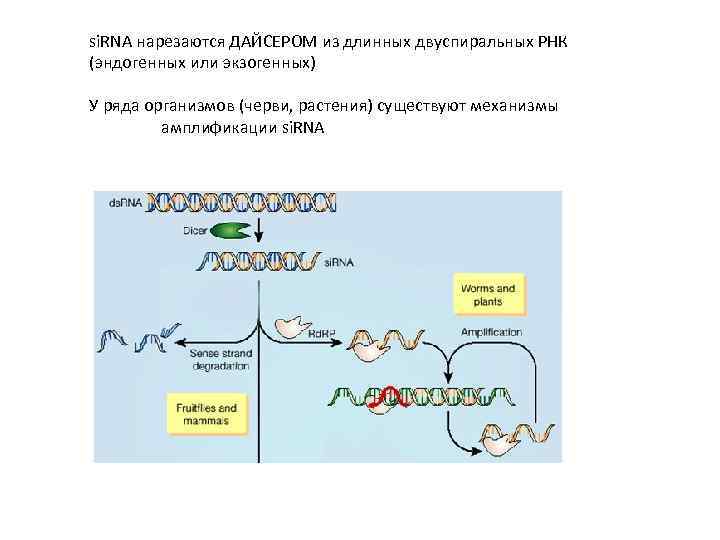
si. RNA нарезаются ДАЙСЕРОМ из длинных двуспиральных РНК (эндогенных или экзогенных) У ряда организмов (черви, растения) существуют механизмы амплификации si. RNA
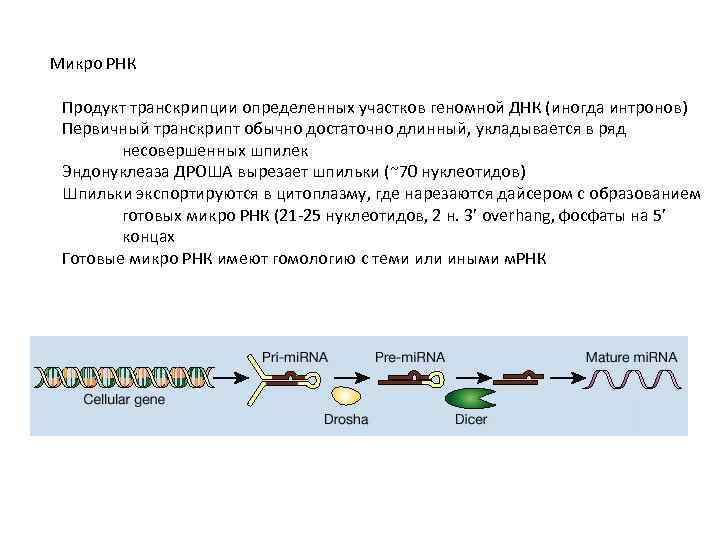
Микро РНК Продукт транскрипции определенных участков геномной ДНК (иногда интронов) Первичный транскрипт обычно достаточно длинный, укладывается в ряд несовершенных шпилек Эндонуклеаза ДРОША вырезает шпильки (~70 нуклеотидов) Шпильки экспортируются в цитоплазму, где нарезаются дайсером с образованием готовых микро РНК (21 -25 нуклеотидов, 2 н. 3’ overhang, фосфаты на 5’ концах Готовые микро РНК имеют гомологию с теми или иными м. РНК

АРГОНАФТ – главный компонент RISC (RNA Induced Silencing Complex) Домены PAZ (те же функции, что и у ДАЙСЕРА) PIWI – внесение разрыва в РНК (slicer) АРГОНАФТ связывает короткую ds. РНК (при участии ряда вспомогательных белков), после чего одна нить (passenger strand) расщепляется, а вторая нить (guide strand) остается в составе комплекса и обеспечивает узнавание РНК-мишени. Остается та нить, у которой легче отделяется 5’ конец) После связывания с м. РНК в нее вносится одиночный разрыв, который служит местом посадки экзонуклеаз
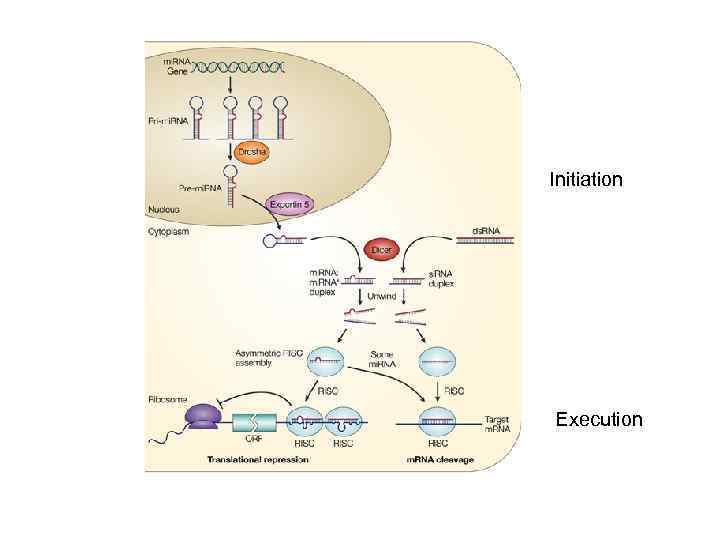
Initiation Execution
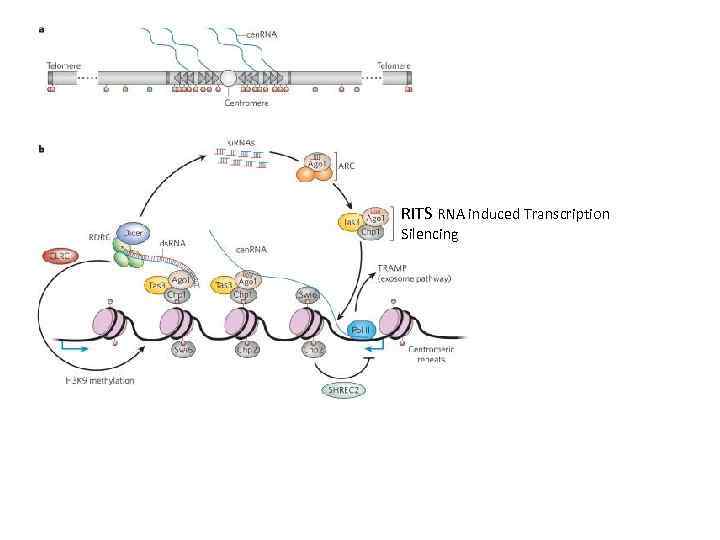
RITS RNA induced Transcription Silencing
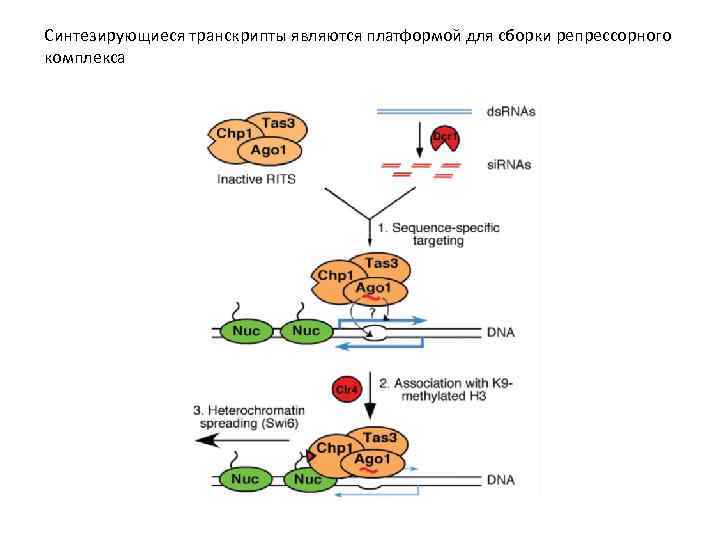
Синтезирующиеся транскрипты являются платформой для сборки репрессорного комплекса

РЕПЛИКАЦИЯ ХРОМАТИНА
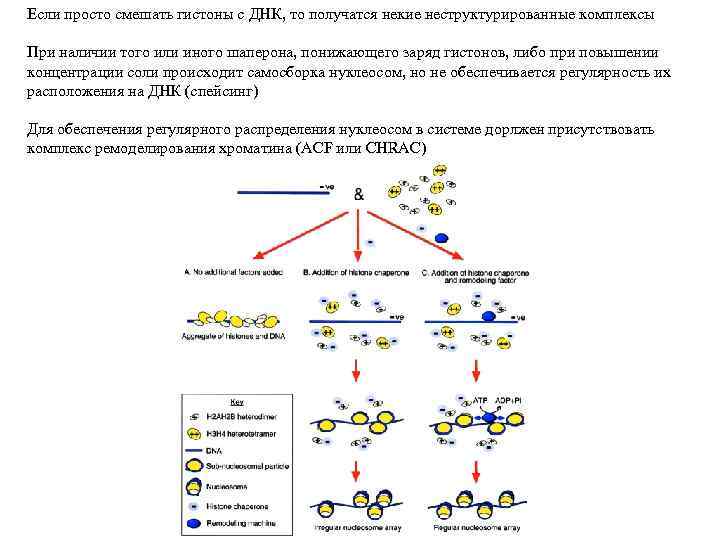
Если просто смешать гистоны с ДНК, то получатся некие неструктурированные комплексы При наличии того или иного шаперона, понижающего заряд гистонов, либо при повышении концентрации соли происходит самосборка нуклеосом, но не обеспечивается регулярность их расположения на ДНК (спейсинг) Для обеспечения регулярного распределения нуклеосом в системе дорлжен присутствовать комплекс ремоделирования хроматина (ACF или CHRAC)
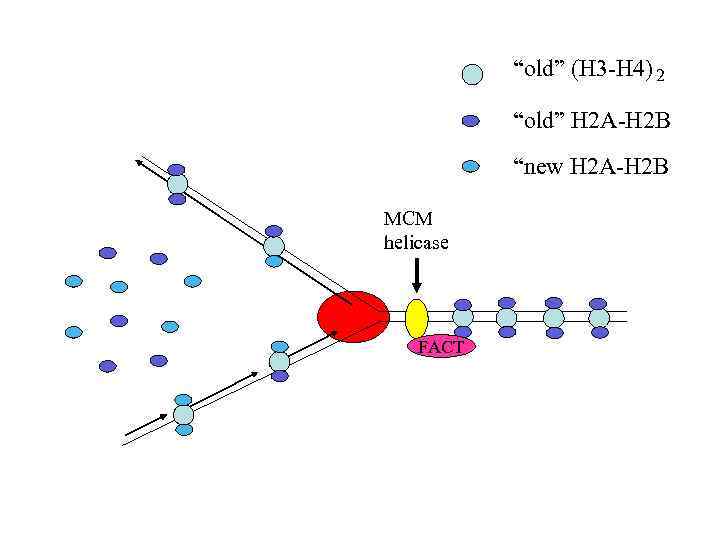
“old” (H 3 -H 4) 2 “old” H 2 A-H 2 B “new H 2 A-H 2 B MCM helicase FACT
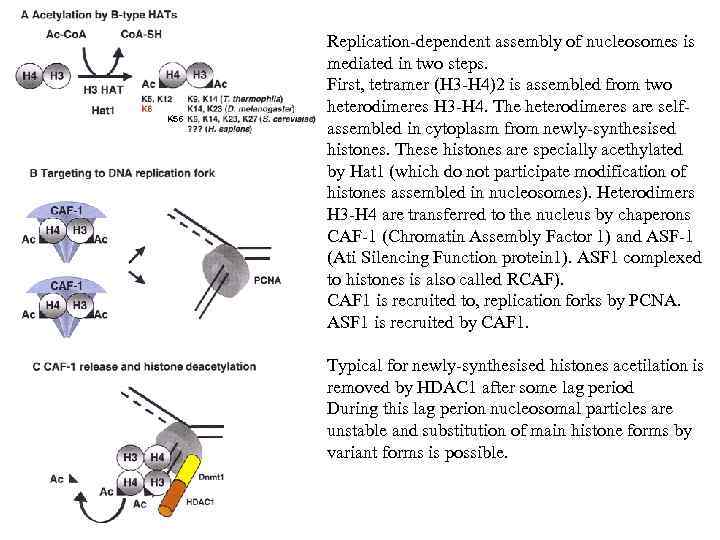
K 56 Replication-dependent assembly of nucleosomes is mediated in two steps. First, tetramer (H 3 -H 4)2 is assembled from two heterodimeres H 3 -H 4. The heterodimeres are selfassembled in cytoplasm from newly-synthesised histones. These histones are specially acethylated by Hat 1 (which do not participate modification of histones assembled in nucleosomes). Heterodimers H 3 -H 4 are transferred to the nucleus by chaperons CAF-1 (Chromatin Assembly Factor 1) and ASF-1 (Ati Silencing Function protein 1). ASF 1 complexed to histones is also called RCAF). CAF 1 is recruited to, replication forks by PCNA. ASF 1 is recruited by CAF 1. Typical for newly-synthesised histones acetilation is removed by HDAC 1 after some lag period During this lag perion nucleosomal particles are unstable and substitution of main histone forms by variant forms is possible.
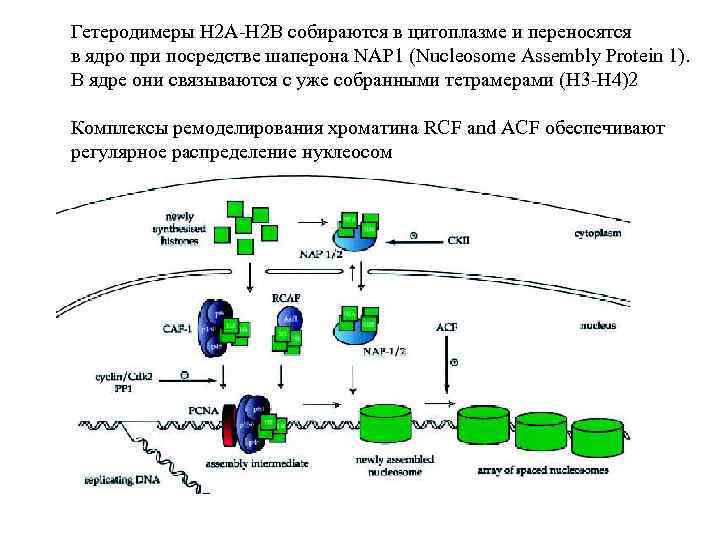
Гетеродимеры H 2 A-H 2 B собираются в цитоплазме и переносятся в ядро при посредстве шаперона NAP 1 (Nucleosome Assembly Protein 1). В ядре они связываются с уже собранными тетрамерами (H 3 -H 4)2 Комплексы ремоделирования хроматина RCF and ACF обеспечивают регулярное распределение нуклеосом
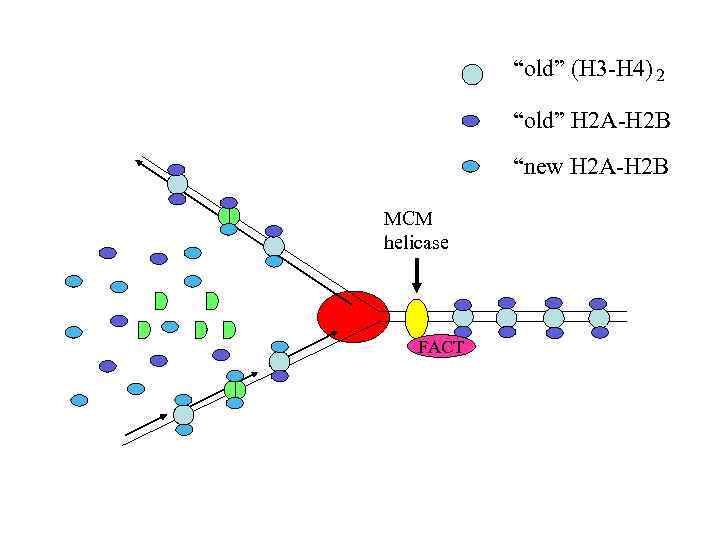
“old” (H 3 -H 4) 2 “old” H 2 A-H 2 B “new H 2 A-H 2 B MCM helicase FACT
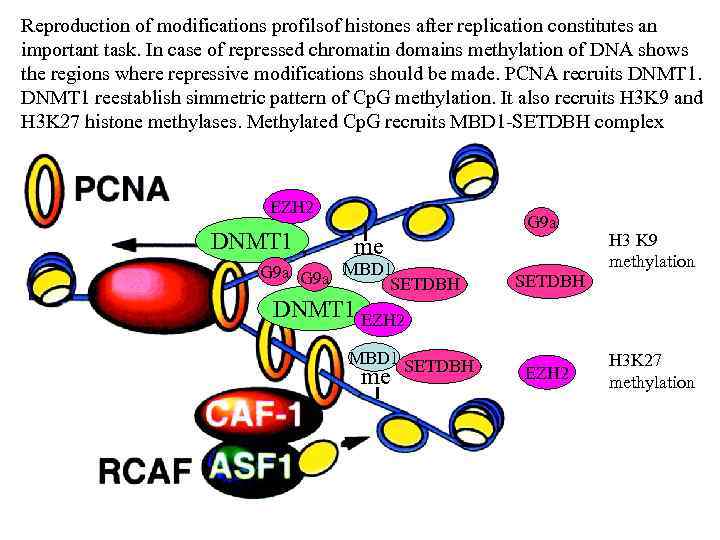
Reproduction of modifications profilsof histones after replication constitutes an important task. In case of repressed chromatin domains methylation of DNA shows the regions where repressive modifications should be made. PCNA recruits DNMT 1 reestablish simmetric pattern of Cp. G methylation. It also recruits H 3 K 9 and H 3 K 27 histone methylases. Methylated Cp. G recruits MBD 1 -SETDBH complex EZH 2 DNMT 1 me G 9 a MBD 1 SETDBH G 9 a SETDBH H 3 K 9 methylation DNMT 1 EZH 2 MBD 1 SETDBH me EZH 2 H 3 K 27 methylation

КОМПАРТМЕНТАЛИЗАЦИЯ КЛЕТОЧНОГО ЯДРА
компартментализация клеточного ядра клеточное ядро ? ?
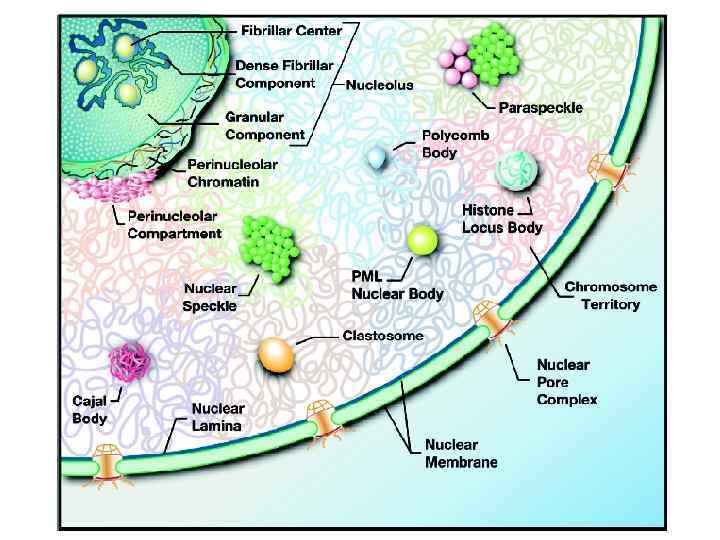
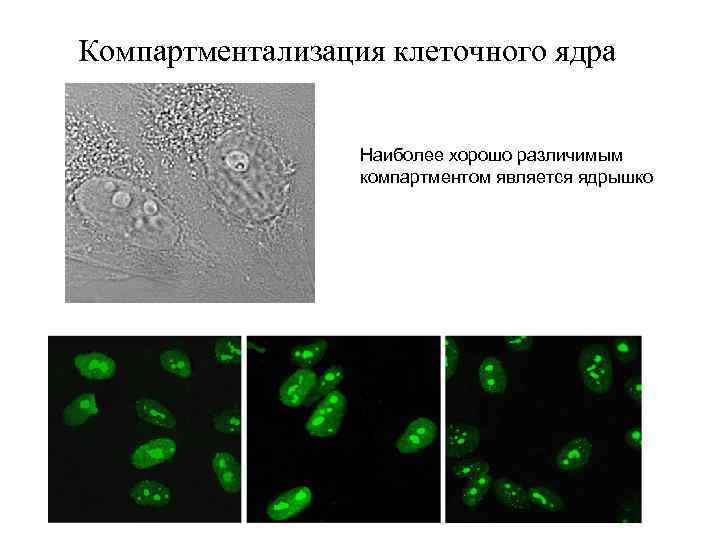
Компартментализация клеточного ядра Наиболее хорошо различимым компартментом является ядрышко

Большинство ядерных компартментов можно увидеть только после окрашивания присутствующих в этих компартментах макромолекул
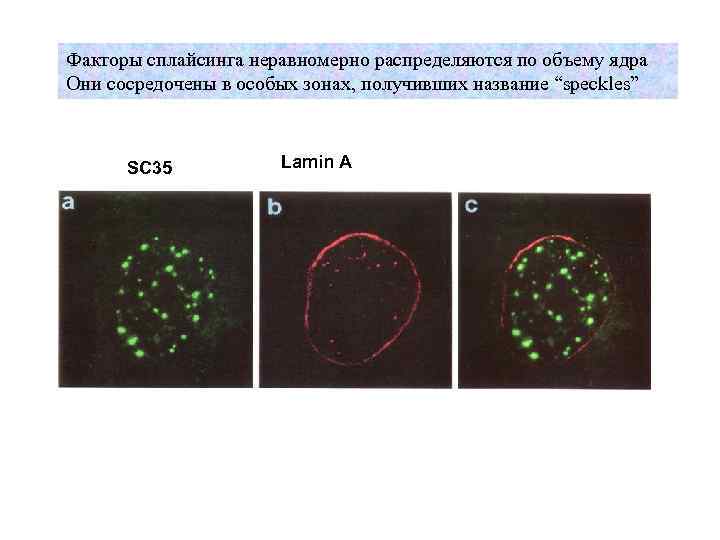
Факторы сплайсинга неравномерно распределяются по объему ядра Они сосредочены в особых зонах, получивших название “speckles” SC 35 Lamin A
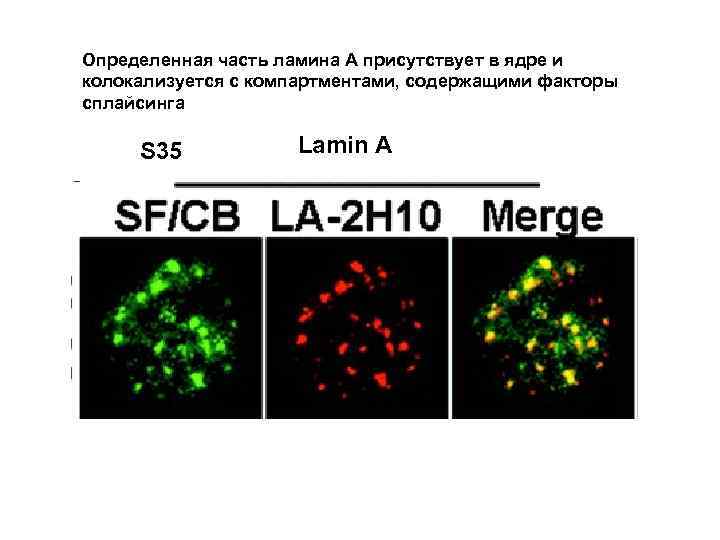
Определенная часть ламина А присутствует в ядре и колокализуется с компартментами, содержащими факторы сплайсинга S 35 Lamin А
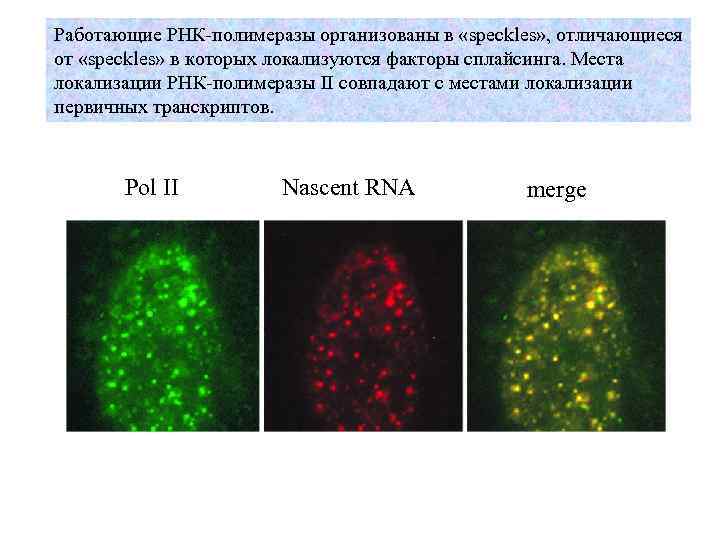
Работающие РНК-полимеразы организованы в «speckles» , отличающиеся от «speckles» в которых локализуются факторы сплайсинга. Места локализации РНК-полимеразы II совпадают с местами локализации первичных транскриптов. Pol II Nascent RNA merge
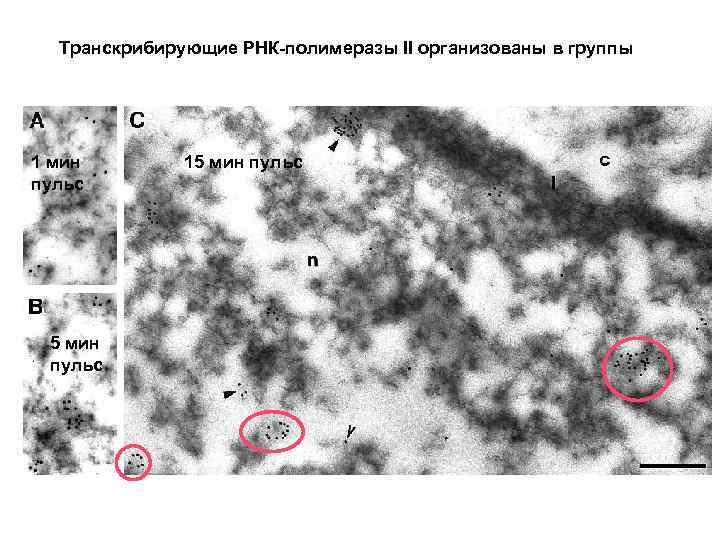
Транскрибирующие РНК-полимеразы II организованы в группы 1 мин пульс 5 мин пульс 15 мин пульс
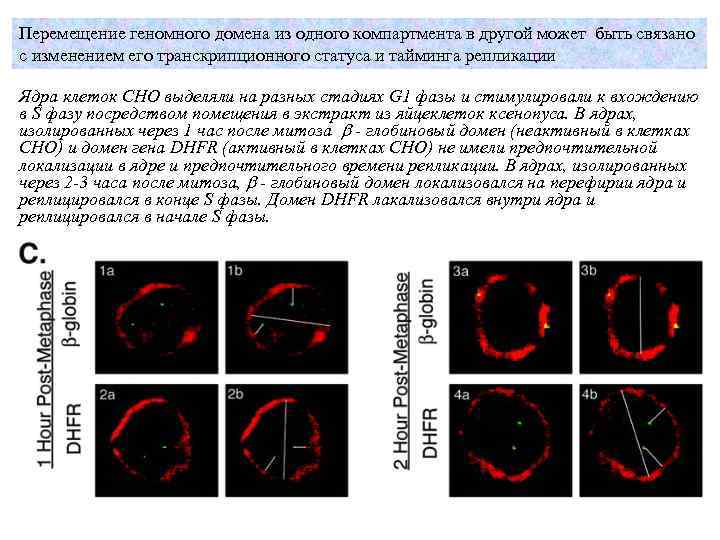
Перемещение геномного домена из одного компартмента в другой может быть связано с изменением его транскрипционного статуса и тайминга репликации Ядра клеток CHO выделяли на разных стадиях G 1 фазы и стимулировали к вхождению в S фазу посредством помещения в экстракт из яйцеклеток ксенопуса. В ядрах, изолированных через 1 час после митоза b - глобиновый домен (неактивный в клетках CHO) и домен гена DHFR (активный в клетках CHO) не имели предпочтительной локализации в ядре и предпочтительного времени репликации. В ядрах, изолированных через 2 -3 часа после митоза, b - глобиновый домен локализовался на перефирии ядра и реплицировался в конце S фазы. Домен DHFR лакализовался внутри ядра и реплицировался в начале S фазы.
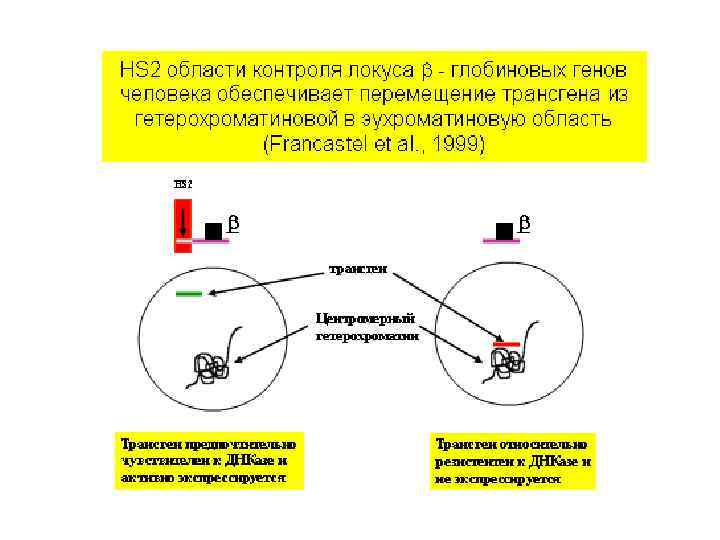
В ядре существуют активные и пассивные области. Пассивными областями являются, в частности, области расположения конститутивного гетерохроматина, в том числе прицентромерные области и переферия ядра. Перемещение гена в неактивную область коррелирует с изменением его транскрипционного статуса и времени репликации. Локальная концентрация тех или иных ДНК-связывающих белков может существенно различаться в активных и пассивных областях
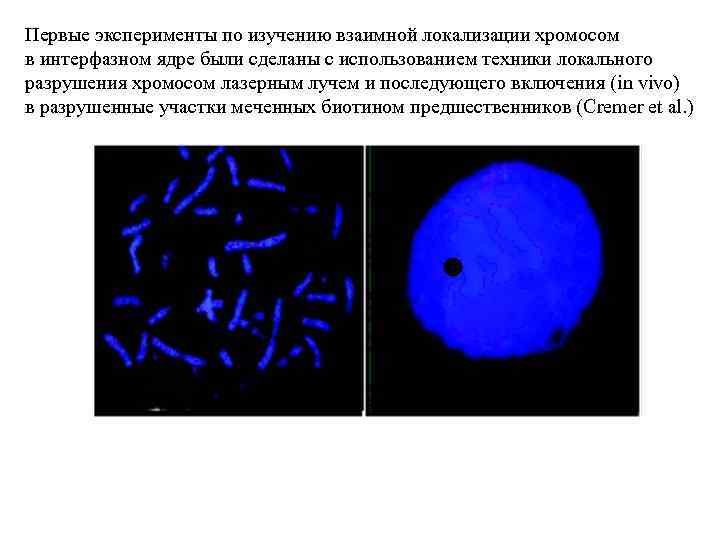
Первые эксперименты по изучению взаимной локализации хромосом в интерфазном ядре были сделаны с использованием техники локального разрушения хромосом лазерным лучем и последующего включения (in vivo) в разрушенные участки меченных биотином предшественников (Cremer et al. )
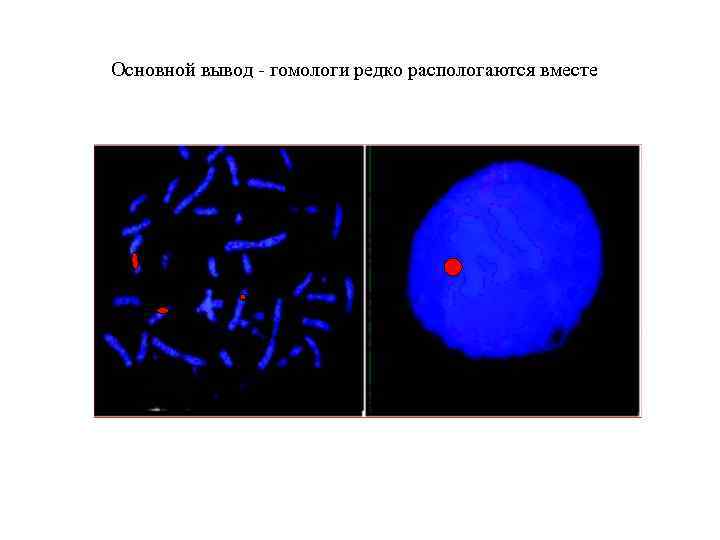
Основной вывод - гомологи редко распологаются вместе
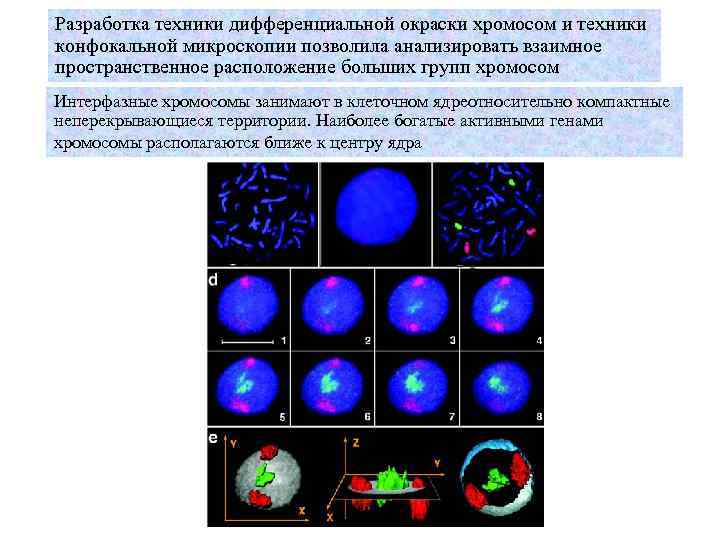
Разработка техники дифференциальной окраски хромосом и техники конфокальной микроскопии позволила анализировать взаимное пространственное расположение больших групп хромосом Интерфазные хромосомы занимают в клеточном ядреотносительно компактные неперекрывающиеся территории. Наиболее богатые активными генами хромосомы располагаются ближе к центру ядра
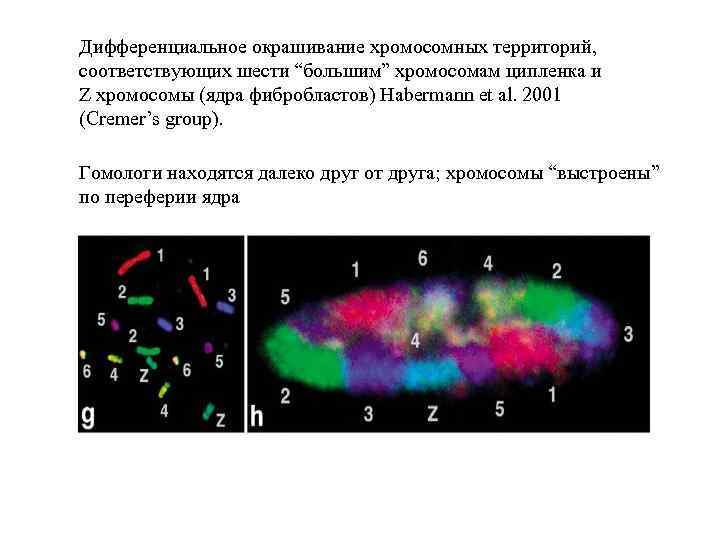
Дифференциальное окрашивание хромосомных территорий, соответствующих шести “большим” хромосомам ципленка и Z хромосомы (ядра фибробластов) Habermann et al. 2001 (Cremer’s group). Гомологи находятся далеко друг от друга; хромосомы “выстроены” по переферии ядра

Богатые генами хромосомы располагаются в центре ядра, а бедные генами хромосомы - на переферии В геноме человека хромосома 18 (зеленый цвет) и хромосома 19 (красный цвет) содержат практически одинаковое количество ДНК (86 и 72 Мв), но резко различаются по содержанию генов. Хромосома 19 наиболее богата генами (1930 генов). Хромосома 18 (зеленый цвет) состоит преимущественно из бедных генами поздне-реплицирующихся хроматиновых доменов
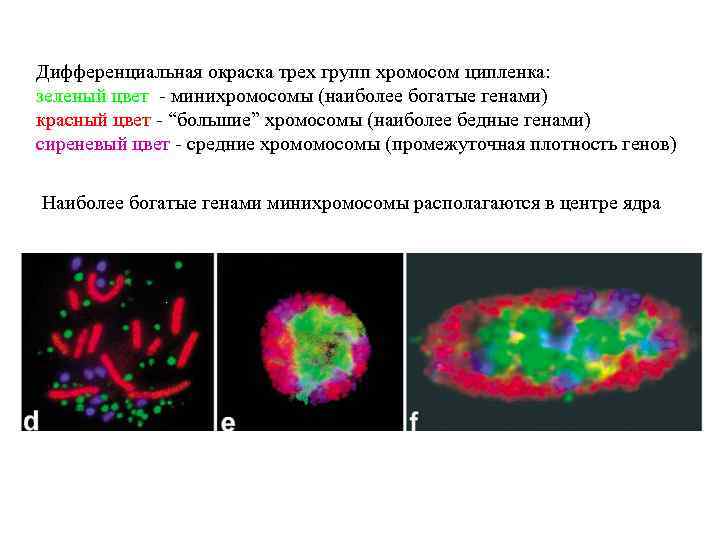
Дифференциальная окраска трех групп хромосом ципленка: зеленый цвет - минихромосомы (наиболее богатые генами) красный цвет - “большие” хромосомы (наиболее бедные генами) сиреневый цвет - средние хромомосомы (промежуточная плотность генов) Наиболее богатые генами минихромосомы располагаются в центре ядра

Интерфазные хромосомы занимают относительно компактные неперекрывающиеся области (хромосомные территории) Существуют определенные правила расположения хромосом в ядре. Богатые генами хромосомы располагаются ближе к центру ядра. Центромера располагаются на наиболее удаленной от центра ядра границе хромосомной территории. Индивидуальные гены имеют предпочтительные позиции в границах хромосомных территорий (ближе к центру - ближе к переферии) Хромосомы, предпочтительно участвующие в реципроктных рекомбинациях, часто располагаются в одном слое или образуют сцепленные группы. Таким образом, вероятность транслокаций между отдельными хромосомами определяется на уровне пространственной организации хромосом в ядре Не существует выраженной корреляциеи между физическими расстояниями в ядре и расстояниями вдоль молекулы ДНК
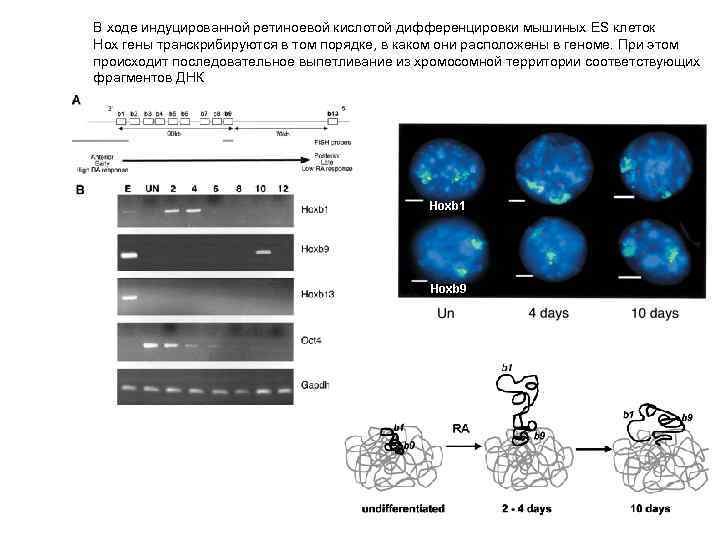
В ходе индуцированной ретиноевой кислотой дифференцировки мышиных ES клеток Hox гены транскрибируются в том порядке, в каком они расположены в геноме. При этом происходит последовательное выпетливание из хромосомной территории соответствующих фрагментов ДНК
lecture_10.ppt