Лекция 12. Трансгенны в медицине.ppt
- Количество слайдов: 57
 Трансгенные растения и животные для медицины 1
Трансгенные растения и животные для медицины 1
 Трансгенными называться растения или животные, в которых успешно функционирует ген (или гены) пересаженные из других видов растений или животных. 2
Трансгенными называться растения или животные, в которых успешно функционирует ген (или гены) пересаженные из других видов растений или животных. 2
 Генетическая инженерия растений l Важным преимуществом растений, по сравнению с животными, является способность растительных клеток развиваться в целое растение, создавая новое трансгенное растение. 3
Генетическая инженерия растений l Важным преимуществом растений, по сравнению с животными, является способность растительных клеток развиваться в целое растение, создавая новое трансгенное растение. 3
 Трансгенные растения получают новые нужные человеку свойства: l l l повышенную устойчивость к вирусам, к гербицидам, к вредителям и болезням растений (картофеля, листья которого являются остро токсичными для колорадского жука и его личинок) пищевые продукты, полученные из таких генномодифицированных культур, могут иметь улучшенные вкусовые качества, лучше выглядеть и дольше храниться. дают более богатый и стабильный урожай, чем их природные аналоги. дают несколько урожаев в год (ремонтантные сорта клубники) имеют повышенную устойчивость к неблагоприятным климатическим условиям (устойчивые к засухе трансгенные растения, с геном скорпиона ) осуществляют синтез некоторых белков животного происхождения (табак синтезирующий лактоферрин человека, интерферон). 4
Трансгенные растения получают новые нужные человеку свойства: l l l повышенную устойчивость к вирусам, к гербицидам, к вредителям и болезням растений (картофеля, листья которого являются остро токсичными для колорадского жука и его личинок) пищевые продукты, полученные из таких генномодифицированных культур, могут иметь улучшенные вкусовые качества, лучше выглядеть и дольше храниться. дают более богатый и стабильный урожай, чем их природные аналоги. дают несколько урожаев в год (ремонтантные сорта клубники) имеют повышенную устойчивость к неблагоприятным климатическим условиям (устойчивые к засухе трансгенные растения, с геном скорпиона ) осуществляют синтез некоторых белков животного происхождения (табак синтезирующий лактоферрин человека, интерферон). 4
 ТРАНСГЕННЫЕ РАСТЕНИЯ. КАК ЭТО ДЕЛАЕТСЯ l l l Метод 1: Существует бактерия Agrobacterium tumefaciens (полевая бактерия), которая обладает способностью встраивать участки своей ДНК в растения, после чего пораженные клетки растения начинают очень быстро делиться, образуя опухоль. Сначала ученые получили штамм этой бактерии, не вызывающий опухолей, но сохраняющий возможность вносить свою ДНК в клетку. В дальнейшем нужный ген сначала вводили (клонировали) в Agrobacterium tumefaciens, а затем заражали этой клонированной бактерией растение. После чего инфецированые клетки растения приобретали нужные свойства. Далее методами клеточной инженерии можно вырастить целое растение из одной его клетки. 5
ТРАНСГЕННЫЕ РАСТЕНИЯ. КАК ЭТО ДЕЛАЕТСЯ l l l Метод 1: Существует бактерия Agrobacterium tumefaciens (полевая бактерия), которая обладает способностью встраивать участки своей ДНК в растения, после чего пораженные клетки растения начинают очень быстро делиться, образуя опухоль. Сначала ученые получили штамм этой бактерии, не вызывающий опухолей, но сохраняющий возможность вносить свою ДНК в клетку. В дальнейшем нужный ген сначала вводили (клонировали) в Agrobacterium tumefaciens, а затем заражали этой клонированной бактерией растение. После чего инфецированые клетки растения приобретали нужные свойства. Далее методами клеточной инженерии можно вырастить целое растение из одной его клетки. 5
 ТРАНСГЕННЫЕ РАСТЕНИЯ. КАК ЭТО ДЕЛАЕТСЯ l l Метод 2: Клетки, предварительно обработанные специальными реагентами, разрушающими толстую клеточную оболочку, помещают в раствор, содержащий: ДНК и вещества, способствующие ее проникновению в клетку. После чего как и в первом случае выращивали из одной клетки целое растение. 6
ТРАНСГЕННЫЕ РАСТЕНИЯ. КАК ЭТО ДЕЛАЕТСЯ l l Метод 2: Клетки, предварительно обработанные специальными реагентами, разрушающими толстую клеточную оболочку, помещают в раствор, содержащий: ДНК и вещества, способствующие ее проникновению в клетку. После чего как и в первом случае выращивали из одной клетки целое растение. 6
 ТРАНСГЕННЫЕ РАСТЕНИЯ. КАК ЭТО ДЕЛАЕТСЯ l l Метод 3: Существует метод бомбардировки растительных клеток специальными, очень маленькими вольфрамовыми пулями, содержащими ДНК. С некоторой вероятностью такая пуля может правильно передать генетический материал клетке и так растение получает новые свойства. А сама пуля ввиду ее микроскопических размеров не мешает нормальному развитию клетки. 7
ТРАНСГЕННЫЕ РАСТЕНИЯ. КАК ЭТО ДЕЛАЕТСЯ l l Метод 3: Существует метод бомбардировки растительных клеток специальными, очень маленькими вольфрамовыми пулями, содержащими ДНК. С некоторой вероятностью такая пуля может правильно передать генетический материал клетке и так растение получает новые свойства. А сама пуля ввиду ее микроскопических размеров не мешает нормальному развитию клетки. 7
 История появления трансгенных растений l l l Первые трансгенные продукты были разработаны американской корпорацией «Монсанто» . В настоящее время эта компания контролирует 80% мирового рынка производства ГМО. В 1988 году были сделаны первые посевы трансгенных злаков В 1993 году первые продукты с ГМкомпонентами появились в продаже. 8
История появления трансгенных растений l l l Первые трансгенные продукты были разработаны американской корпорацией «Монсанто» . В настоящее время эта компания контролирует 80% мирового рынка производства ГМО. В 1988 году были сделаны первые посевы трансгенных злаков В 1993 году первые продукты с ГМкомпонентами появились в продаже. 8
 Мировые производители генномодифицированной продукции l Основными производителями ГМ продукции являются транснациональные корпорации – компании, которые имеют свои представительства в сотнях стран (Monsanto, Agr. Evo, Aventis, Novartis, Du. Pont и др). Они же спонсируют научные разработки в отрасли генной инженерии, содержат мощные исследовательские лаборатории. 9
Мировые производители генномодифицированной продукции l Основными производителями ГМ продукции являются транснациональные корпорации – компании, которые имеют свои представительства в сотнях стран (Monsanto, Agr. Evo, Aventis, Novartis, Du. Pont и др). Они же спонсируют научные разработки в отрасли генной инженерии, содержат мощные исследовательские лаборатории. 9
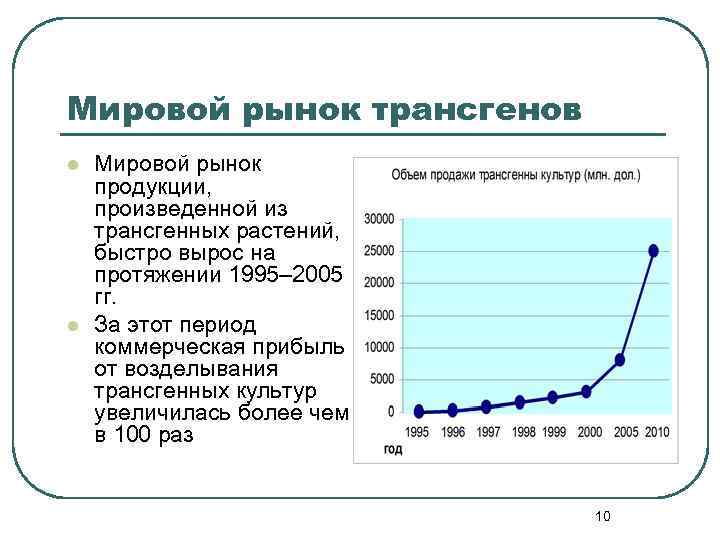 Мировой рынок трансгенов l l Мировой рынок продукции, произведенной из трансгенных растений, быстро вырос на протяжении 1995– 2005 гг. За этот период коммерческая прибыль от возделывания трансгенных культур увеличилась более чем в 100 раз 10
Мировой рынок трансгенов l l Мировой рынок продукции, произведенной из трансгенных растений, быстро вырос на протяжении 1995– 2005 гг. За этот период коммерческая прибыль от возделывания трансгенных культур увеличилась более чем в 100 раз 10
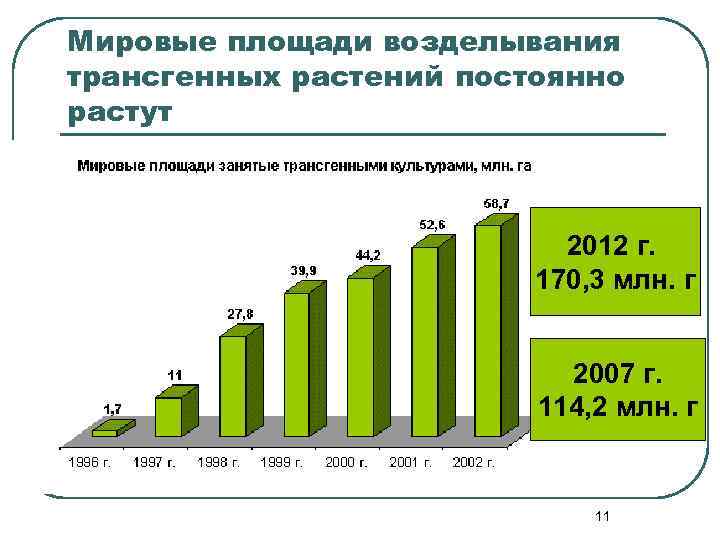 Мировые площади возделывания трансгенных растений постоянно растут 2012 г. 170, 3 млн. г 2007 г. 114, 2 млн. г 11
Мировые площади возделывания трансгенных растений постоянно растут 2012 г. 170, 3 млн. г 2007 г. 114, 2 млн. г 11
 ТРАНСГЕННЫЕ РАСТЕНИЯ. l l В настоящее время в Европе разрешение на использование в пищевых продуктах получили продуктовые компоненты из сортов генетически модифицированной сои, кукурузы и масличных культур. Среди используемых – масла и сиропы, которые содержат „ГМ-производный материал”, а также мука и крахмал. l Однако, частично или полностью наложили запрет на ГМО Австрия, Великобритания, Греция, Италия, Франция, Германия, Саудовская Аравия, Таиланд, Шри-Ланка, Индия, Австралия. l России до настоящего времени ни одна трансгенная культура не выращивается в коммерческих целях, однако экспорт продовольствия содержащего трансгенные растения разрешен (соя, картофель, кукуруза, сахарная свекла, рис). 12
ТРАНСГЕННЫЕ РАСТЕНИЯ. l l В настоящее время в Европе разрешение на использование в пищевых продуктах получили продуктовые компоненты из сортов генетически модифицированной сои, кукурузы и масличных культур. Среди используемых – масла и сиропы, которые содержат „ГМ-производный материал”, а также мука и крахмал. l Однако, частично или полностью наложили запрет на ГМО Австрия, Великобритания, Греция, Италия, Франция, Германия, Саудовская Аравия, Таиланд, Шри-Ланка, Индия, Австралия. l России до настоящего времени ни одна трансгенная культура не выращивается в коммерческих целях, однако экспорт продовольствия содержащего трансгенные растения разрешен (соя, картофель, кукуруза, сахарная свекла, рис). 12
 13
13
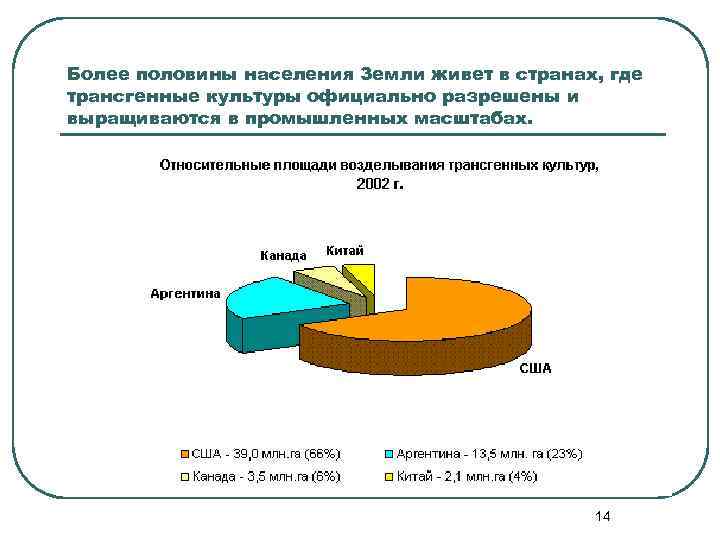 Более половины населения Земли живет в странах, где трансгенные культуры официально разрешены и выращиваются в промышленных масштабах. 14
Более половины населения Земли живет в странах, где трансгенные культуры официально разрешены и выращиваются в промышленных масштабах. 14
 ТРАНСГЕННЫЕ РАСТЕНИЯ. В основном выращивают шесть генномодифицированных культур – сою, кукурузу, хлопчатник, рапс, кабачок и папайю. Для коммерческого использования так же разрешены помидоры, тыква, табак, свекла, гвоздика, цикорий, лен, рис и пшеница. 15
ТРАНСГЕННЫЕ РАСТЕНИЯ. В основном выращивают шесть генномодифицированных культур – сою, кукурузу, хлопчатник, рапс, кабачок и папайю. Для коммерческого использования так же разрешены помидоры, тыква, табак, свекла, гвоздика, цикорий, лен, рис и пшеница. 15
 Где используются трансгенные продукты l l Трансгенная соя входит в состав почти 60% продуктов, среди которых колбасные изделия, пельмени, хлеб, шоколад, маргарин, мороженое, детское питание и др. На основе ГМ-компонентов производятся такие пищевые добавки, как рибофлавин Е 101, Е 101 А, карамель Е 150, ксантан Е 415, лецитин Е 322, Е 153, Е 160 d, Е 161 c, Е 308 q, Е 471, Е 472 f, Е 473, Е 475, Е 476 b, Е 477, Е 479 a, Е 570, Е 572, Е 573, Е 620 -Е 625. 16
Где используются трансгенные продукты l l Трансгенная соя входит в состав почти 60% продуктов, среди которых колбасные изделия, пельмени, хлеб, шоколад, маргарин, мороженое, детское питание и др. На основе ГМ-компонентов производятся такие пищевые добавки, как рибофлавин Е 101, Е 101 А, карамель Е 150, ксантан Е 415, лецитин Е 322, Е 153, Е 160 d, Е 161 c, Е 308 q, Е 471, Е 472 f, Е 473, Е 475, Е 476 b, Е 477, Е 479 a, Е 570, Е 572, Е 573, Е 620 -Е 625. 16
 Компании, использующие ГМпродукты (по данным Гринпис) l l l l l Nestle шоколад, кофейные напитки, детское питание Coca-Сola «Кока-кола» , «Спрайт» , «Фанта» , тоники «Кинли» Danon йогурты, кефир, сыр, детское питание Procter & Gamble чипсы Kellogg’s готовые завтраки, в т. ч. кукурузные хлопья Heinz Foods кетчупы, соусы Hershey’s шоколад, безалкогольные напитки Mc. Donald’s картофель, мясо Mars шоколад «M&M» , «Snikers» , «Twix» , «Milky Way» , «Mars» Официальный сайт Ассоциации генетической безопасности (2006 г. ) добавили к этому списку майонезы «Кальве» , йогурты «Эрманн» , чипсы «Лейз» , супы «Галина Бланка» , фасоль, зеленый горошек и другие продукты «Бондюэль» . 17
Компании, использующие ГМпродукты (по данным Гринпис) l l l l l Nestle шоколад, кофейные напитки, детское питание Coca-Сola «Кока-кола» , «Спрайт» , «Фанта» , тоники «Кинли» Danon йогурты, кефир, сыр, детское питание Procter & Gamble чипсы Kellogg’s готовые завтраки, в т. ч. кукурузные хлопья Heinz Foods кетчупы, соусы Hershey’s шоколад, безалкогольные напитки Mc. Donald’s картофель, мясо Mars шоколад «M&M» , «Snikers» , «Twix» , «Milky Way» , «Mars» Официальный сайт Ассоциации генетической безопасности (2006 г. ) добавили к этому списку майонезы «Кальве» , йогурты «Эрманн» , чипсы «Лейз» , супы «Галина Бланка» , фасоль, зеленый горошек и другие продукты «Бондюэль» . 17
 Пока мы едим в основном натуральные продукты l Генетически модифицированные продукты составляют в рационе землян всего один процент (в основном – соя). По оценкам экспертов, удельный вес ГМ-продукции в Российской Федерации составляет 11– 15% l 18
Пока мы едим в основном натуральные продукты l Генетически модифицированные продукты составляют в рационе землян всего один процент (в основном – соя). По оценкам экспертов, удельный вес ГМ-продукции в Российской Федерации составляет 11– 15% l 18
 Генномодифицированные растения для профилактики заболеваний. l l Для синтеза β-каротина (провитамина А) в растениях необходима фитоен-синтетаза. Этот фермент участвует в конденсации двух молекул геранил-геранил дифосфата. Ген фитоен-синтетазы из нарцисса введен в рис и экспрессирован в эндосперме риса. Таким образом, получен «золотой рис» , имеющий более высокий уровень бета-каротина. По причине недостаточности витамина А в мире ежегодно умирает один миллион детей. А еще 230 млн. детей, по данным ВОЗ, живут под угрозой клинической или субклинической недостаточности витамина А – состояния, которое в большинстве случаев можно предотвратить. Обогащение еды витамином А, по данным ЮНИСЕФ, на 23 % снижает детскую смертность. Создание „Золотого риса” считают самой идеальной работой ученых за последнее время. 19
Генномодифицированные растения для профилактики заболеваний. l l Для синтеза β-каротина (провитамина А) в растениях необходима фитоен-синтетаза. Этот фермент участвует в конденсации двух молекул геранил-геранил дифосфата. Ген фитоен-синтетазы из нарцисса введен в рис и экспрессирован в эндосперме риса. Таким образом, получен «золотой рис» , имеющий более высокий уровень бета-каротина. По причине недостаточности витамина А в мире ежегодно умирает один миллион детей. А еще 230 млн. детей, по данным ВОЗ, живут под угрозой клинической или субклинической недостаточности витамина А – состояния, которое в большинстве случаев можно предотвратить. Обогащение еды витамином А, по данным ЮНИСЕФ, на 23 % снижает детскую смертность. Создание „Золотого риса” считают самой идеальной работой ученых за последнее время. 19
 Генномодифицированные растения для профилактики заболеваний. l Работа по созданию риса, способного в увеличенном количестве накапливать железо, проведена японскими учеными. Ими был изолирован ген ферритина (белка, одна молекула которого накапливает 4500 атомов железа) с повышенной активностью из ростков сои. Этот ген был интродуцирован в геном риса. Исследования линий трансформированных растений показали, что накопление ферритина в их зерне втрое больше, чем в зерне исходных линий. Анемия, обусловленная дефицитом железа, является одним из самых распространенных и тяжелых последствий нарушения питания. По данным ЮНИСЕФ, в мире 2 млрд людей страдают от железодефицитной анемии, а количество людей, которые испытывают дефицит железа, составляет 3, 7 млрд, большинство из которых женщины. 20
Генномодифицированные растения для профилактики заболеваний. l Работа по созданию риса, способного в увеличенном количестве накапливать железо, проведена японскими учеными. Ими был изолирован ген ферритина (белка, одна молекула которого накапливает 4500 атомов железа) с повышенной активностью из ростков сои. Этот ген был интродуцирован в геном риса. Исследования линий трансформированных растений показали, что накопление ферритина в их зерне втрое больше, чем в зерне исходных линий. Анемия, обусловленная дефицитом железа, является одним из самых распространенных и тяжелых последствий нарушения питания. По данным ЮНИСЕФ, в мире 2 млрд людей страдают от железодефицитной анемии, а количество людей, которые испытывают дефицит железа, составляет 3, 7 млрд, большинство из которых женщины. 20
 Создание растений с улучшенными лечебнодиетическими свойствами l l l Многие продукты, потребляемые с фруктами, овощами и злаками, проявляют фармакологические эффекты, блокируют развитие сердечно-сосудистых, раковых и других заболеваний. К таким природным соединениям растений относятся сульфорафан из брокколи, резвератрол из винограда, генистеин из сои, эпигаллокатехин-3 -галлат из зеленого чая Получены трансгенные растения рапса, экспрессирующие ген фитоен-синтетазы, в семенах которых значительно повысилось содержание каротиноидов. Показана экспрессия этого же фермента в клубнях картофеля, что приводило к повышенному синтезу каротиноидов и лютеина. Недавно получены трансгенные растения земляники с повышенным синтезом L-аскорбиновой кислоты. Созданы растения сои с повышенным в пять раз содержанием витамина Е в семенах. 21
Создание растений с улучшенными лечебнодиетическими свойствами l l l Многие продукты, потребляемые с фруктами, овощами и злаками, проявляют фармакологические эффекты, блокируют развитие сердечно-сосудистых, раковых и других заболеваний. К таким природным соединениям растений относятся сульфорафан из брокколи, резвератрол из винограда, генистеин из сои, эпигаллокатехин-3 -галлат из зеленого чая Получены трансгенные растения рапса, экспрессирующие ген фитоен-синтетазы, в семенах которых значительно повысилось содержание каротиноидов. Показана экспрессия этого же фермента в клубнях картофеля, что приводило к повышенному синтезу каротиноидов и лютеина. Недавно получены трансгенные растения земляники с повышенным синтезом L-аскорбиновой кислоты. Созданы растения сои с повышенным в пять раз содержанием витамина Е в семенах. 21
 Трансгенные растения как биопродуценты белков медицинского назначения l l Аппарат транскрипции и трансляции у растений является универсальным и может быть адаптирован не только для накопления гомологичных белков, не синтезируемых данным видом растения, но и для синтеза гетерологичных белков как бактериального, так и животного происхождения. С другой стороны, сами растения in vivo могут служить благоприятной средой для развития различных организмов - бактерий и вирусов, геном которых может быть модифицирован и адаптирован для синтеза соответствующих гетерологичных белков. 22
Трансгенные растения как биопродуценты белков медицинского назначения l l Аппарат транскрипции и трансляции у растений является универсальным и может быть адаптирован не только для накопления гомологичных белков, не синтезируемых данным видом растения, но и для синтеза гетерологичных белков как бактериального, так и животного происхождения. С другой стороны, сами растения in vivo могут служить благоприятной средой для развития различных организмов - бактерий и вирусов, геном которых может быть модифицирован и адаптирован для синтеза соответствующих гетерологичных белков. 22
 Три основных направления создания трансгенных растений - биопродуцентов белков l l Первое. Создание трансгенных растений, в ядерный геном которых перенесены гены, контролирующие синтез соответствующих гетерологичных белков. При переносе в геном растения чужеродные гены, как правило, стабильно интегрируются и передаются потомкам в последующих поколениях согласно законам Менделя 23
Три основных направления создания трансгенных растений - биопродуцентов белков l l Первое. Создание трансгенных растений, в ядерный геном которых перенесены гены, контролирующие синтез соответствующих гетерологичных белков. При переносе в геном растения чужеродные гены, как правило, стабильно интегрируются и передаются потомкам в последующих поколениях согласно законам Менделя 23
 Три основных направления создания трансгенных растений биопродуцентов белков l Второе. Перенос экзогенной ДНК в геном хлоропластов. Однако в литературе встречаются только единичные работы по получению растений с генетически модифицированными хлоропластами. Это связано с чрезвычайной сложностью методов их трансформации и последующего отбора. 24
Три основных направления создания трансгенных растений биопродуцентов белков l Второе. Перенос экзогенной ДНК в геном хлоропластов. Однако в литературе встречаются только единичные работы по получению растений с генетически модифицированными хлоропластами. Это связано с чрезвычайной сложностью методов их трансформации и последующего отбора. 24
 Три основных направления создания трансгенных растений биопродуцентов белков l Третий путь использования растений для накопления белков гетерологичного происхождения основан на природной способности растительных вирусов проникать в клетки растений и колонизировать растительные ткани. На этой основе возникает реальная возможность модификации вирусного генома и адаптации его не только в качестве вектора для доставки в растения соответствующих генетических конструкций, но и в качестве матриц для транзиентной экспрессии генов, кодирующих синтез белков, представляющих коммерческий интерес. 25
Три основных направления создания трансгенных растений биопродуцентов белков l Третий путь использования растений для накопления белков гетерологичного происхождения основан на природной способности растительных вирусов проникать в клетки растений и колонизировать растительные ткани. На этой основе возникает реальная возможность модификации вирусного генома и адаптации его не только в качестве вектора для доставки в растения соответствующих генетических конструкций, но и в качестве матриц для транзиентной экспрессии генов, кодирующих синтез белков, представляющих коммерческий интерес. 25
 Три основных направления создания трансгенных растений биопродуцентов белков l Сравнивая пути наработки гетерологичных белков в растительных тканях, необходимо отметить, что каждый из них имеет свои преимущества и недостатки. В трансгенных растениях перенесенные гены стабильно встраиваются в геном и сохраняются в последующих поколениях, тогда как при интеграции генов в геном вирусов в зараженных вирусами растениях обеспечивается их временная (транзиентная) экспрессия. Накопление соответствующих белковых продуктов будет определяться периодом вегетации зараженного растения-хозяина. С другой стороны, преимуществом вирусного пути накопления белков в растениях является короткий период размножения вирусных частиц, простота инфицирования растений, а также широкий диапазон различных видов растений, которые могли бы быть использованы для этих целей. 26
Три основных направления создания трансгенных растений биопродуцентов белков l Сравнивая пути наработки гетерологичных белков в растительных тканях, необходимо отметить, что каждый из них имеет свои преимущества и недостатки. В трансгенных растениях перенесенные гены стабильно встраиваются в геном и сохраняются в последующих поколениях, тогда как при интеграции генов в геном вирусов в зараженных вирусами растениях обеспечивается их временная (транзиентная) экспрессия. Накопление соответствующих белковых продуктов будет определяться периодом вегетации зараженного растения-хозяина. С другой стороны, преимуществом вирусного пути накопления белков в растениях является короткий период размножения вирусных частиц, простота инфицирования растений, а также широкий диапазон различных видов растений, которые могли бы быть использованы для этих целей. 26
 Растения-продуценты антител l l l В 1989 г. была показана возможность сборки функционально активных иммуноглобулинов класса Ig. G и Ig. A из лёгкой и тяжёлой цепей в растениях табака (Hiatt et al. , 1989). С того момента в нескольких крупных лабораториях мира были получены трансгенные растения продуценты различных типов антител к эпитопам ряда патогенных агентов. Получены: стрептококковый антиген (зубной кариес) на табаке, вирус простого герпеса (соя) раковый эмбриональный антиген (пшеница, рис). 27
Растения-продуценты антител l l l В 1989 г. была показана возможность сборки функционально активных иммуноглобулинов класса Ig. G и Ig. A из лёгкой и тяжёлой цепей в растениях табака (Hiatt et al. , 1989). С того момента в нескольких крупных лабораториях мира были получены трансгенные растения продуценты различных типов антител к эпитопам ряда патогенных агентов. Получены: стрептококковый антиген (зубной кариес) на табаке, вирус простого герпеса (соя) раковый эмбриональный антиген (пшеница, рис). 27
 l Трансгенные растения рассматриваются как потенциальный недорогой источник иммуноглобулинов для медицинских и исследовательских целей. 28
l Трансгенные растения рассматриваются как потенциальный недорогой источник иммуноглобулинов для медицинских и исследовательских целей. 28
 29
29
 Растения-продуценты субъединичных вакцин l Первыми "съедобными вакцинами" были трансгенные растения табака и картофеля, экспрессирующие поверхностный антиген вируса гепатита человека Hbs. Ag (Mason et al. , 1992). 30
Растения-продуценты субъединичных вакцин l Первыми "съедобными вакцинами" были трансгенные растения табака и картофеля, экспрессирующие поверхностный антиген вируса гепатита человека Hbs. Ag (Mason et al. , 1992). 30
 Фармацевтические белки, полученные в трансгенных растениях l l l l l Сывороточный альбумин (цирроз печени, ожоги) - табак Гомодимер коллагена (косметология) - табак β-интерферон (лечение гепатитов С и В ) - табак Эпидермальный фактор роста (заживление ран) - табак Эритропоэтин (анемия) - табак Гемоглобин (кровезаменитель) - табак Соматотропин (гормон роста) - табак Лактоферрин (антимикробное средство) - картофель Интерлейкин (иммунотерапия рака) - картофель 31
Фармацевтические белки, полученные в трансгенных растениях l l l l l Сывороточный альбумин (цирроз печени, ожоги) - табак Гомодимер коллагена (косметология) - табак β-интерферон (лечение гепатитов С и В ) - табак Эпидермальный фактор роста (заживление ран) - табак Эритропоэтин (анемия) - табак Гемоглобин (кровезаменитель) - табак Соматотропин (гормон роста) - табак Лактоферрин (антимикробное средство) - картофель Интерлейкин (иммунотерапия рака) - картофель 31
 Перспективы использования трансгенных растений в медицинских целях l l Несмотря на значительные достижения в области продукции рекомбинантных белков медицинского назначения в растениях, это направление находится лишь на начальном этапе своего развития. Учёные-биотехнологи уверены, что в будущем рекомбинантные препараты, получаемые из генетически модифицированных растений, заменят дорогостоящие бактериальные и животные аналоги на фармацевтическом рынке. 32
Перспективы использования трансгенных растений в медицинских целях l l Несмотря на значительные достижения в области продукции рекомбинантных белков медицинского назначения в растениях, это направление находится лишь на начальном этапе своего развития. Учёные-биотехнологи уверены, что в будущем рекомбинантные препараты, получаемые из генетически модифицированных растений, заменят дорогостоящие бактериальные и животные аналоги на фармацевтическом рынке. 32
 Использование рекомбинантынх ферментов в пищевой промышленности l Отрасли производства в которых применяются рекомбинантные ферменты: Молочная и мясная промышленности, производство крахмала, хлебопекарное производство, виноделие, переработка фруктов и овощей пивоварение, производство этилового спирта, сахарная и масло-жировая промышленности. 33
Использование рекомбинантынх ферментов в пищевой промышленности l Отрасли производства в которых применяются рекомбинантные ферменты: Молочная и мясная промышленности, производство крахмала, хлебопекарное производство, виноделие, переработка фруктов и овощей пивоварение, производство этилового спирта, сахарная и масло-жировая промышленности. 33
 Использование рекомбинантынх ферментов в пищевой промышленности l Особое внимание уделяется модификации молока. Принимая во внимание то обстоятельство, что после питьевого молока самым распространенным молочным продуктом является сыр, генноинженерные работы направлены в основном на улучшение такого технологического свойства молока, как сыропригодность. 34
Использование рекомбинантынх ферментов в пищевой промышленности l Особое внимание уделяется модификации молока. Принимая во внимание то обстоятельство, что после питьевого молока самым распространенным молочным продуктом является сыр, генноинженерные работы направлены в основном на улучшение такого технологического свойства молока, как сыропригодность. 34
 Направления модификации молока l l Увеличение содержания - и - казеинов приводит к повышению плотности сгустка, термостойкости молока и увеличению содержания кальция Внесение протеолитических сайтов в казеины улучшает процессы созревания сыра, увеличивает концентрацию и повышает стабильность казеиновых комплексов, уменьшает размеры мицелл казеина 35
Направления модификации молока l l Увеличение содержания - и - казеинов приводит к повышению плотности сгустка, термостойкости молока и увеличению содержания кальция Внесение протеолитических сайтов в казеины улучшает процессы созревания сыра, увеличивает концентрацию и повышает стабильность казеиновых комплексов, уменьшает размеры мицелл казеина 35
 Генетическая инженерия животных l 1. 2. Все генно-инженерные работы с клетками животных разделяются на две основные группы: Эксперименты с соматическими (не половыми) клетками Эксперименты по трансформации половых клеток (цель получение трансгенных организмов) 36
Генетическая инженерия животных l 1. 2. Все генно-инженерные работы с клетками животных разделяются на две основные группы: Эксперименты с соматическими (не половыми) клетками Эксперименты по трансформации половых клеток (цель получение трансгенных организмов) 36
 Трансформация животного генома l l l Для введения чужеродной ДНК в животную клетку используются носители: векторы на основе ДНК вирусов (бычья папиллома) или ретровирусы (вирус лейкоза мыши). Эти носители легко проникают в клетку хозяина, встраиваются в ее ДНК путем обычной инфекции и обеспечивают высокоэффективный перенос генов. Иногда чужеродную ДНК для введения в клетку упаковывают в липосомы. 37
Трансформация животного генома l l l Для введения чужеродной ДНК в животную клетку используются носители: векторы на основе ДНК вирусов (бычья папиллома) или ретровирусы (вирус лейкоза мыши). Эти носители легко проникают в клетку хозяина, встраиваются в ее ДНК путем обычной инфекции и обеспечивают высокоэффективный перенос генов. Иногда чужеродную ДНК для введения в клетку упаковывают в липосомы. 37
 Генетическая трансформация соматических клеток животных l 1. 2. Цели: Создание клеток продуцентов для получения различных веществ. Модели для изучения тонких механизмов регуляции экспрессии генов и целенаправленного модифицирования генетического аппарата клетки животных и человека (медицинская генетика) 38
Генетическая трансформация соматических клеток животных l 1. 2. Цели: Создание клеток продуцентов для получения различных веществ. Модели для изучения тонких механизмов регуляции экспрессии генов и целенаправленного модифицирования генетического аппарата клетки животных и человека (медицинская генетика) 38
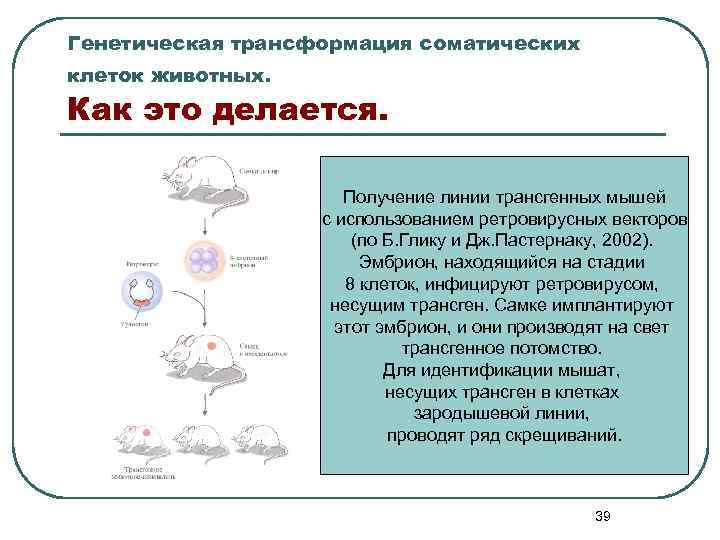 Генетическая трансформация соматических клеток животных. Как это делается. Получение линии трансгенных мышей с использованием ретровирусных векторов (по Б. Глику и Дж. Пастернаку, 2002). Эмбрион, находящийся на стадии 8 клеток, инфицируют ретровирусом, несущим трансген. Самке имплантируют этот эмбрион, и они производят на свет трансгенное потомство. Для идентификации мышат, несущих трансген в клетках зародышевой линии, проводят ряд скрещиваний. 39
Генетическая трансформация соматических клеток животных. Как это делается. Получение линии трансгенных мышей с использованием ретровирусных векторов (по Б. Глику и Дж. Пастернаку, 2002). Эмбрион, находящийся на стадии 8 клеток, инфицируют ретровирусом, несущим трансген. Самке имплантируют этот эмбрион, и они производят на свет трансгенное потомство. Для идентификации мышат, несущих трансген в клетках зародышевой линии, проводят ряд скрещиваний. 39
 Генетическая трансформация соматических клеток животных. Практическое применение. l l Культивирование клеток животных менее экономично, чем бактериальные или дрожжевые культуры, однако они обладают существенным преимуществом – способны осуществлять важные модификации белков. Культуры клеток животных служат источником вирусных антигенов для получения вакцин для животных и человека. При использовании ДНК-вакцин в организм вводится не антиген, а ген, кодирующий синтез этого антигена. Ген встраивается в плазмиду, плазмида вводится в организм путем обычной инъекции, выработка вирусного белка провоцирует синтез специфических антител, т. е. вызывает иммунный ответ. В стадии клинических испытаний в настоящее время находятся ДНК-вакцины против микоплазм, возбудителя туберкулеза, сальмонелеза, лейшманиоза. 40
Генетическая трансформация соматических клеток животных. Практическое применение. l l Культивирование клеток животных менее экономично, чем бактериальные или дрожжевые культуры, однако они обладают существенным преимуществом – способны осуществлять важные модификации белков. Культуры клеток животных служат источником вирусных антигенов для получения вакцин для животных и человека. При использовании ДНК-вакцин в организм вводится не антиген, а ген, кодирующий синтез этого антигена. Ген встраивается в плазмиду, плазмида вводится в организм путем обычной инъекции, выработка вирусного белка провоцирует синтез специфических антител, т. е. вызывает иммунный ответ. В стадии клинических испытаний в настоящее время находятся ДНК-вакцины против микоплазм, возбудителя туберкулеза, сальмонелеза, лейшманиоза. 40
 Генетическая трансформация половых клеток животных l l Цели: Для изменения свойств всего организма необходимо изменить геном половых клеток или зиготы, которые передадут новые свойства потомкам. 41
Генетическая трансформация половых клеток животных l l Цели: Для изменения свойств всего организма необходимо изменить геном половых клеток или зиготы, которые передадут новые свойства потомкам. 41
 Генетическая трансформация половых клеток животных. Как это делается. l l 1. 2. Разработаны способы введения генов в эмбриональные клетки разных животных, в том числе млекопитающих и мух. Существует две основные схемы создания трансгенных животных: Микроинъкция чужеродной ДНК Введение генетической конструкции в эмбриональные стволовые клетки (ЭСК) 42
Генетическая трансформация половых клеток животных. Как это делается. l l 1. 2. Разработаны способы введения генов в эмбриональные клетки разных животных, в том числе млекопитающих и мух. Существует две основные схемы создания трансгенных животных: Микроинъкция чужеродной ДНК Введение генетической конструкции в эмбриональные стволовые клетки (ЭСК) 42
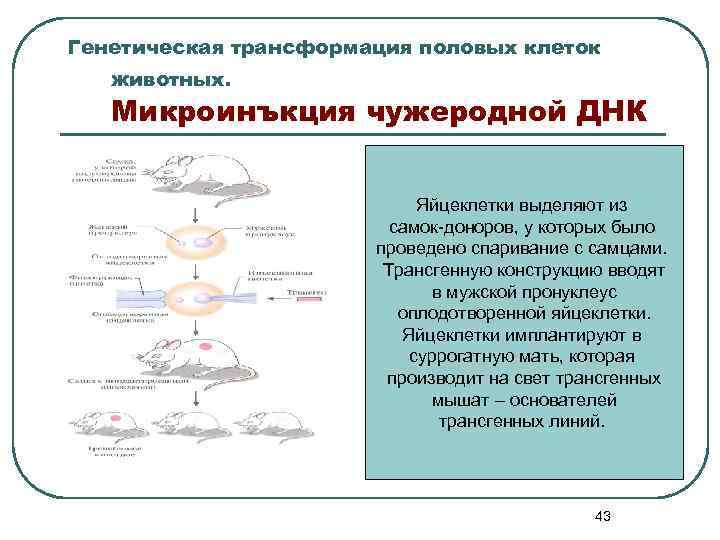 Генетическая трансформация половых клеток животных. Микроинъкция чужеродной ДНК Яйцеклетки выделяют из самок-доноров, у которых было проведено спаривание с самцами. Трансгенную конструкцию вводят в мужской пронуклеус оплодотворенной яйцеклетки. Яйцеклетки имплантируют в суррогатную мать, которая производит на свет трансгенных мышат – основателей трансгенных линий. 43
Генетическая трансформация половых клеток животных. Микроинъкция чужеродной ДНК Яйцеклетки выделяют из самок-доноров, у которых было проведено спаривание с самцами. Трансгенную конструкцию вводят в мужской пронуклеус оплодотворенной яйцеклетки. Яйцеклетки имплантируют в суррогатную мать, которая производит на свет трансгенных мышат – основателей трансгенных линий. 43
 Генетическая трансформация половых клеток животных. Введение генетической конструкции в эмбриональные стволовые клетки (ЭСК). l l ЭСК получают из внутренней клеточной массы бластоцисты мыши. Их трансформируют вектором, несущим трансген, культивируют и идентифицируют трансформированные клетки методом позитивно-негативной селекции или ПЦР. Популяцию трансформированных клеток вновь культивируют и вводят в бластоцисты, которые затем имплантируют в матку суррогатных матерей. Скрещивая животных-основателей, несущих трансген в клетках зародышевой линии, можно получить линии трансгенных мышей. 44
Генетическая трансформация половых клеток животных. Введение генетической конструкции в эмбриональные стволовые клетки (ЭСК). l l ЭСК получают из внутренней клеточной массы бластоцисты мыши. Их трансформируют вектором, несущим трансген, культивируют и идентифицируют трансформированные клетки методом позитивно-негативной селекции или ПЦР. Популяцию трансформированных клеток вновь культивируют и вводят в бластоцисты, которые затем имплантируют в матку суррогатных матерей. Скрещивая животных-основателей, несущих трансген в клетках зародышевой линии, можно получить линии трансгенных мышей. 44
 Клонирование животных l l Клон – популяция клеток или организмов – потомков одной клетки или организма, полученных неполовым путем. Все особи в клоне имеют идентичный набор генов и являются точной копией взятого для размножения экземпляра (прототипа). 45
Клонирование животных l l Клон – популяция клеток или организмов – потомков одной клетки или организма, полученных неполовым путем. Все особи в клоне имеют идентичный набор генов и являются точной копией взятого для размножения экземпляра (прототипа). 45
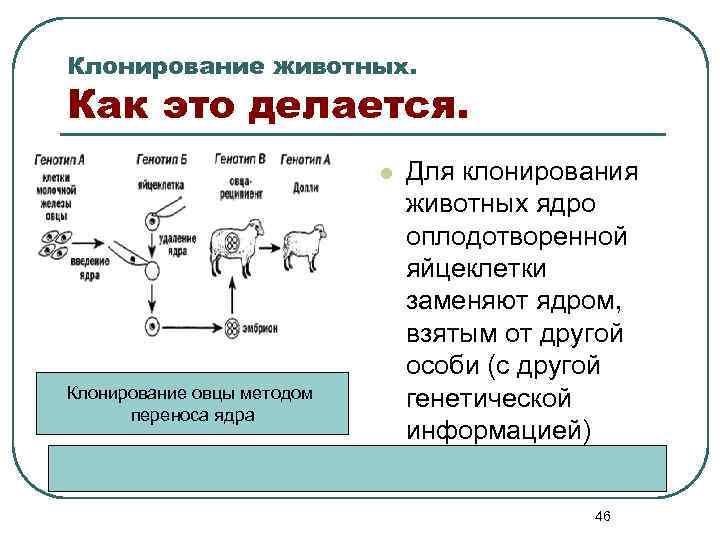 Клонирование животных. Как это делается. l Клонирование овцы методом переноса ядра Для клонирования животных ядро оплодотворенной яйцеклетки заменяют ядром, взятым от другой особи (с другой генетической информацией) 46
Клонирование животных. Как это делается. l Клонирование овцы методом переноса ядра Для клонирования животных ядро оплодотворенной яйцеклетки заменяют ядром, взятым от другой особи (с другой генетической информацией) 46
 Клонирование животных. Как это делается. l l Возможность развиваться во взрослую особь сохраняют ядра из клеток только очень ранних эмбрионов. Четырех – восьми клеточные эмбрионы разделяют на отдельные клетки, культивируют их in vitro и имплантируют в матку суррогатной матери, где они развиваются до рождения. Таким путем можно получать генотипически одинаковые особи (однояйцевых близнецов) 47
Клонирование животных. Как это делается. l l Возможность развиваться во взрослую особь сохраняют ядра из клеток только очень ранних эмбрионов. Четырех – восьми клеточные эмбрионы разделяют на отдельные клетки, культивируют их in vitro и имплантируют в матку суррогатной матери, где они развиваются до рождения. Таким путем можно получать генотипически одинаковые особи (однояйцевых близнецов) 47
 Клонирование овцы l Клонирование овцы осуществлялось методом переноса ядра. Ядро яйцеклетки удаляли с помощью микропипетки, затем культивировали клетки молочной железы взрослой особи и провели их слияние яйцеклетками, лишенными ядра. Выращивание восстановленных яйцеклеток осуществлялось в культуре или в яйцеводе до ранних стадий эмбриогенеза, а затем они имплантировались в матку суррогатной матери. В результате появилась всемирно известная овца Долли, генотип и фенотип которой были полностью идентичны исходной матери. В эксперименте было проведено слияние 277 яйцеклеток с удаленными ядрами с клетками молочной железы. Из 29 эмбрионов только один развился до жизнеспособного плода. 48
Клонирование овцы l Клонирование овцы осуществлялось методом переноса ядра. Ядро яйцеклетки удаляли с помощью микропипетки, затем культивировали клетки молочной железы взрослой особи и провели их слияние яйцеклетками, лишенными ядра. Выращивание восстановленных яйцеклеток осуществлялось в культуре или в яйцеводе до ранних стадий эмбриогенеза, а затем они имплантировались в матку суррогатной матери. В результате появилась всемирно известная овца Долли, генотип и фенотип которой были полностью идентичны исходной матери. В эксперименте было проведено слияние 277 яйцеклеток с удаленными ядрами с клетками молочной железы. Из 29 эмбрионов только один развился до жизнеспособного плода. 48
 Достижения генетической инженерии животных l l 1. 2. Трансгенные животные как модели наследственных заболеваний человека. Использование трансгенных животных в качестве биореакторов. Животные – продуценты биологически активных лекарственных белков человека: трансгенные овцы продуцируют с молоком фактор свертывания крови – лечение гемофилии, 1988 г. Великобритания) Трансгенные коровы, в молоке которых содержится человеческий белок лактоферрин, который применяют для профилактикигастроэнтерологических заболеваний у людей с низкой иммунорезистентностью. 49
Достижения генетической инженерии животных l l 1. 2. Трансгенные животные как модели наследственных заболеваний человека. Использование трансгенных животных в качестве биореакторов. Животные – продуценты биологически активных лекарственных белков человека: трансгенные овцы продуцируют с молоком фактор свертывания крови – лечение гемофилии, 1988 г. Великобритания) Трансгенные коровы, в молоке которых содержится человеческий белок лактоферрин, который применяют для профилактикигастроэнтерологических заболеваний у людей с низкой иммунорезистентностью. 49
 Достижения генетической инженерии животных l Трансгенные животные с выключенными генами (генный нокаут). l Животные-нокауты – удобная модель для исследования функций различных генов. большое значение имеют опыты по созданию животных, продуцирующих молоко, максимально приближенное по составу к материнскому молоку человека. Для этого нужно выключить несколько генов коровы (получить животное-нокаут), а затем ввести в геном коровы несколько генов человека. 50
Достижения генетической инженерии животных l Трансгенные животные с выключенными генами (генный нокаут). l Животные-нокауты – удобная модель для исследования функций различных генов. большое значение имеют опыты по созданию животных, продуцирующих молоко, максимально приближенное по составу к материнскому молоку человека. Для этого нужно выключить несколько генов коровы (получить животное-нокаут), а затем ввести в геном коровы несколько генов человека. 50
 Трансгенные животные – источники органов для пересадки человеку l l l Удобным донором органов являются свиньи, так как подходят человеку по строению, размерам и многим биохимическим показателям. Для пересадки органов необходимо создать трансгенную свинью, у которой будут «нокаутированы» гены тканенесовместимости, а вместо них введены гены тканесовместимости человека. В январе 2002 г. было объявлено о рождении в США пометов трансгенных клонов свиней с «отключенными» генами тканенесовместимости. 51
Трансгенные животные – источники органов для пересадки человеку l l l Удобным донором органов являются свиньи, так как подходят человеку по строению, размерам и многим биохимическим показателям. Для пересадки органов необходимо создать трансгенную свинью, у которой будут «нокаутированы» гены тканенесовместимости, а вместо них введены гены тканесовместимости человека. В январе 2002 г. было объявлено о рождении в США пометов трансгенных клонов свиней с «отключенными» генами тканенесовместимости. 51
 Трансгенные животные l Первые трансгенные животные были получены более 25 лет назад. Однако до сих пор на рынке нет ни одного генетически модифицированного животного для использования в хозяйственной деятельности 52
Трансгенные животные l Первые трансгенные животные были получены более 25 лет назад. Однако до сих пор на рынке нет ни одного генетически модифицированного животного для использования в хозяйственной деятельности 52
 Генодиагностика человека. l l Генодиагностика – совокупность методов по выявлению изменений в структуре генома. Диагностика наследственных заболеваний путем нахождения специфических изменений в генах. ДНК-зонды существуют для диагностирования более 1000 наследственных заболеваний. 53
Генодиагностика человека. l l Генодиагностика – совокупность методов по выявлению изменений в структуре генома. Диагностика наследственных заболеваний путем нахождения специфических изменений в генах. ДНК-зонды существуют для диагностирования более 1000 наследственных заболеваний. 53
 Генетическая терапия l l l Лечение наследственных заболеваний. Устранение генетических дефектов (коррекция наследственных патологий) путем введения в соматические клетки полноценных (функционально активных) генов вместо (или помимо) поврежденного (мутантного) гена. Принципиальный смысл генетической терапии заключается в замещении мутантного белка (с которым связано развитие болезни) клеток человека на соответствующий нормальный белок, который и будет синтезироваться в клетках. 54
Генетическая терапия l l l Лечение наследственных заболеваний. Устранение генетических дефектов (коррекция наследственных патологий) путем введения в соматические клетки полноценных (функционально активных) генов вместо (или помимо) поврежденного (мутантного) гена. Принципиальный смысл генетической терапии заключается в замещении мутантного белка (с которым связано развитие болезни) клеток человека на соответствующий нормальный белок, который и будет синтезироваться в клетках. 54
 Биобезопасность генетически модифицированных организмов l l Биологическая безопасность среди других экологических безопасностей очень специфическая и еще мало изучена. Официально биологическое загрязнение характеризуют как «загрязнение путем сознательного или случайного вселения новых видов, которые беспрепятственно размножаются в условиях отсутствия в них природных врагов и вытесняют местные виды живых организмов» . Качественное отличие этого вида загрязнения от других заключается в способности его компонента к размножению, адаптации и передаче наследственной информации в окружающей среде, мобильности и агрессивности. 55
Биобезопасность генетически модифицированных организмов l l Биологическая безопасность среди других экологических безопасностей очень специфическая и еще мало изучена. Официально биологическое загрязнение характеризуют как «загрязнение путем сознательного или случайного вселения новых видов, которые беспрепятственно размножаются в условиях отсутствия в них природных врагов и вытесняют местные виды живых организмов» . Качественное отличие этого вида загрязнения от других заключается в способности его компонента к размножению, адаптации и передаче наследственной информации в окружающей среде, мобильности и агрессивности. 55
 Биобезопасность генетически модифицированных организмов l l l Системы биобезопасности в настоящее время создаются во многих странах. Развивающимся странам в этом деле способствует программа ООН по защите окружающей среды (ЮНЕП) совместно с Глобальным экологическим фондом (ГЭФ). С 2001 года проект ЮНЕП-ГЭФ по созданию национальных структур биобезопасности начат в более чем 100 странах Африки, Азии, Латинской Америки, Восточной Европы, Кавказа и Центральной Азии. 56
Биобезопасность генетически модифицированных организмов l l l Системы биобезопасности в настоящее время создаются во многих странах. Развивающимся странам в этом деле способствует программа ООН по защите окружающей среды (ЮНЕП) совместно с Глобальным экологическим фондом (ГЭФ). С 2001 года проект ЮНЕП-ГЭФ по созданию национальных структур биобезопасности начат в более чем 100 странах Африки, Азии, Латинской Америки, Восточной Европы, Кавказа и Центральной Азии. 56
 К ГМО постепенно привыкают l l Реакция на продукты из генетически модифицированных источников пищи различна в США и Европе. Потребители в США выражают в основном положительное отношение к генной инженерии. 75% американцев воспринимают применение биотехнологии как большой успех общества, а 44% европейцев – как серьезный риск для здоровья. В то же время 62% американцев и только 22% европейцев готовы купить генетически модифицированный продукт, который характеризуется большей свежестью или улучшенным вкусом. Противники технологии рекомбинантной ДНК, которых 30% в Европе и 13% в США, считают, что эта технология является не только рисковой, но и морально неприемлемой. 57
К ГМО постепенно привыкают l l Реакция на продукты из генетически модифицированных источников пищи различна в США и Европе. Потребители в США выражают в основном положительное отношение к генной инженерии. 75% американцев воспринимают применение биотехнологии как большой успех общества, а 44% европейцев – как серьезный риск для здоровья. В то же время 62% американцев и только 22% европейцев готовы купить генетически модифицированный продукт, который характеризуется большей свежестью или улучшенным вкусом. Противники технологии рекомбинантной ДНК, которых 30% в Европе и 13% в США, считают, что эта технология является не только рисковой, но и морально неприемлемой. 57


