10 Перенос электронов в дыхательной цепи.ppt
- Количество слайдов: 28
 Трансформация энергии в митохондриях Юрий Андреевич Владимиров yuvlad@mail. ru ФБМ МГУ 2008 © 2012 Ю. А. Владимиров (ФФМ МГУ)
Трансформация энергии в митохондриях Юрий Андреевич Владимиров yuvlad@mail. ru ФБМ МГУ 2008 © 2012 Ю. А. Владимиров (ФФМ МГУ)
 Перенос электронов во внутренней мембране митохондрий Юрий Андреевич Владимиров yuvlad@mail. ru ФБМ МГУ 2008 © 2012 Ю. А. Владимиров (ФФМ МГУ)
Перенос электронов во внутренней мембране митохондрий Юрий Андреевич Владимиров yuvlad@mail. ru ФБМ МГУ 2008 © 2012 Ю. А. Владимиров (ФФМ МГУ)
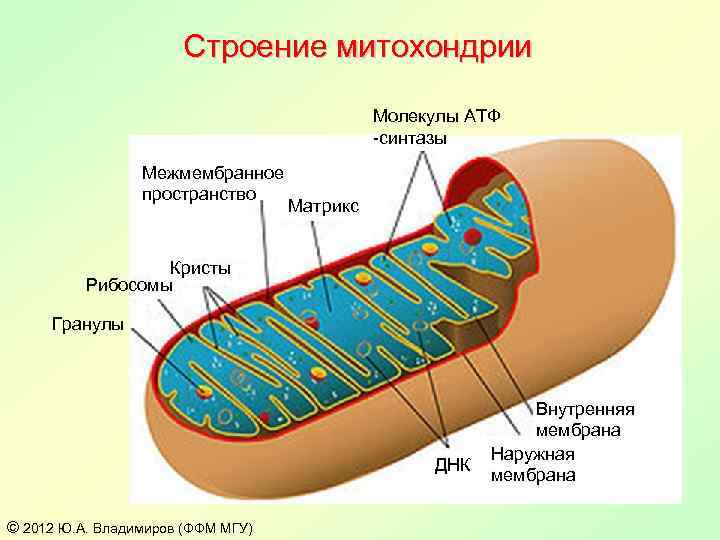 Строение митохондрии Молекулы АТФ -синтазы Межмембранное пространство Матрикс Кристы Рибосомы Гранулы ДНК © 2012 Ю. А. Владимиров (ФФМ МГУ) Внутренняя мембрана Наружная мембрана
Строение митохондрии Молекулы АТФ -синтазы Межмембранное пространство Матрикс Кристы Рибосомы Гранулы ДНК © 2012 Ю. А. Владимиров (ФФМ МГУ) Внутренняя мембрана Наружная мембрана
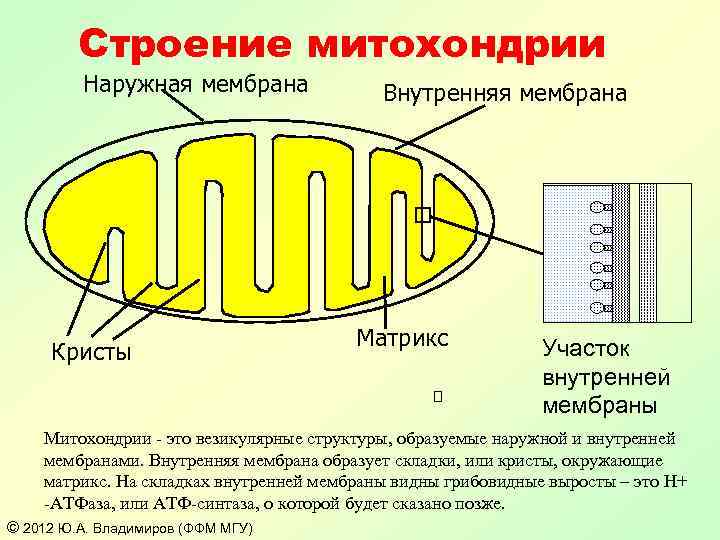 Строение митохондрии Наружная мембрана Кристы Внутренняя мембрана Матрикс Участок внутренней мембраны Митохондрии - это везикулярные структуры, образуемые наружной и внутренней мембранами. Внутренняя мембрана образует складки, или кристы, окружающие матрикс. На складках внутренней мембраны видны грибовидные выросты – это H+ -АТФаза, или АТФ-синтаза, о которой будет сказано позже. © 2012 Ю. А. Владимиров (ФФМ МГУ)
Строение митохондрии Наружная мембрана Кристы Внутренняя мембрана Матрикс Участок внутренней мембраны Митохондрии - это везикулярные структуры, образуемые наружной и внутренней мембранами. Внутренняя мембрана образует складки, или кристы, окружающие матрикс. На складках внутренней мембраны видны грибовидные выросты – это H+ -АТФаза, или АТФ-синтаза, о которой будет сказано позже. © 2012 Ю. А. Владимиров (ФФМ МГУ)
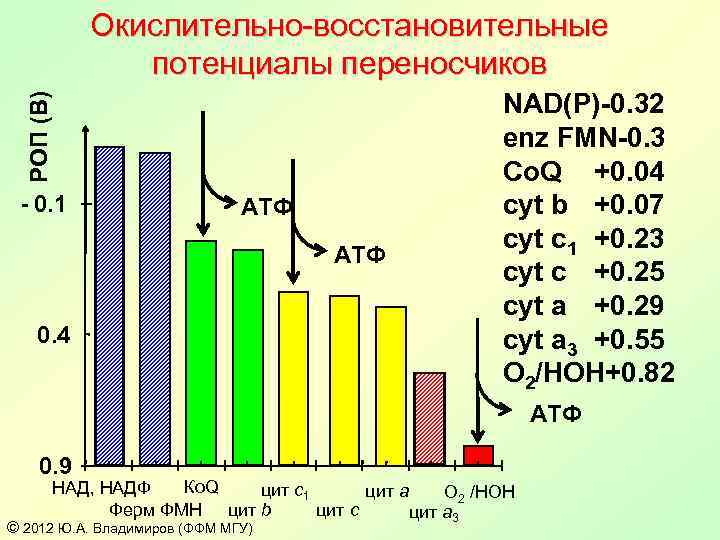 РОП (В) Окислительно-восстановительные потенциалы переносчиков - 0. 1 АТФ 0. 4 NAD(P)-0. 32 enz FMN-0. 3 Co. Q +0. 04 cyt b +0. 07 cyt c 1 +0. 23 cyt c +0. 25 cyt a +0. 29 cyt a 3 +0. 55 O 2/HOH+0. 82 АТФ 0. 9 Ко. Q НАД, НАДФ цит c 1 цит a O 2 /HOH Ферм ФМН цит b цит c цит a 3 © 2012 Ю. А. Владимиров (ФФМ МГУ)
РОП (В) Окислительно-восстановительные потенциалы переносчиков - 0. 1 АТФ 0. 4 NAD(P)-0. 32 enz FMN-0. 3 Co. Q +0. 04 cyt b +0. 07 cyt c 1 +0. 23 cyt c +0. 25 cyt a +0. 29 cyt a 3 +0. 55 O 2/HOH+0. 82 АТФ 0. 9 Ко. Q НАД, НАДФ цит c 1 цит a O 2 /HOH Ферм ФМН цит b цит c цит a 3 © 2012 Ю. А. Владимиров (ФФМ МГУ)
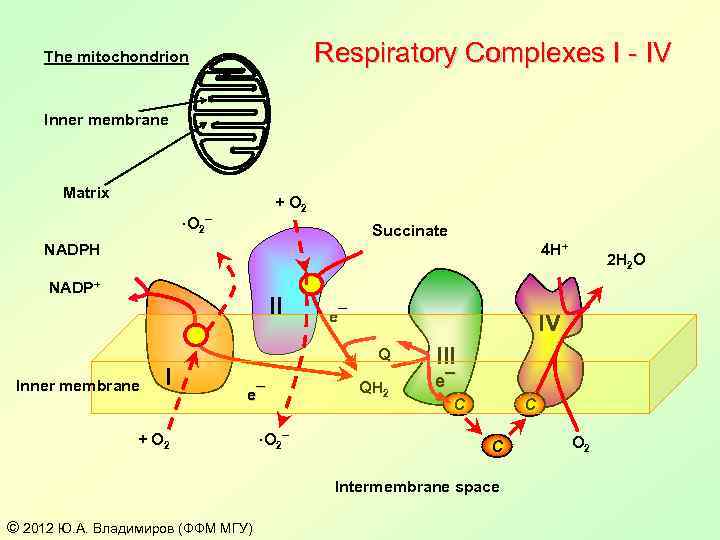 Respiratory Complexes I - IV The mitochondrion Inner membrane Matrix + O 2 ·O 2¯ Succinate NADPH 4 H+ NADP+ II e¯ IV Q Inner membrane I e¯ + O 2 ·O 2¯ III QH 2 e¯ C C C Intermembrane space © 2012 Ю. А. Владимиров (ФФМ МГУ) 2 H 2 O O 2
Respiratory Complexes I - IV The mitochondrion Inner membrane Matrix + O 2 ·O 2¯ Succinate NADPH 4 H+ NADP+ II e¯ IV Q Inner membrane I e¯ + O 2 ·O 2¯ III QH 2 e¯ C C C Intermembrane space © 2012 Ю. А. Владимиров (ФФМ МГУ) 2 H 2 O O 2
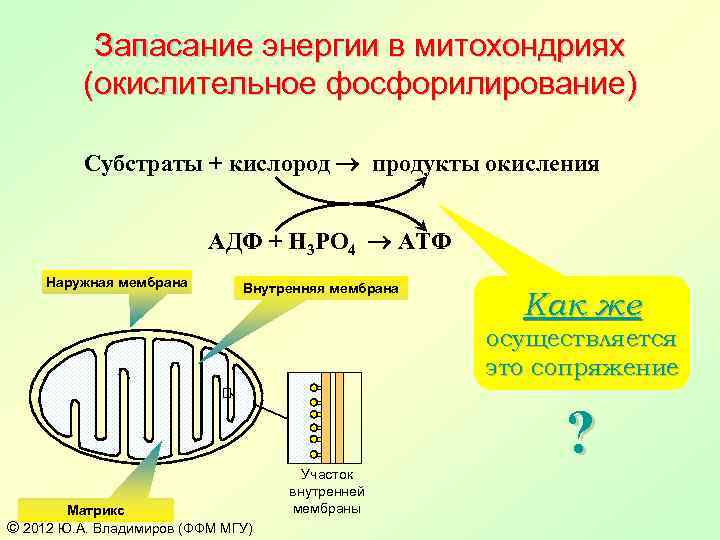 Запасание энергии в митохондриях (окислительное фосфорилирование) Субстраты + кислород продукты окисления АДФ + H 3 PO 4 АТФ Наружная мембрана Внутренняя мембрана Как же осуществляется это сопряжение Матрикс © 2012 Ю. А. Владимиров (ФФМ МГУ) Участок внутренней мембраны ?
Запасание энергии в митохондриях (окислительное фосфорилирование) Субстраты + кислород продукты окисления АДФ + H 3 PO 4 АТФ Наружная мембрана Внутренняя мембрана Как же осуществляется это сопряжение Матрикс © 2012 Ю. А. Владимиров (ФФМ МГУ) Участок внутренней мембраны ?
 Строение дыхательных комплексов © 2012 Ю. А. Владимиров (ФФМ МГУ)
Строение дыхательных комплексов © 2012 Ю. А. Владимиров (ФФМ МГУ)
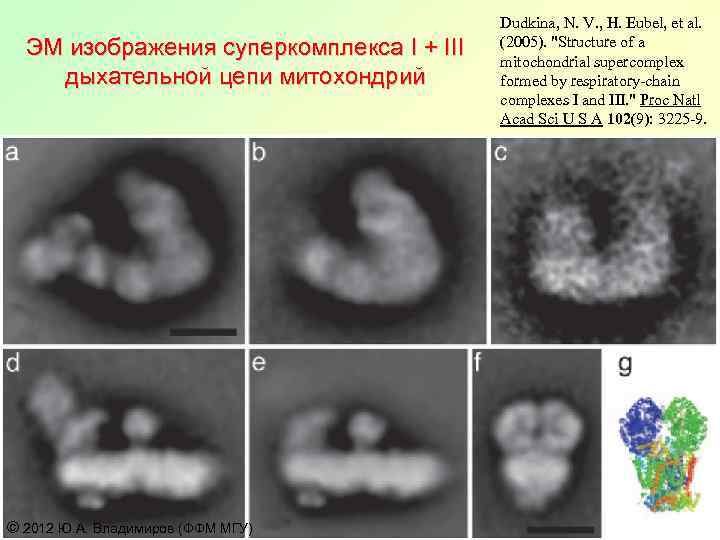 ЭМ изображения суперкомплекса I + III дыхательной цепи митохондрий © 2012 Ю. А. Владимиров (ФФМ МГУ) Dudkina, N. V. , H. Eubel, et al. (2005). "Structure of a mitochondrial supercomplex formed by respiratory-chain complexes I and III. " Proc Natl Acad Sci U S A 102(9): 3225 -9.
ЭМ изображения суперкомплекса I + III дыхательной цепи митохондрий © 2012 Ю. А. Владимиров (ФФМ МГУ) Dudkina, N. V. , H. Eubel, et al. (2005). "Structure of a mitochondrial supercomplex formed by respiratory-chain complexes I and III. " Proc Natl Acad Sci U S A 102(9): 3225 -9.
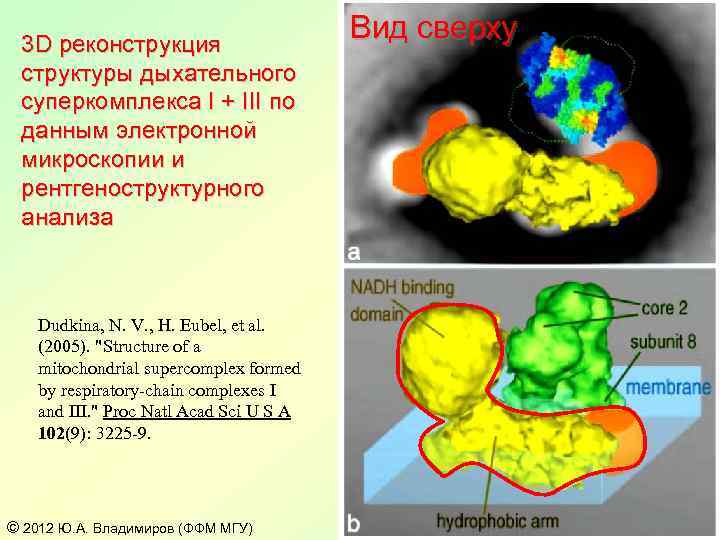 3 D реконструкция структуры дыхательного суперкомплекса I + III по данным электронной микроскопии и рентгеноструктурного анализа Dudkina, N. V. , H. Eubel, et al. (2005). "Structure of a mitochondrial supercomplex formed by respiratory-chain complexes I and III. " Proc Natl Acad Sci U S A 102(9): 3225 -9. © 2012 Ю. А. Владимиров (ФФМ МГУ) Вид сверху
3 D реконструкция структуры дыхательного суперкомплекса I + III по данным электронной микроскопии и рентгеноструктурного анализа Dudkina, N. V. , H. Eubel, et al. (2005). "Structure of a mitochondrial supercomplex formed by respiratory-chain complexes I and III. " Proc Natl Acad Sci U S A 102(9): 3225 -9. © 2012 Ю. А. Владимиров (ФФМ МГУ) Вид сверху
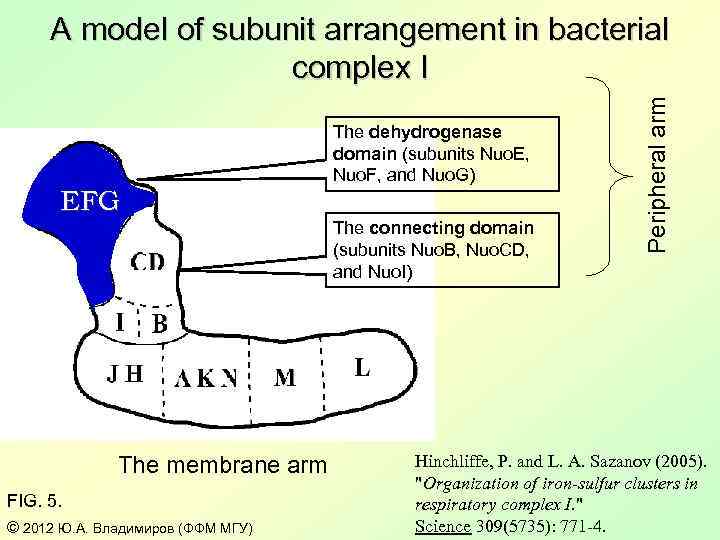 EFG The dehydrogenase domain (subunits Nuo. E, Nuo. F, and Nuo. G) The connecting domain (subunits Nuo. B, Nuo. CD, and Nuo. I) The membrane arm FIG. 5. © 2012 Ю. А. Владимиров (ФФМ МГУ) Peripheral arm A model of subunit arrangement in bacterial complex I Hinchliffe, P. and L. A. Sazanov (2005). "Organization of iron-sulfur clusters in respiratory complex I. " Science 309(5735): 771 -4.
EFG The dehydrogenase domain (subunits Nuo. E, Nuo. F, and Nuo. G) The connecting domain (subunits Nuo. B, Nuo. CD, and Nuo. I) The membrane arm FIG. 5. © 2012 Ю. А. Владимиров (ФФМ МГУ) Peripheral arm A model of subunit arrangement in bacterial complex I Hinchliffe, P. and L. A. Sazanov (2005). "Organization of iron-sulfur clusters in respiratory complex I. " Science 309(5735): 771 -4.
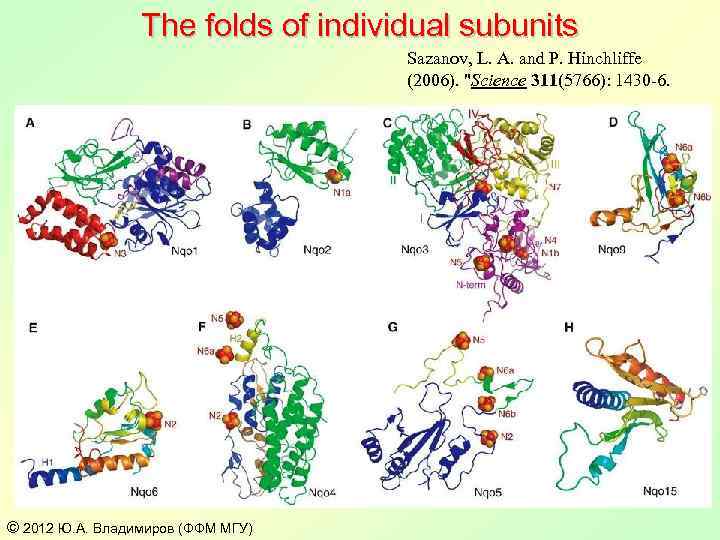 The folds of individual subunits Sazanov, L. A. and P. Hinchliffe (2006). "Science 311(5766): 1430 -6. © 2012 Ю. А. Владимиров (ФФМ МГУ)
The folds of individual subunits Sazanov, L. A. and P. Hinchliffe (2006). "Science 311(5766): 1430 -6. © 2012 Ю. А. Владимиров (ФФМ МГУ)
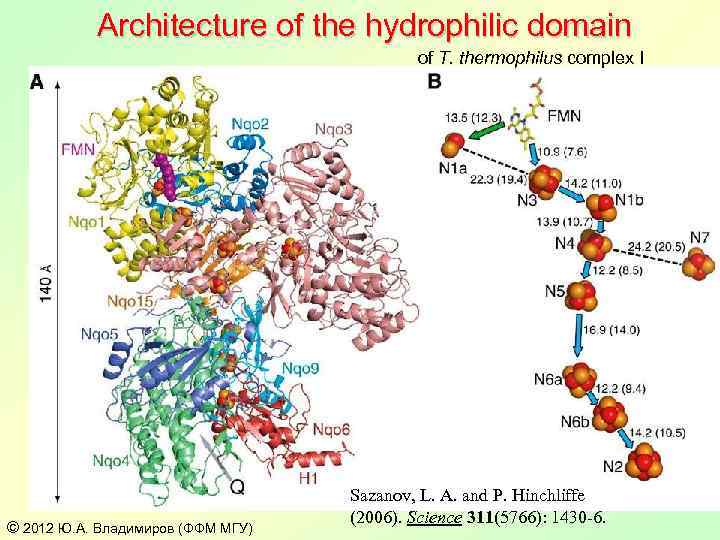 Architecture of the hydrophilic domain of T. thermophilus complex I © 2012 Ю. А. Владимиров (ФФМ МГУ) Sazanov, L. A. and P. Hinchliffe (2006). Science 311(5766): 1430 -6.
Architecture of the hydrophilic domain of T. thermophilus complex I © 2012 Ю. А. Владимиров (ФФМ МГУ) Sazanov, L. A. and P. Hinchliffe (2006). Science 311(5766): 1430 -6.
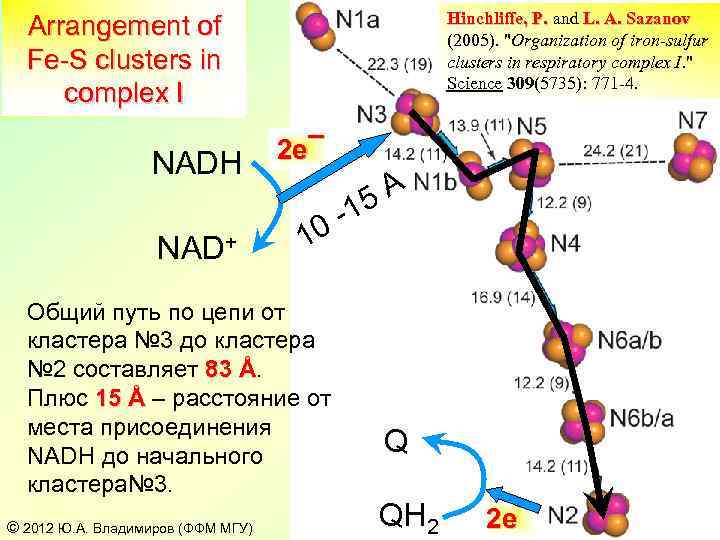 Hinchliffe, P. and L. A. Sazanov (2005). "Organization of iron-sulfur clusters in respiratory complex I. " Science 309(5735): 771 -4. Arrangement of Fe-S clusters in complex I NADH NAD+ 2 e¯ 10 Общий путь по цепи от кластера № 3 до кластера № 2 составляет 83 Å. Плюс 15 Å – расстояние от места присоединения NADH до начального кластера№ 3. © 2012 Ю. А. Владимиров (ФФМ МГУ) 5 A -1 Q QH 2 2 e¯
Hinchliffe, P. and L. A. Sazanov (2005). "Organization of iron-sulfur clusters in respiratory complex I. " Science 309(5735): 771 -4. Arrangement of Fe-S clusters in complex I NADH NAD+ 2 e¯ 10 Общий путь по цепи от кластера № 3 до кластера № 2 составляет 83 Å. Плюс 15 Å – расстояние от места присоединения NADH до начального кластера№ 3. © 2012 Ю. А. Владимиров (ФФМ МГУ) 5 A -1 Q QH 2 2 e¯
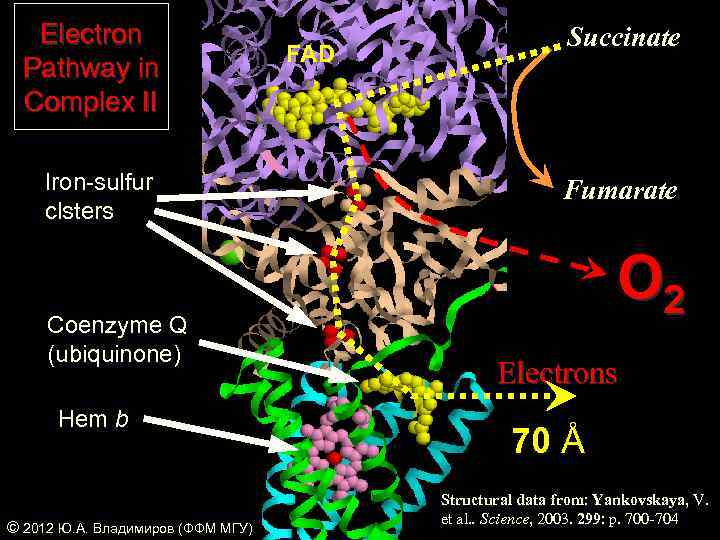 Electron Pathway in Complex II Iron-sulfur clsters Coenzyme Q (ubiquinone) Hem b © 2012 Ю. А. Владимиров (ФФМ МГУ) FAD Succinate Fumarate O 2 Electrons 70 Å Structural data from: Yankovskaya, V. et al. . Science, 2003. 299: p. 700 -704
Electron Pathway in Complex II Iron-sulfur clsters Coenzyme Q (ubiquinone) Hem b © 2012 Ю. А. Владимиров (ФФМ МГУ) FAD Succinate Fumarate O 2 Electrons 70 Å Structural data from: Yankovskaya, V. et al. . Science, 2003. 299: p. 700 -704
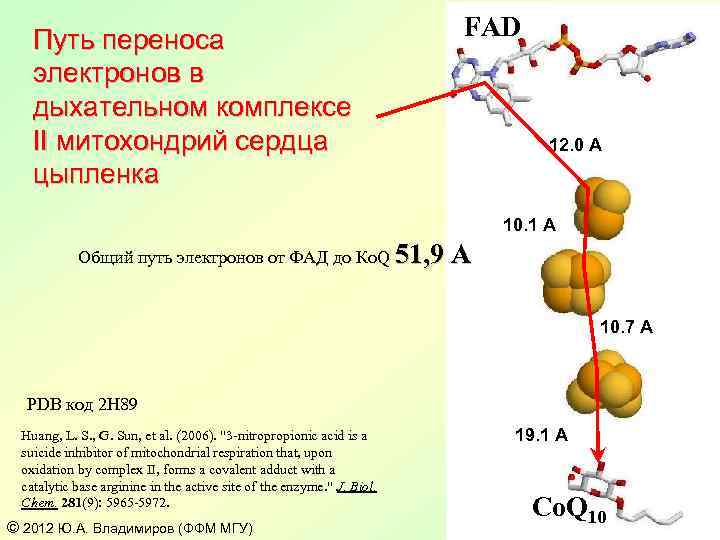 Путь переноса электронов в дыхательном комплексе II митохондрий сердца цыпленка FAD 12. 0 A 10. 1 A Общий путь электронов от ФАД до Ко. Q 51, 9 А 10. 7 A PDB код 2 H 89 Huang, L. S. , G. Sun, et al. (2006). "3 -nitropropionic acid is a suicide inhibitor of mitochondrial respiration that, upon oxidation by complex II, forms a covalent adduct with a catalytic base arginine in the active site of the enzyme. " J. Biol. Chem. 281(9): 5965 -5972. © 2012 Ю. А. Владимиров (ФФМ МГУ) 19. 1 A Co. Q 10
Путь переноса электронов в дыхательном комплексе II митохондрий сердца цыпленка FAD 12. 0 A 10. 1 A Общий путь электронов от ФАД до Ко. Q 51, 9 А 10. 7 A PDB код 2 H 89 Huang, L. S. , G. Sun, et al. (2006). "3 -nitropropionic acid is a suicide inhibitor of mitochondrial respiration that, upon oxidation by complex II, forms a covalent adduct with a catalytic base arginine in the active site of the enzyme. " J. Biol. Chem. 281(9): 5965 -5972. © 2012 Ю. А. Владимиров (ФФМ МГУ) 19. 1 A Co. Q 10
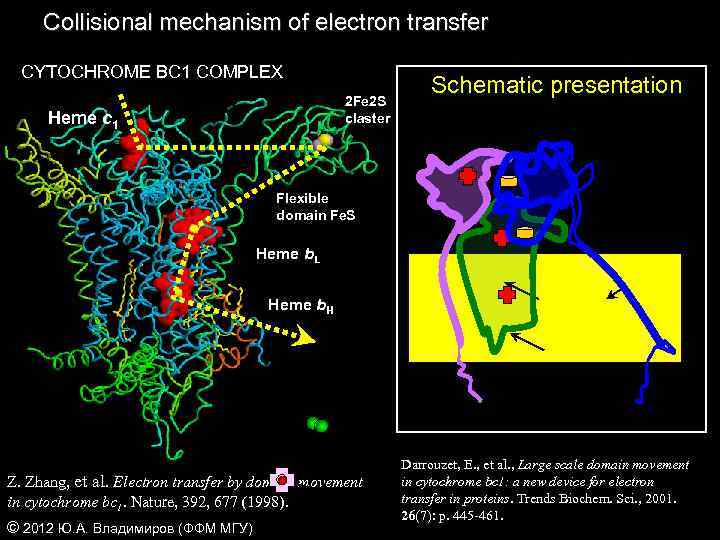 Collisional mechanism of electron transfer CYTOCHROME BC 1 COMPLEX 2 Fe 2 S claster Heme c 1 Schematic presentation Flexible domain Fe. S Heme b. L Heme b. H Z. Zhang, et al. Electron transfer by domain movement in cytochrome bc 1. Nature, 392, 677 (1998). © 2012 Ю. А. Владимиров (ФФМ МГУ) Darrouzet, E. , et al. , Large scale domain movement in cytochrome bc 1: a new device for electron transfer in proteins. Trends Biochem. Sci. , 2001. 26(7): p. 445 -461.
Collisional mechanism of electron transfer CYTOCHROME BC 1 COMPLEX 2 Fe 2 S claster Heme c 1 Schematic presentation Flexible domain Fe. S Heme b. L Heme b. H Z. Zhang, et al. Electron transfer by domain movement in cytochrome bc 1. Nature, 392, 677 (1998). © 2012 Ю. А. Владимиров (ФФМ МГУ) Darrouzet, E. , et al. , Large scale domain movement in cytochrome bc 1: a new device for electron transfer in proteins. Trends Biochem. Sci. , 2001. 26(7): p. 445 -461.
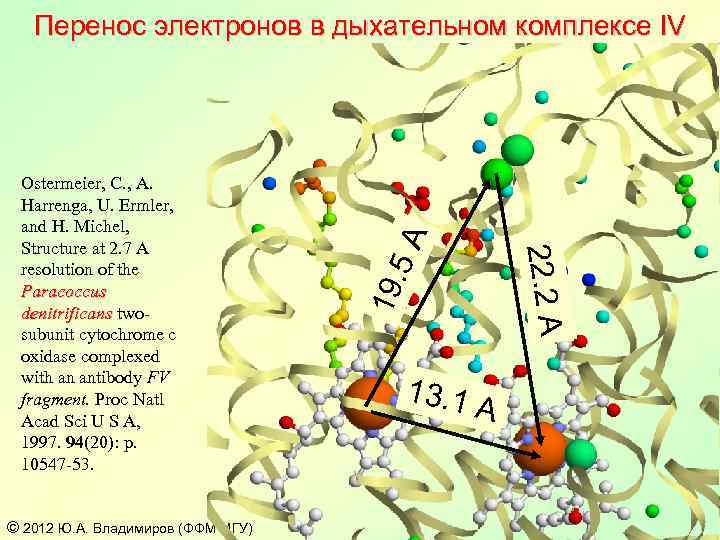 © 2012 Ю. А. Владимиров (ФФМ МГУ) 19. 22. 2 A Ostermeier, C. , A. Harrenga, U. Ermler, and H. Michel, Structure at 2. 7 A resolution of the Paracoccus denitrificans twosubunit cytochrome c oxidase complexed with an antibody FV fragment. Proc Natl Acad Sci U S A, 1997. 94(20): p. 10547 -53. 5 A Перенос электронов в дыхательном комплексе IV 13. 1 A
© 2012 Ю. А. Владимиров (ФФМ МГУ) 19. 22. 2 A Ostermeier, C. , A. Harrenga, U. Ermler, and H. Michel, Structure at 2. 7 A resolution of the Paracoccus denitrificans twosubunit cytochrome c oxidase complexed with an antibody FV fragment. Proc Natl Acad Sci U S A, 1997. 94(20): p. 10547 -53. 5 A Перенос электронов в дыхательном комплексе IV 13. 1 A
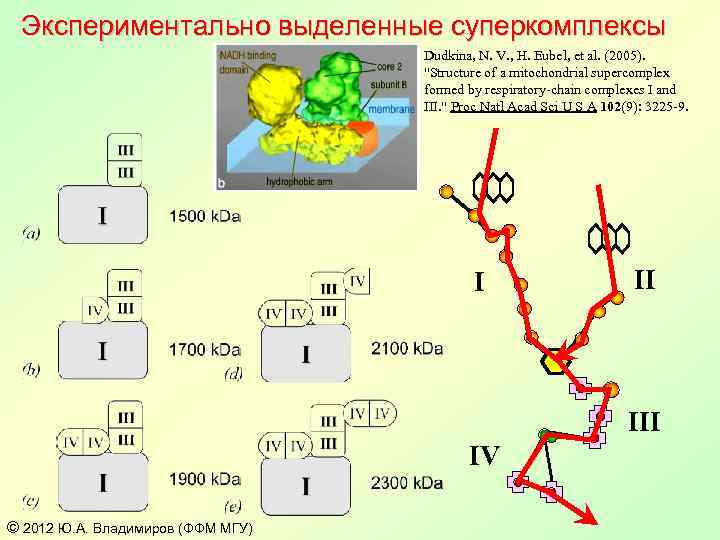 Экспериментально выделенные суперкомплексы Dudkina, N. V. , H. Eubel, et al. (2005). "Structure of a mitochondrial supercomplex formed by respiratory-chain complexes I and III. " Proc Natl Acad Sci U S A 102(9): 3225 -9. I II IV © 2012 Ю. А. Владимиров (ФФМ МГУ)
Экспериментально выделенные суперкомплексы Dudkina, N. V. , H. Eubel, et al. (2005). "Structure of a mitochondrial supercomplex formed by respiratory-chain complexes I and III. " Proc Natl Acad Sci U S A 102(9): 3225 -9. I II IV © 2012 Ю. А. Владимиров (ФФМ МГУ)
 Механизм переноса электронов между редокс-центрами © 2012 Ю. А. Владимиров (ФФМ МГУ)
Механизм переноса электронов между редокс-центрами © 2012 Ю. А. Владимиров (ФФМ МГУ)
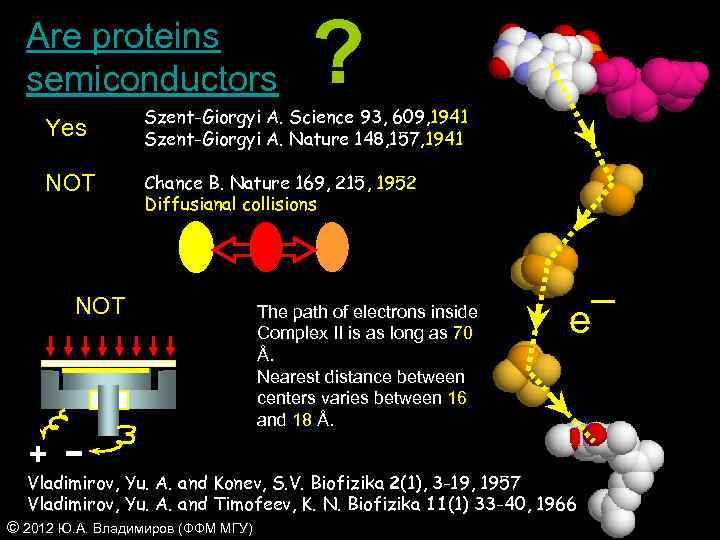 Are proteins semiconductors Yes NOT ? Szent-Giorgyi A. Science 93, 609, 1941 Szent-Giorgyi A. Nature 148, 157, 1941 Chance B. Nature 169, 215, 1952 Diffusianal collisions NOT + The path of electrons inside Complex II is as long as 70 Å. Nearest distance between centers varies between 16 and 18 Å. e¯ Vladimirov, Yu. A. and Konev, S. V. Biofizika 2(1), 3 -19, 1957 Vladimirov, Yu. A. and Timofeev, K. N. Biofizika 11(1) 33 -40, 1966 © 2012 Ю. А. Владимиров (ФФМ МГУ)
Are proteins semiconductors Yes NOT ? Szent-Giorgyi A. Science 93, 609, 1941 Szent-Giorgyi A. Nature 148, 157, 1941 Chance B. Nature 169, 215, 1952 Diffusianal collisions NOT + The path of electrons inside Complex II is as long as 70 Å. Nearest distance between centers varies between 16 and 18 Å. e¯ Vladimirov, Yu. A. and Konev, S. V. Biofizika 2(1), 3 -19, 1957 Vladimirov, Yu. A. and Timofeev, K. N. Biofizika 11(1) 33 -40, 1966 © 2012 Ю. А. Владимиров (ФФМ МГУ)
 Туннельный перенос электронов Диффузионный механизм – не единственный и скорее всего – не главный. © 2012 Ю. А. Владимиров (ФФМ МГУ)
Туннельный перенос электронов Диффузионный механизм – не единственный и скорее всего – не главный. © 2012 Ю. А. Владимиров (ФФМ МГУ)
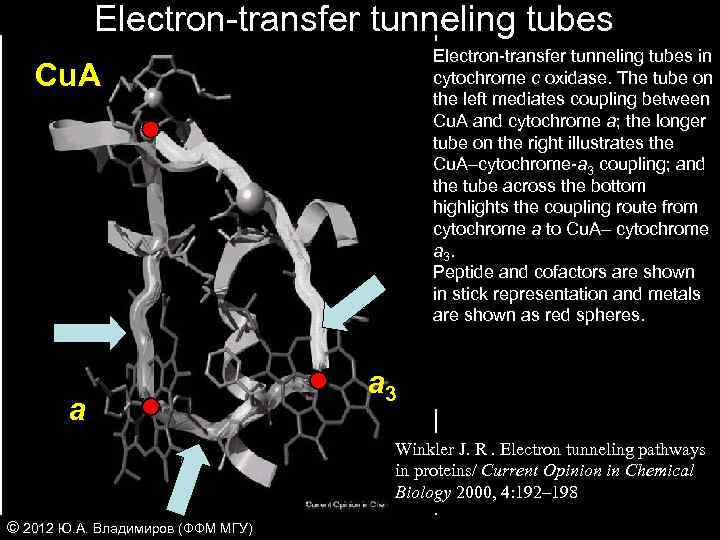 Electron-transfer tunneling tubes in cytochrome c oxidase. The tube on the left mediates coupling between Cu. A and cytochrome a; the longer tube on the right illustrates the Cu. A–cytochrome-a 3 coupling; and the tube across the bottom highlights the coupling route from cytochrome a to Cu. A– cytochrome a 3. Peptide and cofactors are shown in stick representation and metals are shown as red spheres. Cu. A a a 3 Winkler J. R. Electron tunneling pathways in proteins/ Current Opinion in Chemical Biology 2000, 4: 192– 198 © 2012 Ю. А. Владимиров (ФФМ МГУ)
Electron-transfer tunneling tubes in cytochrome c oxidase. The tube on the left mediates coupling between Cu. A and cytochrome a; the longer tube on the right illustrates the Cu. A–cytochrome-a 3 coupling; and the tube across the bottom highlights the coupling route from cytochrome a to Cu. A– cytochrome a 3. Peptide and cofactors are shown in stick representation and metals are shown as red spheres. Cu. A a a 3 Winkler J. R. Electron tunneling pathways in proteins/ Current Opinion in Chemical Biology 2000, 4: 192– 198 © 2012 Ю. А. Владимиров (ФФМ МГУ)
 Оценка скорости переноса электронов Скорость переноса электрона в белках изучают главным образом методами быстрой кинетики. © 2012 Ю. А. Владимиров (ФФМ МГУ)
Оценка скорости переноса электронов Скорость переноса электрона в белках изучают главным образом методами быстрой кинетики. © 2012 Ю. А. Владимиров (ФФМ МГУ)
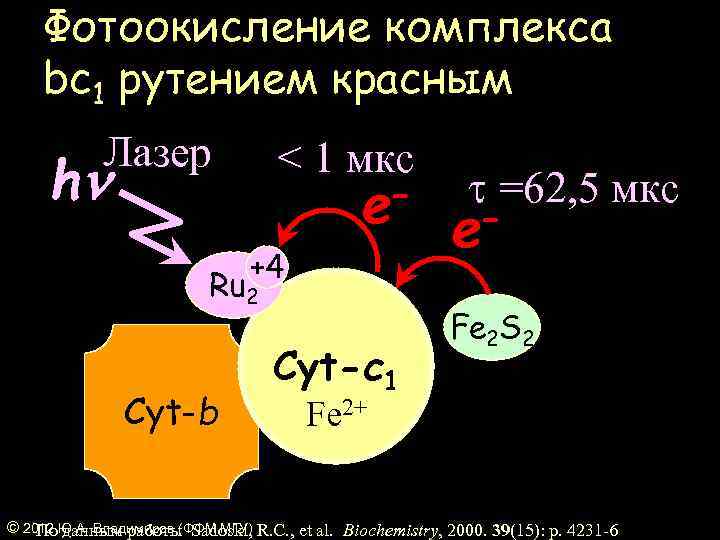 Фотоокисление комплекса bс1 рутением красным Лазер < 1 мкс hn – e +4 Ru 2 Cyt-b Cyt-c 1 t =62, 5 мкс – e Fe 2 S 2 Fe 2+ © 2012 Ю. А. Владимиров (ФФМ МГУ) R. C. , et al. Biochemistry, 2000. 39(15): p. 4231 -6 По данным работы Sadoski,
Фотоокисление комплекса bс1 рутением красным Лазер < 1 мкс hn – e +4 Ru 2 Cyt-b Cyt-c 1 t =62, 5 мкс – e Fe 2 S 2 Fe 2+ © 2012 Ю. А. Владимиров (ФФМ МГУ) R. C. , et al. Biochemistry, 2000. 39(15): p. 4231 -6 По данным работы Sadoski,
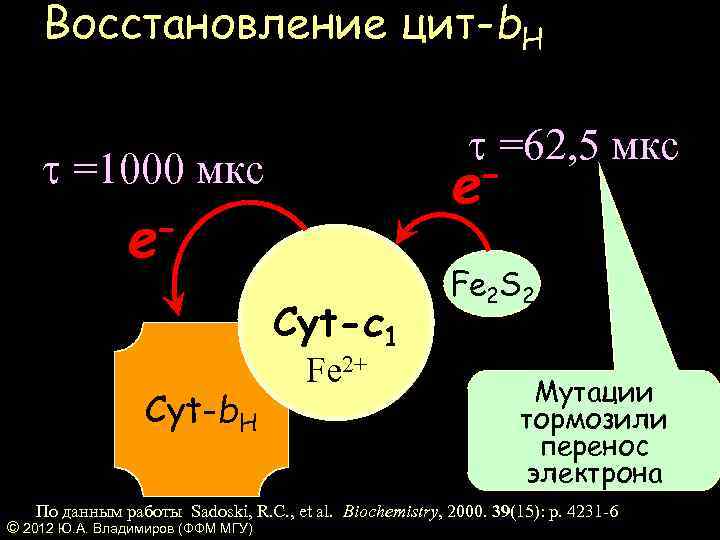 Восстановление цит-b. H t =62, 5 мкс t =1000 мкс – e Cyt-c 1 Cyt-b. H Fe 2+ Fe 2 S 2 Мутации тормозили перенос электрона По данным работы Sadoski, R. C. , et al. Biochemistry, 2000. 39(15): p. 4231 -6 © 2012 Ю. А. Владимиров (ФФМ МГУ)
Восстановление цит-b. H t =62, 5 мкс t =1000 мкс – e Cyt-c 1 Cyt-b. H Fe 2+ Fe 2 S 2 Мутации тормозили перенос электрона По данным работы Sadoski, R. C. , et al. Biochemistry, 2000. 39(15): p. 4231 -6 © 2012 Ю. А. Владимиров (ФФМ МГУ)
 Диффузионный механизм переноса электронов При небольших расстояниях скорости диффузионного переноса очень велики. © 2012 Ю. А. Владимиров (ФФМ МГУ)
Диффузионный механизм переноса электронов При небольших расстояниях скорости диффузионного переноса очень велики. © 2012 Ю. А. Владимиров (ФФМ МГУ)
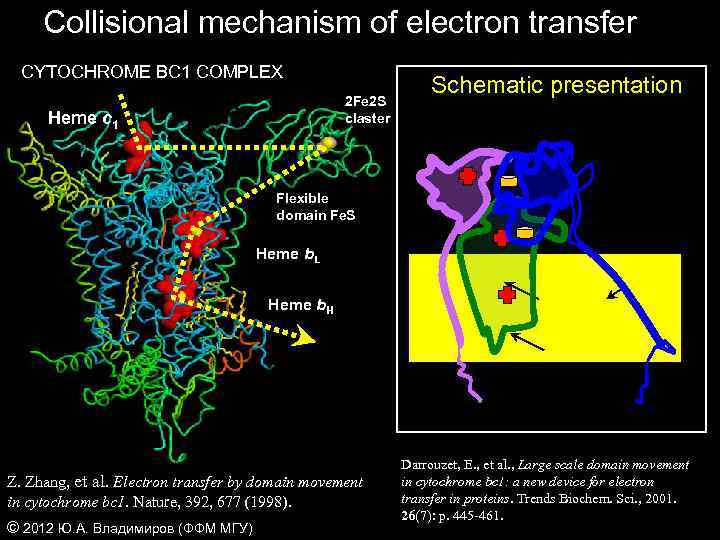 Collisional mechanism of electron transfer CYTOCHROME BC 1 COMPLEX 2 Fe 2 S claster Heme c 1 Schematic presentation Flexible domain Fe. S Heme b. L Heme b. H Z. Zhang, et al. Electron transfer by domain movement in cytochrome bc 1. Nature, 392, 677 (1998). © 2012 Ю. А. Владимиров (ФФМ МГУ) Darrouzet, E. , et al. , Large scale domain movement in cytochrome bc 1: a new device for electron transfer in proteins. Trends Biochem. Sci. , 2001. 26(7): p. 445 -461.
Collisional mechanism of electron transfer CYTOCHROME BC 1 COMPLEX 2 Fe 2 S claster Heme c 1 Schematic presentation Flexible domain Fe. S Heme b. L Heme b. H Z. Zhang, et al. Electron transfer by domain movement in cytochrome bc 1. Nature, 392, 677 (1998). © 2012 Ю. А. Владимиров (ФФМ МГУ) Darrouzet, E. , et al. , Large scale domain movement in cytochrome bc 1: a new device for electron transfer in proteins. Trends Biochem. Sci. , 2001. 26(7): p. 445 -461.


