42dd4d4f00b70ce5131937c92bbb3ff4.ppt
- Количество слайдов: 14

Traçabilité et Pilotage de production dans les Industries Pharmaceutiques et Chimiques Prochim / Propharma LYON 30 -31/01/2000 Jean Vieille, animateur FBF, président ISA France Jean Vieille Prochim Pro. Pharma Lyon 31/01/2001

Sommaire • Traçabilité? • Information de Traçabilité • Généalogie et Récursivité de l’information • Traçabilité dans la Supply Chain • Réglementation – Exactitude : validation, signature – Support et Persistance : • Organismes et travaux Jean Vieille Prochim Pro. Pharma Lyon 31/01/2001

Traçabilité? • Un mot inconnu des dictionnaires – « Garder la trace » de ce qui s’est passé – Information disponible dans son contexte d’origine • Besoins « proactifs » : performance – Maîtrise de la Qualité – Amélioration du procédé – Optimisation de la maintenance • Besoins « réactifs » : recherche des causes – Sécurité des produits et des personnes – Anomalies du procédé – Pannes • Contraintes: – Pharmacie : Réglementation (réactif) – Chimie : Amélioration (proactif) Jean Vieille Prochim Pro. Pharma Lyon 31/01/2001

Quelle Information – Quel support • Support: – Produit : le Lot – Ressources – Documentation Système et Produits • Information: – Qualité: Données physico-bio-chimiques – Procédé: Exécution du mode opératoire – Ressources: Opérateurs, Équipements – Ingénierie: Évolution du système, des modes opératoires Jean Vieille Prochim Pro. Pharma Lyon 31/01/2001
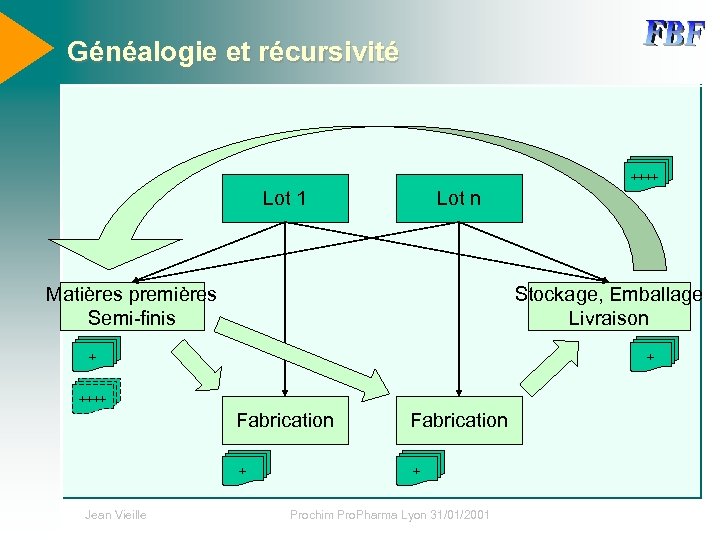
Généalogie et récursivité ++++ Lot 1 Lot n Matières premières Semi-finis Stockage, Emballage Livraison + + ++++ Fabrication + Jean Vieille Fabrication + Prochim Pro. Pharma Lyon 31/01/2001
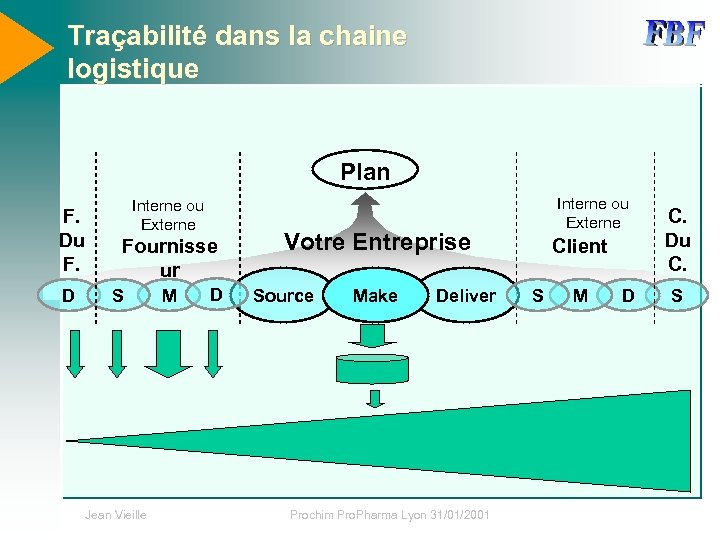
Traçabilité dans la chaine logistique Plan F. Du F. D Interne ou Externe Fournisse ur S Jean Vieille M D Interne ou Externe Votre Entreprise Source Make Deliver Prochim Pro. Pharma Lyon 31/01/2001 Client S M D C. Du C. S

Information de Production • Activités Source / Deliver / Plan – Peu d’information opérationnelles – Quelques informations qualitatives • Conditionnement, Emballage • Pollutions • Périssement (chaîne du froid…) • Activité Make – L’essentiel de l’information opérationnelle et qualitative – Volume important Jean Vieille Prochim Pro. Pharma Lyon 31/01/2001

Traçabilité et Production • Collecte de l’information – – Quoi? Quelle granularité? Attachée au contexte Archivée / Validée • Utilisation dans le système de production – Analytique, exhaustive : • Suivi et Performance • Utilisation dans le système d’Entreprise – Synthétique, consolidée, validée: • Certificats AQ • Généalogie Jean Vieille Prochim Pro. Pharma Lyon 31/01/2001
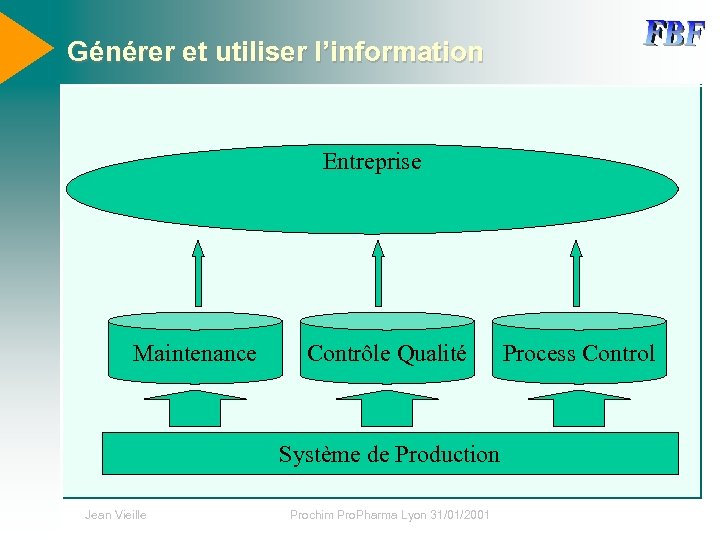
Générer et utiliser l’information Entreprise Maintenance Contrôle Qualité Système de Production Jean Vieille Prochim Pro. Pharma Lyon 31/01/2001 Process Control

Points particuliers • Quelle information? – Déroulement du procédé: respect, forçage des étapes – Actions manuelles sur les actionneurs, les consignes – Déviations, Alarmes et événements sensibles • Traçabilité – Contexte : horodate, versions, audit-trail – Environnement : Opérateur, Équipement, Produit, Opération – Garantie d’origine et de validité de l’information • Consolidation – – Historique Produit / Equipement Journal de batch, déroulement, conditions déviations process, Suivi matière, MO et Equipement Historique des révisions • Protection des enregistrements – Protection contre les modifications – Mode et sécurité d’archivage – Garantie de relecture Jean Vieille Prochim Pro. Pharma Lyon 31/01/2001

Réglementation • Concerne la Pharmacie ainsi que les bases chimiques de la Pharmacies – Bonnes Pratiques de Fabrication « c. GMP » • Concernent l’ensemble du système de production • Inclut les recommandations pour les systèmes d’information • Inclut les BPFs concernant l’information critique liée au produit – Archivage Électronique • Constitue un sujet à part entière • Comment valider et conserver l’information? – Validation des systèmes • Découle des BPF • S’assurer de l’intégrité des comportements opérationnels Jean Vieille Prochim Pro. Pharma Lyon 31/01/2001

Réglementation : CGMP • FDA – 21 -CFR-210 « Current good manufacturing practice in manufacturing, processing, packing, or holding of drugs; general » – 21 -CFR-211 « Current good manufacturing practice for finished pharmaceuticals (1997) • Commission Européenne – Directive 91/356/EEC, (1991) – VOLUME 4 - Medicinal products for human and veterinary use : Good manufacturing practices (1998) • Annex 11 – Computerised Systems Jean Vieille Prochim Pro. Pharma Lyon 31/01/2001

Réglementation : Archivage et Signature Electronique • FDA 21 -CFR-11 « Electronic Records; Electronic Signatures » (1997) – Assure que l’information est • Digne de confiance, Fiable et Compatible avec les travaux FDA – Conformité pour • Remplacer le papier et la signature manuelle – Problèmes: • • Sécurité réseau Validation du système, Contrôle des modifications du système Calculs non validés (macros) « Audit trail » des modifications de l’opérateur, Ecrasement des enregistrements • Autres travaux – E-commerce signatures – Directive européenne Jean Vieille Prochim Pro. Pharma Lyon 31/01/2001

Réglementation : Validation • ISPE / GAMP Forum – Good Automated Manufacturing Practices GAMP 3 « Guide for Validation of Automated Systems in Pharmaceutical Manufacture » • NAMUR – NE 58, NE 68, NE 72 « Validation of Process Control System » • ISO – ISO 9000 -3 /9001 / 9002 / – ISO/IEC 12207 « Information Technology Software life cycle processes » Jean Vieille Prochim Pro. Pharma Lyon 31/01/2001
42dd4d4f00b70ce5131937c92bbb3ff4.ppt