2. Стволовые клетки и биотехнология растений.pptx
- Количество слайдов: 60
 “Тотипотентные” и стволовые клетки растений: изучение и перспективы использования в биотехнологии. Д. б. н. , профессор генетики, Александр Гапоненко 1
“Тотипотентные” и стволовые клетки растений: изучение и перспективы использования в биотехнологии. Д. б. н. , профессор генетики, Александр Гапоненко 1
 Темы лекции Проблемы создания трансгенных растений. Ø Гены “интереса” и геномика (коснулись на предыдущей лекции) Ø Регенерация растений из клеток in vitro Все ли клетки высших растений “тотипотентны”? Ø Культура клеток и морфогенез растений in vitro Ø «Фитогормоны» и регуляторы роста растений Имеют ли растения настоящие стволовые клетки (СК)? Ø Первичные меристемы: апикальные меристемы побегов и корней Ø Молекулярно-генетическая база свойства «быть СК» } Генетическая регуляция процессов развития растений Ø MADS гены и морфогенез растений Ø м. РНК Интерференция Ø Протеосомы и регуляции развития растений * Важные темы для обсуждения в будущем * 2
Темы лекции Проблемы создания трансгенных растений. Ø Гены “интереса” и геномика (коснулись на предыдущей лекции) Ø Регенерация растений из клеток in vitro Все ли клетки высших растений “тотипотентны”? Ø Культура клеток и морфогенез растений in vitro Ø «Фитогормоны» и регуляторы роста растений Имеют ли растения настоящие стволовые клетки (СК)? Ø Первичные меристемы: апикальные меристемы побегов и корней Ø Молекулярно-генетическая база свойства «быть СК» } Генетическая регуляция процессов развития растений Ø MADS гены и морфогенез растений Ø м. РНК Интерференция Ø Протеосомы и регуляции развития растений * Важные темы для обсуждения в будущем * 2
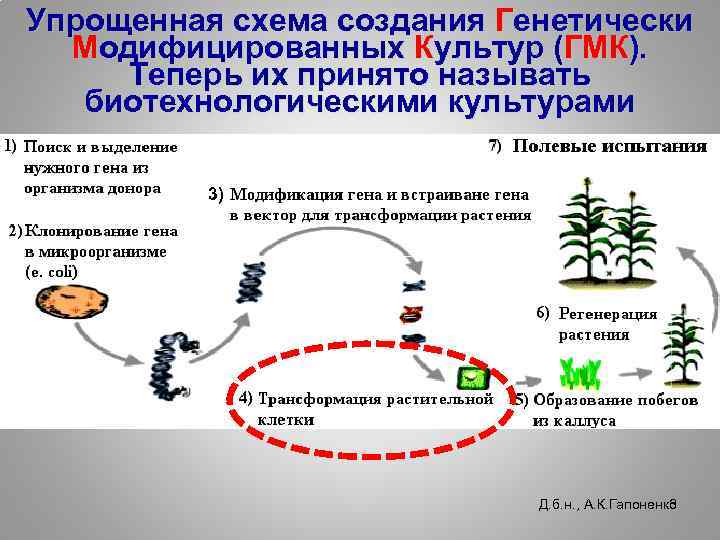 Упрощенная схема создания Генетически Модифицированных Культур (ГМК). Теперь их принято называть биотехнологическими культурами 3) Д. б. н. , А. К. Гапоненко 3
Упрощенная схема создания Генетически Модифицированных Культур (ГМК). Теперь их принято называть биотехнологическими культурами 3) Д. б. н. , А. К. Гапоненко 3
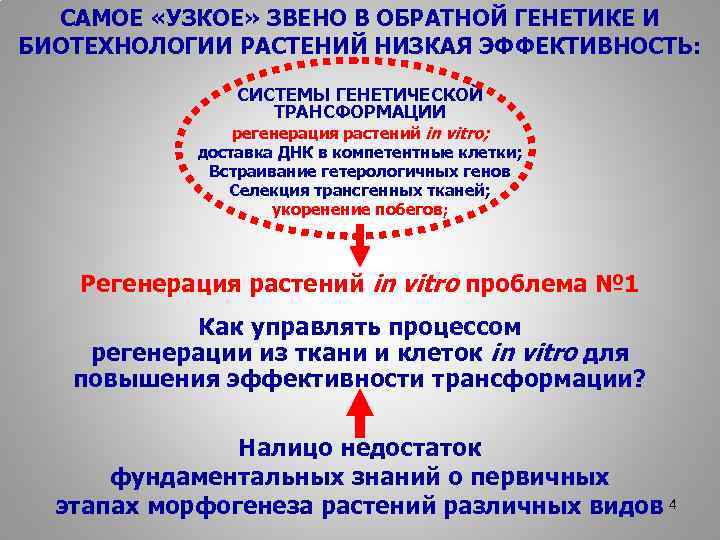 САМОЕ «УЗКОЕ» ЗВЕНО В ОБРАТНОЙ ГЕНЕТИКЕ И БИОТЕХНОЛОГИИ РАСТЕНИЙ НИЗКАЯ ЭФФЕКТИВНОСТЬ: СИСТЕМЫ ГЕНЕТИЧЕСКОЙ ТРАНСФОРМАЦИИ регенерация растений in vitro; доставка ДНК в компетентные клетки; Встраивание гетерологичных генов Селекция трансгенных тканей; укоренение побегов; Регенерация растений in vitro проблема № 1 Как управлять процессом регенерации из ткани и клеток in vitro для повышения эффективности трансформации? Налицо недостаток фундаментальных знаний о первичных этапах морфогенеза растений различных видов 4
САМОЕ «УЗКОЕ» ЗВЕНО В ОБРАТНОЙ ГЕНЕТИКЕ И БИОТЕХНОЛОГИИ РАСТЕНИЙ НИЗКАЯ ЭФФЕКТИВНОСТЬ: СИСТЕМЫ ГЕНЕТИЧЕСКОЙ ТРАНСФОРМАЦИИ регенерация растений in vitro; доставка ДНК в компетентные клетки; Встраивание гетерологичных генов Селекция трансгенных тканей; укоренение побегов; Регенерация растений in vitro проблема № 1 Как управлять процессом регенерации из ткани и клеток in vitro для повышения эффективности трансформации? Налицо недостаток фундаментальных знаний о первичных этапах морфогенеза растений различных видов 4
 ОПРЕДЕЛЕНИЯ “ТОТИПОТЕНТНЫХ” И СТВОЛОВЫХ КЛЕТОК (СК) q «Все живые клетки растений имеют потенцию развиться в целое растение – то есть тотипотентны» . Этот термин “totipotency”, первый, в 1902 г ввел GOTTLIEB HABERLANDT. Его теория, ни самим Хаберлендом, ни кем другим еще не была доказана. q С времен РАИСЫ ГЕОРГИЕВНЫ БУТЕНКО (1920 – 2004), в русско-язычных работах прочно установилось мнение, что все клетки растений тотипотентны – в том смысле, что из всякой клетки растения можно получить целое растение. На сегодняшний день это не соответствует нашим возможностям. НАИБОЛЕЕ КРАТКОЕ И ТОЧНОЕ ОПРЕДЕЛЕНИЕ СК: q СК – “КЛЕТКИ, СОХРАНЯЮЩИЕ СПОСОБНОСТЬ ВОЗОБНОВЛЯТЬ САМИ СЕБЯ ПОСРЕДСТВОМ МИТОЗА И СПОСОБНЫЕ ДИФФЕРЕНЦИРОВАТЬСЯ В СПЕЦИАЛИЗИРОВАННЫЕ КЛЕТКИ”. q При обсуждение свойств “потентности” клеток растений в дифференцировке, в нашем случае, речь пойдет о возможности регенерации растения из тканей и отдельных клеток и путей управления этими процессами. 5
ОПРЕДЕЛЕНИЯ “ТОТИПОТЕНТНЫХ” И СТВОЛОВЫХ КЛЕТОК (СК) q «Все живые клетки растений имеют потенцию развиться в целое растение – то есть тотипотентны» . Этот термин “totipotency”, первый, в 1902 г ввел GOTTLIEB HABERLANDT. Его теория, ни самим Хаберлендом, ни кем другим еще не была доказана. q С времен РАИСЫ ГЕОРГИЕВНЫ БУТЕНКО (1920 – 2004), в русско-язычных работах прочно установилось мнение, что все клетки растений тотипотентны – в том смысле, что из всякой клетки растения можно получить целое растение. На сегодняшний день это не соответствует нашим возможностям. НАИБОЛЕЕ КРАТКОЕ И ТОЧНОЕ ОПРЕДЕЛЕНИЕ СК: q СК – “КЛЕТКИ, СОХРАНЯЮЩИЕ СПОСОБНОСТЬ ВОЗОБНОВЛЯТЬ САМИ СЕБЯ ПОСРЕДСТВОМ МИТОЗА И СПОСОБНЫЕ ДИФФЕРЕНЦИРОВАТЬСЯ В СПЕЦИАЛИЗИРОВАННЫЕ КЛЕТКИ”. q При обсуждение свойств “потентности” клеток растений в дифференцировке, в нашем случае, речь пойдет о возможности регенерации растения из тканей и отдельных клеток и путей управления этими процессами. 5
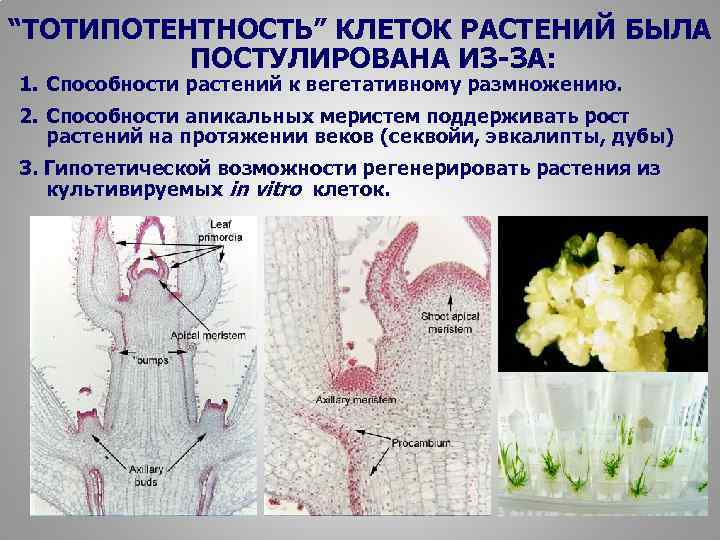 “ТОТИПОТЕНТНОСТЬ” КЛЕТОК РАСТЕНИЙ БЫЛА ПОСТУЛИРОВАНА ИЗ-ЗА: 1. Способности растений к вегетативному размножению. 2. Способности апикальных меристем поддерживать рост растений на протяжении веков (секвойи, эвкалипты, дубы) 3. Гипотетической возможности регенерировать растения из культивируемых in vitro клеток. 6
“ТОТИПОТЕНТНОСТЬ” КЛЕТОК РАСТЕНИЙ БЫЛА ПОСТУЛИРОВАНА ИЗ-ЗА: 1. Способности растений к вегетативному размножению. 2. Способности апикальных меристем поддерживать рост растений на протяжении веков (секвойи, эвкалипты, дубы) 3. Гипотетической возможности регенерировать растения из культивируемых in vitro клеток. 6
 Культура клеток и тканей растений это - подержание роста клеток или тканей и органов растений в стерильных условиях, путем создания питательных и физиологических условий in vitro (в «стекле» т. е. в пробирке). Культура клеток имеет научное и практическое значение. В коммерческих целях методы культуры клеток используют для микроклонального размножения ценных растений и производства биологически активных соединений, используя для этого промышленные установки. Создание генетически модифицированных растений включает, как правило, этап культуры клеток.
Культура клеток и тканей растений это - подержание роста клеток или тканей и органов растений в стерильных условиях, путем создания питательных и физиологических условий in vitro (в «стекле» т. е. в пробирке). Культура клеток имеет научное и практическое значение. В коммерческих целях методы культуры клеток используют для микроклонального размножения ценных растений и производства биологически активных соединений, используя для этого промышленные установки. Создание генетически модифицированных растений включает, как правило, этап культуры клеток.
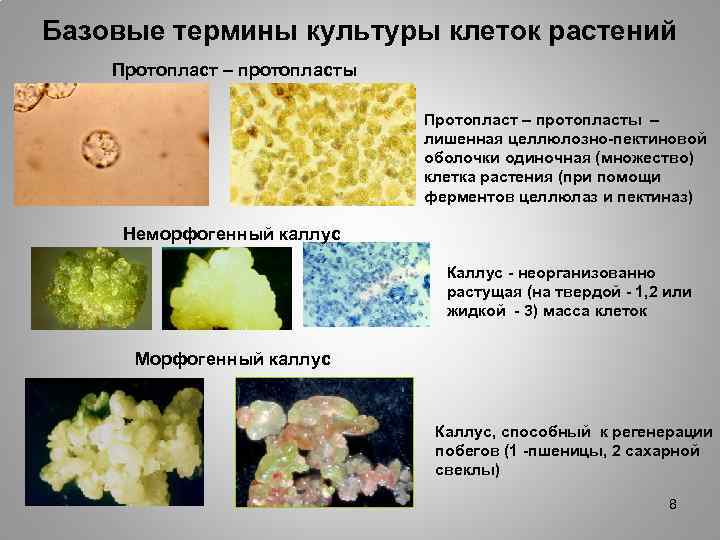 Базовые термины культуры клеток растений Протопласт – протопласты – лишенная целлюлозно-пектиновой оболочки одиночная (множество) клетка растения (при помощи ферментов целлюлаз и пектиназ) Неморфогенный каллус Каллус - неорганизованно растущая (на твердой - 1, 2 или жидкой - 3) масса клеток Морфогенный каллус Каллус, способный к регенерации побегов (1 -пшеницы, 2 сахарной свеклы) 8
Базовые термины культуры клеток растений Протопласт – протопласты – лишенная целлюлозно-пектиновой оболочки одиночная (множество) клетка растения (при помощи ферментов целлюлаз и пектиназ) Неморфогенный каллус Каллус - неорганизованно растущая (на твердой - 1, 2 или жидкой - 3) масса клеток Морфогенный каллус Каллус, способный к регенерации побегов (1 -пшеницы, 2 сахарной свеклы) 8
 Базовые термины культуры клеток растений Регенерация побегов Развитие побегов из клеток морфогенного каллуса или клеток меристемных тканей пшеница Развитие апикальных меристем побегов из клеток морфогенного каллуса Индукция множества апикальных меристем (подсолнечник) Укоренение побегов (подсолнечник) 9 Укоренение побегов подсолнечника методом прививок
Базовые термины культуры клеток растений Регенерация побегов Развитие побегов из клеток морфогенного каллуса или клеток меристемных тканей пшеница Развитие апикальных меристем побегов из клеток морфогенного каллуса Индукция множества апикальных меристем (подсолнечник) Укоренение побегов (подсолнечник) 9 Укоренение побегов подсолнечника методом прививок
 Базовые термины культуры клеток растений Клональное микроразмножение сахарной свеклы Получение в условиях in vitro (в пробирке), неполовым путем растений, генетически идентичных исходному экземпляру) подсолнечника 10
Базовые термины культуры клеток растений Клональное микроразмножение сахарной свеклы Получение в условиях in vitro (в пробирке), неполовым путем растений, генетически идентичных исходному экземпляру) подсолнечника 10
 Для чего нужна культура клеток растений 1. Как метод для изучения физиологии и генетики растений. 2. Культура пыльников и микроспор для получения дигаплоидов. 3. Промышленное получение физиологически активных веществ (Синтез вторичных метаболитов и полимеров). 4. Культивирование зародышей после гибридизации (Embryo rescue) для ускорения селекционного процесса и преодоления межвидового барьера несовместимости). 5. Обеззараживание растений (для получения безвирусных культур). 6. Микроклональное размножение для сохранения ценных генотипов растений и промышленного цветоводства. 7. В ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ РАСТЕНИЙ, КАК ОДИН ИЗ ГЛАВНЫХ ЭТАПОВ ПОЛУЧЕНИЯ ТРАНСГЕНННЫХ РАСТЕНИЙ.
Для чего нужна культура клеток растений 1. Как метод для изучения физиологии и генетики растений. 2. Культура пыльников и микроспор для получения дигаплоидов. 3. Промышленное получение физиологически активных веществ (Синтез вторичных метаболитов и полимеров). 4. Культивирование зародышей после гибридизации (Embryo rescue) для ускорения селекционного процесса и преодоления межвидового барьера несовместимости). 5. Обеззараживание растений (для получения безвирусных культур). 6. Микроклональное размножение для сохранения ценных генотипов растений и промышленного цветоводства. 7. В ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ РАСТЕНИЙ, КАК ОДИН ИЗ ГЛАВНЫХ ЭТАПОВ ПОЛУЧЕНИЯ ТРАНСГЕНННЫХ РАСТЕНИЙ.
 Немного истории: 1902 год. Хаберлендт пытался выращивать клетки палисадной паренхимы листьев различных растений. Деления клеток не удалось достичь. 1934 год. Вайт получил постоянно растущие культуры меристематических клеток томатов на среде, содержащей соли, экстракт дрожжей и три витамина – пиридоксин, тиамин и никотиновую кислоту. 1953 год. Миллер и Скуг открыли кинетин – регулятор роста растений. Проф. , А. К. Гапоненко 12
Немного истории: 1902 год. Хаберлендт пытался выращивать клетки палисадной паренхимы листьев различных растений. Деления клеток не удалось достичь. 1934 год. Вайт получил постоянно растущие культуры меристематических клеток томатов на среде, содержащей соли, экстракт дрожжей и три витамина – пиридоксин, тиамин и никотиновую кислоту. 1953 год. Миллер и Скуг открыли кинетин – регулятор роста растений. Проф. , А. К. Гапоненко 12
 Дальнейших прогресс: 1958 -60 гг. Морель культивировал орхидеи для освобождения от вирусной инфекции 1962 г. Мурасиге и Скуг опубликовали состав среды для табака 60 – 70 годы. Мурасиге культивировал пыльцевые зерна для получения гаплоидных растений. 1970 -80 гг. Кокинг разработал способы энзиматического выделения и культивирования протопластов. 1974 г. Карлсон, Мельхерс и Глеба произвели соматическую гибридизацию путем слияния протопластов различных видов. Начало 80 гг. Использование каллусных, меристемных и протопластных культур для генетической инженерии растений.
Дальнейших прогресс: 1958 -60 гг. Морель культивировал орхидеи для освобождения от вирусной инфекции 1962 г. Мурасиге и Скуг опубликовали состав среды для табака 60 – 70 годы. Мурасиге культивировал пыльцевые зерна для получения гаплоидных растений. 1970 -80 гг. Кокинг разработал способы энзиматического выделения и культивирования протопластов. 1974 г. Карлсон, Мельхерс и Глеба произвели соматическую гибридизацию путем слияния протопластов различных видов. Начало 80 гг. Использование каллусных, меристемных и протопластных культур для генетической инженерии растений.
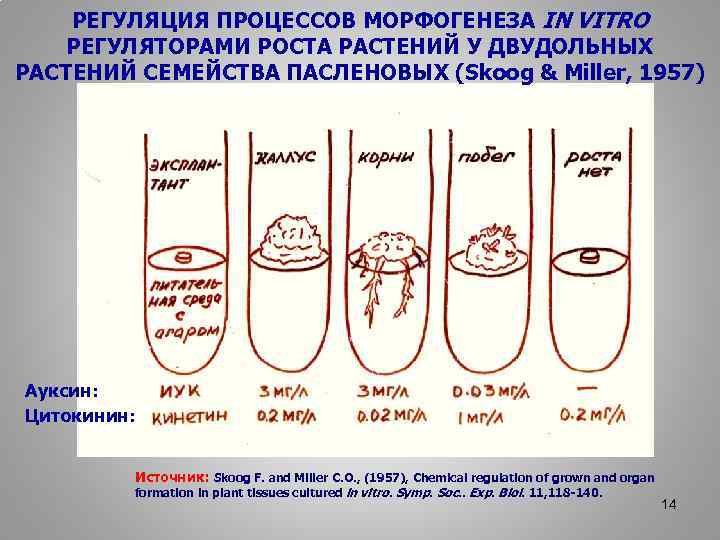 РЕГУЛЯЦИЯ ПРОЦЕССОВ МОРФОГЕНЕЗА IN VITRO РЕГУЛЯТОРАМИ РОСТА РАСТЕНИЙ У ДВУДОЛЬНЫХ РАСТЕНИЙ СЕМЕЙСТВА ПАСЛЕНОВЫХ (Skoog & Miller, 1957) Ауксин: Цитокинин: Источник: Skoog F. and Miller C. O. , (1957), Chemical regulation of grown and organ formation in plant tissues cultured in vitro. Symp. Soc. . Exp. Biol. 11, 118 -140. 14
РЕГУЛЯЦИЯ ПРОЦЕССОВ МОРФОГЕНЕЗА IN VITRO РЕГУЛЯТОРАМИ РОСТА РАСТЕНИЙ У ДВУДОЛЬНЫХ РАСТЕНИЙ СЕМЕЙСТВА ПАСЛЕНОВЫХ (Skoog & Miller, 1957) Ауксин: Цитокинин: Источник: Skoog F. and Miller C. O. , (1957), Chemical regulation of grown and organ formation in plant tissues cultured in vitro. Symp. Soc. . Exp. Biol. 11, 118 -140. 14
 «Фитогормоны» и Регуляторы Роста Растений. Термин «фитогормоны» используется много лет, но это не точный термин, правильней называть все эти вещества регуляторами роста растений. q Пять классических типов «гормонов растений» : Ø Ø Ø Ауксины Цитокинины Гибберелины Абсцизовая кислота Этилен q Все эти соединения синтезируются растениями. Ø Это небольшие молекулы от 28 Da (этилен) до 346 Da (GA), Ø Активны при концентрациях от 10 -6 до 10 -8 M. Ø Распространяются внутри тканей от клетки к клетке (ауксин), Ø Распространяются via васкулярных сосудов (цитокинины), Ø Распространяются via межклеточных пространств (этилен). q Добавочные субстанции, признанные как Регуляторы Роста Растений - РРР (Plant Grown Regulators – PGRs): q Полиамины (Polyamines) q Джасмонаты (Jasmonates) q Салициловая кислота (Salicylic acid) q Брасиностероиды (Brassinosteroids) q Другие 15
«Фитогормоны» и Регуляторы Роста Растений. Термин «фитогормоны» используется много лет, но это не точный термин, правильней называть все эти вещества регуляторами роста растений. q Пять классических типов «гормонов растений» : Ø Ø Ø Ауксины Цитокинины Гибберелины Абсцизовая кислота Этилен q Все эти соединения синтезируются растениями. Ø Это небольшие молекулы от 28 Da (этилен) до 346 Da (GA), Ø Активны при концентрациях от 10 -6 до 10 -8 M. Ø Распространяются внутри тканей от клетки к клетке (ауксин), Ø Распространяются via васкулярных сосудов (цитокинины), Ø Распространяются via межклеточных пространств (этилен). q Добавочные субстанции, признанные как Регуляторы Роста Растений - РРР (Plant Grown Regulators – PGRs): q Полиамины (Polyamines) q Джасмонаты (Jasmonates) q Салициловая кислота (Salicylic acid) q Брасиностероиды (Brassinosteroids) q Другие 15
 О различиях между гормонами животных и ростовыми регуляторами растений (РРР). 1. РРР синтезируются растениями и показывают биологическую активность при очень низких концентрациях (<1 m. M - <1 u. M). Регулируют процессы роста и развития растений. 2. РРР играют фундаментальную роль в регуляции физиологических процессах in vivo по принципу доза/эффект, который может изменяться с изменением чувствительностью тканей в онтогенезе. 3. Гормоны животных высокоспецифичны, РРР обнаруживают широкий и сложный спектр действий, то есть неспецифичны. 4. В отличие от гормонов млекопитающих, различные РРР могут взаимодействовать, синергически или антагонистически, вызывая часто противоположный эффект. 5. Гормоны животных это соединения типа белков, имеющих высокое информационное содержание, или стероиды. Гормоны растений - это низкомолекулярные химические соединения, обеспечивающие включение/ выключение сигнала и стимулирующие каскад событий в клетке, ведущих к ответу. 6. Результаты действия РРР могут наступать или немедленно, или после определенного промежутка времени. Во втором случае, очевидно, затрагиваются процессы экспрессии генов (траскрипция, трансляция). 16
О различиях между гормонами животных и ростовыми регуляторами растений (РРР). 1. РРР синтезируются растениями и показывают биологическую активность при очень низких концентрациях (<1 m. M - <1 u. M). Регулируют процессы роста и развития растений. 2. РРР играют фундаментальную роль в регуляции физиологических процессах in vivo по принципу доза/эффект, который может изменяться с изменением чувствительностью тканей в онтогенезе. 3. Гормоны животных высокоспецифичны, РРР обнаруживают широкий и сложный спектр действий, то есть неспецифичны. 4. В отличие от гормонов млекопитающих, различные РРР могут взаимодействовать, синергически или антагонистически, вызывая часто противоположный эффект. 5. Гормоны животных это соединения типа белков, имеющих высокое информационное содержание, или стероиды. Гормоны растений - это низкомолекулярные химические соединения, обеспечивающие включение/ выключение сигнала и стимулирующие каскад событий в клетке, ведущих к ответу. 6. Результаты действия РРР могут наступать или немедленно, или после определенного промежутка времени. Во втором случае, очевидно, затрагиваются процессы экспрессии генов (траскрипция, трансляция). 16
 Существуют виды, регенерация растений которых in vitro из клеток крайне затруднена, это так называемые «recalcitrance» виды. q. Получить in vitro регенерацию растений из клеток листа, стебля и даже корня двудольных растений семейства пасленовых [Solanaceae : (табак, томаты, картофель)] не сложно. q. Регенерация проростков и корней in vitro из клеток многих генотипов подсолнечника и сахарной свеклы получена пока лишь в некоторых лабораториях. q. Регенерация растений злаков в культуре клеток впервые была показана только в начале 80 годов прошлого века. q. Показано, что по мере прохождения онтогенеза, клетки злаков в отличии от семейства пасленовых теряют свойства тотипотентности. 17
Существуют виды, регенерация растений которых in vitro из клеток крайне затруднена, это так называемые «recalcitrance» виды. q. Получить in vitro регенерацию растений из клеток листа, стебля и даже корня двудольных растений семейства пасленовых [Solanaceae : (табак, томаты, картофель)] не сложно. q. Регенерация проростков и корней in vitro из клеток многих генотипов подсолнечника и сахарной свеклы получена пока лишь в некоторых лабораториях. q. Регенерация растений злаков в культуре клеток впервые была показана только в начале 80 годов прошлого века. q. Показано, что по мере прохождения онтогенеза, клетки злаков в отличии от семейства пасленовых теряют свойства тотипотентности. 17
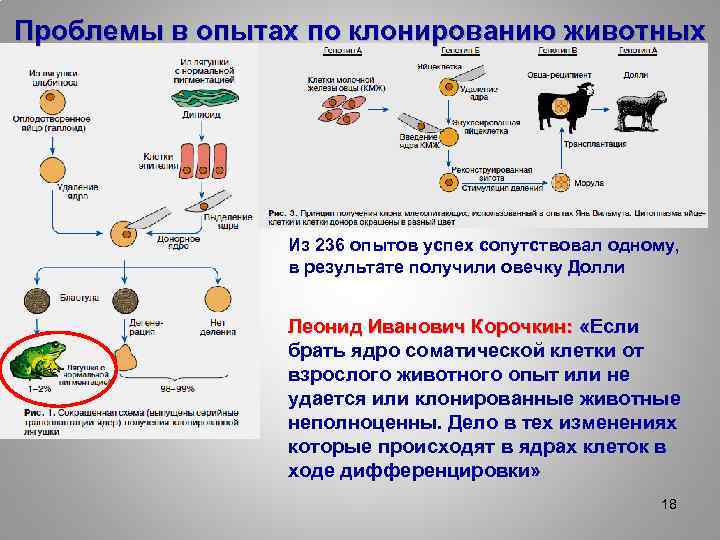 Проблемы в опытах по клонированию животных Из 236 опытов успех сопутствовал одному, в результате получили овечку Долли Леонид Иванович Корочкин: «Если брать ядро соматической клетки от взрослого животного опыт или не удается или клонированные животные неполноценны. Дело в тех изменениях которые происходят в ядрах клеток в ходе дифференцировки» 18
Проблемы в опытах по клонированию животных Из 236 опытов успех сопутствовал одному, в результате получили овечку Долли Леонид Иванович Корочкин: «Если брать ядро соматической клетки от взрослого животного опыт или не удается или клонированные животные неполноценны. Дело в тех изменениях которые происходят в ядрах клеток в ходе дифференцировки» 18
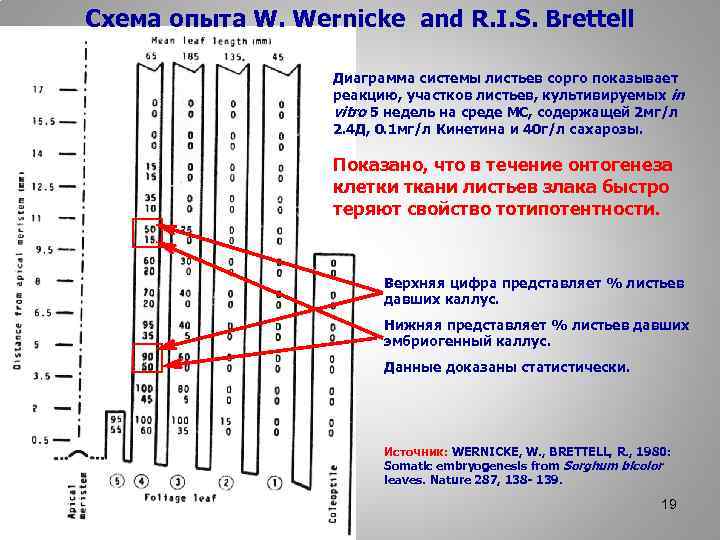 Схема опыта W. Wernicke and R. I. S. Brettell Диаграмма системы листьев сорго показывает реакцию, участков листьев, культивируемых in vitro 5 недель на среде МС, содержащей 2 мг/л 2. 4 Д, 0. 1 мг/л Кинетина и 40 г/л сахарозы. Показано, что в течение онтогенеза клетки ткани листьев злака быстро теряют свойство тотипотентности. Верхняя цифра представляет % листьев давших каллус. Нижняя представляет % листьев давших эмбриогенный каллус. Данные доказаны статистически. Источник: WERNICKE, W. , BRETTELL, R. , 1980: Somatic embryogenesis from Sorghum bicolor leaves. Nature 287, 138 - 139. 19
Схема опыта W. Wernicke and R. I. S. Brettell Диаграмма системы листьев сорго показывает реакцию, участков листьев, культивируемых in vitro 5 недель на среде МС, содержащей 2 мг/л 2. 4 Д, 0. 1 мг/л Кинетина и 40 г/л сахарозы. Показано, что в течение онтогенеза клетки ткани листьев злака быстро теряют свойство тотипотентности. Верхняя цифра представляет % листьев давших каллус. Нижняя представляет % листьев давших эмбриогенный каллус. Данные доказаны статистически. Источник: WERNICKE, W. , BRETTELL, R. , 1980: Somatic embryogenesis from Sorghum bicolor leaves. Nature 287, 138 - 139. 19
 Культура соматических клеток злаков на примере мягкой(Triticum aestivum L) и твердой (T. durum Desf) пшеницы Ведение культуры клеток злаков имеет ряд особенностей, отличающие ее от культуры клеток пасленовых: q Только некоторые клетки растений злаков показывают свой ство тотипотентности. Наилучший эксплант – клетки щитка незрелых зародышей на 10 -12 дней после опыления. q Для индукции компетентного к морфогенезу каллуса исполь зуется синтетический ауксин – 2, 4 Д (2, 4 дихлорфенокси уксусная кислота). q Регенерация побегов индуцируется удалением 2, 4 Д из среды: пересадкой каллуса на среду, не содержащую 2, 4 Д. 20
Культура соматических клеток злаков на примере мягкой(Triticum aestivum L) и твердой (T. durum Desf) пшеницы Ведение культуры клеток злаков имеет ряд особенностей, отличающие ее от культуры клеток пасленовых: q Только некоторые клетки растений злаков показывают свой ство тотипотентности. Наилучший эксплант – клетки щитка незрелых зародышей на 10 -12 дней после опыления. q Для индукции компетентного к морфогенезу каллуса исполь зуется синтетический ауксин – 2, 4 Д (2, 4 дихлорфенокси уксусная кислота). q Регенерация побегов индуцируется удалением 2, 4 Д из среды: пересадкой каллуса на среду, не содержащую 2, 4 Д. 20
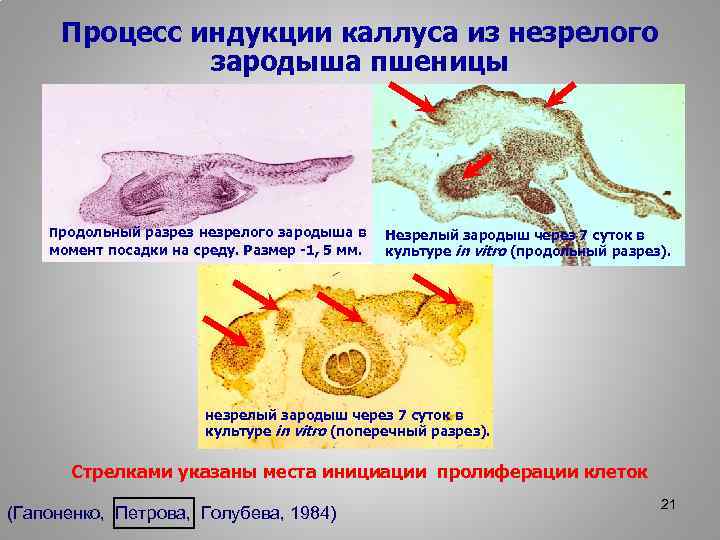 Процесс индукции каллуса из незрелого зародыша пшеницы Продольный разрез незрелого зародыша в момент посадки на среду. Размер -1, 5 мм. Незрелый зародыш через 7 суток в культуре in vitro (продольный разрез). незрелый зародыш через 7 суток в культуре in vitro (поперечный разрез). Стрелками указаны места инициации пролиферации клеток (Гапоненко, Петрова, Голубева, 1984) 21
Процесс индукции каллуса из незрелого зародыша пшеницы Продольный разрез незрелого зародыша в момент посадки на среду. Размер -1, 5 мм. Незрелый зародыш через 7 суток в культуре in vitro (продольный разрез). незрелый зародыш через 7 суток в культуре in vitro (поперечный разрез). Стрелками указаны места инициации пролиферации клеток (Гапоненко, Петрова, Голубева, 1984) 21
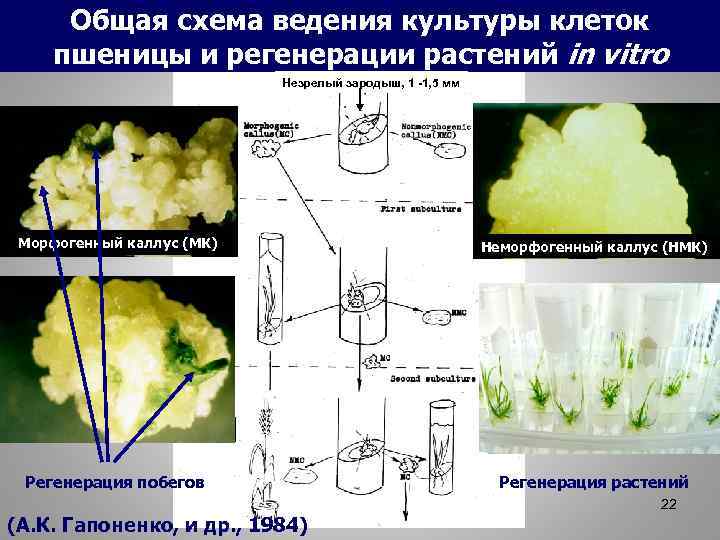 Общая схема ведения культуры клеток пшеницы и регенерации растений in vitro Незрелый зародыш, 1 -1, 5 мм Морфогенный каллус (МК) Неморфогенный каллус (НМК) Морфогенный каллус (МК) Регенерация побегов Регенерация растений 22 (А. К. Гапоненко, и др. , 1984)
Общая схема ведения культуры клеток пшеницы и регенерации растений in vitro Незрелый зародыш, 1 -1, 5 мм Морфогенный каллус (МК) Неморфогенный каллус (НМК) Морфогенный каллус (МК) Регенерация побегов Регенерация растений 22 (А. К. Гапоненко, и др. , 1984)
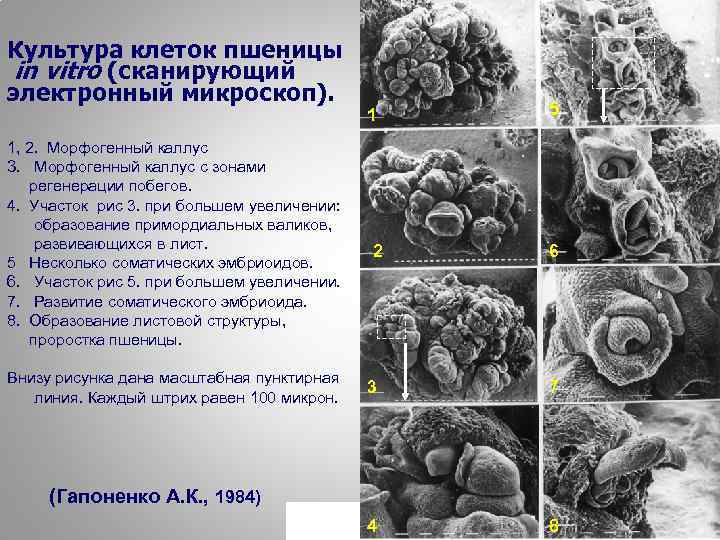 Культура клеток пшеницы in vitro (сканирующий электронный микроскоп). 1, 2. Морфогенный каллус 3. Морфогенный каллус с зонами регенерации побегов. 4. Участок рис 3. при большем увеличении: образование примордиальных валиков, развивающихся в лист. 5 Несколько соматических эмбриоидов. 6. Участок рис 5. при большем увеличении. 7. Развитие соматического эмбриоида. 8. Образование листовой структуры, проростка пшеницы. Внизу рисунка дана масштабная пунктирная линия. Каждый штрих равен 100 микрон. 1 2 3 5 6 7 (Гапоненко А. К. , 1984) 23 4 8
Культура клеток пшеницы in vitro (сканирующий электронный микроскоп). 1, 2. Морфогенный каллус 3. Морфогенный каллус с зонами регенерации побегов. 4. Участок рис 3. при большем увеличении: образование примордиальных валиков, развивающихся в лист. 5 Несколько соматических эмбриоидов. 6. Участок рис 5. при большем увеличении. 7. Развитие соматического эмбриоида. 8. Образование листовой структуры, проростка пшеницы. Внизу рисунка дана масштабная пунктирная линия. Каждый штрих равен 100 микрон. 1 2 3 5 6 7 (Гапоненко А. К. , 1984) 23 4 8
 ТИПЫ МОРФОГЕНЕТИЧЕСКИХ ПРОЦЕССОВ В КУЛЬТУРЕ КЛЕТОК IN VITRO I. ОРГАНОГЕНЕЗ - ОБРАЗОВАНИЕ ОРГАНОВ: ЗАЧАТКОВ ЛИСТЬЕВ ИЛИ КОРНЕЙ. II. СОМАТИЧЕСКИЙ ЭМБРИОГЕНЕЗ - ВОЗНИКНОВЕНИЕ СОМАТИЧЕСКИХ ЭМБРИОИДОВ (БИПОЛЯРНЫХ СТРУКТУР, ИМЕЮЩИХ АПЕКСЫ ПОБЕГА И КОРНЯ). ПУТИ РЕГЕНЕРАЦИИ РАСТЕНИЙ 1. ПРЯМАЯ РЕГЕНЕРАЦИЯ ПОБЕГОВ, при культивировании меристемных тканей 2. РЕГЕНЕРАЦИЯ ПОБЕГОВ ЧЕРЕЗ СТАДИЮ ОБРАЗОВАНИЯ КАЛЛУСА: 2. 1 При определенном балансе эндогенных/экзогенных РРР происходит дедифференцировка клеток экспланта, которые начинают неорганизованно делиться – образуется каллус. 2. 2 Внесение или удаление необходимых ростовых регуляторов в среду может вести к редифференцировки клеток каллуса и индуцировать морфогенез. 24
ТИПЫ МОРФОГЕНЕТИЧЕСКИХ ПРОЦЕССОВ В КУЛЬТУРЕ КЛЕТОК IN VITRO I. ОРГАНОГЕНЕЗ - ОБРАЗОВАНИЕ ОРГАНОВ: ЗАЧАТКОВ ЛИСТЬЕВ ИЛИ КОРНЕЙ. II. СОМАТИЧЕСКИЙ ЭМБРИОГЕНЕЗ - ВОЗНИКНОВЕНИЕ СОМАТИЧЕСКИХ ЭМБРИОИДОВ (БИПОЛЯРНЫХ СТРУКТУР, ИМЕЮЩИХ АПЕКСЫ ПОБЕГА И КОРНЯ). ПУТИ РЕГЕНЕРАЦИИ РАСТЕНИЙ 1. ПРЯМАЯ РЕГЕНЕРАЦИЯ ПОБЕГОВ, при культивировании меристемных тканей 2. РЕГЕНЕРАЦИЯ ПОБЕГОВ ЧЕРЕЗ СТАДИЮ ОБРАЗОВАНИЯ КАЛЛУСА: 2. 1 При определенном балансе эндогенных/экзогенных РРР происходит дедифференцировка клеток экспланта, которые начинают неорганизованно делиться – образуется каллус. 2. 2 Внесение или удаление необходимых ростовых регуляторов в среду может вести к редифференцировки клеток каллуса и индуцировать морфогенез. 24
 ДЕДИФФЕРЕНЦИРОВКА Модель органогенеза растений через стадию каллуса или как клетки in vitro меняют свои свойства. Оптимальные условия в культуре клеток (соотношение и концентрация ауксинов и цитокининов в CIM*) Включение гормональной сигнальной трансдукции Активация p. Rb типа генов, ремоделирование хроматина АКТИВАЦИЯ NAM ГЕНОВ И ФОРМИРОВАНИЕ НИШИ СК *CIM, Callus-Induction Medium; Кондиционные среды *SIM, Shoot-Induction Medium Оптимальное соотношение и концентрация ауксинов и цитокининов в SIM* Редифференцировка Полярный транспорт ауксина и ассиметричное распределение гормонов ИСТОЧНИК: Cell Fate Switch during in vitro Plant Organogenesis, Xiang Yu Zhao et al, Journal of Integrative Plant Biology, 2008, 50 (7): 816– 824, Изменение структуры хроматина и эпигенетические модификации (метилирование и ацетилирование) Активация WUS и CLV 3 и образование стволовых клеток Изменение концентрации и распределение эндогенных ауксинов в каллусе Изменение структуры хроматина и эпигенетические модификации (метилирование и ацетилирование) АКТИВАЦИЯ КЛЮЧЕВЫХ ГЕНОВ, ИДЕНТИФИКАЦИИ ОРГАНА МОРФОГЕНЕЗ IN VITRO 25
ДЕДИФФЕРЕНЦИРОВКА Модель органогенеза растений через стадию каллуса или как клетки in vitro меняют свои свойства. Оптимальные условия в культуре клеток (соотношение и концентрация ауксинов и цитокининов в CIM*) Включение гормональной сигнальной трансдукции Активация p. Rb типа генов, ремоделирование хроматина АКТИВАЦИЯ NAM ГЕНОВ И ФОРМИРОВАНИЕ НИШИ СК *CIM, Callus-Induction Medium; Кондиционные среды *SIM, Shoot-Induction Medium Оптимальное соотношение и концентрация ауксинов и цитокининов в SIM* Редифференцировка Полярный транспорт ауксина и ассиметричное распределение гормонов ИСТОЧНИК: Cell Fate Switch during in vitro Plant Organogenesis, Xiang Yu Zhao et al, Journal of Integrative Plant Biology, 2008, 50 (7): 816– 824, Изменение структуры хроматина и эпигенетические модификации (метилирование и ацетилирование) Активация WUS и CLV 3 и образование стволовых клеток Изменение концентрации и распределение эндогенных ауксинов в каллусе Изменение структуры хроматина и эпигенетические модификации (метилирование и ацетилирование) АКТИВАЦИЯ КЛЮЧЕВЫХ ГЕНОВ, ИДЕНТИФИКАЦИИ ОРГАНА МОРФОГЕНЕЗ IN VITRO 25
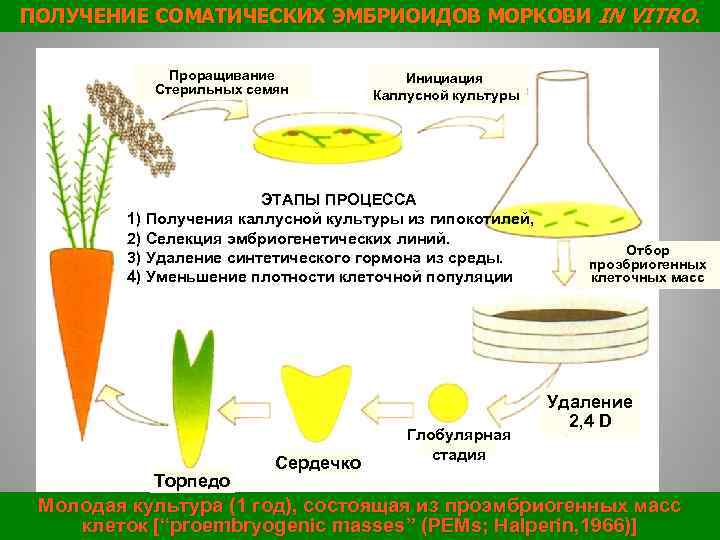 ПОЛУЧЕНИЕ СОМАТИЧЕСКИХ ЭМБРИОИДОВ МОРКОВИ IN VITRO. Проращивание Стерильных семян Инициация Каллусной культуры ЭТАПЫ ПРОЦЕССА 1) Получения каллусной культуры из гипокотилей, 2) Селекция эмбриогенетических линий. 3) Удаление синтетического гормона из среды. 4) Уменьшение плотности клеточной популяции Торпедо Сердечко Глобулярная стадия Отбор проэбриогенных клеточных масс Удаление 2, 4 D 26 Молодая культура (1 год), состоящая из проэмбриогенных масс клеток [“proembryogenic masses” (PEMs; Halperin, 1966)]
ПОЛУЧЕНИЕ СОМАТИЧЕСКИХ ЭМБРИОИДОВ МОРКОВИ IN VITRO. Проращивание Стерильных семян Инициация Каллусной культуры ЭТАПЫ ПРОЦЕССА 1) Получения каллусной культуры из гипокотилей, 2) Селекция эмбриогенетических линий. 3) Удаление синтетического гормона из среды. 4) Уменьшение плотности клеточной популяции Торпедо Сердечко Глобулярная стадия Отбор проэбриогенных клеточных масс Удаление 2, 4 D 26 Молодая культура (1 год), состоящая из проэмбриогенных масс клеток [“proembryogenic masses” (PEMs; Halperin, 1966)]
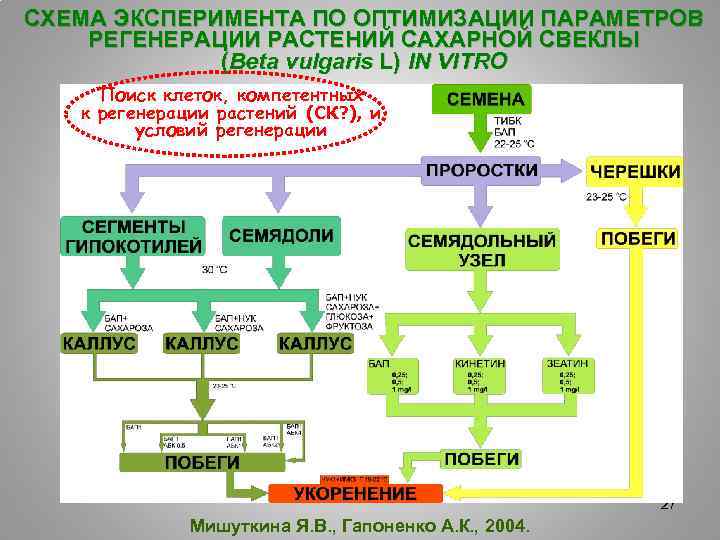 СХЕМА ЭКСПЕРИМЕНТА ПО ОПТИМИЗАЦИИ ПАРАМЕТРОВ РЕГЕНЕРАЦИИ РАСТЕНИЙ САХАРНОЙ СВЕКЛЫ (Beta vulgaris L) IN VITRO Поиск клеток, компетентных к регенерации растений (СК? ), и условий регенерации 27 Мишуткина Я. В. , Гапоненко А. К. , 2004.
СХЕМА ЭКСПЕРИМЕНТА ПО ОПТИМИЗАЦИИ ПАРАМЕТРОВ РЕГЕНЕРАЦИИ РАСТЕНИЙ САХАРНОЙ СВЕКЛЫ (Beta vulgaris L) IN VITRO Поиск клеток, компетентных к регенерации растений (СК? ), и условий регенерации 27 Мишуткина Я. В. , Гапоненко А. К. , 2004.
 Сахарная свекла в культуре клеток in vitro Регенерация из Проростки Каллусообразова из каллуса семядольного узла ние Регенерация из черешка листа Микроклональное размножение Коллекция трансформантов Растение перед цветением Мишуткина и Гапоненко, 2004 Опыление под изоляторами
Сахарная свекла в культуре клеток in vitro Регенерация из Проростки Каллусообразова из каллуса семядольного узла ние Регенерация из черешка листа Микроклональное размножение Коллекция трансформантов Растение перед цветением Мишуткина и Гапоненко, 2004 Опыление под изоляторами
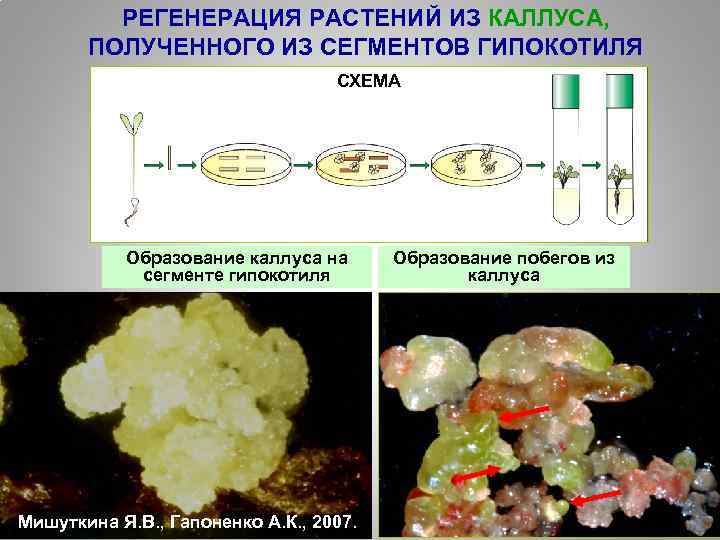 РЕГЕНЕРАЦИЯ РАСТЕНИЙ ИЗ КАЛЛУСА, ПОЛУЧЕННОГО ИЗ СЕГМЕНТОВ ГИПОКОТИЛЯ СХЕМА Образование каллуса на сегменте гипокотиля Мишуткина Я. В. , Гапоненко А. К. , 2007. Образование побегов из каллуса 29
РЕГЕНЕРАЦИЯ РАСТЕНИЙ ИЗ КАЛЛУСА, ПОЛУЧЕННОГО ИЗ СЕГМЕНТОВ ГИПОКОТИЛЯ СХЕМА Образование каллуса на сегменте гипокотиля Мишуткина Я. В. , Гапоненко А. К. , 2007. Образование побегов из каллуса 29
 РЕГЕНЕРАЦИЯ РАСТЕНИЙ САХАРНОЙ СВЕКЛЫ ИЗ ЧЕРЕШКОВ ЛИСТЬЕВ СХЕМА Регенерация побегов из черешков листьев 30 Мишуткина Я. В. , Гапоненко А. К. , 2007.
РЕГЕНЕРАЦИЯ РАСТЕНИЙ САХАРНОЙ СВЕКЛЫ ИЗ ЧЕРЕШКОВ ЛИСТЬЕВ СХЕМА Регенерация побегов из черешков листьев 30 Мишуткина Я. В. , Гапоненко А. К. , 2007.
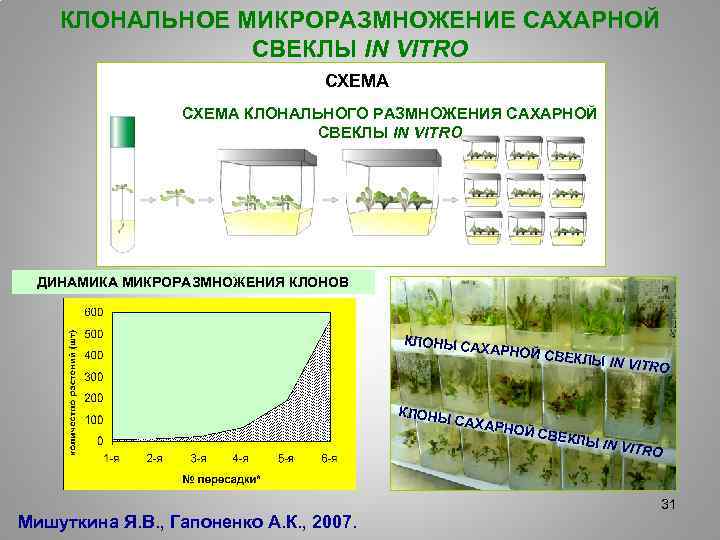 КЛОНАЛЬНОЕ МИКРОРАЗМНОЖЕНИЕ САХАРНОЙ СВЕКЛЫ IN VITRO СХЕМА КЛОНАЛЬНОГО РАЗМНОЖЕНИЯ САХАРНОЙ СВЕКЛЫ IN VITRO ДИНАМИКА МИКРОРАЗМНОЖЕНИЯ КЛОНОВ КЛОНЫ С А ХАРНОЙ С КЛОНЫ САХАР ВЕКЛЫ IN Мишуткина Я. В. , Гапоненко А. К. , 2007. НОЙ С ВЕКЛЫ VITRO IN VITR O 31
КЛОНАЛЬНОЕ МИКРОРАЗМНОЖЕНИЕ САХАРНОЙ СВЕКЛЫ IN VITRO СХЕМА КЛОНАЛЬНОГО РАЗМНОЖЕНИЯ САХАРНОЙ СВЕКЛЫ IN VITRO ДИНАМИКА МИКРОРАЗМНОЖЕНИЯ КЛОНОВ КЛОНЫ С А ХАРНОЙ С КЛОНЫ САХАР ВЕКЛЫ IN Мишуткина Я. В. , Гапоненко А. К. , 2007. НОЙ С ВЕКЛЫ VITRO IN VITR O 31
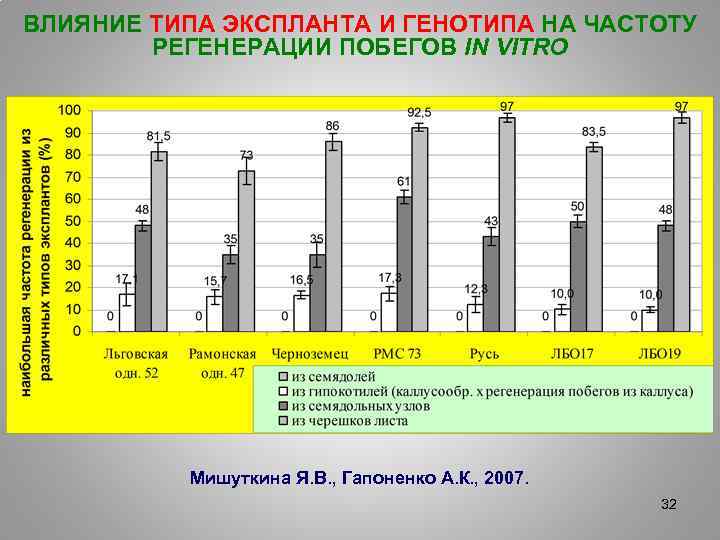 ВЛИЯНИЕ ТИПА ЭКСПЛАНТА И ГЕНОТИПА НА ЧАСТОТУ РЕГЕНЕРАЦИИ ПОБЕГОВ IN VITRO Мишуткина Я. В. , Гапоненко А. К. , 2007. 32
ВЛИЯНИЕ ТИПА ЭКСПЛАНТА И ГЕНОТИПА НА ЧАСТОТУ РЕГЕНЕРАЦИИ ПОБЕГОВ IN VITRO Мишуткина Я. В. , Гапоненко А. К. , 2007. 32
 Культура соматических клеток подсолнечника in vitro В А А. Неморфогенный каллус. В. Регенерация побегов из морфогенного каллуса. (Гапоненко А. К. , Воронина И. П. , 1989) 33
Культура соматических клеток подсолнечника in vitro В А А. Неморфогенный каллус. В. Регенерация побегов из морфогенного каллуса. (Гапоненко А. К. , Воронина И. П. , 1989) 33
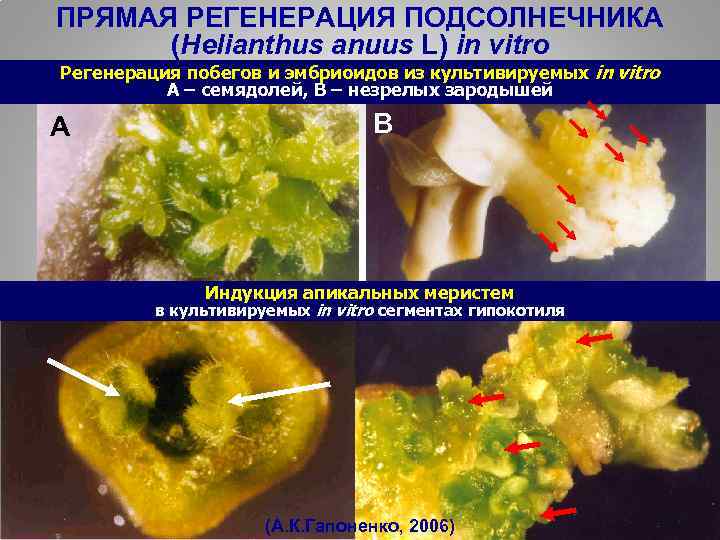 ПРЯМАЯ РЕГЕНЕРАЦИЯ ПОДСОЛНЕЧНИКА (Helianthus anuus L) in vitro Регенерация побегов и эмбриоидов из культивируемых in vitro A – семядолей, B – незрелых зародышей А В Индукция апикальных меристем в культивируемых in vitro сегментах гипокотиля C 34 (А. К. Гапоненко, 2006)
ПРЯМАЯ РЕГЕНЕРАЦИЯ ПОДСОЛНЕЧНИКА (Helianthus anuus L) in vitro Регенерация побегов и эмбриоидов из культивируемых in vitro A – семядолей, B – незрелых зародышей А В Индукция апикальных меристем в культивируемых in vitro сегментах гипокотиля C 34 (А. К. Гапоненко, 2006)
 Укоренение побегов подсолнечника in vitro Действие пониженных температур и индолил - 3 - масляной кислоты на частоту укоренения Температура, C +27 o +14 o IBA, мг/л 1 мг/л Цитокинин, мг/л 0. 5 1. 0 Число подегов 50 74 179 138 5 8 50 35 10. 0 10. 8 28. 2 26. 1 Число укорененных побегов частота укоренения, % (А. К. Гапоненко, 1993) 35
Укоренение побегов подсолнечника in vitro Действие пониженных температур и индолил - 3 - масляной кислоты на частоту укоренения Температура, C +27 o +14 o IBA, мг/л 1 мг/л Цитокинин, мг/л 0. 5 1. 0 Число подегов 50 74 179 138 5 8 50 35 10. 0 10. 8 28. 2 26. 1 Число укорененных побегов частота укоренения, % (А. К. Гапоненко, 1993) 35
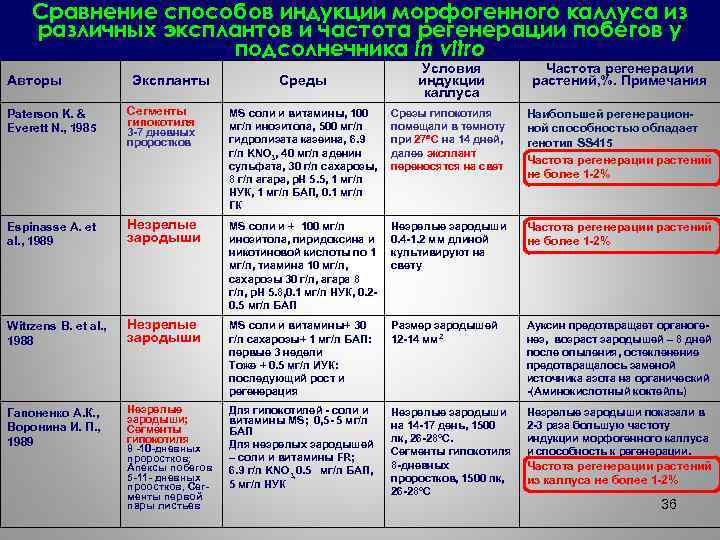 Сравнение способов индукции морфогенного каллуса из различных эксплантов и частота регенерации побегов у подсолнечника in vitro Авторы Экспланты Среды Условия индукции каллуса Частота регенерации растений, %. Примечания Paterson K. & Everett N. , 1985 Сегменты гипокотиля MS соли и витамины, 100 мг/л инозитола, 500 мг/л гидролизата казеина, 6. 9 г/л KNO 3, 40 мг/л аденин сульфата, 30 г/л сахарозы, 8 г/л агара, р. Н 5. 5, 1 мг/л НУК, 1 мг/л БАП, 0. 1 мг/л ГК Срезы гипокотиля помещали в темноту при 27 С на 14 дней, далее эксплант переносятся на свет Наибольшей регенерационной способностью обладает генотип SS 415 Частота регенерации растений не более 1 -2% Espinasse A. et al. , 1989 Незрелые зародыши MS соли и + 100 мг/л инозитола, пиридоксина и никотиновой кислоты по 1 мг/л, тиамина 10 мг/л, сахарозы 30 г/л, агара 8 г/л, р. Н 5. 8, 0. 1 мг/л НУК, 0. 20. 5 мг/л БАП Незрелые зародыши 0. 4 -1. 2 мм длиной культивируют на свету Частота регенерации растений не более 1 -2% Witrzens B. et al. , 1988 Незрелые зародыши MS соли и витамины+ 30 г/л сахарозы+ 1 мг/л БАП: первые 3 недели Тоже + 0. 5 мг/л ИУК: последующий рост и регенерация Размер зародышей 12 -14 мм 2 Ауксин предотвращает органогенез, возраст зародышей – 8 дней после опыления, остекленение предотвращалось заменой источника азота на органический -(Аминокислотный коктейль) Гапоненко А. К. , Воронина И. П. , 1989 Незрелые зародыши; Сегменты гипокотиля 8 -10 -дневных проростков; Апексы побегов 5 -11 - дневных проостков, Сегменты первой пары листьев Для гипокотилей - соли и витамины MS; 0, 5 - 5 мг/л БАП Для незрелых зародышей – соли и витамины FR; 6. 9 г/л KNO 3, 0. 5 мг/л БАП, 5 мг/л НУК Незрелые зародыши на 14 -17 день, 1500 лк, 26 -28ºС. Сегменты гипокотиля 8 -дневных проростков, 1500 лк, 26 -28ºС Незрелые зародыши показали в 2 -3 раза большую частоту индукции морфогенного каллуса и способность к регенерации. 3 -7 дневных проростков Частота регенерации растений из каллуса не более 1 -2% 36
Сравнение способов индукции морфогенного каллуса из различных эксплантов и частота регенерации побегов у подсолнечника in vitro Авторы Экспланты Среды Условия индукции каллуса Частота регенерации растений, %. Примечания Paterson K. & Everett N. , 1985 Сегменты гипокотиля MS соли и витамины, 100 мг/л инозитола, 500 мг/л гидролизата казеина, 6. 9 г/л KNO 3, 40 мг/л аденин сульфата, 30 г/л сахарозы, 8 г/л агара, р. Н 5. 5, 1 мг/л НУК, 1 мг/л БАП, 0. 1 мг/л ГК Срезы гипокотиля помещали в темноту при 27 С на 14 дней, далее эксплант переносятся на свет Наибольшей регенерационной способностью обладает генотип SS 415 Частота регенерации растений не более 1 -2% Espinasse A. et al. , 1989 Незрелые зародыши MS соли и + 100 мг/л инозитола, пиридоксина и никотиновой кислоты по 1 мг/л, тиамина 10 мг/л, сахарозы 30 г/л, агара 8 г/л, р. Н 5. 8, 0. 1 мг/л НУК, 0. 20. 5 мг/л БАП Незрелые зародыши 0. 4 -1. 2 мм длиной культивируют на свету Частота регенерации растений не более 1 -2% Witrzens B. et al. , 1988 Незрелые зародыши MS соли и витамины+ 30 г/л сахарозы+ 1 мг/л БАП: первые 3 недели Тоже + 0. 5 мг/л ИУК: последующий рост и регенерация Размер зародышей 12 -14 мм 2 Ауксин предотвращает органогенез, возраст зародышей – 8 дней после опыления, остекленение предотвращалось заменой источника азота на органический -(Аминокислотный коктейль) Гапоненко А. К. , Воронина И. П. , 1989 Незрелые зародыши; Сегменты гипокотиля 8 -10 -дневных проростков; Апексы побегов 5 -11 - дневных проостков, Сегменты первой пары листьев Для гипокотилей - соли и витамины MS; 0, 5 - 5 мг/л БАП Для незрелых зародышей – соли и витамины FR; 6. 9 г/л KNO 3, 0. 5 мг/л БАП, 5 мг/л НУК Незрелые зародыши на 14 -17 день, 1500 лк, 26 -28ºС. Сегменты гипокотиля 8 -дневных проростков, 1500 лк, 26 -28ºС Незрелые зародыши показали в 2 -3 раза большую частоту индукции морфогенного каллуса и способность к регенерации. 3 -7 дневных проростков Частота регенерации растений из каллуса не более 1 -2% 36
 ВЫВОДЫ О КОМПЕТЕНТНОСТИ К РЕГЕНЕРАЦИИ IN VITRO У ПРЕДСТАВИТЕЛЕЙ ТРЕХ СЕМЕЙСТВ РАСТЕНИЙ ДВУДОЛЬНЫХ: 1. А стровые (Asteráceae) - подсолнечник 2. Амарантовые ( Amaranthaceae) – сахарная свекла ОДНОДОЛЬНЫХ: Зла ки (Gramíneae) мягкая пшеница 1. Частота регенерации растений из каллусных культур, полученных из не меристемных тканей зрелого спорофита растений колеблется от 0, 00 до 1 -2%. 2. Это означает, что более 90 % клеток у этих видов не «тотипотентны» , а доля плюропотентных клеток у этих видов не более 10%. 3. Частота прямой регенерации растений из меристем зрелого спорофита растений и каллуса, полученного из незрелых зародышей составляет от 20 до 70 %. 4. Очевидно, что плюропотентные клетки растений, присутствуют большей частью в меристемах и клетках незрелых зародышей. 5. Показана возможна индукция апикальных меристем, а 37 значит и стволовых клеток из тканей зрелого спорофита растений.
ВЫВОДЫ О КОМПЕТЕНТНОСТИ К РЕГЕНЕРАЦИИ IN VITRO У ПРЕДСТАВИТЕЛЕЙ ТРЕХ СЕМЕЙСТВ РАСТЕНИЙ ДВУДОЛЬНЫХ: 1. А стровые (Asteráceae) - подсолнечник 2. Амарантовые ( Amaranthaceae) – сахарная свекла ОДНОДОЛЬНЫХ: Зла ки (Gramíneae) мягкая пшеница 1. Частота регенерации растений из каллусных культур, полученных из не меристемных тканей зрелого спорофита растений колеблется от 0, 00 до 1 -2%. 2. Это означает, что более 90 % клеток у этих видов не «тотипотентны» , а доля плюропотентных клеток у этих видов не более 10%. 3. Частота прямой регенерации растений из меристем зрелого спорофита растений и каллуса, полученного из незрелых зародышей составляет от 20 до 70 %. 4. Очевидно, что плюропотентные клетки растений, присутствуют большей частью в меристемах и клетках незрелых зародышей. 5. Показана возможна индукция апикальных меристем, а 37 значит и стволовых клеток из тканей зрелого спорофита растений.
 ОПРЕДЕЛЕНИЯ “ТОТИПОТЕНТНЫХ” И СТВОЛОВЫХ КЛЕТОК (СК) q «Все живые клетки растений имеют потенцию развиться в целое растение – то есть тотипотентны» . Этот термин “totipotency”, первый, в 1902 г ввел GOTTLIEB HABERLANDT. Его теория, ни самим Хаберлендом, ни кем другим еще не была доказана. q С времен РАИСЫ ГЕОРГИЕВНЫ БУТЕНКО (1920 – 2004), в русско-язычных работах прочно установилось мнение, что все клетки растений тотипотентны – в том смысле, что из всякой клетки растения можно получить целое растение. На сегодняшний день это не соответствует нашим возможностям. НАИБОЛЕЕ КРАТКОЕ И ТОЧНОЕ ОПРЕДЕЛЕНИЕ СК: q СК – “КЛЕТКИ, СОХРАНЯЮЩИЕ СПОСОБНОСТЬ ВОЗОБНОВЛЯТЬ САМИ СЕБЯ ПОСРЕДСТВОМ МИТОЗА И СПОСОБНЫЕ ДИФФЕРЕНЦИРОВАТЬСЯ В СПЕЦИАЛИЗИРОВАННЫЕ КЛЕТКИ”. q При обсуждение свойств “потентности” клеток растений в дифференцировке, в нашем случае, речь пойдет о возможности регенерации растения из тканей и отдельных клеток и путей управления этими процессами. 38
ОПРЕДЕЛЕНИЯ “ТОТИПОТЕНТНЫХ” И СТВОЛОВЫХ КЛЕТОК (СК) q «Все живые клетки растений имеют потенцию развиться в целое растение – то есть тотипотентны» . Этот термин “totipotency”, первый, в 1902 г ввел GOTTLIEB HABERLANDT. Его теория, ни самим Хаберлендом, ни кем другим еще не была доказана. q С времен РАИСЫ ГЕОРГИЕВНЫ БУТЕНКО (1920 – 2004), в русско-язычных работах прочно установилось мнение, что все клетки растений тотипотентны – в том смысле, что из всякой клетки растения можно получить целое растение. На сегодняшний день это не соответствует нашим возможностям. НАИБОЛЕЕ КРАТКОЕ И ТОЧНОЕ ОПРЕДЕЛЕНИЕ СК: q СК – “КЛЕТКИ, СОХРАНЯЮЩИЕ СПОСОБНОСТЬ ВОЗОБНОВЛЯТЬ САМИ СЕБЯ ПОСРЕДСТВОМ МИТОЗА И СПОСОБНЫЕ ДИФФЕРЕНЦИРОВАТЬСЯ В СПЕЦИАЛИЗИРОВАННЫЕ КЛЕТКИ”. q При обсуждение свойств “потентности” клеток растений в дифференцировке, в нашем случае, речь пойдет о возможности регенерации растения из тканей и отдельных клеток и путей управления этими процессами. 38
 Имеют ли растения настоящие стволовые клетки (СК)? q Это дискуссионный вопрос, поскольку в культуре клеток двудольных растений in vitro возможно регенерировать эмбриоиды и органы из дифференцированных клеток листьев, сегментов гипокотиля и других тканей. q Из этого можно заключить, что клетки листьев двудольных могут выступать в роли стволовых – или что концепция стволовых клеток неприменима к растениям. q Традиционная точка зрения о СК животных претерпевает эволюцию в связи с новыми данными о пластичности судьбы клеток взрослых особей, изменяемой сигналами из окружения (Blau et al. , 2001). q В результате многочисленных экспериментов возникла новая точка зрения: СК не неизбежная специфическая клеточная сущность, а что СК представляют функцию, которая может осуществляться разными типами клеток. q НАИБОЛЕЕ ЭКСТРЕМАЛЬНАЯ ТОЧКА ЗРЕНИЯ: ВСЕ КЛЕТКИ ПОЛУЧАЮ ЩИЕ УПРАВЛЯЮЩИЙ СИГНАЛ (ИЛИ КОМБИНАЦИЮ СИГНАЛОВ) ПРИОБРЕТАЮТ СОСТОЯНИЕ «СТВОЛОВЫХ КЛЕТОК» . 39
Имеют ли растения настоящие стволовые клетки (СК)? q Это дискуссионный вопрос, поскольку в культуре клеток двудольных растений in vitro возможно регенерировать эмбриоиды и органы из дифференцированных клеток листьев, сегментов гипокотиля и других тканей. q Из этого можно заключить, что клетки листьев двудольных могут выступать в роли стволовых – или что концепция стволовых клеток неприменима к растениям. q Традиционная точка зрения о СК животных претерпевает эволюцию в связи с новыми данными о пластичности судьбы клеток взрослых особей, изменяемой сигналами из окружения (Blau et al. , 2001). q В результате многочисленных экспериментов возникла новая точка зрения: СК не неизбежная специфическая клеточная сущность, а что СК представляют функцию, которая может осуществляться разными типами клеток. q НАИБОЛЕЕ ЭКСТРЕМАЛЬНАЯ ТОЧКА ЗРЕНИЯ: ВСЕ КЛЕТКИ ПОЛУЧАЮ ЩИЕ УПРАВЛЯЮЩИЙ СИГНАЛ (ИЛИ КОМБИНАЦИЮ СИГНАЛОВ) ПРИОБРЕТАЮТ СОСТОЯНИЕ «СТВОЛОВЫХ КЛЕТОК» . 39
 Клетки растений в культуре in vitro в свете современных точек зрения о состоянии СК q Протопласты, выделенные из тканей листа, подвергаются воздейст вию сигналов, таких как РРР, которые «переключают» программу состояния клеток на недифференцированное, подобное состоянию СК, что позволяет клеткам развиваться в целое растение. q Показано, что цитокининовый сигнал воспринимается и идентифици руется рецептором-киназы, который обеспечивает эмбриогенетичес кую компетенцию культивируемых клеток арабидопсиса (Hecht et al. , 2001). q Скрытая плюрипотентность многих клеток растений, которая прояв ляется в культуре in vitro покажется объяснимой, если мы примем точку зрения об идентичности СК, как транзиентному клеточному состоянию, которое контролируется соответствующими сигналами среды. 40
Клетки растений в культуре in vitro в свете современных точек зрения о состоянии СК q Протопласты, выделенные из тканей листа, подвергаются воздейст вию сигналов, таких как РРР, которые «переключают» программу состояния клеток на недифференцированное, подобное состоянию СК, что позволяет клеткам развиваться в целое растение. q Показано, что цитокининовый сигнал воспринимается и идентифици руется рецептором-киназы, который обеспечивает эмбриогенетичес кую компетенцию культивируемых клеток арабидопсиса (Hecht et al. , 2001). q Скрытая плюрипотентность многих клеток растений, которая прояв ляется в культуре in vitro покажется объяснимой, если мы примем точку зрения об идентичности СК, как транзиентному клеточному состоянию, которое контролируется соответствующими сигналами среды. 40
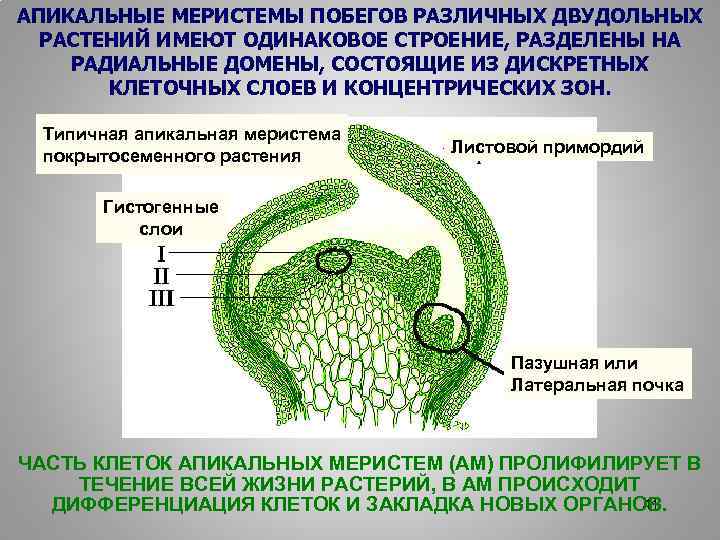 АПИКАЛЬНЫЕ МЕРИСТЕМЫ ПОБЕГОВ РАЗЛИЧНЫХ ДВУДОЛЬНЫХ РАСТЕНИЙ ИМЕЮТ ОДИНАКОВОЕ СТРОЕНИЕ, РАЗДЕЛЕНЫ НА РАДИАЛЬНЫЕ ДОМЕНЫ, СОСТОЯЩИЕ ИЗ ДИСКРЕТНЫХ КЛЕТОЧНЫХ СЛОЕВ И КОНЦЕНТРИЧЕСКИХ ЗОН. Типичная апикальная меристема покрытосеменного растения Листовой примордий Гистогенные слои Пазушная или Латеральная почка ЧАСТЬ КЛЕТОК АПИКАЛЬНЫХ МЕРИСТЕМ (АМ) ПРОЛИФИЛИРУЕТ В ТЕЧЕНИЕ ВСЕЙ ЖИЗНИ РАСТЕРИЙ, В АМ ПРОИСХОДИТ 41 ДИФФЕРЕНЦИАЦИЯ КЛЕТОК И ЗАКЛАДКА НОВЫХ ОРГАНОВ.
АПИКАЛЬНЫЕ МЕРИСТЕМЫ ПОБЕГОВ РАЗЛИЧНЫХ ДВУДОЛЬНЫХ РАСТЕНИЙ ИМЕЮТ ОДИНАКОВОЕ СТРОЕНИЕ, РАЗДЕЛЕНЫ НА РАДИАЛЬНЫЕ ДОМЕНЫ, СОСТОЯЩИЕ ИЗ ДИСКРЕТНЫХ КЛЕТОЧНЫХ СЛОЕВ И КОНЦЕНТРИЧЕСКИХ ЗОН. Типичная апикальная меристема покрытосеменного растения Листовой примордий Гистогенные слои Пазушная или Латеральная почка ЧАСТЬ КЛЕТОК АПИКАЛЬНЫХ МЕРИСТЕМ (АМ) ПРОЛИФИЛИРУЕТ В ТЕЧЕНИЕ ВСЕЙ ЖИЗНИ РАСТЕРИЙ, В АМ ПРОИСХОДИТ 41 ДИФФЕРЕНЦИАЦИЯ КЛЕТОК И ЗАКЛАДКА НОВЫХ ОРГАНОВ.
 ОТКРЫТИЕ «МЕРИСТЕМЫ ОЖИДАНИЯ» И ПРИНЦИПОВ ОРГАНИЗАЦИИ АПИКАЛЬНОЙ МЕРИСТЕМЫ РАСТЕНИЙ q Группа клеток, локализованных в апексе, находится в покое и делятся редко. Деление этих клеток активируется при переходе к образованию генеративных органов. Эти клетки были названы “le meristéme d’attente” (Buvat, 1955) и позднее центральной зоной. q Клетки активно делятся под этой зоной и особенно на периферии. Листовые примордии развиваются за счет делений клеток второго слоя. q В стебле (в отличии от корня), между междоузлиями деления продолжаются после образования листовых примордиев. Конечный фенотип клеток формируется удлинением. ИСТОЧНИК: Buvat , R. (1955). Le méristème apical de la tige. Annales Biol. 31, 595 -656. 42
ОТКРЫТИЕ «МЕРИСТЕМЫ ОЖИДАНИЯ» И ПРИНЦИПОВ ОРГАНИЗАЦИИ АПИКАЛЬНОЙ МЕРИСТЕМЫ РАСТЕНИЙ q Группа клеток, локализованных в апексе, находится в покое и делятся редко. Деление этих клеток активируется при переходе к образованию генеративных органов. Эти клетки были названы “le meristéme d’attente” (Buvat, 1955) и позднее центральной зоной. q Клетки активно делятся под этой зоной и особенно на периферии. Листовые примордии развиваются за счет делений клеток второго слоя. q В стебле (в отличии от корня), между междоузлиями деления продолжаются после образования листовых примордиев. Конечный фенотип клеток формируется удлинением. ИСТОЧНИК: Buvat , R. (1955). Le méristème apical de la tige. Annales Biol. 31, 595 -656. 42
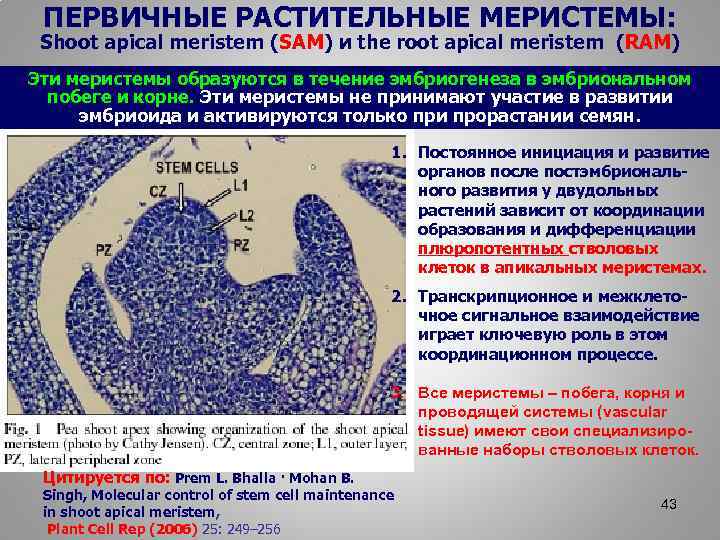 ПЕРВИЧНЫЕ РАСТИТЕЛЬНЫЕ МЕРИСТЕМЫ: Shoot apical meristem (SAM) и the root apical meristem (RAM) Эти меристемы образуются в течение эмбриогенеза в эмбриональном побеге и корне. Эти меристемы не принимают участие в развитии эмбриоида и активируются только при прорастании семян. 1. Постоянное инициация и развитие органов после постэмбрионального развития у двудольных растений зависит от координации образования и дифференциации плюропотентных стволовых клеток в апикальных меристемах. 2. Транскрипционное и межклеточное сигнальное взаимодействие играет ключевую роль в этом координационном процессе. 3. Все меристемы – побега, корня и проводящей системы (vascular tissue) имеют свои специализированные наборы стволовых клеток. Цитируется по: Prem L. Bhalla · Mohan B. Singh, Molecular control of stem cell maintenance in shoot apical meristem, Plant Cell Rep (2006) 25: 249– 256 43
ПЕРВИЧНЫЕ РАСТИТЕЛЬНЫЕ МЕРИСТЕМЫ: Shoot apical meristem (SAM) и the root apical meristem (RAM) Эти меристемы образуются в течение эмбриогенеза в эмбриональном побеге и корне. Эти меристемы не принимают участие в развитии эмбриоида и активируются только при прорастании семян. 1. Постоянное инициация и развитие органов после постэмбрионального развития у двудольных растений зависит от координации образования и дифференциации плюропотентных стволовых клеток в апикальных меристемах. 2. Транскрипционное и межклеточное сигнальное взаимодействие играет ключевую роль в этом координационном процессе. 3. Все меристемы – побега, корня и проводящей системы (vascular tissue) имеют свои специализированные наборы стволовых клеток. Цитируется по: Prem L. Bhalla · Mohan B. Singh, Molecular control of stem cell maintenance in shoot apical meristem, Plant Cell Rep (2006) 25: 249– 256 43
 Показатель преломления биологических объектов почти такой же как у стекла, поэтому наблюдение этих объектов, находящийся на поверхности предметного стекла, в обычном микроскопе весьма затруднено. Конфокальный микроскоп, имеющий высокий контраст, даёт две неоценимые возможности: он позволяет исследовать ткани на клеточном уровне в состоянии физиологической жизнедеятельности, а также оценивать результаты исследования (то есть клеточной активности) в четырёх измерениях — высота, ширина, глубина и время. 44
Показатель преломления биологических объектов почти такой же как у стекла, поэтому наблюдение этих объектов, находящийся на поверхности предметного стекла, в обычном микроскопе весьма затруднено. Конфокальный микроскоп, имеющий высокий контраст, даёт две неоценимые возможности: он позволяет исследовать ткани на клеточном уровне в состоянии физиологической жизнедеятельности, а также оценивать результаты исследования (то есть клеточной активности) в четырёх измерениях — высота, ширина, глубина и время. 44
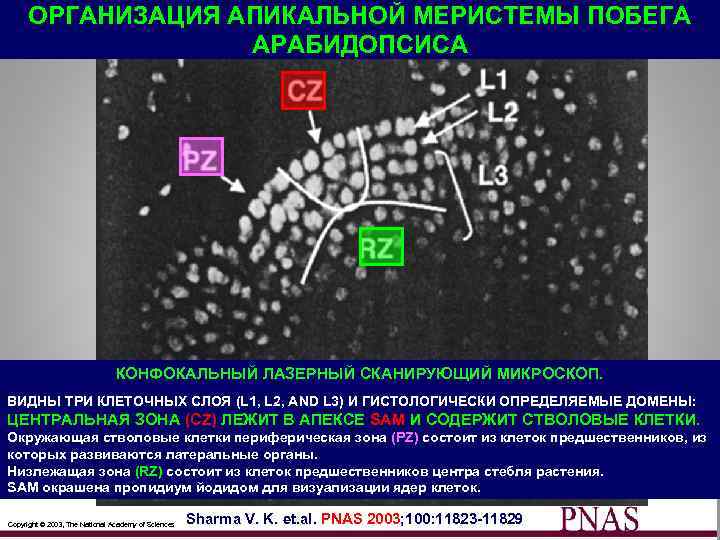 ОРГАНИЗАЦИЯ АПИКАЛЬНОЙ МЕРИСТЕМЫ ПОБЕГА АРАБИДОПСИСА КОНФОКАЛЬНЫЙ ЛАЗЕРНЫЙ СКАНИРУЮЩИЙ МИКРОСКОП. ВИДНЫ ТРИ КЛЕТОЧНЫХ СЛОЯ (L 1, L 2, AND L 3) И ГИСТОЛОГИЧЕСКИ ОПРЕДЕЛЯЕМЫЕ ДОМЕНЫ: ЦЕНТРАЛЬНАЯ ЗОНА (CZ) ЛЕЖИТ В АПЕКСЕ SAM И СОДЕРЖИТ СТВОЛОВЫЕ КЛЕТКИ. Окружающая стволовые клетки периферическая зона (PZ) состоит из клеток предшественников, из которых развиваются латеральные органы. Низлежащая зона (RZ) состоит из клеток предшественников центра стебля растения. SAM окрашена пропидиум йодидом для визуализации ядер клеток. 45 Copyright © 2003, The National Academy of Sciences Sharma V. K. et. al. PNAS 2003; 100: 11823 -11829
ОРГАНИЗАЦИЯ АПИКАЛЬНОЙ МЕРИСТЕМЫ ПОБЕГА АРАБИДОПСИСА КОНФОКАЛЬНЫЙ ЛАЗЕРНЫЙ СКАНИРУЮЩИЙ МИКРОСКОП. ВИДНЫ ТРИ КЛЕТОЧНЫХ СЛОЯ (L 1, L 2, AND L 3) И ГИСТОЛОГИЧЕСКИ ОПРЕДЕЛЯЕМЫЕ ДОМЕНЫ: ЦЕНТРАЛЬНАЯ ЗОНА (CZ) ЛЕЖИТ В АПЕКСЕ SAM И СОДЕРЖИТ СТВОЛОВЫЕ КЛЕТКИ. Окружающая стволовые клетки периферическая зона (PZ) состоит из клеток предшественников, из которых развиваются латеральные органы. Низлежащая зона (RZ) состоит из клеток предшественников центра стебля растения. SAM окрашена пропидиум йодидом для визуализации ядер клеток. 45 Copyright © 2003, The National Academy of Sciences Sharma V. K. et. al. PNAS 2003; 100: 11823 -11829
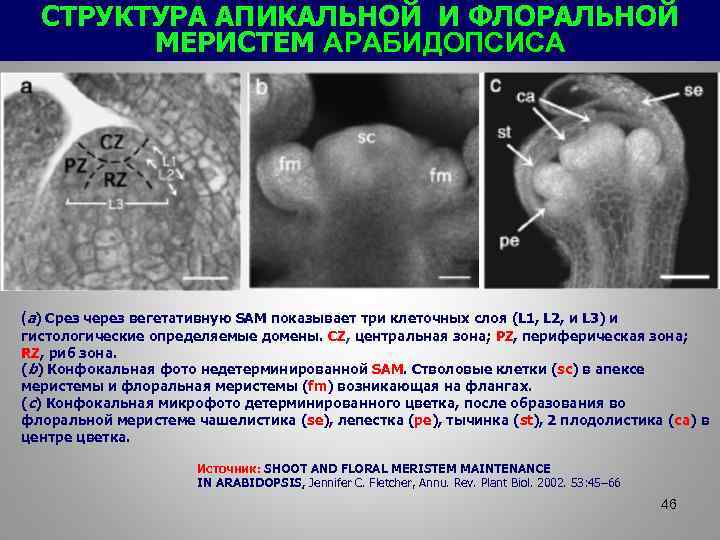 СТРУКТУРА АПИКАЛЬНОЙ И ФЛОРАЛЬНОЙ МЕРИСТЕМ АРАБИДОПСИСА (a) Срез через вегетативную SAM показывает три клеточных слоя (L 1, L 2, и L 3) и гистологические определяемые домены. CZ, центральная зона; PZ, периферическая зона; RZ, риб зона. (b) Конфокальная фото недетерминированной SAM. Стволовые клетки (sc) в апексе меристемы и флоральная меристемы (fm) возникающая на флангах. (c) Конфокальная микрофото детерминированного цветка, после образования во флоральной меристеме чашелистика (se), лепестка (pe), тычинка (st), 2 плодолистика (ca) в центре цветка. Источник: SHOOT AND FLORAL MERISTEM MAINTENANCE IN ARABIDOPSIS, Jennifer C. Fletcher, Annu. Rev. Plant Biol. 2002. 53: 45– 66 46
СТРУКТУРА АПИКАЛЬНОЙ И ФЛОРАЛЬНОЙ МЕРИСТЕМ АРАБИДОПСИСА (a) Срез через вегетативную SAM показывает три клеточных слоя (L 1, L 2, и L 3) и гистологические определяемые домены. CZ, центральная зона; PZ, периферическая зона; RZ, риб зона. (b) Конфокальная фото недетерминированной SAM. Стволовые клетки (sc) в апексе меристемы и флоральная меристемы (fm) возникающая на флангах. (c) Конфокальная микрофото детерминированного цветка, после образования во флоральной меристеме чашелистика (se), лепестка (pe), тычинка (st), 2 плодолистика (ca) в центре цветка. Источник: SHOOT AND FLORAL MERISTEM MAINTENANCE IN ARABIDOPSIS, Jennifer C. Fletcher, Annu. Rev. Plant Biol. 2002. 53: 45– 66 46
 КЛЮЧЕВЫЕ ГЕНЫ, КОНТРОЛИРУЮЩИЕ РАЗВИТИЕ q За последние годы было показано, что ключевые гены, контролирующие развитие, часто являются членами очень ограниченного числа мультигенных семейств, которые кодируют транскрипционные факторы. q Парадигмой таких генных семейств являются гомеобокс- содержащие гены, играющие ключевую роль в спецификации плана тела животных и растений как в развитии, так и в эволюции. 47
КЛЮЧЕВЫЕ ГЕНЫ, КОНТРОЛИРУЮЩИЕ РАЗВИТИЕ q За последние годы было показано, что ключевые гены, контролирующие развитие, часто являются членами очень ограниченного числа мультигенных семейств, которые кодируют транскрипционные факторы. q Парадигмой таких генных семейств являются гомеобокс- содержащие гены, играющие ключевую роль в спецификации плана тела животных и растений как в развитии, так и в эволюции. 47
 Some important genes that regulate SAM Exciting developments in plant stem cell research Vageeshbabu S. Hanur, CURRENT SCIENCE, 1670 VOL. 92, NO. 12, 25 JUNE 2007 48
Some important genes that regulate SAM Exciting developments in plant stem cell research Vageeshbabu S. Hanur, CURRENT SCIENCE, 1670 VOL. 92, NO. 12, 25 JUNE 2007 48
 МУТАЦИИ ИЗМЕНЯЮЩИЕ СУДЬБУ СТВОЛОВЫХ КЛЕТОК Понимание механизмов, поддерживающих стволовые клетки растений, пришло из анализа мутантов Arabidopsis действующих на этот процесс. 1. Растения с мутацией потери функции shoot meristem less (stm) - отсутствии SAM и следовательно не содержащие стволовые клетки, сохраняют эмбриогенез и нормальное прорастание, но не способны производить органы после окончания эмбриогенеза. Ген stm принадлежит к классу гомеобокс KNOX генов. 2. Гены Arabidopsis CLAVATA 1 (CLV 1), CLV 2 , и CLV 3 участвуют в регуляции числа стволовых клеток в меристемах побега и цветка. Растения с мутациями потери функции в любом из CLV генов образуют увеличенные меристемы побега и цветка и производят добавочные органы побегов и цветка (Clark et al. , 1993, 1995; Kayes and Clark, 1998). 3. Растения, несущие мутации потери функции в локусе WUSCHEL (WUS), образуют эмбриогенетические SAM, которые не сохраняют своих свойств после образования несколько латеральных органов. 4. Новые SAM создаются de novo на основе WUS мутаций семядолей или листьев, но эти меристемы также преждевременно завершают развитие. Такая модель stop-and-start роста, приводит к образованию цветков типа щеток, которое продолжается в фазе цветения. ИСТОЧНИК: Analysis of the Transcription Factor WUSCHEL and Its Functional Homologue in Antirrhinum Reveals a 49 Potential Mechanism for Their Roles in Meristem Maintenance, M. Kieffer, et al, The Plant Cell Preview, www. aspb. org, 2006.
МУТАЦИИ ИЗМЕНЯЮЩИЕ СУДЬБУ СТВОЛОВЫХ КЛЕТОК Понимание механизмов, поддерживающих стволовые клетки растений, пришло из анализа мутантов Arabidopsis действующих на этот процесс. 1. Растения с мутацией потери функции shoot meristem less (stm) - отсутствии SAM и следовательно не содержащие стволовые клетки, сохраняют эмбриогенез и нормальное прорастание, но не способны производить органы после окончания эмбриогенеза. Ген stm принадлежит к классу гомеобокс KNOX генов. 2. Гены Arabidopsis CLAVATA 1 (CLV 1), CLV 2 , и CLV 3 участвуют в регуляции числа стволовых клеток в меристемах побега и цветка. Растения с мутациями потери функции в любом из CLV генов образуют увеличенные меристемы побега и цветка и производят добавочные органы побегов и цветка (Clark et al. , 1993, 1995; Kayes and Clark, 1998). 3. Растения, несущие мутации потери функции в локусе WUSCHEL (WUS), образуют эмбриогенетические SAM, которые не сохраняют своих свойств после образования несколько латеральных органов. 4. Новые SAM создаются de novo на основе WUS мутаций семядолей или листьев, но эти меристемы также преждевременно завершают развитие. Такая модель stop-and-start роста, приводит к образованию цветков типа щеток, которое продолжается в фазе цветения. ИСТОЧНИК: Analysis of the Transcription Factor WUSCHEL and Its Functional Homologue in Antirrhinum Reveals a 49 Potential Mechanism for Their Roles in Meristem Maintenance, M. Kieffer, et al, The Plant Cell Preview, www. aspb. org, 2006.
 Ген WUS кодирует новый субтип гомеодоменного белка ядерной локализации, действующего как транскрипционный фактор, поддерживающий меристемное состояние клеток. q WUS m. RNA впервые обнаруживается при развитии зародыша на стадии 16 клеток. В это время, экспрессия WUS наблюдается только в четырех внутрен них клетках апекса. q Ген WUS регулирует сохранение СК в меристеме в недифференцированном состоянии. q При продолжение эмбриогенеза, асимметричное клеточное деление приводит к асимметричному распределению транскриптов WUS и, последовательной локализации WUS экспрессирующего домена во внутренних слоях развиваю- щейся SAM. q WUS m. RNA присутствует в маленькой группой клеток во внутреннем слое побега и после флоральной меристемы не определяется ни в эпителиальной ни в субэпителиальных слоях этих тканей. q Экспрессия домена WUS поддерживается активностью генов FASCIATED 1 (FAS 1 и FAS 2), которые кодируют компонент сборки хроматина фактор-1. FAS 1 и FAS 2 могут поддерживать стабильную транскрипцию гена WUS участвуя в соответствующем устройстве хроматина. Источник: Analysis of the Transcription Factor WUSCHEL and Its Functional Homologue in Antirrhinum Reveals a Potential Mechanism for 50 Their Roles in Meristem Maintenance, M. Kieffer, et al, The Plant Cell Preview, www. aspb. org, 2006
Ген WUS кодирует новый субтип гомеодоменного белка ядерной локализации, действующего как транскрипционный фактор, поддерживающий меристемное состояние клеток. q WUS m. RNA впервые обнаруживается при развитии зародыша на стадии 16 клеток. В это время, экспрессия WUS наблюдается только в четырех внутрен них клетках апекса. q Ген WUS регулирует сохранение СК в меристеме в недифференцированном состоянии. q При продолжение эмбриогенеза, асимметричное клеточное деление приводит к асимметричному распределению транскриптов WUS и, последовательной локализации WUS экспрессирующего домена во внутренних слоях развиваю- щейся SAM. q WUS m. RNA присутствует в маленькой группой клеток во внутреннем слое побега и после флоральной меристемы не определяется ни в эпителиальной ни в субэпителиальных слоях этих тканей. q Экспрессия домена WUS поддерживается активностью генов FASCIATED 1 (FAS 1 и FAS 2), которые кодируют компонент сборки хроматина фактор-1. FAS 1 и FAS 2 могут поддерживать стабильную транскрипцию гена WUS участвуя в соответствующем устройстве хроматина. Источник: Analysis of the Transcription Factor WUSCHEL and Its Functional Homologue in Antirrhinum Reveals a Potential Mechanism for 50 Their Roles in Meristem Maintenance, M. Kieffer, et al, The Plant Cell Preview, www. aspb. org, 2006
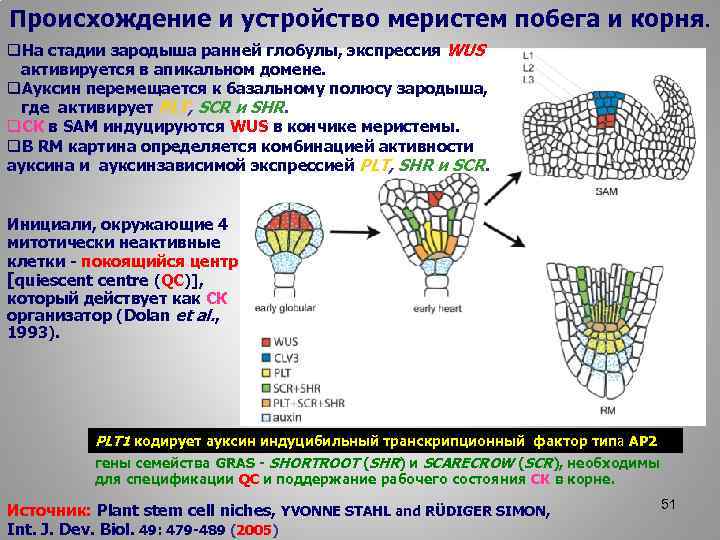 Происхождение и устройство меристем побега и корня. q. На стадии зародыша ранней глобулы, экспрессия WUS активируется в апикальном домене. q. Ауксин перемещается к базальному полюсу зародыша, где активирует PLT, SCR и SHR. q. СК в SAM индуцируются WUS в кончике меристемы. q. В RM картина определяется комбинацией активности ауксина и ауксинзависимой экспрессией PLT, SHR и SCR. Инициали, окружающие 4 митотически неактивные клетки - покоящийся центр [quiescentre (QC)], который действует как СК организатор (Dolan et al. , 1993). PLT 1 кодирует ауксин индуцибильный транскрипционный фактор типа AP 2 гены семейства GRAS - SHORTROOT (SHR) и SCARECROW (SCR), необходимы для спецификации QC и поддержание рабочего состояния СК в корне. Источник: Plant stem cell niches, YVONNE STAHL and RÜDIGER SIMON, Int. J. Dev. Biol. 49: 479 -489 (2005) 51
Происхождение и устройство меристем побега и корня. q. На стадии зародыша ранней глобулы, экспрессия WUS активируется в апикальном домене. q. Ауксин перемещается к базальному полюсу зародыша, где активирует PLT, SCR и SHR. q. СК в SAM индуцируются WUS в кончике меристемы. q. В RM картина определяется комбинацией активности ауксина и ауксинзависимой экспрессией PLT, SHR и SCR. Инициали, окружающие 4 митотически неактивные клетки - покоящийся центр [quiescentre (QC)], который действует как СК организатор (Dolan et al. , 1993). PLT 1 кодирует ауксин индуцибильный транскрипционный фактор типа AP 2 гены семейства GRAS - SHORTROOT (SHR) и SCARECROW (SCR), необходимы для спецификации QC и поддержание рабочего состояния СК в корне. Источник: Plant stem cell niches, YVONNE STAHL and RÜDIGER SIMON, Int. J. Dev. Biol. 49: 479 -489 (2005) 51
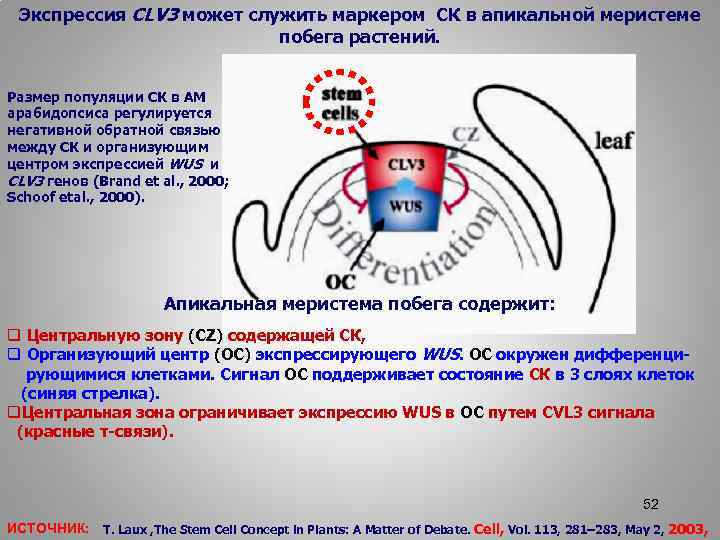 Экспрессия CLV 3 может служить маркером СК в апикальной меристеме побега растений. Размер популяции СК в АМ арабидопсиса регулируется негативной обратной связью между СК и организующим центром экспрессией WUS и CLV 3 генов (Brand et al. , 2000; Schoof etal. , 2000). Апикальная меристема побега содержит: q Центральную зону (CZ) содержащей СК, q Организующий центр (OC) экспрессирующего WUS. OC окружен дифференци рующимися клетками. Сигнал ОС поддерживает состояние СК в 3 слоях клеток (синяя стрелка). q. Центральная зона ограничивает экспрессию WUS в ОС путем CVL 3 сигнала (красные т-связи). 52 ИСТОЧНИК: T. Laux , The Stem Cell Concept in Plants: A Matter of Debate. Cell, Vol. 113, 281– 283, May 2, 2003,
Экспрессия CLV 3 может служить маркером СК в апикальной меристеме побега растений. Размер популяции СК в АМ арабидопсиса регулируется негативной обратной связью между СК и организующим центром экспрессией WUS и CLV 3 генов (Brand et al. , 2000; Schoof etal. , 2000). Апикальная меристема побега содержит: q Центральную зону (CZ) содержащей СК, q Организующий центр (OC) экспрессирующего WUS. OC окружен дифференци рующимися клетками. Сигнал ОС поддерживает состояние СК в 3 слоях клеток (синяя стрелка). q. Центральная зона ограничивает экспрессию WUS в ОС путем CVL 3 сигнала (красные т-связи). 52 ИСТОЧНИК: T. Laux , The Stem Cell Concept in Plants: A Matter of Debate. Cell, Vol. 113, 281– 283, May 2, 2003,
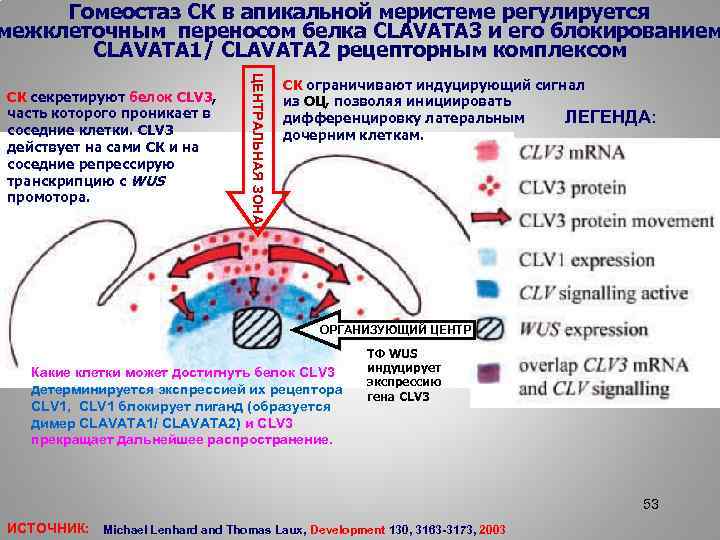 Гомеостаз СК в апикальной меристеме регулируется межклеточным переносом белка CLAVATA 3 и его блокированием CLAVATA 1/ CLAVATA 2 рецепторным комплексом ЦЕНТРАЛЬНАЯ ЗОНА СК секретируют белок CLV 3, часть которого проникает в соседние клетки. CLV 3 действует на сами СК и на соседние репрессирую транскрипцию с WUS промотора. СК ограничивают индуцирующий сигнал из ОЦ, позволяя инициировать ЛЕГЕНДА: дифференцировку латеральным дочерним клеткам. ОРГАНИЗУЮЩИЙ ЦЕНТР Какие клетки может достигнуть белок CLV 3 детерминируется экспрессией их рецептора CLV 1, CLV 1 блокирует лиганд (образуется димер CLAVATA 1/ CLAVATA 2) и CLV 3 прекращает дальнейшее распространение. ТФ WUS индуцирует экспрессию гена CLV 3 53 ИСТОЧНИК: Michael Lenhard and Thomas Laux, Development 130, 3163 -3173, 2003
Гомеостаз СК в апикальной меристеме регулируется межклеточным переносом белка CLAVATA 3 и его блокированием CLAVATA 1/ CLAVATA 2 рецепторным комплексом ЦЕНТРАЛЬНАЯ ЗОНА СК секретируют белок CLV 3, часть которого проникает в соседние клетки. CLV 3 действует на сами СК и на соседние репрессирую транскрипцию с WUS промотора. СК ограничивают индуцирующий сигнал из ОЦ, позволяя инициировать ЛЕГЕНДА: дифференцировку латеральным дочерним клеткам. ОРГАНИЗУЮЩИЙ ЦЕНТР Какие клетки может достигнуть белок CLV 3 детерминируется экспрессией их рецептора CLV 1, CLV 1 блокирует лиганд (образуется димер CLAVATA 1/ CLAVATA 2) и CLV 3 прекращает дальнейшее распространение. ТФ WUS индуцирует экспрессию гена CLV 3 53 ИСТОЧНИК: Michael Lenhard and Thomas Laux, Development 130, 3163 -3173, 2003
 МЕРИСТЕМЫ РАСТЕНИЙ - ЭТО НИША СТВОЛОВЫХ КЛЕТОК, КОТОРАЯ СТИМУЛИРУЕТ ВЫЖИВАНИЕ СТВОЛОВЫХ КЛЕТОК И ИХ СВОЙСТВО ПРОДУЦИРОВАТЬ ПОТОМСТВО, ПРЕДНАЗНАЧЕННОЕ ДЛЯ ДИФФЕРЕНЦИРОВКИ. q Хотя СК имеют высокую степень самовосстановления и необходимы для производства тканей и/или регенерации, СК делятся очень редко. q В большинстве случаев потомство СТ не дифференцируется прямо, но образует промежуточную клеточную популяцию более быстро делящихся предшественников. q Эти временно размножающиеся клетки [transit amplifying cells – (TA cells)] имеют ограниченный пролиферативный потенциал и уже ограниченный потенциал дифференцировки. Их главная задача увеличить популяцию клеток, возникших из одного деления стволовой клетки. Источник: Plant stem cell niches, YVONNE STAHL and RÜDIGER SIMON, Int. J. Dev. Biol. 49: 479 -489 (2005) 54
МЕРИСТЕМЫ РАСТЕНИЙ - ЭТО НИША СТВОЛОВЫХ КЛЕТОК, КОТОРАЯ СТИМУЛИРУЕТ ВЫЖИВАНИЕ СТВОЛОВЫХ КЛЕТОК И ИХ СВОЙСТВО ПРОДУЦИРОВАТЬ ПОТОМСТВО, ПРЕДНАЗНАЧЕННОЕ ДЛЯ ДИФФЕРЕНЦИРОВКИ. q Хотя СК имеют высокую степень самовосстановления и необходимы для производства тканей и/или регенерации, СК делятся очень редко. q В большинстве случаев потомство СТ не дифференцируется прямо, но образует промежуточную клеточную популяцию более быстро делящихся предшественников. q Эти временно размножающиеся клетки [transit amplifying cells – (TA cells)] имеют ограниченный пролиферативный потенциал и уже ограниченный потенциал дифференцировки. Их главная задача увеличить популяцию клеток, возникших из одного деления стволовой клетки. Источник: Plant stem cell niches, YVONNE STAHL and RÜDIGER SIMON, Int. J. Dev. Biol. 49: 479 -489 (2005) 54
 АЛЬТЕРНАТИВНЫЙ МЕТОД РЕГЕНЕРАЦИИ РАСТЕНИЙ q Открытия цитокининов показали возможность регенерации растений in vitro из соматических клеток (Skoog and Miller 1957; Takebe et al. 1971). q. С тех пор цитокинины и ауксины были главными факторами индукции меристемных клеток к регенерации растений. q. За последние 10 лет появились работы, демонстрирующие что регенерация из соматических клеток может быть индуцирована эктопической экспрессией генов, кодирующих транскрипционые факторы. Таких как: ØLEAFY COTYLEDON 1 (LEC 1, Lotan et al. 1998), ØLEAFY COTYLEDON 2 (LEC 2, Stone et al. 2001), ØLEC 1 -LIKE (Kwong et al. 2003), ØWUSCHEL (WUS, Laux et al. 1996; Zuo et al. 2002; Gallois et al. 2004) ØBABY BOOM (BBM, Boutilier et al. 2002). ØWUSCHEL (WUS, Syeda Zinia Rashid et al. 2007). ЭТО ОТКРЫВАЕТ ВОЗМОЖНОСТИ РАЗВИТИЯ АЛЬТЕРНАТИВНОГО МЕТОДА РЕГЕНЕРАЦИИ РАСТЕНИЙ БЕЗ ИСПОЛЬЗОВАНИЯ РРР. 55
АЛЬТЕРНАТИВНЫЙ МЕТОД РЕГЕНЕРАЦИИ РАСТЕНИЙ q Открытия цитокининов показали возможность регенерации растений in vitro из соматических клеток (Skoog and Miller 1957; Takebe et al. 1971). q. С тех пор цитокинины и ауксины были главными факторами индукции меристемных клеток к регенерации растений. q. За последние 10 лет появились работы, демонстрирующие что регенерация из соматических клеток может быть индуцирована эктопической экспрессией генов, кодирующих транскрипционые факторы. Таких как: ØLEAFY COTYLEDON 1 (LEC 1, Lotan et al. 1998), ØLEAFY COTYLEDON 2 (LEC 2, Stone et al. 2001), ØLEC 1 -LIKE (Kwong et al. 2003), ØWUSCHEL (WUS, Laux et al. 1996; Zuo et al. 2002; Gallois et al. 2004) ØBABY BOOM (BBM, Boutilier et al. 2002). ØWUSCHEL (WUS, Syeda Zinia Rashid et al. 2007). ЭТО ОТКРЫВАЕТ ВОЗМОЖНОСТИ РАЗВИТИЯ АЛЬТЕРНАТИВНОГО МЕТОДА РЕГЕНЕРАЦИИ РАСТЕНИЙ БЕЗ ИСПОЛЬЗОВАНИЯ РРР. 55
 АЛЬТЕРНАТИВНЫЙ МЕТОД РЕГЕНЕРАЦИИ РАСТЕНИЙ q Открытия цитокининов показали возможность регенерации растений in vitro из соматических клеток (Skoog and Mi-ller 1957; Steward et al. 1958; Takebe et al. 1971). q. С тех пор цитокинины и ауксины были главными факторами индукции меристемных клеток к регенерации. q. Сравнительно недавно появились работы, демонстрирующие что регенерация из соматических клеток может быть индуцирована эктопической экспрессией различных генов, кодирующих транскрипционые факторы. Таких как: ØLEAFY COTYLEDON 1 (LEC 1, Lotan et al. 1998), ØLEAFY COTYLEDON 2 (LEC 2, Stone et al. 2001), ØLEC 1 -LIKE (Kwong et al. 2003), ØWUSCHEL (WUS, Laux et al. 1996; Zuo et al. 2002; Gallois et al. 2004) ØBABY BOOM (BBM, Boutilier et al. 2002). ЭТО ОТКРЫВАЕТ ВОЗМОЖНОСТИ РАЗВИТИЯ АЛЬТЕРНАТИВНОГО МЕТОДА РЕГЕНЕРАЦИИ РАСТЕНИЙ БЕЗ ИСПОЛЬЗОВАНИЯ РРР. 56
АЛЬТЕРНАТИВНЫЙ МЕТОД РЕГЕНЕРАЦИИ РАСТЕНИЙ q Открытия цитокининов показали возможность регенерации растений in vitro из соматических клеток (Skoog and Mi-ller 1957; Steward et al. 1958; Takebe et al. 1971). q. С тех пор цитокинины и ауксины были главными факторами индукции меристемных клеток к регенерации. q. Сравнительно недавно появились работы, демонстрирующие что регенерация из соматических клеток может быть индуцирована эктопической экспрессией различных генов, кодирующих транскрипционые факторы. Таких как: ØLEAFY COTYLEDON 1 (LEC 1, Lotan et al. 1998), ØLEAFY COTYLEDON 2 (LEC 2, Stone et al. 2001), ØLEC 1 -LIKE (Kwong et al. 2003), ØWUSCHEL (WUS, Laux et al. 1996; Zuo et al. 2002; Gallois et al. 2004) ØBABY BOOM (BBM, Boutilier et al. 2002). ЭТО ОТКРЫВАЕТ ВОЗМОЖНОСТИ РАЗВИТИЯ АЛЬТЕРНАТИВНОГО МЕТОДА РЕГЕНЕРАЦИИ РАСТЕНИЙ БЕЗ ИСПОЛЬЗОВАНИЯ РРР. 56
 ЭКТОПИЧЕСКАЯ ЭКСПРЕССИЯ ТРАНСКРИПЦИОННОГО ФАКТОРА BABY BOOM ЗАПУСКАЕТ ПЕРЕХОД ОТ ВЕГЕТАТИВНОГО К ЭМБРИОГЕНЕТИЧЕСКОМУ РОСТУ. q Молекулярные механизмы лежащие в инициации эмбриогенетического пути развития в основном неизвестны q Для изучения этого пути было призведено субтрактивная гибридизация с целью идентификации генов увеличивающих индукцию развития эмбриоидов in vitro в процессе развития незрелых пыльцевых зерен у Brassica napus q Один из выделенных генов BABY BOOM (BBM), показал схожесть с транскрипционными факторами AP 2/ERF и экспрессировался преимущественно в развивающихся зародышах и семенах. q Эктопическая экспрессия транскрипционного фактора BABY BOOM привела к спонтанному образованию соматических зародышей и семядоли подобных структур в проростках. Источник: Ectopic Expression of BABY BOOM Triggers a Conversion from Vegetative to 57 Embryonic Growth, Kim Boutilier, et al, The Plant Cell, Vol. 14, 1737– 1749, August 2002,
ЭКТОПИЧЕСКАЯ ЭКСПРЕССИЯ ТРАНСКРИПЦИОННОГО ФАКТОРА BABY BOOM ЗАПУСКАЕТ ПЕРЕХОД ОТ ВЕГЕТАТИВНОГО К ЭМБРИОГЕНЕТИЧЕСКОМУ РОСТУ. q Молекулярные механизмы лежащие в инициации эмбриогенетического пути развития в основном неизвестны q Для изучения этого пути было призведено субтрактивная гибридизация с целью идентификации генов увеличивающих индукцию развития эмбриоидов in vitro в процессе развития незрелых пыльцевых зерен у Brassica napus q Один из выделенных генов BABY BOOM (BBM), показал схожесть с транскрипционными факторами AP 2/ERF и экспрессировался преимущественно в развивающихся зародышах и семенах. q Эктопическая экспрессия транскрипционного фактора BABY BOOM привела к спонтанному образованию соматических зародышей и семядоли подобных структур в проростках. Источник: Ectopic Expression of BABY BOOM Triggers a Conversion from Vegetative to 57 Embryonic Growth, Kim Boutilier, et al, The Plant Cell, Vol. 14, 1737– 1749, August 2002,
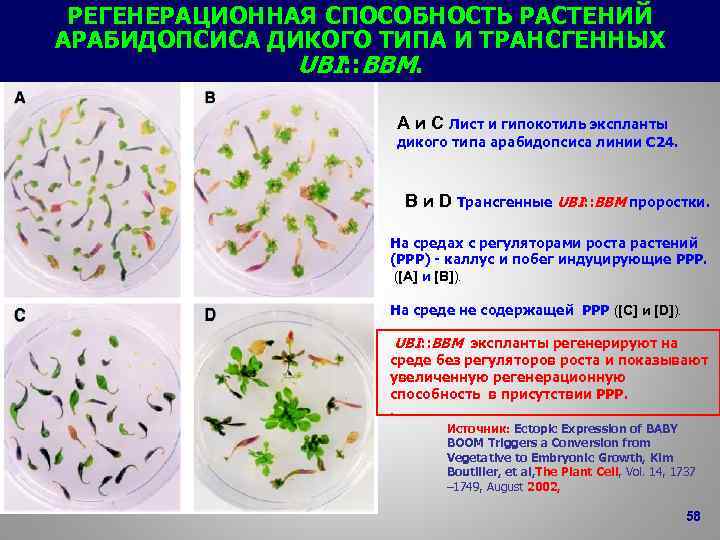 РЕГЕНЕРАЦИОННАЯ СПОСОБНОСТЬ РАСТЕНИЙ АРАБИДОПСИСА ДИКОГО ТИПА И ТРАНСГЕННЫХ UBI: : BBM. A и C Лист и гипокотиль экспланты дикого типа арабидопсиса линии C 24. B и D Трансгенные UBI: : BBM проростки. На средах с регуляторами роста растений (РРР) - каллус и побег индуцирующие РРР. ([A] и [B]). На среде не содержащей РРР ([C] и [D]). UBI: : BBM экспланты регенерируют на среде без регуляторов роста и показывают увеличенную регенерационную способность в присутствии РРР. . Источник: Ectopic Expression of BABY BOOM Triggers a Conversion from Vegetative to Embryonic Growth, Kim Boutilier, et al, The Plant Cell, Vol. 14, 1737 – 1749, August 2002, 58
РЕГЕНЕРАЦИОННАЯ СПОСОБНОСТЬ РАСТЕНИЙ АРАБИДОПСИСА ДИКОГО ТИПА И ТРАНСГЕННЫХ UBI: : BBM. A и C Лист и гипокотиль экспланты дикого типа арабидопсиса линии C 24. B и D Трансгенные UBI: : BBM проростки. На средах с регуляторами роста растений (РРР) - каллус и побег индуцирующие РРР. ([A] и [B]). На среде не содержащей РРР ([C] и [D]). UBI: : BBM экспланты регенерируют на среде без регуляторов роста и показывают увеличенную регенерационную способность в присутствии РРР. . Источник: Ectopic Expression of BABY BOOM Triggers a Conversion from Vegetative to Embryonic Growth, Kim Boutilier, et al, The Plant Cell, Vol. 14, 1737 – 1749, August 2002, 58
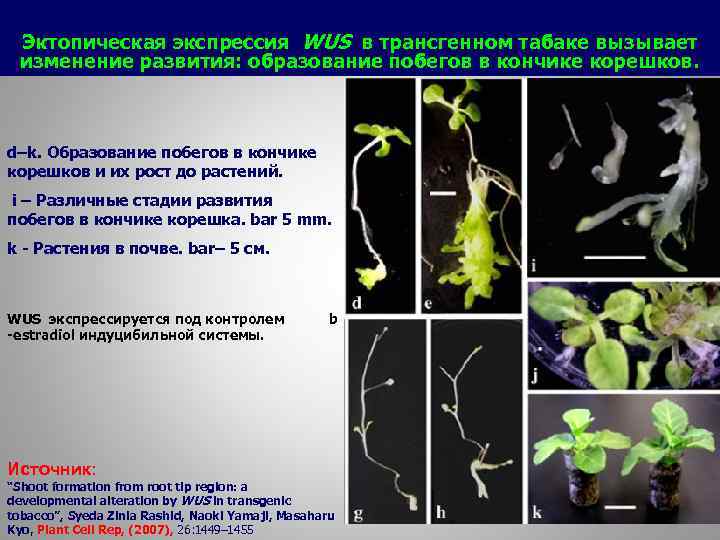 Эктопическая экспрессия WUS в трансгенном табаке вызывает изменение развития: образование побегов в кончике корешков. d–k. Образование побегов в кончике корешков и их рост до растений. i – Различные стадии развития побегов в кончике корешка. bar 5 mm. k - Растения в почве. bar– 5 см. WUS экспрессируется под контролем b -estradiol индуцибильной системы. Источник: “Shoot formation from root tip region: a developmental alteration by WUS in transgenic tobacco”, Syeda Zinia Rashid, Naoki Yamaji, Masaharu Kyo, Plant Cell Rep, (2007), 26: 1449– 1455 59
Эктопическая экспрессия WUS в трансгенном табаке вызывает изменение развития: образование побегов в кончике корешков. d–k. Образование побегов в кончике корешков и их рост до растений. i – Различные стадии развития побегов в кончике корешка. bar 5 mm. k - Растения в почве. bar– 5 см. WUS экспрессируется под контролем b -estradiol индуцибильной системы. Источник: “Shoot formation from root tip region: a developmental alteration by WUS in transgenic tobacco”, Syeda Zinia Rashid, Naoki Yamaji, Masaharu Kyo, Plant Cell Rep, (2007), 26: 1449– 1455 59
 Благодарю за внимание. Проф. , А. К. Гапоненко 60
Благодарю за внимание. Проф. , А. К. Гапоненко 60


