Tochki_restriktsiyi_KTs.ppt
- Количество слайдов: 27

Точки рестрикції клітинного циклу та біохімічна регуляція переходу клітин в точках рестрикції

Якщо клітина не досягає точки R (точки рестрикції), вона виходить із циклу і вступає в період репродуктивного спокою (G 0 - періоду для того, щоб (в залежності від причин зупинки): (1) вижить в умовах недостатку поживних субстратів або факторів росту, (2)диференціюватися та виконати свої специфічні функції, (3)ДЛЯ МІТОТИЧНО АКТИВНИХ КЛІТИН - G 1 (4) здійснити репарацію пошкодженої ДНК. (5)

Тривалість фаз клітинного циклу для мітотично активних клітин знаходиться в такій послідовності: M<G 2<S<G 1 Основні “звіряльні” точки для мітотично активних клітин знаходяться на етапах переходу G 1 - S; S-G 2; M Точка рестрикції (рання, постмітотична)початок G 1 Точка рестрикції (пізня, пресинтетична) – кінець G 1
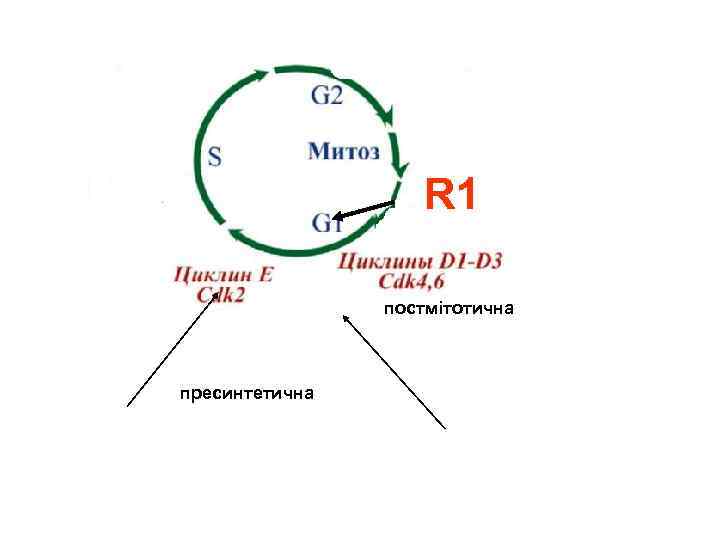
R 1 постмітотична пресинтетична

G 1 - S перехід розділяють на 2 періоди G 1 – основні причини, які лежать в основі порушень клітинного циклу в цій точці рестрикції 1)двухланцюгові розриви в молекулі ДНК як результат впливу УФ та гама-опромінення, алкілюючих агентів, зміні температури (нагрівання, або охолодження) 2)неправильна сегрегація хромосом (розходження їх до різних полюсів анафазної пластинки) в результаті попереднього поділу (що може також бути пов’язано з утворенням мікроядер) 3)розрушення системи мікротрубочок. тобто, порушення, які призводять до зупинки клітин в рестрикційній точці G 1 пов’язані з дефектами хромосом.

Точка рестрикції клітинного циклу G 1 умовно поділяється на ранню та пізню. В ранній (постмітотичній) задіяні ізоформи цикліну D та циклінзалежні кінази Cdk 4, 6 а також їх комплекси D 1 -D 3 Cdk 4, 6; В пізній (пресинтетичній) - циклін E та циклінзалежна кіназа Cdk 2 а також їх комплекси Е –Cdk 2
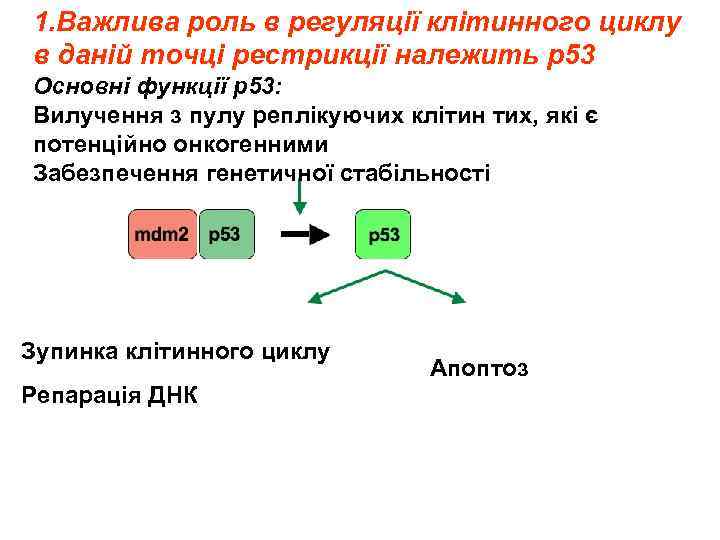
1. Важлива роль в регуляції клітинного циклу в даній точці рестрикції належить р53 Основні функції р53: Вилучення з пулу реплікуючих клітин тих, які є потенційно онкогенними Забезпечення генетичної стабільності Зупинка клітинного циклу Репарація ДНК Апоптоз

p 53 (білок p 53) — це транскрипційний фактор, який має м. м. 43, 7 к. Да, рухливість знижена при електрофоретичному розділенні за рахунок залишків проліну. Ген людини, який кодує білок p 53, називається TP 53, який розміщений на 17 хромосомі (17 p 13. 1), у інших ссавців у миші — хромосома 11; щурі — хромосома 10; собака — хромосома 5; свиня— хромосома 12
-Арест клітинного циклу Апоптоз

Активація білка р53 відбувається у відповідь на багаточисельні стресові стимули: Класичні стимули (безпосереднє пошкодження ДНК) -Ушкодження сегрегації генетичного матеріалу (це може бути пов’язано з дисфункціями мітотичного веретена) -Зменшення концентрації вільних рибонуклеотидів -Гіпоксія -Температурний шок (переважно тепловий) -Високі концентрації NO -Іонізуюче випромінення

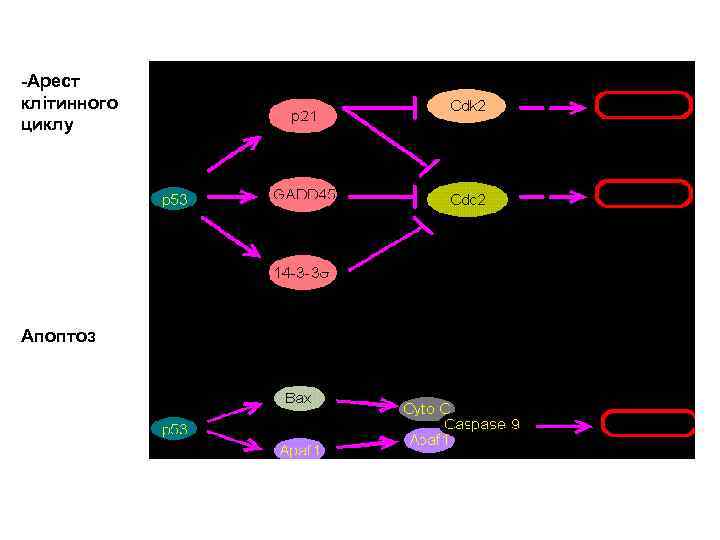
За наявності в клітині хромосомних ушкоджень активація р53 відбувається декількома способами: - шляхом зменшення швидкості розпаду р53 - шляхом підвищення функціональної активності Основні фукції, які виконує білок р53 - зупинка клітинного цикла і реплікації ДНК; при сильному стресовому сигналі — запуск апоптозу -вилучення з пула реплікуючих клітин тих, які є потенційно онкогенними -Забезпечення генетичної стабільності

На даний момент описано 2 типа білка р53 – дикий (wild type) p 53, який присутній у всіх проліферуючих клітинах, а також в клітинах, що піддаються апоптозу після певних сигналів. Однак ген, який піддається змінам, таким як делеції, реверсії, точкові мутації, так званий мутантний mt 53 призводить до інгібування апоптозу – він проявляє супресорну дію на дикий тип р53, маскуючи клітину під апоптотичну Молекула білка р53 складається із декількох функціонально-значимих доменів, які відіграють важливу роль в регуляції його активності. N-кінцевий домен залучений в транскрипційну активність генів- мішеней. Цей же участок взаємодіє з білком Mdm 2 , який є інгібітором р53 [ Kussie ea 1996 , Lin ea 1994 ]. Фосфорилювання N-кінцевих амінокислот приводить до зміни зв’язування р53 з Mdm 2.

Було також виявлено, що в клітинах, у яких клітинний цикл короткий концентрація р53 вища, ніж у клітинах з більш тривалим циклом. Отже, підвищена концентрація р53 – це підготовка клітини для миттєвої реакції на можливе виникнення ушкоджень ДНК. Однак висока концентрація р53 недостатня для його активації. Концентрація білка р53 збільшуєтья в результаті зняття інгібування трансляції його м. РНК. Пригнічення трансляції відбувається в результаті зв’язування регуляторних білків з послідовностями нуклеотидів в 3’ -нетраснслюєму участку м. РНК. Модифікація білку р53 призводить до його активації. Неактивний білок знаходиться в цитоплазмі ( на деяких етапах клітинного циклу), активний білок локалізований в ядрі. За відсутності стресового чинника білок має короткий період напіврозпаду (5 -20 хвилин в залежності від типу клітин). в регуляції стабільності та активності білка р53 ключова роль належить білку Mdm 2.
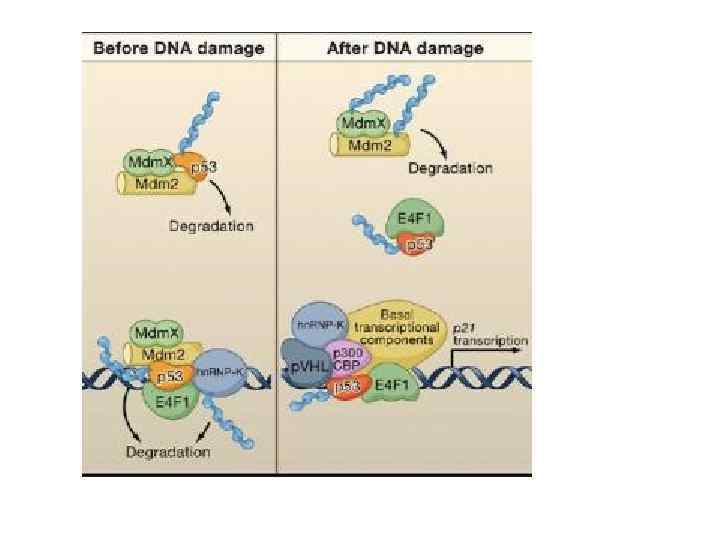

За нормальних умов в клітині експресується р53 та Mdm 2. Функція білку Mdm 2 спочатку була встановлена у мишей (mouse double minute chromosome amplified oncogene — онкоген, який був ампліфікований на хромосомі типу «double minute» . Гомологічний ген людини HDM 2 також є онкогеном. N-кінцевий домен білка Mdm 2 зв’язується з N-кінцевим трансактивуючим доменом білка р53. Таким чином, білок Mdm 2 пригнічує активність білка р53. Крім того, комплекс Mdm 2: р53 є інгібітором транскрипції.

Білок Mdm 2 є ферментом групи E 3 системи убіквітинзалежного протеолізу з вираженою специфічністю по відношенню до білка р53. Білок Mdm 2 каталізує перенос активованого убіквітину з ферменту групи Е 2 на білок р53 і є Е 3 -лігазою. Маркований убіквітином білок р53 – субстрат для 26 S протеасоми, де відбувається протеоліз р53. В нормальних умовах постійно утворюється комплекс Mdm 2: р53 та відбувається протеоліз р53, що є поясненням низької концентрації р53 в клітині. Додавання моноклональних антитіл до комплексу Mdm 2: p 53 призводить до значного збільшення концентрації білку р53. також підвищена експресія білка Mdm 2 є онкогеним фактором, а сам білок відноситься до протоонкогенів. Крім 26 S протеасоми протеоліз білка р53 може відбувається цистеїновими протеазами родини кальпаїнів.

Молекула білка р53 складається із декількох функціонально- значимих доменів, які відіграють важливу роль в регуляції його активності. N-кінцевий домен залучений в транскрипційну активність генів- мішеней. Цей же участок взаємодіє з білком Mdm 2 , який є інгібітором р53 [ Kussie ea 1996 , Lin ea 1994 ]. Фосфорилювання N-кінцевих амінокислот приводить до зміни зв’язування р53 з Mdm 2. Пролін-богатий домен необхідний для повної супресорної активності р53 [ Walker ea 1996 ]. Центральний домен р53 приймає безпосередню участь в пізнаванні та зв’язуванні із специфічними послідовностями ДНК [ Cho ea 1994 ]. Лінкерний домен відповідальний за ядерну локализацію р53 [ Addison ea 1990 , Shaulsky ea 1990 ]. aльфа-спіральний домен забезпечує тетрамеризацію молекул р53 Втрата здатності до олігомеризації при порушенні a-спірального домену приводить до функціональної інактивації білка [ Sturzbecher ea 1992 , Tarunina ea 1993 ].

Відповідь клітини на активацію р53 – апоптоз чи зупинка клітинного циклу залежить від багатьох факторів: гістогенетичного типу клітин (наприклад, в нормальних фібробластах, як правило, спостерігають зупинку клітинного циклу, тоді як у лімфоцитах – апоптоз), ступеня активації р53 (із збільшенням рівня його експресії підвищується вірогідність апоптозу), функціональної активності сигнального шляху p 21 WAF 1 p. Rb-E 2 F, що відповідає за зупинку в G 1 і т. д. , а точка зупинки клітинного циклу визначається тим, у якій фазі мітотичного циклу перебуває клітина під час підвищення експресії р53 та яким фактором спричинена його активація.

Порушення функції р53, характерні для більшості різноманітних новоутворень, значно послаблюють функції “контрольних точок” клітинного циклу та одночасно гальмують індукцію апоптозу, що, поряд з іншими наслідками дисфункції р53, а саме втратою механізму, що обмежує створення додаткових центросом , значно підвищує вірогідність появи проліферуючих клітин з спонтанно виниклими чи індукованими генетичними аномаліями – змінами кількості хромосом або ампліфікацією окремих генів. Важливо підкреслити, що відновлення нормальної функції р53 у клітинах, що її втратили, навпаки, призводить до зменшення темпів виникнення генетичних мутацій. Вивчення білкового профілю тринадцяти нормальних та трансформованих клітинних ліній методом моноклональних антитіл виявило присутність специфічного білка р53 в ядрах трансформованих клітин, котрий був відсутній у нормальних клітинах мишей, але був присутній у нормальних клітинах людини. У останньому випадку кількість р53 була високою у експоненціальній фазі росту клітин та низькою у стаціонарній фазі росту.

Активований білок р53 стимулює експресію гену mdm 2 – за механізмом зворотнього негативного зв’язку. Функція білку Mdm 2 в маркуванні білка р53 для деградації не є селективною, тому що кіназа JNK, яка утворює комплекс з білком р53 приводить до убіквітування та деградації р53. Якщо зменшується концентрація р53 та концентрація інгібітора p 27 і зростає внутрішньоклітинний вміст циклінів D після звіряльної точки G 1 то відбувається активація CDK і, в кінцевому рахунку, фосфорилювання білка p. Rb, звільненням пов'язаного з ним фактора транскрипції E 2 F і активацією транскрипції відповідних генів. На ранніх стадіях фази G 1 клітинного циклу концентрація білка p 27 все ще залишається досить високою. Ця зворотність можлива до точки переходу, після проходження якої клітина стає комітованою до поділу і не супроводжується пригніченням клітинного циклу. З цього моменту клітини стають незалежними від зовнішніх стимулів до поділу, проте зберігають здатність до самоконтролю клітинного циклу.

В регуляції активності G 1 -переходу також задіяні інгібітори циклінзалежних кіназ родини INK 4 (p 15, p 16, p 18 і p 19), які специфічно взаємодіють з кіназами CDK 4 і CDK 6. Білки p 15 і p 16 ідентифіковані як супресори пухлинного росту, і їх синтез регулюється білком p. Rb. Всі чотири білка блокують активацію CDK 4 і CDK 6, або послаблюючи їх взаємодія з цикліном, або витісняючи їх з комплексу. Хоча обидва білка p 16 і p 27 володіють здатністю пригнічувати активність CDK 4 і CDK 6, перший має більшу спорідненість до цих протеїнкінази. Якщо концентрація p 16 підвищується до рівня, при якому він повністю пригнічує активність кіназ CDK 4 / 6, білок p 27 стає основним інгібітором кінази CDK 2.

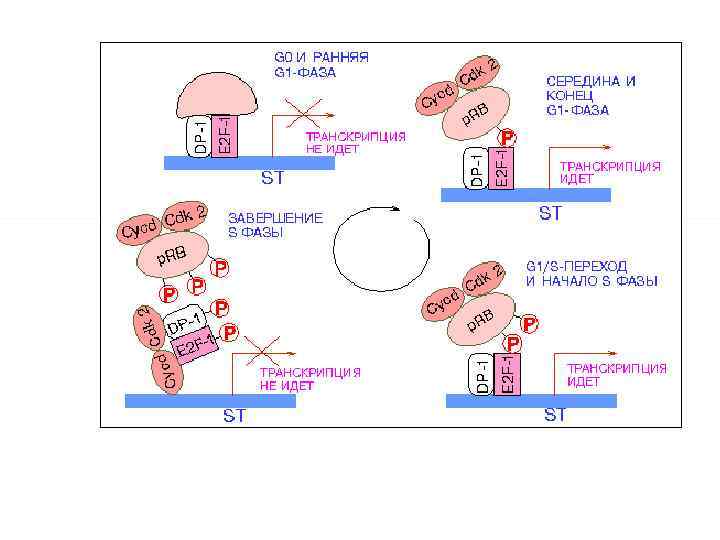
У відповідь на пошкодження ДНК, викликані УФ або іонізуючої радіацією, білок p 53 індукує транскрипцію гена білка p 21. Підвищення його внутрішньоклітинної концентрації блокує активацію CDK 2 циклінe E або A. Це зупиняє клітини в пізній фазі G 1 або ранній S-фазі клітинного циклу. Ця точка характеризується у випадку неможливості усунення ушкоджень вступом клітини в апоптоз. Існують дві різноспрямовані системи регуляції пізнього G 1 / S - переходу: позитивна і негативна (O `Connor DJ, Lam E. , ea. , 1995). Система позитивно регулююча вхід в S-фазу, включає гетеродимер E 2 F 1/DP-1

Для транскрипції багатьох генів задіяних в синтезі ДНК необхідні транскрипційні фактори родини E 2 F , зокрема генів, продуктами яких є білки дигідрофолатредуктаза, тимідилатсинтетаза ДНК-полімераза гена цикліну Е , гена цикліну А , гена PCNA , гена ДНК-полімерази aльфа [ Helin, ea 1998 , Less M. L. , Harlow E. , 1995 ). Зв’язування з білками р. Rb и p 70 інгібує E 2 F ( Lodish. H. , 1995 ). За мітогенної стимуляції p. Rb в середині G 1 -фази фосфорилюється комплексом циклін D - Сdk 4 (або циклін D - Cdk 6 ), що викликає вивільнення транскрипційних факторів E 2 F - DP із комплексу з p. Rb та їх активацію [ Mittnacht, ea 1998 ]. Після цього відбувається стимуляція транскрипції гену цикліну Е , в результаті чого активуються комплекси циклін Е - Cdk 2 , які також фосфорилюють p. Rb. Таким чином, виникає регуляторна петля, яка підтримує активність транскрипційних факторів E 2 F – DP, які контролюють гени реплікації ДНК. Активність фактору E 2 F-1/DP-1 змінюється в залежності від фази клітинного циклу: -зворотня модуляція при взаємодії з білком p. RB в фазі G 0 та на початку G 1, а також при фосфорилюванні комплексом A/Cdc 2 в кінці S- фази. Комплекси D/Cdk 4, E/Cdk 2 позитивно модулюють активність фактора E 2 F-1/DP-1 під час G 1 (пізня точка рестрикції)/S- переходу і на початку Sфази.

Звіряльна точка S-періоду – недостатня концентрація нуклеотидів в клітині Звіряльна точка G 2 -періоду: -Незавершеність реплікації участків хромосом -Крупні ушкодження ДНК (які можуть зберігатись із попереднього періоду або набуті) Звіряльна точка метафази мітозу: -неправильна зборка веретена поділу (це можуть бути неприкріплені кінетохори хроматид до мікротрубочок веретена поділу) Дисфункція білків родин BUB (budding uninhibited by benomyl) , MAD (mitotic arrest deficient), які контролюють приєднання конденсованих хромосом до мітотичного веретену в метафазі мітозу та запобігають розбіжності кожної з двох гомологічних хроматид під час цитокінезу.

Висновки • Мітотично активні клітини в мають ряд точок рестрикції, які запобігають проходженню клітинного циклу при наявності певних ушкоджень. • Дисфункції регуляції в рестрикційних точках призводять до порушення клітинного циклу та набуття клітинами неконтрольованого поділу. • Гени, транскрипційні фактори, цикліни та циклінзалежні кінази, задіяні в регуляції клітинного циклу розлядаються як мішені направленої терапії трансформованих клітин •

Запитання: Які клітини Вам відомі стосовно поділу? Які звіряльні точки клітинного циклу Вам відомі? Функції білка р53 в регуляції клітинного циклу. Механізми регуляції активності р53. Роль Mdm 2 в активації функції р53 Транскрипційні фактори E 2 F-1/DP-1 в регуляції звіряльних точок клітинного циклу В яких клітинах порушена функція білка р53? За яких умов в клітинах індукується апоптоз? Які інгібітори задіяні в регуляції переходу G 1 -S
Tochki_restriktsiyi_KTs.ppt