Химические связи.pptx
- Количество слайдов: 17
 Типы химических связей Андреева Елена 11 группа 2014 г
Типы химических связей Андреева Елена 11 группа 2014 г
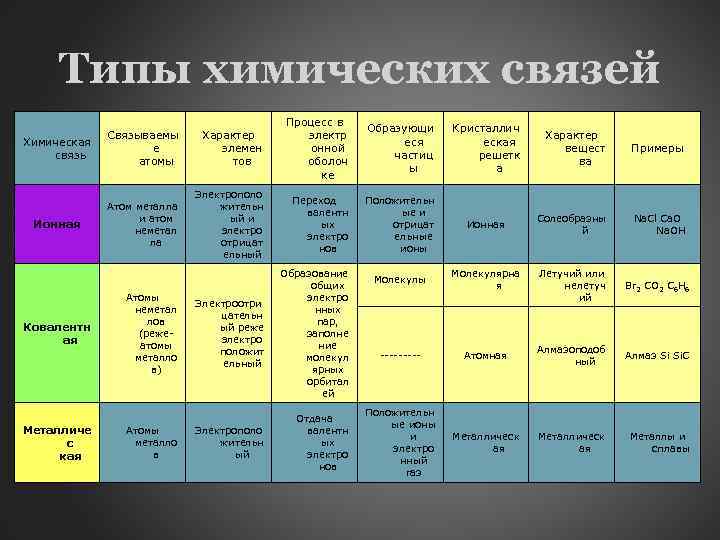 Типы химических связей Химическая связь Связываемы е атомы Характер элемен тов Ионная Атом металла и атом неметал ла Электрополо жительн ый и электро отрицат ельный Ковалентн ая Металличе с кая Атомы неметал лов (режеатомы металло в) Атомы металло в Электроотри цательн ый реже электро положит ельный Электрополо жительн ый Процесс в электр онной оболоч ке Образующи еся частиц ы Кристаллич еская решетк а Переход валентн ых электро нов Положительн ые и отрицат ельные ионы Ионная Солеобразны й Na. Cl Ca. O Na. OH Молекулы Молекулярна я Летучий или нелетуч ий Br 2 CO 2 C 6 H 6 ----- Атомная Алмазоподоб ный Алмаз Si Si. C Положительн ые ионы и электро нный газ Металлическ ая Металлы и сплавы Образование общих электро нных пар, заполне ние молекул ярных орбитал ей Отдача валентн ых электро нов Характер вещест ва Примеры
Типы химических связей Химическая связь Связываемы е атомы Характер элемен тов Ионная Атом металла и атом неметал ла Электрополо жительн ый и электро отрицат ельный Ковалентн ая Металличе с кая Атомы неметал лов (режеатомы металло в) Атомы металло в Электроотри цательн ый реже электро положит ельный Электрополо жительн ый Процесс в электр онной оболоч ке Образующи еся частиц ы Кристаллич еская решетк а Переход валентн ых электро нов Положительн ые и отрицат ельные ионы Ионная Солеобразны й Na. Cl Ca. O Na. OH Молекулы Молекулярна я Летучий или нелетуч ий Br 2 CO 2 C 6 H 6 ----- Атомная Алмазоподоб ный Алмаз Si Si. C Положительн ые ионы и электро нный газ Металлическ ая Металлы и сплавы Образование общих электро нных пар, заполне ние молекул ярных орбитал ей Отдача валентн ых электро нов Характер вещест ва Примеры
 Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов. Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H 2, O 2, N 2, Cl 2 Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H 2 O, NF 3, CO 2. Ковалентная связь образуется между атомами элементов, обладающих электроотрицательным характером. Электроотрицательность - это способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи. Ряд электроотрицательностей
Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов. Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H 2, O 2, N 2, Cl 2 Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H 2 O, NF 3, CO 2. Ковалентная связь образуется между атомами элементов, обладающих электроотрицательным характером. Электроотрицательность - это способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи. Ряд электроотрицательностей
 Ковалентная связь неполярная
Ковалентная связь неполярная
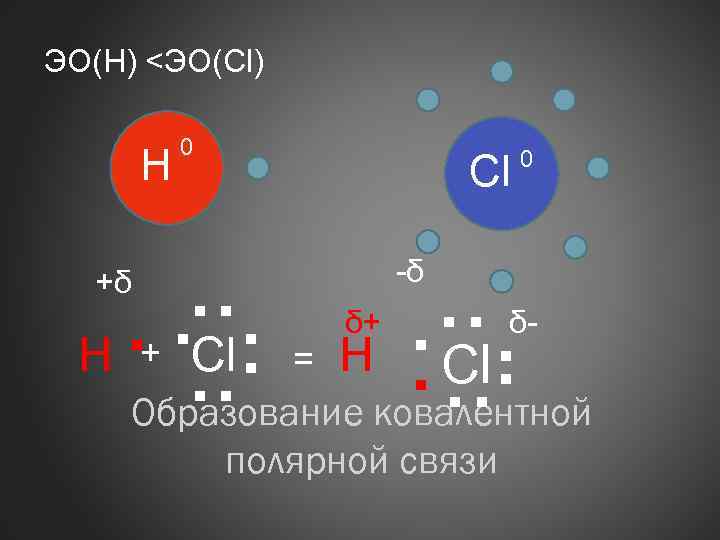 ЭО(Н) <ЭО(Cl) H 0 Сl 0 . . Cl. Н. . ковалентной. . Образование -δ +δ + = δ+ полярной связи δ-
ЭО(Н) <ЭО(Cl) H 0 Сl 0 . . Cl. Н. . ковалентной. . Образование -δ +δ + = δ+ полярной связи δ-
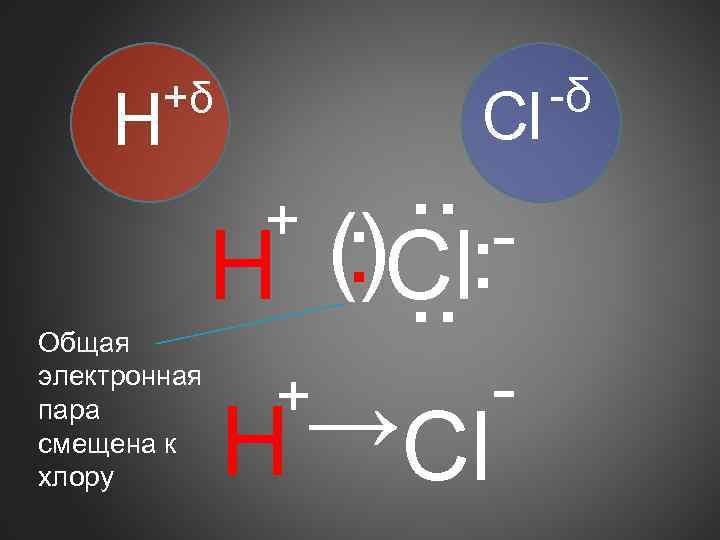 +δ H Общая электронная пара смещена к хлору Cl . . . +. (. )Cl. H. . + →Cl H -δ
+δ H Общая электронная пара смещена к хлору Cl . . . +. (. )Cl. H. . + →Cl H -δ
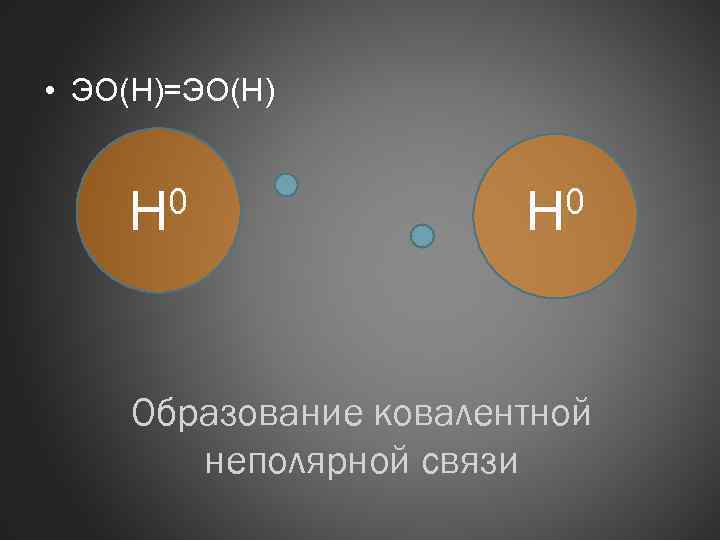 • ЭО(Н)=ЭО(Н) 0 Н Образование ковалентной неполярной связи
• ЭО(Н)=ЭО(Н) 0 Н Образование ковалентной неполярной связи
 Ионная связь Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путём полного перехода общей электронной плотности к атому более электроотрицательного элемента. Ионы - это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или присоединени электронов. При отдаче электронов образуется положительно заряженный ион-катион, присоединении-отрицательный-анион. Схема образования ионной связи.
Ионная связь Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путём полного перехода общей электронной плотности к атому более электроотрицательного элемента. Ионы - это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или присоединени электронов. При отдаче электронов образуется положительно заряженный ион-катион, присоединении-отрицательный-анион. Схема образования ионной связи.
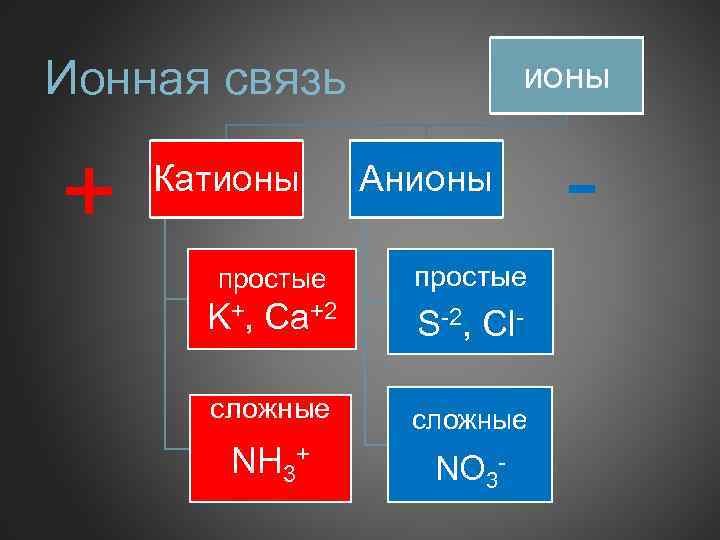 Ионная связь + Катионы Анионы простые K+, Ca+2 S-2, Cl- сложные NH 3+ NO 3 - -
Ионная связь + Катионы Анионы простые K+, Ca+2 S-2, Cl- сложные NH 3+ NO 3 - -
 11+(-11)=0 Na 0 11+(-10)=+1 - 1 е = Na+ № группы Образование катионов
11+(-11)=0 Na 0 11+(-10)=+1 - 1 е = Na+ № группы Образование катионов
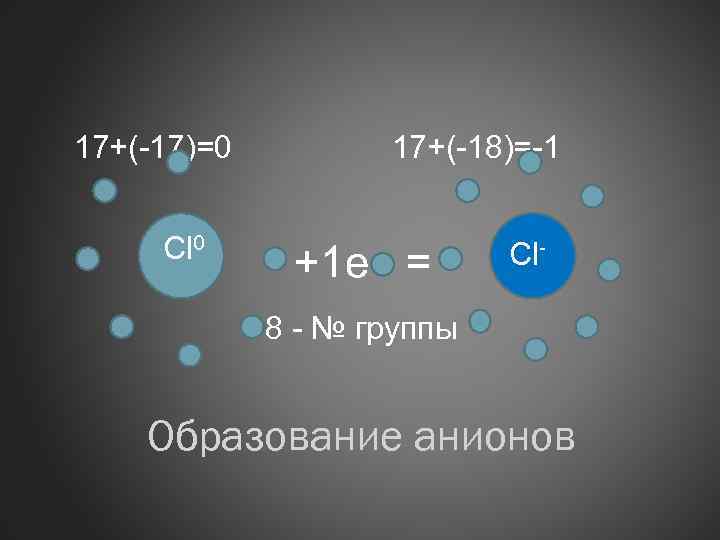 17+(-17)=0 Сl 0 17+(-18)=-1 +1 е = Cl- 8 - № группы Образование анионов
17+(-17)=0 Сl 0 17+(-18)=-1 +1 е = Cl- 8 - № группы Образование анионов
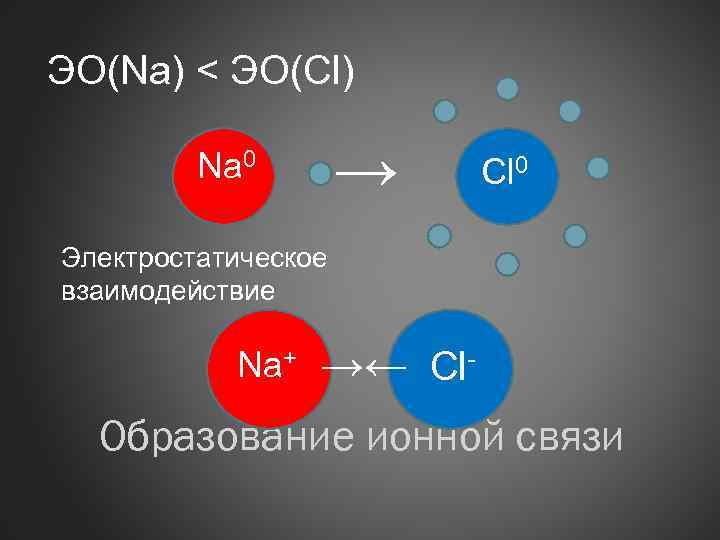 ЭО(Na) < ЭО(Cl) → Na 0 Cl 0 Электростатическое взаимодействие Na+ →← Cl- Образование ионной связи
ЭО(Na) < ЭО(Cl) → Na 0 Cl 0 Электростатическое взаимодействие Na+ →← Cl- Образование ионной связи
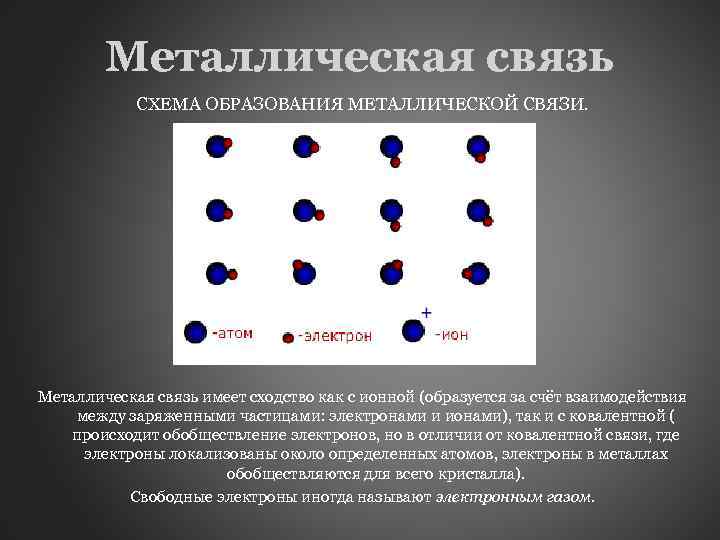 Металлическая связь СХЕМА ОБРАЗОВАНИЯ МЕТАЛЛИЧЕСКОЙ СВЯЗИ. Металлическая связь имеет сходство как с ионной (образуется за счёт взаимодействия между заряженными частицами: электронами и ионами), так и с ковалентной ( происходит обобществление электронов, но в отличии от ковалентной связи, где электроны локализованы около определенных атомов, электроны в металлах обобществляются для всего кристалла). Свободные электроны иногда называют электронным газом.
Металлическая связь СХЕМА ОБРАЗОВАНИЯ МЕТАЛЛИЧЕСКОЙ СВЯЗИ. Металлическая связь имеет сходство как с ионной (образуется за счёт взаимодействия между заряженными частицами: электронами и ионами), так и с ковалентной ( происходит обобществление электронов, но в отличии от ковалентной связи, где электроны локализованы около определенных атомов, электроны в металлах обобществляются для всего кристалла). Свободные электроны иногда называют электронным газом.
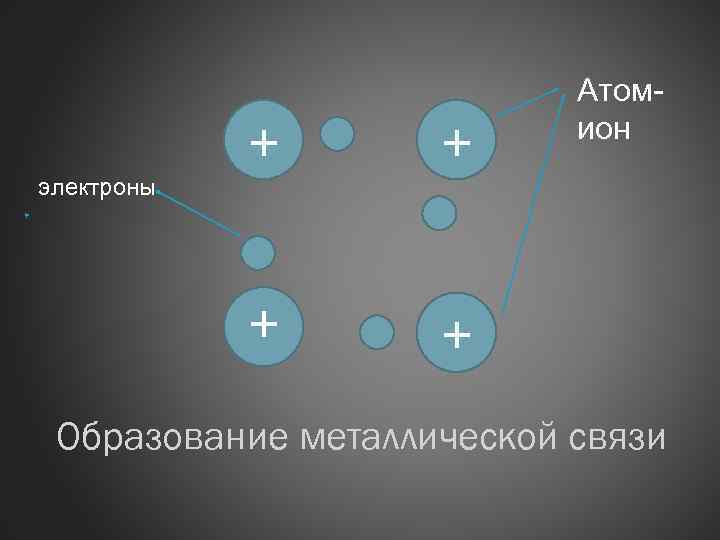 + + + Атомион + электроны Образование металлической связи
+ + + Атомион + электроны Образование металлической связи
 Количество электронов на последнем уровне (номер группы) 0 К – 1 е = 0 – 2 e = Mg 2+ Мg 0 – 3 e = Al 3+ Al ЗАПИСЬ ОБРАЗОВАНИЯ МЕТАЛЛИЧЕСКОЙ СВЯЗИ + К
Количество электронов на последнем уровне (номер группы) 0 К – 1 е = 0 – 2 e = Mg 2+ Мg 0 – 3 e = Al 3+ Al ЗАПИСЬ ОБРАЗОВАНИЯ МЕТАЛЛИЧЕСКОЙ СВЯЗИ + К
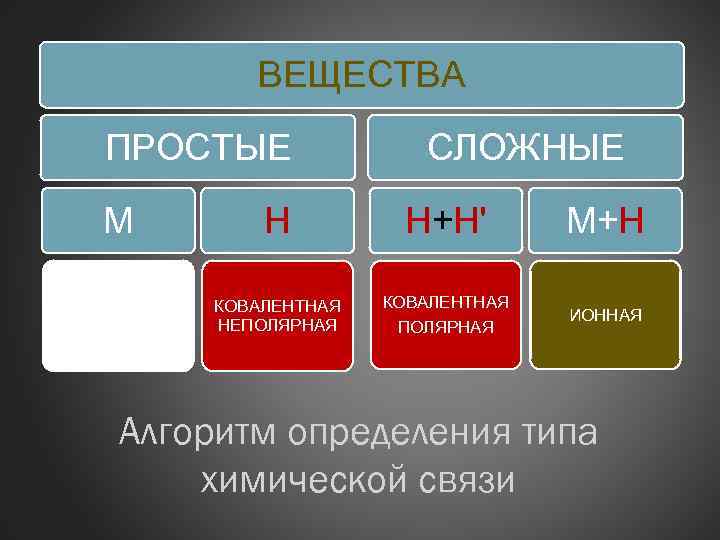 ВЕЩЕСТВА ПРОСТЫЕ СЛОЖНЫЕ М Н Н+Н' М+Н МЕТАЛЛИЧЕСКАЯ КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ КОВАЛЕНТНАЯ ПОЛЯРНАЯ ИОННАЯ Алгоритм определения типа химической связи
ВЕЩЕСТВА ПРОСТЫЕ СЛОЖНЫЕ М Н Н+Н' М+Н МЕТАЛЛИЧЕСКАЯ КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ КОВАЛЕНТНАЯ ПОЛЯРНАЯ ИОННАЯ Алгоритм определения типа химической связи
 © Helen
© Helen


