2.tipi_reaktsii.ppt
- Количество слайдов: 83
 Типы химических реакций 1. Реакции в органической химии 2. Сопряжение. Электронные эффекты заместителей. 3. Кислотность органических соединений (самостоятельно) Лектор: кандидат биологических наук, доцент Мицуля Татьяна Петровна 1
Типы химических реакций 1. Реакции в органической химии 2. Сопряжение. Электронные эффекты заместителей. 3. Кислотность органических соединений (самостоятельно) Лектор: кандидат биологических наук, доцент Мицуля Татьяна Петровна 1
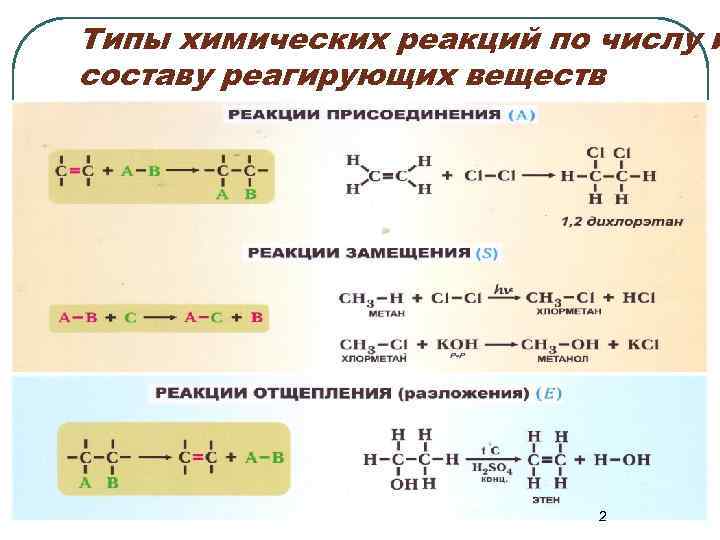 Типы химических реакций по числу и составу реагирующих веществ 2
Типы химических реакций по числу и составу реагирующих веществ 2
 Типы химических реакций по числу и составу реагирующих веществ 3
Типы химических реакций по числу и составу реагирующих веществ 3
 Важнейшие реакции в органической химии 4
Важнейшие реакции в органической химии 4
 Виды органических реакций 5
Виды органических реакций 5
 Виды органических реакций 6
Виды органических реакций 6
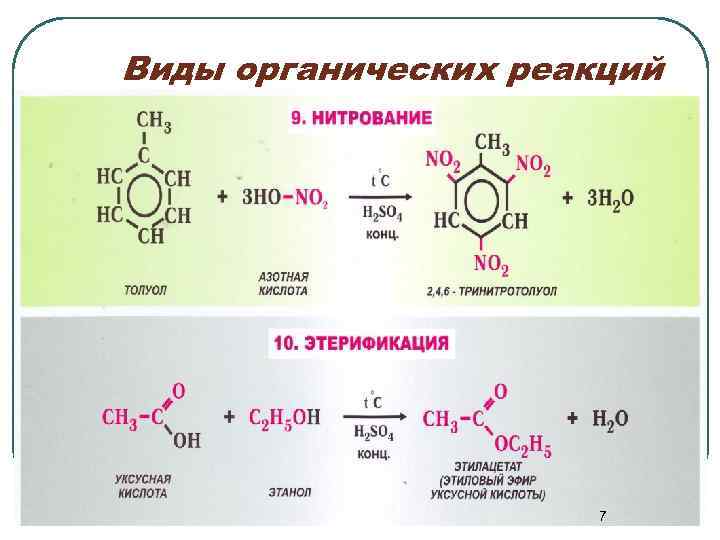 Виды органических реакций 7
Виды органических реакций 7
 Виды органических реакций 8
Виды органических реакций 8
 Виды органических реакций 9
Виды органических реакций 9
 Виды органических реакций 10
Виды органических реакций 10
 2. Сопряжение В молекулах органических соединений возникают различные электронные эффекты, сопровождающиеся перераспределением электронной плотности ковалентных связей. Сопряжение - явление выравнивания связей и зарядов в реальной молекуле по сравнению с идеальной, но несуществующей структурой. 11
2. Сопряжение В молекулах органических соединений возникают различные электронные эффекты, сопровождающиеся перераспределением электронной плотности ковалентных связей. Сопряжение - явление выравнивания связей и зарядов в реальной молекуле по сравнению с идеальной, но несуществующей структурой. 11
 Сопряжёнными называются системы с чередующимися простыми и кратными связями или системы, в которых у атома соседнего с двойной связью есть pорбиталь с неподелённой парой электронов. В сопряженных системах возникает делокализованная связь, молекулярная орбиталь которой охватывает более двух атомов. Сопряжённые системы бывают с открытой и замкнутой цепью сопряжения. 12
Сопряжёнными называются системы с чередующимися простыми и кратными связями или системы, в которых у атома соседнего с двойной связью есть pорбиталь с неподелённой парой электронов. В сопряженных системах возникает делокализованная связь, молекулярная орбиталь которой охватывает более двух атомов. Сопряжённые системы бывают с открытой и замкнутой цепью сопряжения. 12
 Различают 2 основных вида сопряжения: π-π - сопряжение и p-π – сопряжение. π-π – сопряженная система – это система с чередующимися одинарными и кратными связями: CH 2 = CH – CH = CH 2 бутадиен-1, 3 13
Различают 2 основных вида сопряжения: π-π - сопряжение и p-π – сопряжение. π-π – сопряженная система – это система с чередующимися одинарными и кратными связями: CH 2 = CH – CH = CH 2 бутадиен-1, 3 13
 p-π – сопряженная система – это система, в которой рядом с π-связью имеется гетероатом X с неподеленной электронной парой: CH 2 = CH – X: Например: 14
p-π – сопряженная система – это система, в которой рядом с π-связью имеется гетероатом X с неподеленной электронной парой: CH 2 = CH – X: Например: 14
 Сопряженные системы с открытой цепью сопряжения Сопряженная система бутадиен-1, 3 CH 2=CH-CH=CH 2 , -сопряжение Единая 4 -электронная система Гипотетическая структура молекулы 15
Сопряженные системы с открытой цепью сопряжения Сопряженная система бутадиен-1, 3 CH 2=CH-CH=CH 2 , -сопряжение Единая 4 -электронная система Гипотетическая структура молекулы 15
 , -сопряжение в бутадиене Единая 4 -электронная система 16
, -сопряжение в бутадиене Единая 4 -электронная система 16
 В пентадиене-1, 4 -связи находятся слишком далеко друг от друга, поэтому их -орбитали не перекрываются: 17
В пентадиене-1, 4 -связи находятся слишком далеко друг от друга, поэтому их -орбитали не перекрываются: 17
 Система сопряжения может включать и гетероатом (О, N, S). π-π-сопряжение c гетероатомом в цепи осуществляется в карбонильных соединениях, например акролеине: СН 2 = СН - СН= О Цепь сопряжения включает три sp 2 -гибридизированных атома углерода и атом кислорода, каждый из которых вносит в единую 4π-электронную систему по одному рэлектрону. 18
Система сопряжения может включать и гетероатом (О, N, S). π-π-сопряжение c гетероатомом в цепи осуществляется в карбонильных соединениях, например акролеине: СН 2 = СН - СН= О Цепь сопряжения включает три sp 2 -гибридизированных атома углерода и атом кислорода, каждый из которых вносит в единую 4π-электронную систему по одному рэлектрону. 18
 π-π-Сопряжение O H 2 C π-Орбиталь CHCH 19
π-π-Сопряжение O H 2 C π-Орбиталь CHCH 19
 π-π-Сопряжение O H 2 C CHCH 20 π-Орбиталь карбонильной группы
π-π-Сопряжение O H 2 C CHCH 20 π-Орбиталь карбонильной группы
 π-π-Сопряжение O H 2 C CHCH 21 Единая 4 π-электронная система
π-π-Сопряжение O H 2 C CHCH 21 Единая 4 π-электронная система
 p-π-сопряжение реализуется в молекуле дивинилового эфира. . . H 2 C = CH – O – CH = CH 2 Электронная пара атома кислорода участвует в образовании единого 6πэлектронного облака с четырьмя рэлектронами атомов углерода. 22
p-π-сопряжение реализуется в молекуле дивинилового эфира. . . H 2 C = CH – O – CH = CH 2 Электронная пара атома кислорода участвует в образовании единого 6πэлектронного облака с четырьмя рэлектронами атомов углерода. 22
 p-π-Сопряжение в производных карбонильных соединений π-Орбиталь карбонильной группы 23
p-π-Сопряжение в производных карбонильных соединений π-Орбиталь карбонильной группы 23
 p-π-Сопряжение p-Орбиталь гетероатома X с неподеленной электронной парой 24
p-π-Сопряжение p-Орбиталь гетероатома X с неподеленной электронной парой 24
 p-π-Сопряжение Единая 4π-электронная система 25
p-π-Сопряжение Единая 4π-электронная система 25
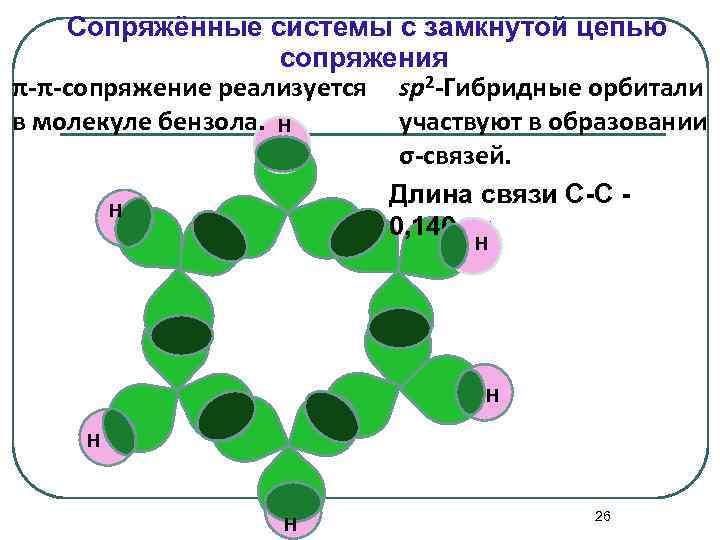 Сопряжённые системы с замкнутой цепью сопряжения π-π-сопряжение реализуется sp 2 -Гибридные орбитали в молекуле бензола. Н участвуют в образовании σ-связей. Длина связи С-С Н 0, 140 нм Н Н 26
Сопряжённые системы с замкнутой цепью сопряжения π-π-сопряжение реализуется sp 2 -Гибридные орбитали в молекуле бензола. Н участвуют в образовании σ-связей. Длина связи С-С Н 0, 140 нм Н Н 26
 Шесть негибридных орбиталей перекрываются с образованием общего -электронного облака: перекрывающиеся p-электроны единая 6 -электронная система 27
Шесть негибридных орбиталей перекрываются с образованием общего -электронного облака: перекрывающиеся p-электроны единая 6 -электронная система 27
 Строение молекулы бензола 28
Строение молекулы бензола 28
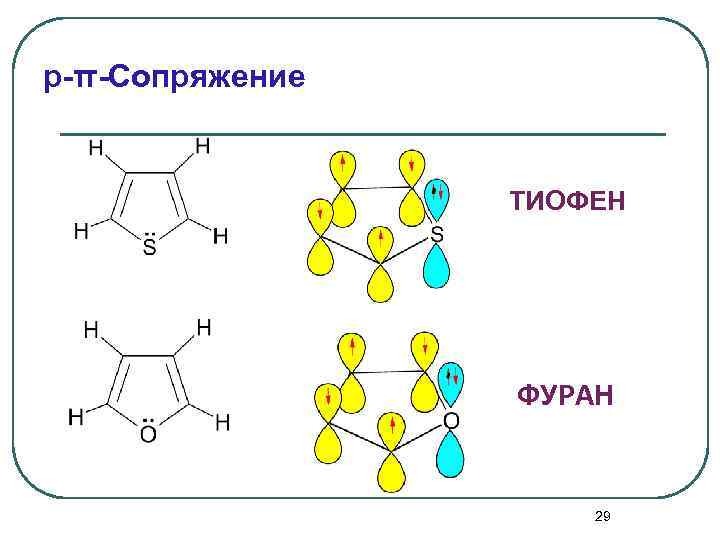 p-π-Сопряжение ТИОФЕН ФУРАН 29
p-π-Сопряжение ТИОФЕН ФУРАН 29
 p-π-Сопряжение ПУРИН 30
p-π-Сопряжение ПУРИН 30
 Ароматическими называют циклические соединения, имеющие замкнутую сопряженную систему, единое π-электронное облако в которых делокализовано на всех атомах цикла. 31
Ароматическими называют циклические соединения, имеющие замкнутую сопряженную систему, единое π-электронное облако в которых делокализовано на всех атомах цикла. 31
 Ароматичность Бензол С 6 Н 6 является ароматическим соединением, т. к. отвечает критериям ароматичности. Хюккель Эрих Хюккель 1896 -1980 32
Ароматичность Бензол С 6 Н 6 является ароматическим соединением, т. к. отвечает критериям ароматичности. Хюккель Эрих Хюккель 1896 -1980 32
 Критерии ароматичности 1. Молекула имеет циклическое строение. 2. Все атомы цикла находятся в состоянии sp 2 -гибридизации, образуя плоский σ-скелет молекулы, перпендикулярно к которому располагаются р-орбитали атомов. 3. Существует единая π-электронная система, охватывающая все атомы цикла и содержащая по правилу Хюккеля (4 n+2) - π электрона = 6 π е-, где n-натуральный ряд чисел 33
Критерии ароматичности 1. Молекула имеет циклическое строение. 2. Все атомы цикла находятся в состоянии sp 2 -гибридизации, образуя плоский σ-скелет молекулы, перпендикулярно к которому располагаются р-орбитали атомов. 3. Существует единая π-электронная система, охватывающая все атомы цикла и содержащая по правилу Хюккеля (4 n+2) - π электрона = 6 π е-, где n-натуральный ряд чисел 33
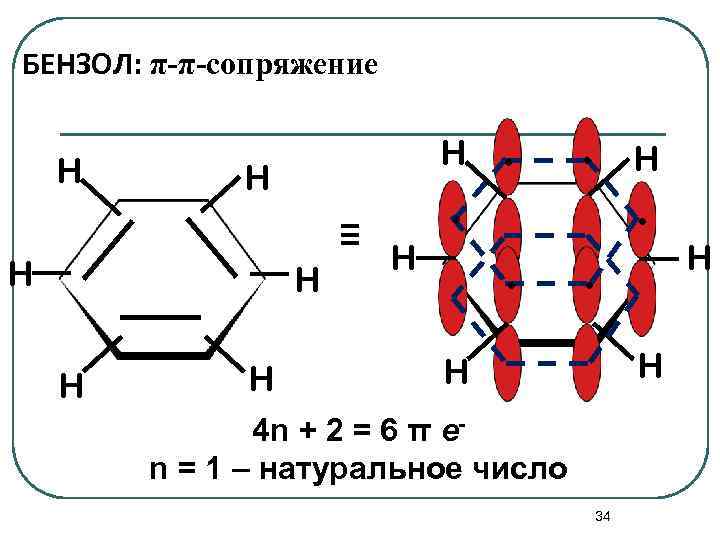 БЕНЗОЛ: π-π-сопряжение H H H H ≡ . . H . H H 4 n + 2 = 6 π еn = 1 – натуральное число 34
БЕНЗОЛ: π-π-сопряжение H H H H ≡ . . H . H H 4 n + 2 = 6 π еn = 1 – натуральное число 34
 Нафталин С 10 Н 8 4 n+2 = 10 n=2 35
Нафталин С 10 Н 8 4 n+2 = 10 n=2 35
 ПИРИДИН 36
ПИРИДИН 36
 Пиридин отвечает критериям ароматичности: 1. Молекула имеет циклическое строение. 2. Все атомы цикла находятся в состоянии sp 2 гибридизации, образуя плоский σ-скелет молекулы, перпендикулярно к которому располагаются р-орбитали атомов. 3. Существует единая π-электронная система, охватывающая все атомы цикла и содержащая по правилу Хюккеля (4 n+2) - π электрона=6 πе 37
Пиридин отвечает критериям ароматичности: 1. Молекула имеет циклическое строение. 2. Все атомы цикла находятся в состоянии sp 2 гибридизации, образуя плоский σ-скелет молекулы, перпендикулярно к которому располагаются р-орбитали атомов. 3. Существует единая π-электронная система, охватывающая все атомы цикла и содержащая по правилу Хюккеля (4 n+2) - π электрона=6 πе 37
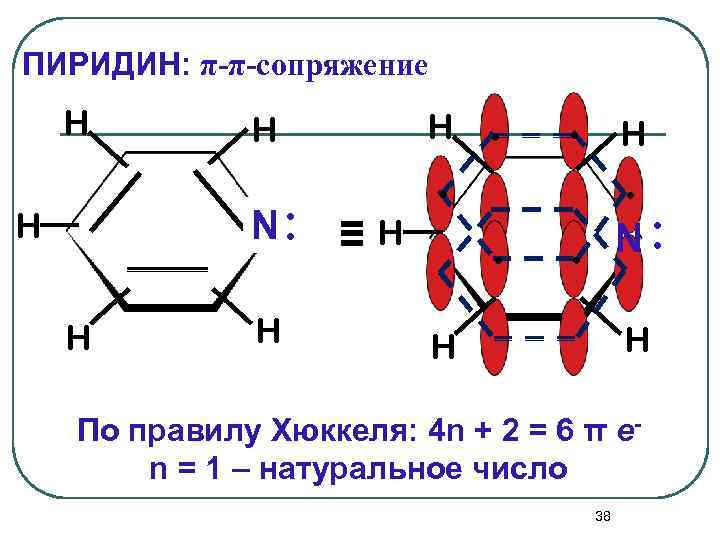 ПИРИДИН: π-π-сопряжение H N: H H H . ≡H . . N: . H H По правилу Хюккеля: 4 n + 2 = 6 π еn = 1 – натуральное число 38
ПИРИДИН: π-π-сопряжение H N: H H H . ≡H . . N: . H H По правилу Хюккеля: 4 n + 2 = 6 π еn = 1 – натуральное число 38
 Атом азота поставляет в сопряженную цепь один электрон и сохраняет пару электронов вне сопряженной цепи. За счет этой электронной пары пиридин проявляет свойства органического основания-протолита, т. к. способен присоединять протон по донорно-акцепторному механизму с образованием пиридиний-катиона. 39
Атом азота поставляет в сопряженную цепь один электрон и сохраняет пару электронов вне сопряженной цепи. За счет этой электронной пары пиридин проявляет свойства органического основания-протолита, т. к. способен присоединять протон по донорно-акцепторному механизму с образованием пиридиний-катиона. 39
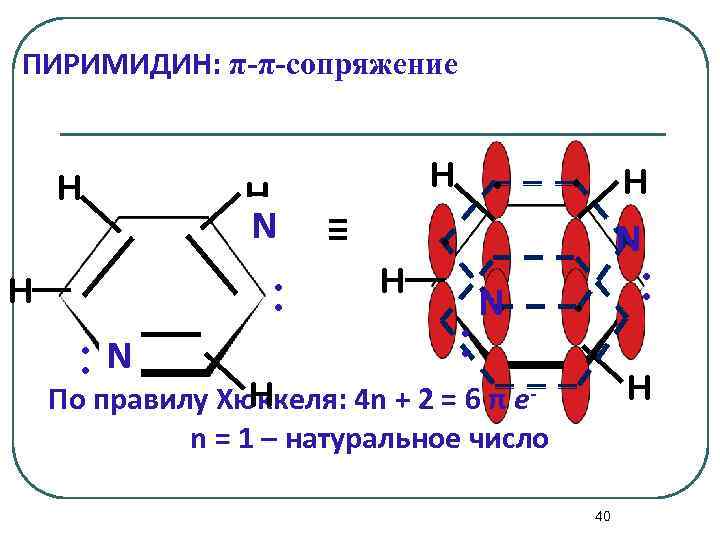 ПИРИМИДИН: π-π-сопряжение H H N : H : N . H . ≡ . N H : . N : . H H По правилу Хюккеля: 4 n + 2 = 6 π еn = 1 – натуральное число 40
ПИРИМИДИН: π-π-сопряжение H H N : H : N . H . ≡ . N H : . N : . H H По правилу Хюккеля: 4 n + 2 = 6 π еn = 1 – натуральное число 40
 ПИРРОЛ - p-π-сопряжение ≡ По правилу Хюккеля: 4 n + 2 = 6 π еn = 1 – натуральное число 41
ПИРРОЛ - p-π-сопряжение ≡ По правилу Хюккеля: 4 n + 2 = 6 π еn = 1 – натуральное число 41
 2. Электронные эффекты Взаимное влияние атомов в молекуле заместителей может осуществляться по системе δсвязей (индуктивный эффект), по системе -связей (мезомерный эффект). 42
2. Электронные эффекты Взаимное влияние атомов в молекуле заместителей может осуществляться по системе δсвязей (индуктивный эффект), по системе -связей (мезомерный эффект). 42
 Индуктивный эффект (I-эффект) – смещение электронной плотности по цепи δ-связей, которое обусловлено различиями в электроотрицательностях атомов: 43
Индуктивный эффект (I-эффект) – смещение электронной плотности по цепи δ-связей, которое обусловлено различиями в электроотрицательностях атомов: 43
 Индуктивный эффект обозначают буквой I и графически изображают стрелкой, остриё которой направлено в сторону более ЭО элемента. Действие индуктивного эффекта наиболее сильно проявляется на двух ближайших атомах углерода, а через 3 -4 связи он затухает. 44
Индуктивный эффект обозначают буквой I и графически изображают стрелкой, остриё которой направлено в сторону более ЭО элемента. Действие индуктивного эффекта наиболее сильно проявляется на двух ближайших атомах углерода, а через 3 -4 связи он затухает. 44
 –I эффект проявляют заместители, которые содержат атомы с большей ЭО, чем у углерода: -F, -Cl, -Br, -OH, -NH 2, NO 2, >C=O, -COOH и др. Это электроноакцепторные заместители (ЭА). Они снижают электронную плотность в углеродной цепи. 45
–I эффект проявляют заместители, которые содержат атомы с большей ЭО, чем у углерода: -F, -Cl, -Br, -OH, -NH 2, NO 2, >C=O, -COOH и др. Это электроноакцепторные заместители (ЭА). Они снижают электронную плотность в углеродной цепи. 45
 +I эффект проявляют заместители, содержащие атомы с низкой электроотрицательностью: металлы (Mg, -Li); насыщенные углеводородные радикалы (-CH 3, -C 2 H 5) и т. п. Это электронодонорные (ЭД) заместители, например, радикалы метил и этил, металлы натрий, калий и др. 46
+I эффект проявляют заместители, содержащие атомы с низкой электроотрицательностью: металлы (Mg, -Li); насыщенные углеводородные радикалы (-CH 3, -C 2 H 5) и т. п. Это электронодонорные (ЭД) заместители, например, радикалы метил и этил, металлы натрий, калий и др. 46
 Мезомерный эффект – смещение электронной плотности по цепи сопряженных -связей. Возникает только при наличии сопряжения связей. Действие мезомерного эффекта заместителей проявляется как в открытых, так и замкнутых системах. 47
Мезомерный эффект – смещение электронной плотности по цепи сопряженных -связей. Возникает только при наличии сопряжения связей. Действие мезомерного эффекта заместителей проявляется как в открытых, так и замкнутых системах. 47
 - М-эффект проявляют заместители, понижающие электронную плотность в сопряженной системе. Заместители содержат кратные связи: -CHO, -COOH, NO 2, -SO 3 H, -CN). Это электроноакцепторные (ЭА) заместители. 48
- М-эффект проявляют заместители, понижающие электронную плотность в сопряженной системе. Заместители содержат кратные связи: -CHO, -COOH, NO 2, -SO 3 H, -CN). Это электроноакцепторные (ЭА) заместители. 48
 +М-эффектом обладают заместители, повышающие электронную плотность в сопряженной системе. К ним относятся -OH, -NH 2, -OCH 3, -O-, -F, -Cl, -Br, -I и др. Это электронодонорные заместители (ЭД). 49
+М-эффектом обладают заместители, повышающие электронную плотность в сопряженной системе. К ним относятся -OH, -NH 2, -OCH 3, -O-, -F, -Cl, -Br, -I и др. Это электронодонорные заместители (ЭД). 49
 В молекулах органических соединений индуктивный и мезомерный эффекты заместителей, действуют одновременно. 50
В молекулах органических соединений индуктивный и мезомерный эффекты заместителей, действуют одновременно. 50
 Если мезомерный и индуктивный эффекты имеют разные знаки, то мезомерный эффект в основном значительно преобладает над индуктивным эффектом. (+M >> -I) -ОН : электронодонорный заместитель -NH 2: электронодонорный заместитель 51
Если мезомерный и индуктивный эффекты имеют разные знаки, то мезомерный эффект в основном значительно преобладает над индуктивным эффектом. (+M >> -I) -ОН : электронодонорный заместитель -NH 2: электронодонорный заместитель 51
 -СООН, -СНО: электроноакцепторный заместитель 52
-СООН, -СНО: электроноакцепторный заместитель 52
 Таким образом, учитывая перераспределение электронной плотности в молекулах органических 53 соединений, в том числе биологически
Таким образом, учитывая перераспределение электронной плотности в молекулах органических 53 соединений, в том числе биологически
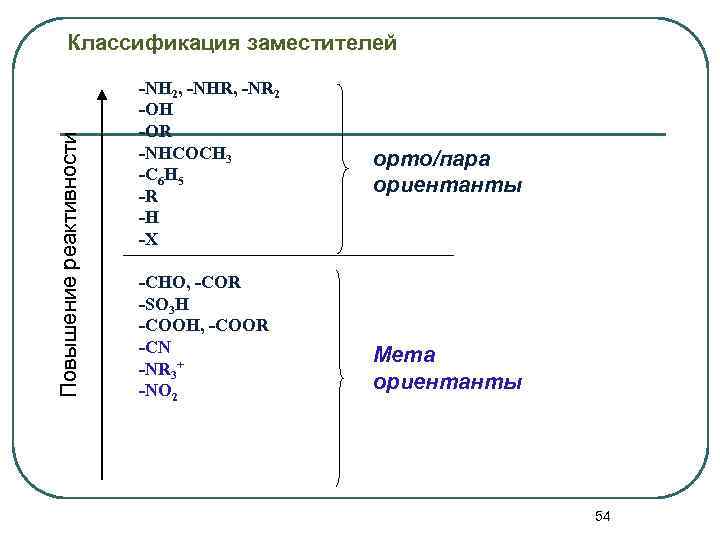 Повышение реактивности Классификация заместителей -NH 2, -NHR, -NR 2 -OH -OR -NHCOCH 3 -C 6 H 5 -R -H -X -CHO, -COR -SO 3 H -COOH, -COOR -CN -NR 3+ -NO 2 орто/пара ориентанты Мета ориентанты 54
Повышение реактивности Классификация заместителей -NH 2, -NHR, -NR 2 -OH -OR -NHCOCH 3 -C 6 H 5 -R -H -X -CHO, -COR -SO 3 H -COOH, -COOR -CN -NR 3+ -NO 2 орто/пара ориентанты Мета ориентанты 54
 Электронные эффекты заместителей 55
Электронные эффекты заместителей 55
 Спасибо за внимание! 56
Спасибо за внимание! 56
 3. Кислотность органических соединений Кислотно-основные свойства органических веществ рассматривают, основываясь на положениях протонной теории кислот и оснований (Бренстед. Лоури, 1913 г. ). 57
3. Кислотность органических соединений Кислотно-основные свойства органических веществ рассматривают, основываясь на положениях протонной теории кислот и оснований (Бренстед. Лоури, 1913 г. ). 57
 Основные положения теории: 1. Кислота – частица (молекула или ион), отдающая протон в данной реакции, т. е. донор H+. 58
Основные положения теории: 1. Кислота – частица (молекула или ион), отдающая протон в данной реакции, т. е. донор H+. 58
 2. Основание – частица (молекула или ион), присоединяющая протон в данной реакии, т. е. акцептор H+. 59
2. Основание – частица (молекула или ион), присоединяющая протон в данной реакии, т. е. акцептор H+. 59
 Протолитическая теория кислот и оснований Основание – частица (молекула или ион), присоединяющая протон в данной реакии, т. е. акцептор H+. 60
Протолитическая теория кислот и оснований Основание – частица (молекула или ион), присоединяющая протон в данной реакии, т. е. акцептор H+. 60
 3. Кислота и основание связаны в сопряженную пару протолитов, частицы которой отличаются по составу на один передаваемый протон (H+): кислота основание + Например: Н+ кислота основание сопряжённое основание сопряжённая кислота 61
3. Кислота и основание связаны в сопряженную пару протолитов, частицы которой отличаются по составу на один передаваемый протон (H+): кислота основание + Например: Н+ кислота основание сопряжённое основание сопряжённая кислота 61
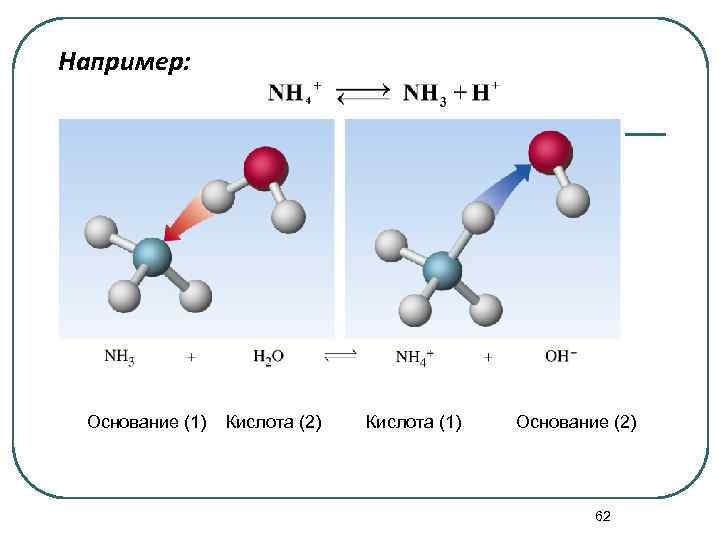 Например: Основание (1) Кислота (2) Кислота (1) Основание (2) 62
Например: Основание (1) Кислота (2) Кислота (1) Основание (2) 62
 4. Сильной сопряженной кислоте соответствует слабое сопряженной основание и наоборот: сильная к-та слабое осн-е сильное основание 63
4. Сильной сопряженной кислоте соответствует слабое сопряженной основание и наоборот: сильная к-та слабое осн-е сильное основание 63
 Протолитическая теория кислот и оснований. 5. Кислоты-протолиты делят на 3 класса: А) нейтральные В) катионные С) анионные 64
Протолитическая теория кислот и оснований. 5. Кислоты-протолиты делят на 3 класса: А) нейтральные В) катионные С) анионные 64
 Основания-протолиты также делятся на 3 класса: A) Нейтральные NH 3 + Н+ B) Катионные Fe. OH+ C) Анионные СН 3 СОО- + Н+ NH 4+ Сl-, CH 3 COOСН 3 СООН 65
Основания-протолиты также делятся на 3 класса: A) Нейтральные NH 3 + Н+ B) Катионные Fe. OH+ C) Анионные СН 3 СОО- + Н+ NH 4+ Сl-, CH 3 COOСН 3 СООН 65
 6. Амфолиты – протолиты, способные как принимать, так и отдавать протоны: Кислота Основание Кислота Кис лота Осно вание Сопряж. осн-е Сопряж. К-та 66
6. Амфолиты – протолиты, способные как принимать, так и отдавать протоны: Кислота Основание Кислота Кис лота Осно вание Сопряж. осн-е Сопряж. К-та 66
 7. Количественно сила кислотпротолитов оценивается величиной константы кислотности (Ка). Ка характеризует момент химического равновесия в процессе переноса протона и определяется на основании закона действующих масс. 67
7. Количественно сила кислотпротолитов оценивается величиной константы кислотности (Ка). Ка характеризует момент химического равновесия в процессе переноса протона и определяется на основании закона действующих масс. 67
 Пример: 68
Пример: 68
 Таким образом, чем выше концентрация сопряженных частиц продуктов протонного переноса, тем больше значение Ка, а значит тем сильнее кислота-протолит. 69
Таким образом, чем выше концентрация сопряженных частиц продуктов протонного переноса, тем больше значение Ка, а значит тем сильнее кислота-протолит. 69
 На практике используют показатель константы кислотности (p. Ka): Чем меньше значение p. Ka, тем сильнее кислота. 70
На практике используют показатель константы кислотности (p. Ka): Чем меньше значение p. Ka, тем сильнее кислота. 70
 Кислотным центром называется элемент (С, S, O, N) и связанный с ним атом водорода. Органические кислоты соответственно классифицируются по кислотному центру на О-Н; S-H; N-H; C-H кислоты. 71
Кислотным центром называется элемент (С, S, O, N) и связанный с ним атом водорода. Органические кислоты соответственно классифицируются по кислотному центру на О-Н; S-H; N-H; C-H кислоты. 71
 Формулы и названия веществ р. Ка 18 10, 5 30 9, 9 С 2 Н 5 ОН С 2 Н 5 SH С 2 Н 5 NH 2 С 6 Н 5 ОН этанол этантиол этанамин фенол Чем больше значение р. Ка, тем слабее кислота. 72
Формулы и названия веществ р. Ка 18 10, 5 30 9, 9 С 2 Н 5 ОН С 2 Н 5 SH С 2 Н 5 NH 2 С 6 Н 5 ОН этанол этантиол этанамин фенол Чем больше значение р. Ка, тем слабее кислота. 72
 На стабильность аниона оказывают влияние следующие факторы: 1. Природа элемента в кислотном центре. а) электроотрицательность элемента Сравним кислотные свойства веществ с одинаковыми радикалами: СН 3–СН 2 –ОН (р. Ка=18) СН 3–СН 2 –NH 2 (р. Ка=30). 73
На стабильность аниона оказывают влияние следующие факторы: 1. Природа элемента в кислотном центре. а) электроотрицательность элемента Сравним кислотные свойства веществ с одинаковыми радикалами: СН 3–СН 2 –ОН (р. Ка=18) СН 3–СН 2 –NH 2 (р. Ка=30). 73
 кислород более электроотрицательный элемент связь О-Н более полярна, чем N-H, что способствует более легкой отщепляемости в О-Н кислотном центре по сравнению с N-H центром. Амины более слабые кислоты, чем спирты. 74
кислород более электроотрицательный элемент связь О-Н более полярна, чем N-H, что способствует более легкой отщепляемости в О-Н кислотном центре по сравнению с N-H центром. Амины более слабые кислоты, чем спирты. 74
 б) поляризуемость элемента в кислотном центре. Сравним кислотные свойства веществ с одинаковыми радикалами: СН 3–СН 2 –ОН (р. Ка=18) СН 3–СН 2 –SH (р. Ка=10, 5). 75
б) поляризуемость элемента в кислотном центре. Сравним кислотные свойства веществ с одинаковыми радикалами: СН 3–СН 2 –ОН (р. Ка=18) СН 3–СН 2 –SH (р. Ка=10, 5). 75
 Благодаря большему радиусу и более высокой поляризуемости атома серы, отрицательный заряд в анионе СН 3–СН 2–S- (меркаптид-ион) делокализован в большем объёме, чем в алкоксид-ионе СН 3–СН 2–О-. Это обусловливает более высокую стабильность меркаптид-иона по сравнению с алкоксид-ионом. Этантиол является более сильной кислотой, чем этанол. 76
Благодаря большему радиусу и более высокой поляризуемости атома серы, отрицательный заряд в анионе СН 3–СН 2–S- (меркаптид-ион) делокализован в большем объёме, чем в алкоксид-ионе СН 3–СН 2–О-. Это обусловливает более высокую стабильность меркаптид-иона по сравнению с алкоксид-ионом. Этантиол является более сильной кислотой, чем этанол. 76
 2. Влияние сопряжения на стабильность аниона. Пример: Этанол СН 3–СН 2–ОН Фенол С 6 Н 5 –ОН р. Ка=18 р. Ка=9, 9 77
2. Влияние сопряжения на стабильность аниона. Пример: Этанол СН 3–СН 2–ОН Фенол С 6 Н 5 –ОН р. Ка=18 р. Ка=9, 9 77
 В молекуле фенола под влиянием ЭД-заместителя электронная плотность смещена от заместителя и делокализована по ароматическому кольцу. Образующийся при отщеплении иона Н+ феноксид-ион С 6 Н 5–О- , является р, -сопряжённой системой и обладает высокой стабильностью. 78
В молекуле фенола под влиянием ЭД-заместителя электронная плотность смещена от заместителя и делокализована по ароматическому кольцу. Образующийся при отщеплении иона Н+ феноксид-ион С 6 Н 5–О- , является р, -сопряжённой системой и обладает высокой стабильностью. 78
 Фенол проявляет более выраженные кислотные свойства, чем одноатомные спирты. 79
Фенол проявляет более выраженные кислотные свойства, чем одноатомные спирты. 79
 3. Влияние заместителей на стабильность аниона. СН 3–СН 2–СООН пропановая к-та СН 3–СН (ОН)–СООН 2 -оксипропановая к-та р. Ка=4, 9 р. Ка=3, 83 80
3. Влияние заместителей на стабильность аниона. СН 3–СН 2–СООН пропановая к-та СН 3–СН (ОН)–СООН 2 -оксипропановая к-та р. Ка=4, 9 р. Ка=3, 83 80
 Наличие в радикале кислоты ЭА заместителя –ОН-группы способствует делокализации отрицательного заряда в лактатанионе, что повышает его стабильность по сравнению с пропионат-анионом. ЭА-заместители усиливают кислотность, а ЭД - снижают. 81
Наличие в радикале кислоты ЭА заместителя –ОН-группы способствует делокализации отрицательного заряда в лактатанионе, что повышает его стабильность по сравнению с пропионат-анионом. ЭА-заместители усиливают кислотность, а ЭД - снижают. 81
 4. Влияние растворителя на стабильность аниона. Чем меньше радикал аниона, тем он более гидратирован и стабилен. Муравьиная кислота р. Ка=3, 7 Уксусная кислота р. Ка=4, 76 Пропионовая кислота р. Ка=4, 90 Так как формиат-ион имеет малые размеры, он наиболее гидратирован и стабилен, по сравнению с ацетатионом и пропионат- ионом. l l l 82
4. Влияние растворителя на стабильность аниона. Чем меньше радикал аниона, тем он более гидратирован и стабилен. Муравьиная кислота р. Ка=3, 7 Уксусная кислота р. Ка=4, 76 Пропионовая кислота р. Ка=4, 90 Так как формиат-ион имеет малые размеры, он наиболее гидратирован и стабилен, по сравнению с ацетатионом и пропионат- ионом. l l l 82
 Спасибо за внимание! 83
Спасибо за внимание! 83


