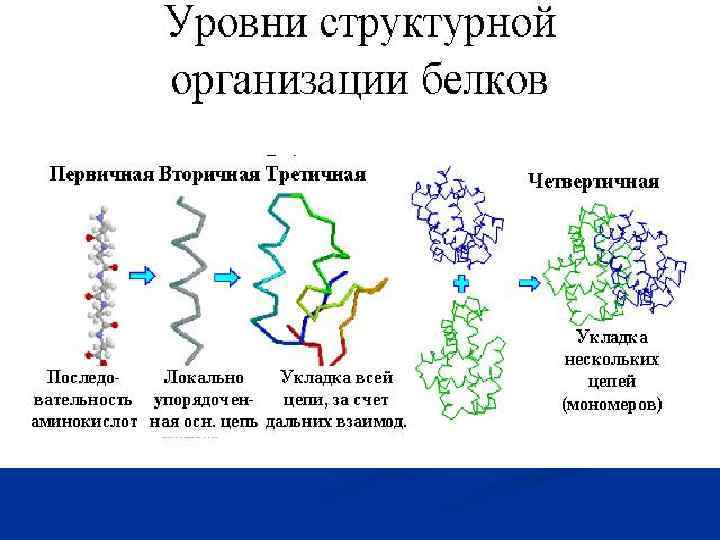
Уровни структурной организации белков.ppt
- Количество слайдов: 10
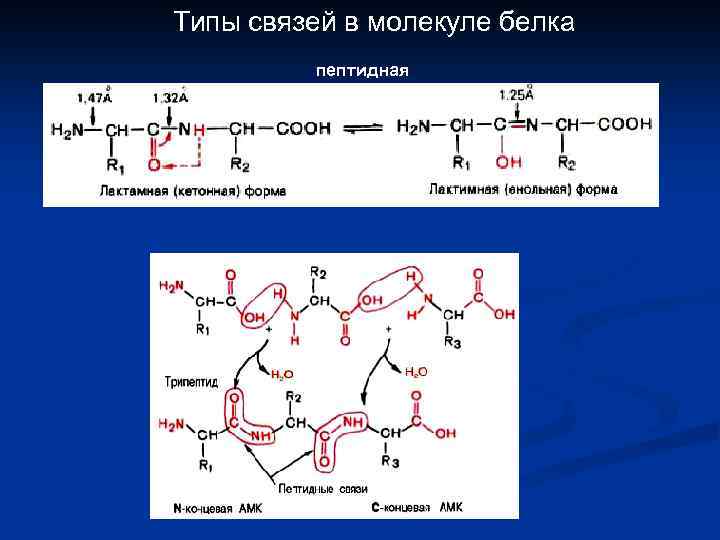
Типы связей в молекуле белка пептидная
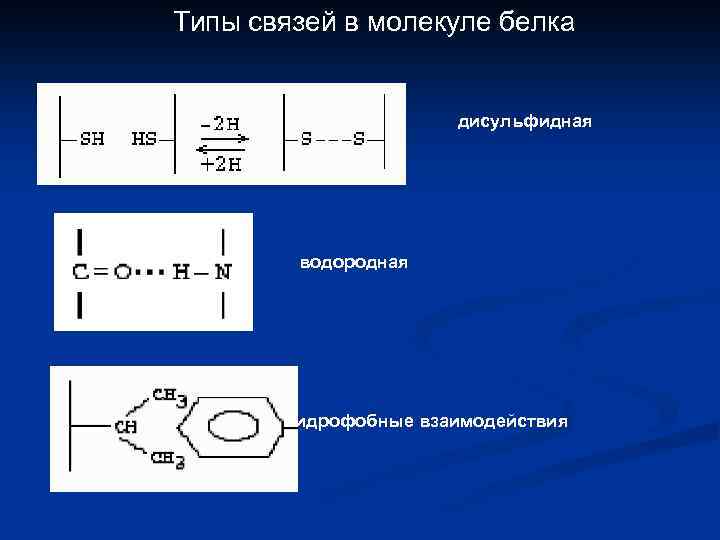
Типы связей в молекуле белка дисульфидная водородная гидрофобные взаимодействия
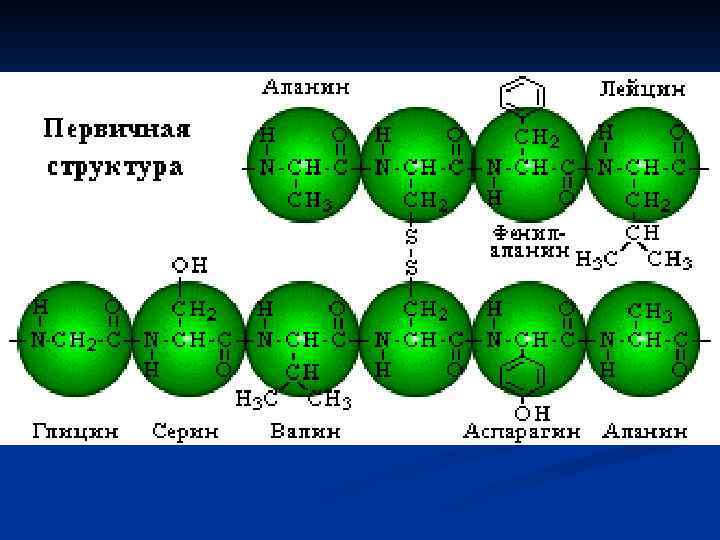
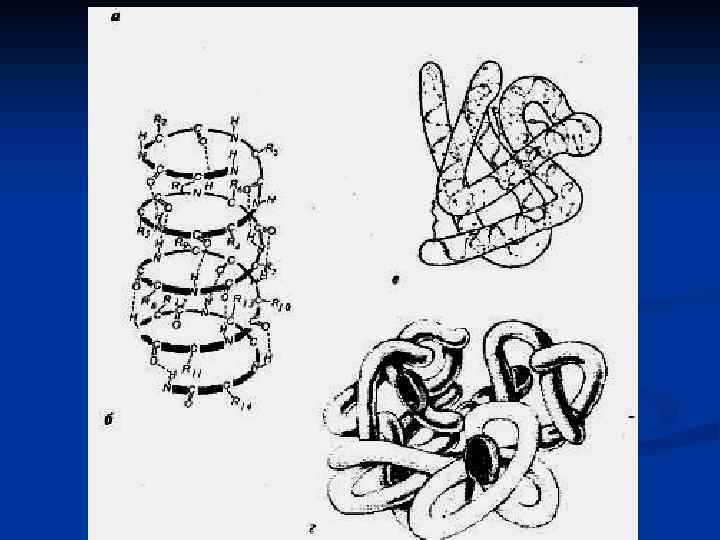
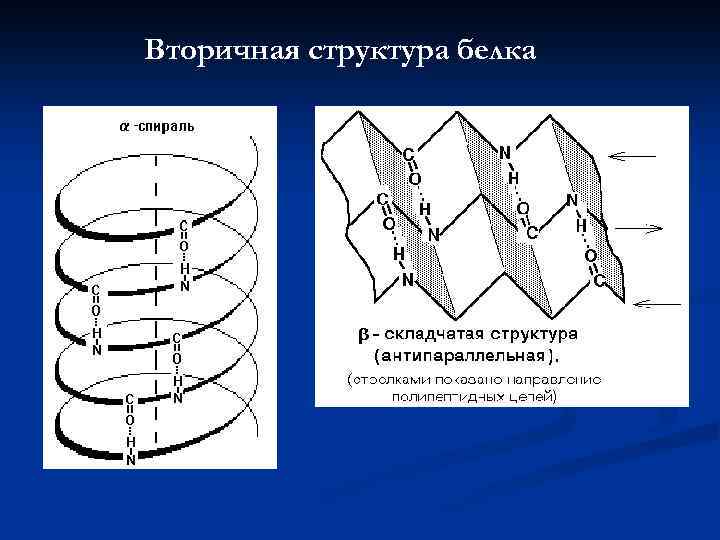
Вторичная структура белка
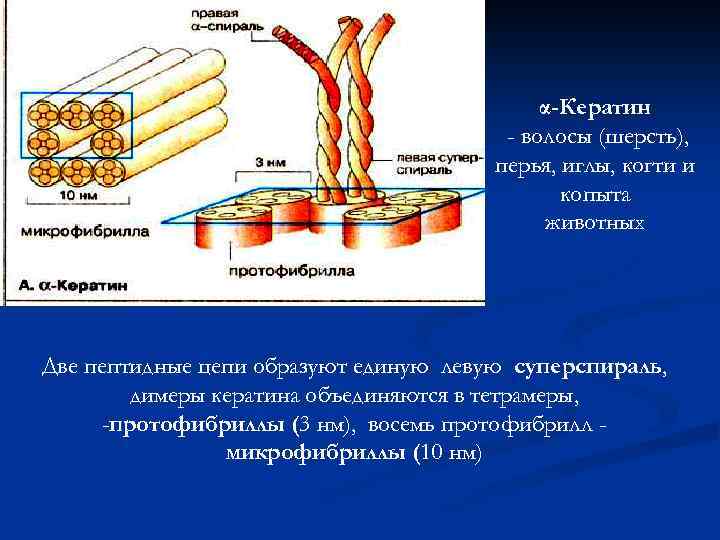
α-Кератин - волосы (шерсть), перья, иглы, когти и копыта животных Две пептидные цепи образуют единую левую суперспираль, димеры кератина объединяются в тетрамеры, -протофибриллы (3 нм), восемь протофибрилл микрофибриллы (10 нм)
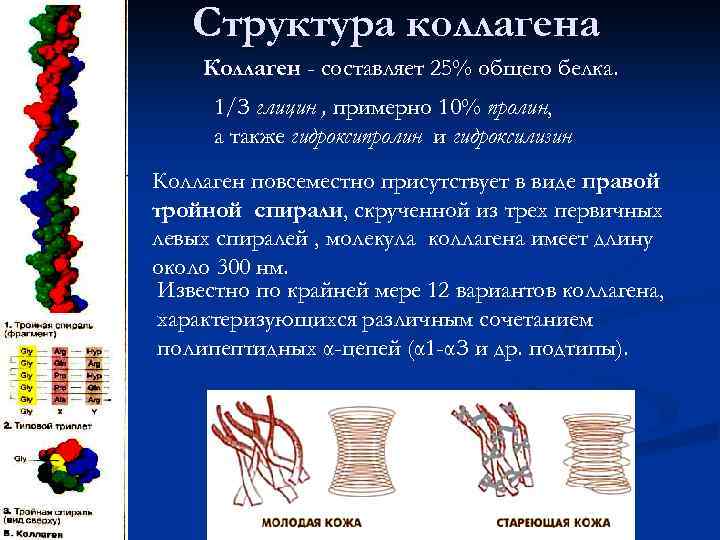
Структура коллагена Коллаген - составляет 25% общего белка. 1/З глицин , примерно 10% пролин, а также гидроксипролин и гидроксилизин Коллаген повсеместно присутствует в виде правой тройной спирали, скрученной из трех первичных левых спиралей , молекула коллагена имеет длину около 300 нм. Известно по крайней мере 12 вариантов коллагена, характеризующихся различным сочетанием полипептидных α-цепей (α 1 -αЗ и др. подтипы).

Ocновной белок шелка, фиброин, обладает структурой антипараллельного складчатого листа Фактически фиброин состоит на 80% из глицина, аланина и серина

Содержание белка в продуктах питания сыр 20 -36% горох 26% мясо 18 -22% рыба 17 -20% яйца 13% гречневая крупа 11% пшено 10% макароны 9 -13% рис 8% ржаной хлеб 7, 8% молоко 3, 5% картофель 1, 5 -2% свекла 1, 6% капуста 1, 1 -1, 6% морковь 0, 8 -1% яблоки 0, 3 -0, 4% :
Уровни структурной организации белков.ppt