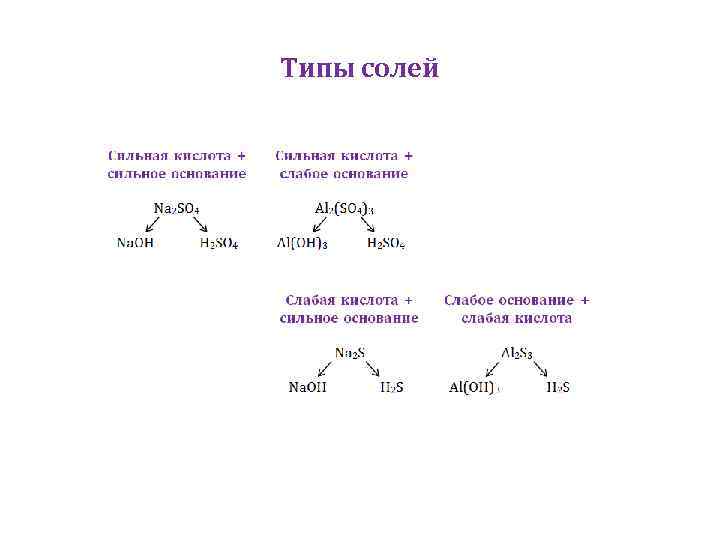
 Типы солей
Типы солей
 Сильные основания Сильные кислоты HCl HBr HI HNO 3 HCl. O 4 HMn. O 4 H 2 SO 4 H 2 Cr. O 4 Правило Полинга Ha. XOb b – a = 0 или 1 – слабая b – a = 2 или 3 – сильная
Сильные основания Сильные кислоты HCl HBr HI HNO 3 HCl. O 4 HMn. O 4 H 2 SO 4 H 2 Cr. O 4 Правило Полинга Ha. XOb b – a = 0 или 1 – слабая b – a = 2 или 3 – сильная
 Сильная кислота + слабое основание: гидролиз по катиону
Сильная кислота + слабое основание: гидролиз по катиону
 Слабая кислота + сильное основание: гидролиз по аниону
Слабая кислота + сильное основание: гидролиз по аниону
 Слабая кислота + слабое основание: гидролиз по аниону и по катиону • Существующие соли • Некоторые «? » и «–» соли
Слабая кислота + слабое основание: гидролиз по аниону и по катиону • Существующие соли • Некоторые «? » и «–» соли
 Ловушки в тестах • «Н» соли не гидролизуются
Ловушки в тестах • «Н» соли не гидролизуются
 Ловушки в тестах • среда растворов кислых солей активных металлов: кислая щелочная HSO 4–, H 2 PO 4– HS –, HCO 3–, HPO 42–…
Ловушки в тестах • среда растворов кислых солей активных металлов: кислая щелочная HSO 4–, H 2 PO 4– HS –, HCO 3–, HPO 42–…
 Распознавание солей
Распознавание солей
 Совместный гидролиз
Совместный гидролиз
 Совместный гидролиз в заданиях ЕГЭ № 32. Оксид железа (III) растворили в соляной кислоте. К полученному раствору добавили карбонат калия. Выпавший осадок отделили и прокалили. Над полученным веществом пропустили водород при нагревании.
Совместный гидролиз в заданиях ЕГЭ № 32. Оксид железа (III) растворили в соляной кислоте. К полученному раствору добавили карбонат калия. Выпавший осадок отделили и прокалили. Над полученным веществом пропустили водород при нагревании.
 Совместный гидролиз в заданиях ЕГЭ № 32. Натрий растворили в воде. Через полученный раствор пропустили недостаток сернистого газа, а затем добавили бромид алюминия. Выпавший осадок отделили и прокалили.
Совместный гидролиз в заданиях ЕГЭ № 32. Натрий растворили в воде. Через полученный раствор пропустили недостаток сернистого газа, а затем добавили бромид алюминия. Выпавший осадок отделили и прокалили.
 Совместный гидролиз в заданиях ЕГЭ
Совместный гидролиз в заданиях ЕГЭ
 Совместный гидролиз в заданиях ЕГЭ
Совместный гидролиз в заданиях ЕГЭ