6. Типы сложных реакций.ppt
- Количество слайдов: 24
 ТИПЫ СЛОЖНЫХ РЕАКЦИЙ
ТИПЫ СЛОЖНЫХ РЕАКЦИЙ
 Параллельные реакции первого порядка Разложение хлората калия при медленном нагревании Кинетическое уравнение записывается с учетом принципа независимости
Параллельные реакции первого порядка Разложение хлората калия при медленном нагревании Кинетическое уравнение записывается с учетом принципа независимости
 Решение этого уравнения записывается так же, как и для одной реакции первого порядка Для параллельных реакций в любой момент времени отношение концентраций продуктов постоянно и определяется константами скорости элементарных стадий Протекает главным образом та реакция, которая требует наименьшей энергии активации
Решение этого уравнения записывается так же, как и для одной реакции первого порядка Для параллельных реакций в любой момент времени отношение концентраций продуктов постоянно и определяется константами скорости элементарных стадий Протекает главным образом та реакция, которая требует наименьшей энергии активации
 Последовательные реакции первого порядка Процесс омыления диэтилоксалата едким натром; этот процесс протекает последовательно в две стадии
Последовательные реакции первого порядка Процесс омыления диэтилоксалата едким натром; этот процесс протекает последовательно в две стадии
 Пусть в начальный момент времени есть только вещество A. Применим к этой системе закон действующих масс и принцип независимости химических реакций:
Пусть в начальный момент времени есть только вещество A. Применим к этой системе закон действующих масс и принцип независимости химических реакций:
![С начальными условиями [A]0 = a, [B]0 = [D]0 = 0. Решение этой системы С начальными условиями [A]0 = a, [B]0 = [D]0 = 0. Решение этой системы](https://present5.com/presentation/146535609_136179900/image-6.jpg) С начальными условиями [A]0 = a, [B]0 = [D]0 = 0. Решение этой системы дает концентрации веществ:
С начальными условиями [A]0 = a, [B]0 = [D]0 = 0. Решение этой системы дает концентрации веществ:
 КИНЕТИЧЕСКИЕ МОДЕЛИ ДЛЯ БИОЛОГИЧЕСКИХ СИСТЕМ
КИНЕТИЧЕСКИЕ МОДЕЛИ ДЛЯ БИОЛОГИЧЕСКИХ СИСТЕМ
 ОСОБЕННОСТИ КИНЕТИКИ БИОЛОГИЧЕСКИХ СИСТЕМ (БС) 1. В БС в качестве переменных выступают не только концентрации, но и любые другие величины. 2. Переменные изменяются не только во времени, но и в пространстве. Скорость определяется не только константами реакции, но и диффузионными процессами. 3. БС пространственно неоднородны. Условия в разных частях системы могут отличаться. 4. БС мультистационарны. Может быть несколько устойчивых режимов функционирования. 5. Процессы в БС нелинейны. 6. Кинетические модели БС крайне сложные. Моделирование требует большого числа упрощений.
ОСОБЕННОСТИ КИНЕТИКИ БИОЛОГИЧЕСКИХ СИСТЕМ (БС) 1. В БС в качестве переменных выступают не только концентрации, но и любые другие величины. 2. Переменные изменяются не только во времени, но и в пространстве. Скорость определяется не только константами реакции, но и диффузионными процессами. 3. БС пространственно неоднородны. Условия в разных частях системы могут отличаться. 4. БС мультистационарны. Может быть несколько устойчивых режимов функционирования. 5. Процессы в БС нелинейны. 6. Кинетические модели БС крайне сложные. Моделирование требует большого числа упрощений.
 Модель Мальтуса. Экспоненциальный рост α — коэффициент прироста x 0 — численность популяции в начальный момент времени.
Модель Мальтуса. Экспоненциальный рост α — коэффициент прироста x 0 — численность популяции в начальный момент времени.
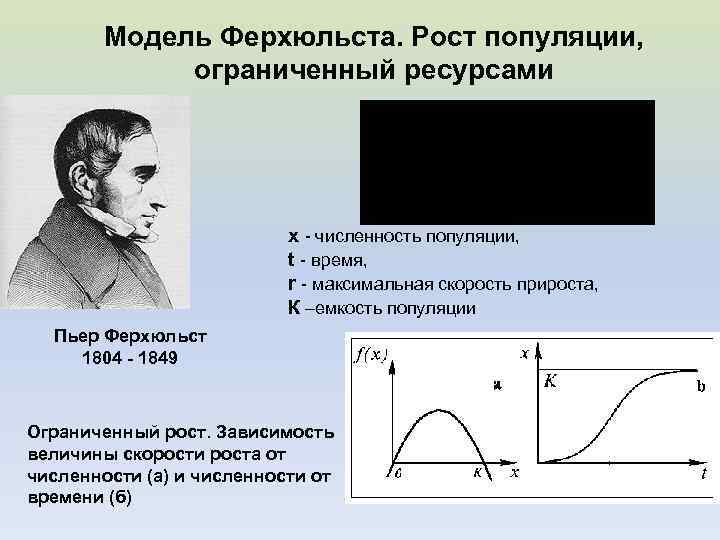 Модель Ферхюльста. Рост популяции, ограниченный ресурсами х - численность популяции, t - время, r - максимальная скорость прироста, К –емкость популяции Пьер Ферхюльст 1804 - 1849 Ограниченный рост. Зависимость величины скорости роста от численности (а) и численности от времени (б)
Модель Ферхюльста. Рост популяции, ограниченный ресурсами х - численность популяции, t - время, r - максимальная скорость прироста, К –емкость популяции Пьер Ферхюльст 1804 - 1849 Ограниченный рост. Зависимость величины скорости роста от численности (а) и численности от времени (б)
 Модель Вольтерры «хищник - жертва» Рост численности жертв Вито Вольтерра 1860 - 1940, Убыль хищников k 1 - характеризует частоту встреч хищников и жертв, k 1/ - коэффициент убыли хищников
Модель Вольтерры «хищник - жертва» Рост численности жертв Вито Вольтерра 1860 - 1940, Убыль хищников k 1 - характеризует частоту встреч хищников и жертв, k 1/ - коэффициент убыли хищников
 Совместное существование жертв и хищников k 1 - характеризует частоту встреч хищников и жертв, k 2 – коэффициент выживаемости жертв при встрече с хищниками k 1/ - коэффициент убыли хищников k 2/ - коэффициент эффективности поедания жертв
Совместное существование жертв и хищников k 1 - характеризует частоту встреч хищников и жертв, k 2 – коэффициент выживаемости жертв при встрече с хищниками k 1/ - коэффициент убыли хищников k 2/ - коэффициент эффективности поедания жертв
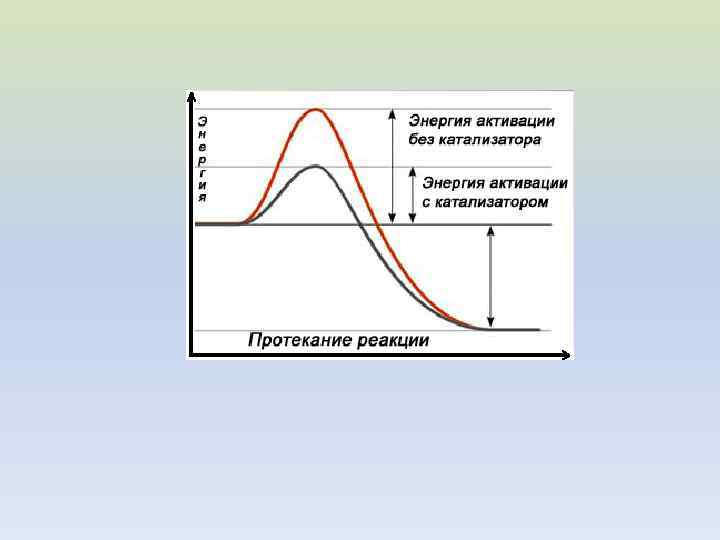
 ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ ЭНЕРГИЯ АКТИВАЦИИ
ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ ЭНЕРГИЯ АКТИВАЦИИ
 Я. Х. Вант-Гофф (1852– 1911)
Я. Х. Вант-Гофф (1852– 1911)
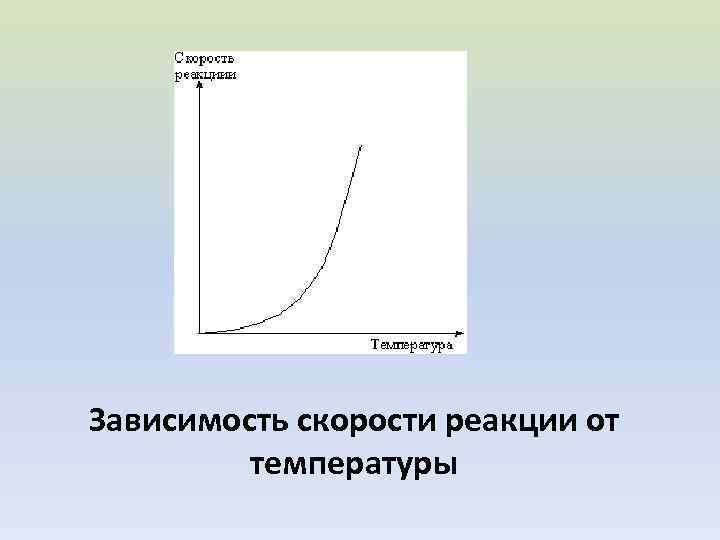 Зависимость скорости реакции от температуры
Зависимость скорости реакции от температуры
 С. А. Аррениус (1859– 1927) Ea - энергия активации
С. А. Аррениус (1859– 1927) Ea - энергия активации
 Зависимость ln k от 1/T.
Зависимость ln k от 1/T.

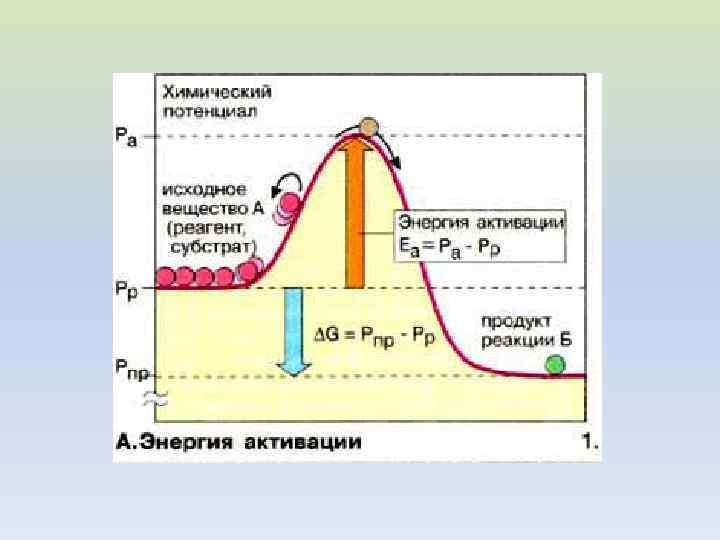
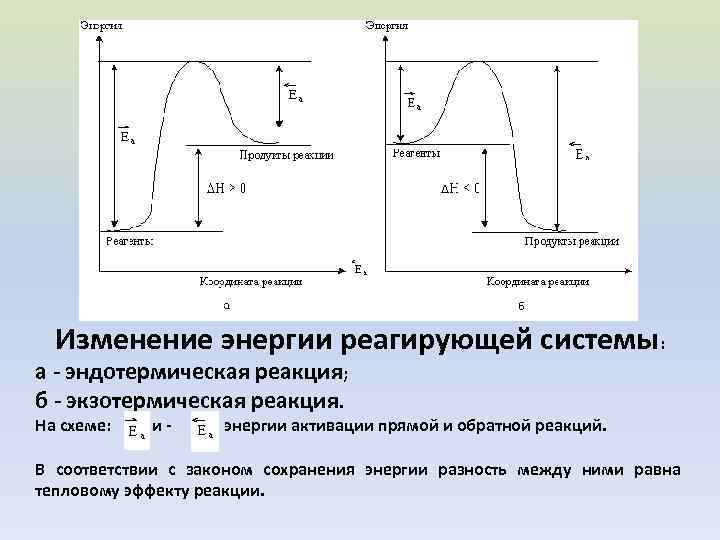 Изменение энергии реагирующей системы: а - эндотермическая реакция; б - экзотермическая реакция. На схеме: и- энергии активации прямой и обратной реакций. В соответствии с законом сохранения энергии разность между ними равна тепловому эффекту реакции.
Изменение энергии реагирующей системы: а - эндотермическая реакция; б - экзотермическая реакция. На схеме: и- энергии активации прямой и обратной реакций. В соответствии с законом сохранения энергии разность между ними равна тепловому эффекту реакции.
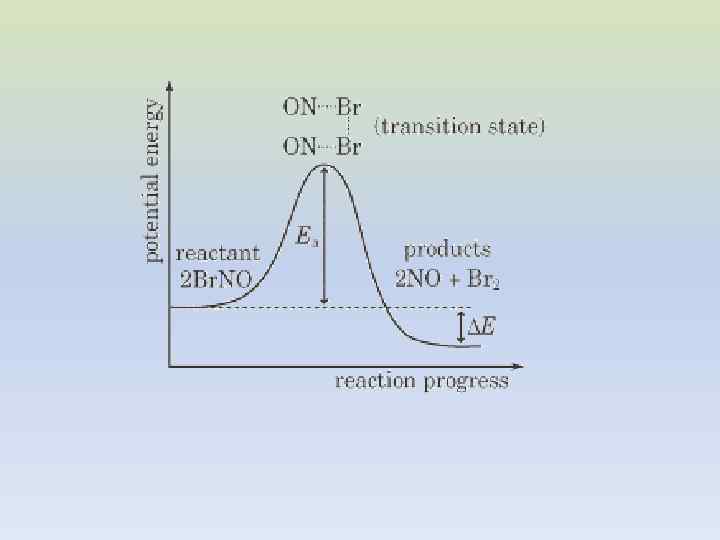
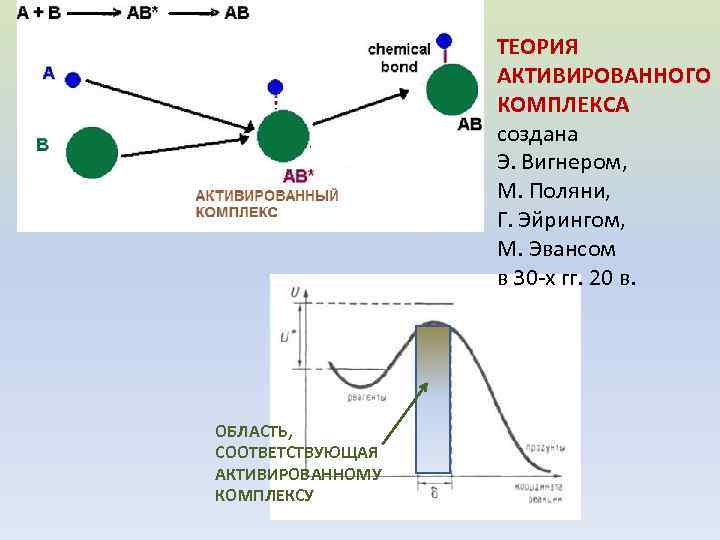 ТЕОРИЯ АКТИВИРОВАННОГО КОМПЛЕКСА создана Э. Вигнером, М. Поляни, Г. Эйрингом, М. Эвансом в 30 -х гг. 20 в. ОБЛАСТЬ, СООТВЕТСТВУЮЩАЯ АКТИВИРОВАННОМУ КОМПЛЕКСУ
ТЕОРИЯ АКТИВИРОВАННОГО КОМПЛЕКСА создана Э. Вигнером, М. Поляни, Г. Эйрингом, М. Эвансом в 30 -х гг. 20 в. ОБЛАСТЬ, СООТВЕТСТВУЮЩАЯ АКТИВИРОВАННОМУ КОМПЛЕКСУ
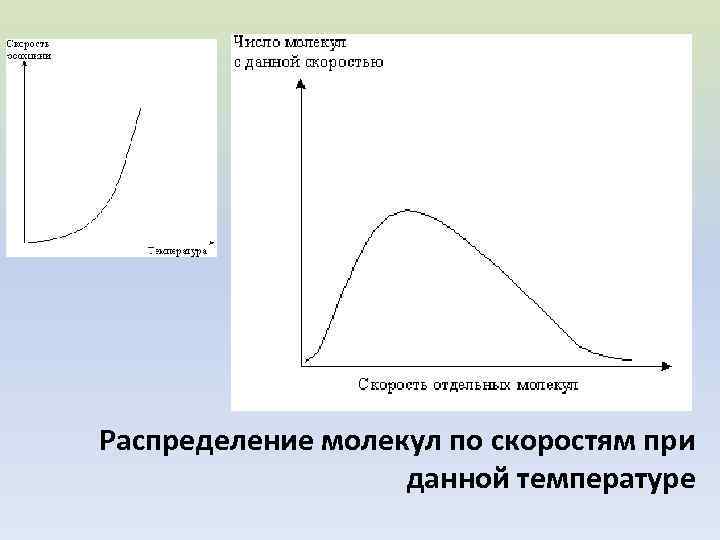 Распределение молекул по скоростям при данной температуре
Распределение молекул по скоростям при данной температуре