ТИПЫ ГИБРИДИЗАЦИИ Гибридизация


ТИПЫ ГИБРИДИЗАЦИИ

Гибридизация - это процесс выравнивания атомных орбиталей по форме и энергии

Причины гибридизации: необходимость образования равноценных связей с другими атомами максимальное удаление атомов друг от друга в пространстве

На форму молекул влияют: тип гибридизации атомных орбиталей число атомов в молекуле если в молекуле есть π- связь, то на каждуюπ -связь остается негибридным одно p-облако

Первое валентное состояние углерода sр3 -Гибридизация - смешение одной 2 s- и трех 2 р-орбиталей. Все четыре гибридные орбитали строго ориентированы в пространстве под углом 109° 28' друг к другу, создавая утолщенными "лепестками" геометрическую фигуру - тетраэдр Поэтому sp 3 -гибридизованный атом углерода часто называют "тетраэдрическим". Состояние углеродного атома с sp 3 -гибридными орбиталями (первое валентное состояние) характерно для предельных углеводородов – алканов.
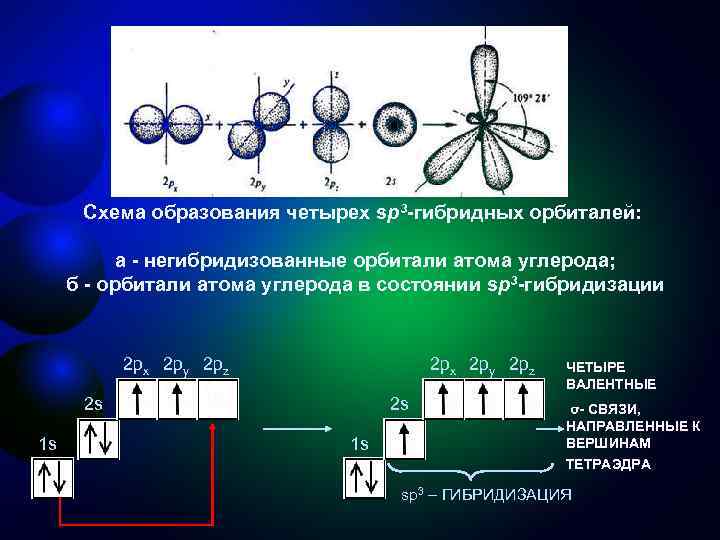
Схема образования четырех sp 3 -гибридных орбиталей: а - негибридизованные орбитали атома углерода; б - орбитали атома углерода в состоянии sp 3 -гибридизации 2 px 2 py 2 pz ЧЕТЫРЕ ВАЛЕНТНЫЕ 2 s σ- СВЯЗИ, НАПРАВЛЕННЫЕ К 1 s ВЕРШИНАМ ТЕТРАЭДРА sp 3 – ГИБРИДИЗАЦИЯ
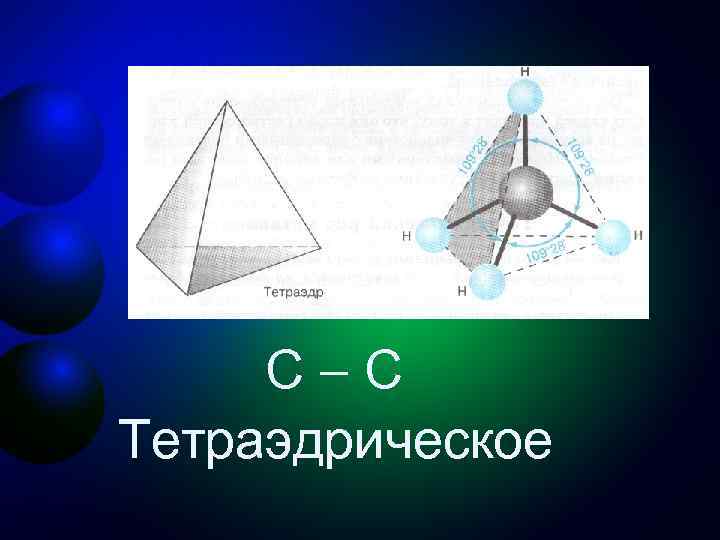
C C Тетраэдрическое

Второе валентное состояние углерода sр2 -Гибридизация - смешение одной 2 s- и двух 2 р- орбиталей, одна 2 p не гибридизована и перпендикулярна плоскости, в которой расположены три sp 2 -гибридные орбитали. Состояние атома углерода с sp 2 -гибридными орбиталями (второе валентное состояние) характерно для непредельных углеводородов ряда этилена - алкенов
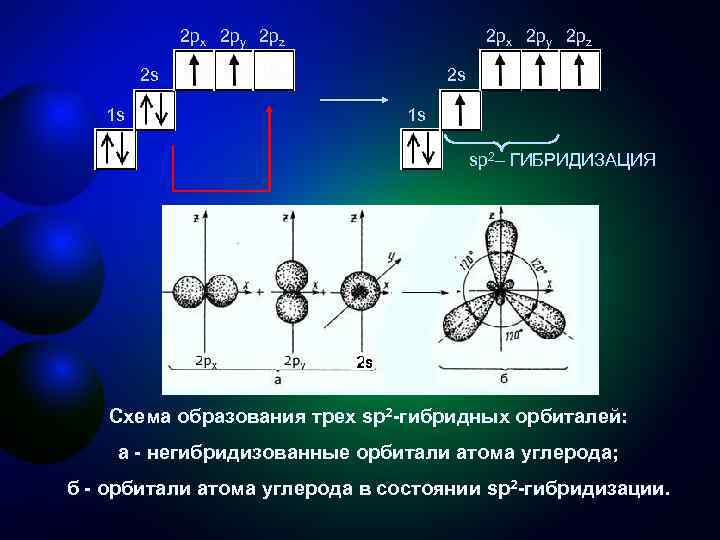
2 px 2 py 2 pz 2 s 2 s 1 s sp 2– ГИБРИДИЗАЦИЯ Схема образования трех sр2 -гибридных орбиталей: a - негибридизованные орбитали атома углерода; б - орбитали атома углерода в состоянии sp 2 -гибридизации.
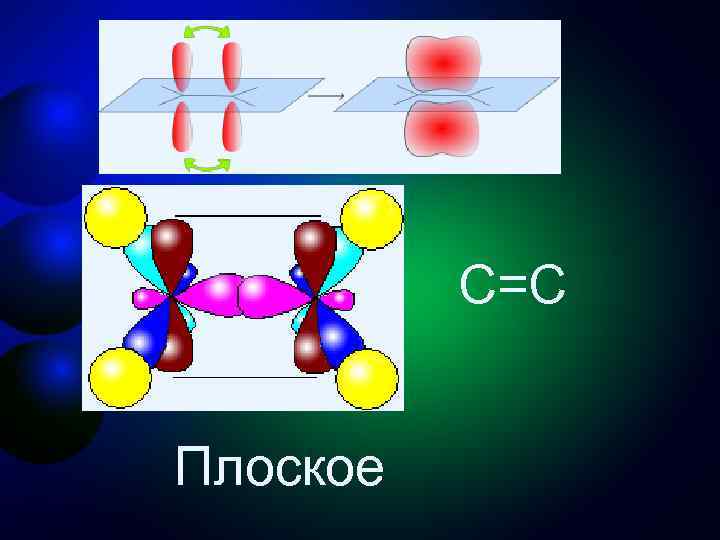
C=C Плоское

Третье валентное состояние углерода sр-Гибридизация - смешение одной 2 s- и одной 2 р-орбитали. Две гибридные орбитали расположены на одной прямой линии под углом 180° друг к другу. Остальные две негибридизованные 2 р-орбитали расположены во взаимно перпендикулярных плоскостях. Состояние атома углерода с sp-гибридными орбиталями (третье валентное состояние) характерно для непредельных углеводородов ацетиленового ряда - алкинов.
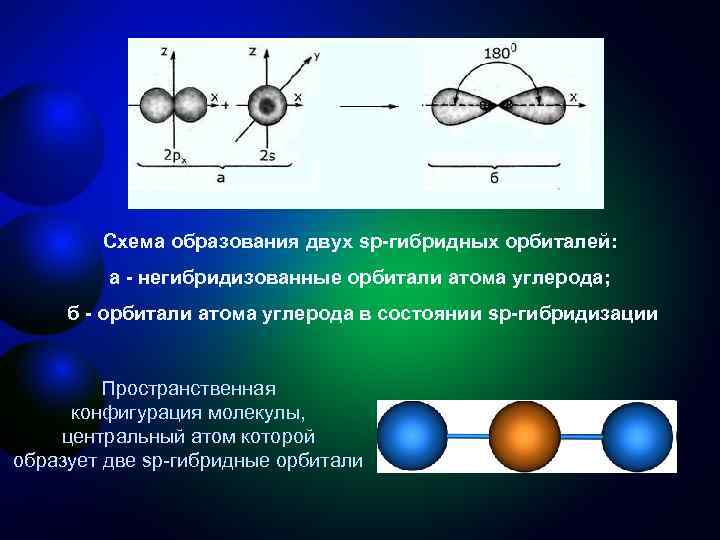
Схема образования двух sp-гибридных орбиталей: а - негибридизованные орбитали атома углерода; б - орбитали атома углерода в состоянии sp-гибридизации Пространственная конфигурация молекулы, центральный атом которой образует две sp-гибридные орбитали
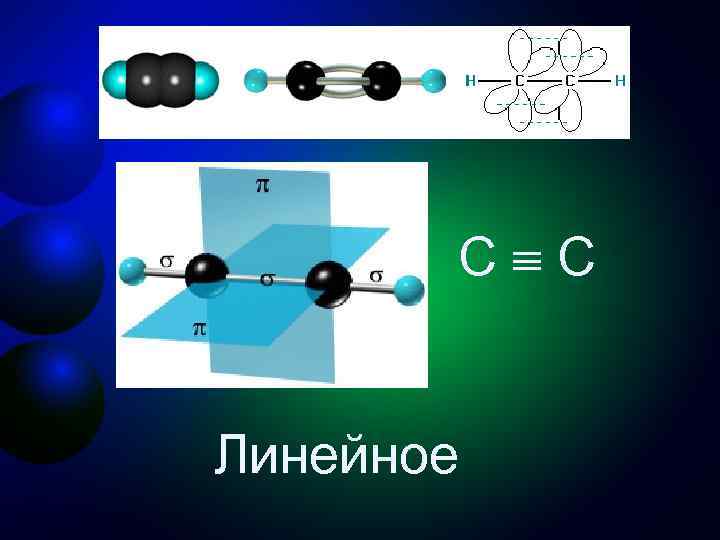
C C Линейное

Домашнее задание: § 3 -4 Спасибо за внимание!

