Термодинамика и статфизика, 20 13.pptx
- Количество слайдов: 55

The enthalpy The combination of thermodynamic variables, U + PV , occurs sufficiently often to acquire its own name. The enthalpy H is defined as H = U + PV. (enthalpy) (2. 29) We can use (2. 29) to find a simple expression for CP , the heat capacity at constant pressure. From (2. 15) and (2. 22), we have d. U = d. Q − Pd. V or d. Q = d. U + Pd. V (at constant pressure). From the identity, d(PV) = Pd. V + V d. P, we can write d. Q = d. U + d(PV ) − V d. P. At constant pressure d. Q = d. U + d(PV) = d(U + PV) = d. H. Hence, we can define the heat capacity at constant pressure as CP = ∂H/∂T, (2. 30) where we have suppressed noting that the pressure P is held constant during differentiation. We will learn that the enthalpy is another state function that often makes the analysis of a system simpler. At this point, we can only see that CP can be expressed more simply in terms of the enthalpy.



Figure 2. 5: A P-V diagram for adiabatic and isothermal processes. The two processes begin at the same initial temperature, but the adiabatic process has a steeper slope and ends at a higher temperature.

• • In Figure 2. 5 we show the P-V diagram for both isothermal and adiabatic processes. The adiabatic curve has a steeper slope than the isothermal curves at any point. From (2. 45) we see that the slope of an adiabatic curve for an ideal gas is in contrast to the slope of an isothermal curve for an ideal gas:

• • • Инженеры создали квантовый холодильник Фото: nist. gov Американские ученые разработали холодильник, который использует законы квантовой физики для снижения температуры. Результаты работы сотрудников Национального института стандартов и технологий (NIST) опубликованы на сайте организации. Новый прибор в рамках эксперимента позволил охладить квадратную медную пластину со стороной 2, 5 сантиметра и толщиной 3 миллиметра до температуры 265 милликельвинов (шкала Кельвина отсчитывается от абсолютного нуля — -273, 15 по Цельсию) за 18 часов. Таких температур невозможно достичь стандартными криогенными технологиями — жидкий гелий охлаждает объекты до 300 милликельвинов (4, 2 кельвина при атмосферном давлении). Охлаждающий элемент состоит из 48 слоеных структур, в которых пластины обычного и сверхпроводящего металлов разделяет изолятор нанометровой толщины. При появлении разности потенциалов, «горячие» электроны из обычного металла переходят через изоляцию в сверхпроводник за счет туннельного эффекта. Металлическая пластина, в свою очередь, забирает тепловую энергию у охлаждаемого объекта. Охлаждающую установку планируют применять для повышения производительности квантовых систем получения информации, а также чувствительных элементов телескопов. Исследователи рассчитывают добиться минимальной температуры в 100 милликельвинов, применив более энергоэффективные сверхпроводящие элементы в конструкции холодильника.

• 6. 3. Эффузия в разреженном газе • В параграфе 6. 2 отмечалось, что коэффициенты теплопроводности и вязкости не зависят от плотности газа. Однако постоянство этих коэффициентов сохраняется, только в том случае, если плотность газа достаточно велика. Для сильно разреженного газа, плотность которого столь мала, что длина свободного пробега его молекул становится сравнима с характерным размером сосуда , коэффициенты теплопроводности и вязкости начинают зависеть от плотности. С уменьшением плотности газа эти коэффициенты начинают уменьшаться.

• Это связано с тем, что при увеличении длины свободного пробега до характерного размера сосуда , молекулы газа начинают гораздо реже сталкиваться друг с другом и гораздо чаще со стенками сосуда. При этом перенос энергии и импульса от одной стенки сосуда до другой происходит с помощью молекул, которые практически не сталкиваются между собой. Это приводит к тому, что молекула газа, получившая энергию и импульс от одной из стенок, передает их непосредственно другой стенки сосуда без промежуточных соударений с другими молекулами.

• Состояние газа, при котором длина свободного пробега его молекул становится порядка или более характерного размера сосуда , в котором находится газ, называется вакуумом. • Различают низкий вакуум, при котором , средний, когда и высокий (или глубокий), при котором. • Отметим, что газ при одной и той же плотности в сосудах разного размера может находиться в обычном состоянии при и описываться полученными выше уравнениями переноса, а может представлять собой вакуум при , для описания которого эти уравнения не применимы. Так в частности воздух при нормальном атмосферном давлении в небольших порах дерева или почвы может находиться в состоянии вакуума, в отличие от того же воздуха в макроскопическом сосуде.

• Рассмотрим процесс переноса в разреженном газе. Пусть имеется заполненный разреженным газом сосуд, разделенный перегородкой с небольшим отверстием. Будем считать, что размер отверстия и толщина перегородки много меньше длины свободного пробега молекул газа. • Процесс истечения разреженного газа из отверстия, характерные размеры которого много меньше длины свободного пробега, называется эффузией (от лат. effusio разлитие, растекание).

Рис. 6. 2. Схема сосуда с разреженным газом

• Процесс истечения разреженного газа из отверстия, характерные размеры которого много меньше длины свободного пробега, называется эффузией

• Из формулы (вывод формулы) следует, что если температуры стенок в двух частях рассматриваемого сосуда различны, то в состоянии равновесия давление разреженного газа в этих частях будет так же различным. В части сосуда с большей температурой стенок давление газа так же будет большим. • Условие равновесия разреженного газа существенно отличается от аналогичного условия для не разреженного газа, длина свободного пробега молекул которого много меньше характерного размера отверстия в перегородке сосуда. Для такого газа, как известно, равновесие наступает при равенстве давлений в обеих частях сосуда. • Одним из следствий выражения является то, что если давления и были первоначально одинаковыми, то вследствие эффузии газ начнет перетекать из области с более низкой температурой, в область с более высокой. Это явление называется тепловой эффузией.

• Примером природного явления, в котором проявляется тепловая эффузия, может служить процесс выхода воздуха из почвы днем и всасывания его в почву ночью. В дневные часы верхний слой почвы нагревается, и воздух по небольшим порам и отверстиям в почве выходит наружу. В ночные часы, вследствие охлаждения верхнего слоя почвы процесс происходит в обратном направлении.

• Для разделения газовых смесей, в частности смесей изотопов, нашло применение явление изотермической эффузии. Это явление заключается в том, что газ из смеси, молекулы которого имеют меньшую массу, более интенсивно проходит через пористую перегородку, чем газ, имеющий более тяжелые молекулы. Изотермическая эффузия нашла применение, в частности, для разделения изотопов урана при его обогащении.

• В разреженном газе имеет место радиометрический эффект - отталкивание от нагретой поверхности (пластины) другой, более холодной пластины. Если длина свободного пробега молекул газа сравнима или меньше расстояния между пластинами, то происходит непосредственный перенос импульса молекулами газа от горячей пластины к холодной, что и приводит к появлению силы отталкивания.

• Технической реализацией радиометрического эффекта являются радиометрические манометры - приборы, в которых одна из пластин является подвижной и по её смещению можно, зная зависимость силы отталкивания от давления, измерить давление разреженного газа. Обычно считают, что оно пропорционально силе отталкивания. • Область применения радиационных манометров со стороны высоких давлений (низкий вакуум с давлением газа порядка обычно 102 - 103 Па) определяется сравнимостью длины свободного пробега с расстоянием между пластинами, а со стороны низких давлений (высокий вакуум с давлением 10 -3 - 10 -2 Па) - проявлением давления света (инфракрасного излучения), излучаемого нагретой пластиной.

Уравнение Ван-дер-Ваальса • Предпринималось много попыток для учета отклонений свойств реальных газов от свойств идеального газа путем введения различных поправок в уравнение состояния идеального газа. Наибольшее распространение вследствие простоты и физической наглядности получило уравнение Ван-дер-Ваальса (1873).

• Ван-дер-Ваальс в 1873 г. дал функциональную интерпретацию внутреннего давления. Согласно модели Ван-дер-Ваальса, силы притяжения между молекулами (силы Ван-дер -Ваальса) обратно пропорциональны шестой степени расстояния между ними, или второй степени объема, занимаемого газом. Считается также, что силы притяжения суммируются с внешним давлением. С учетом этих соображений уравнение состояния идеального газа преобразуется в уравнение Ван-дер-Ваальса: (1. 5)

• или для одного моля

• Уравнение (1. 6) можно переписать так, чтобы выразить в явном виде давление или объем

Уравнение (1. 8) содержит объем в третьей степени и, следовательно, имеет или три действительных корня, или один действительный и два мнимых. При высоких температурах уравнение (1. 8) имеет один действительный корень, и по мере повышения температуры кривые, вычисленные по уравнению Ван-дер. Ваальса, приближаются к гиперболам, соответствующим уравнению состояния идеального газа.
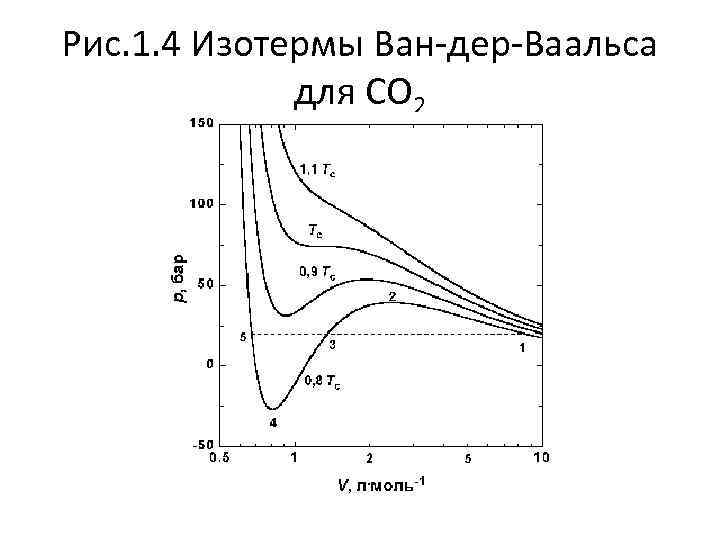
Рис. 1. 4 Изотермы Ван-дер-Ваальса для СО 2

• На рис. 1. 4 (стр. 7) приведены изотермы, вычисленные по уравнению Ван-дер-Ваальса для диоксида углерода (значения констант a и b взяты из табл. 1. 3). Из рисунка видно, что при температурах ниже критической (31, 04 °С) вместо горизонтальных прямых, соответствующих равновесию жидкости и пара, получаются волнообразные кривые 12345 с тремя действительными корнями, из которых только два, 1 и 5, физически осуществимы. Третий корень (точка 3) физически не реален, поскольку находится на участке кривой 234, противоречащем условию стабильности термодинамической системы

• Состояния на участках 12 и 54, которые соответствуют переохлажденному пару и перегретой жидкости, соответственно, являются неустойчивыми (метастабильными) и могут быть лишь частично реализуемы в специальных условиях. Так, осторожно сжимая пар выше точки 1 (рис. 1. 4), можно подняться по кривой 12. Для этого необходимо отсутствие в паре центров конденсации, и в первую очередь пыли. В этом случае пар оказывается в пересыщенном, т. е. переохлажденном состоянии. И наоборот, образованию капелек жидкости в таком паре способствуют, например, попадающие в него ионы. Это свойство пересыщенного пара используется в известной камере Вильсона (1912), применяемой для регистрации заряженных частиц. Движущаяся заряженная частица, попадая в камеру, содержащую пересыщенный пар, и соударяясь с молекулами, образует на своем пути ионы, создающие туманный след – трек, который фиксируется

• По мере повышения температуры все три корня сближаются, и при критической температуре Tc все три корня становятся равными. В критической точке изотерма Ван-дер-Ваальса имеет точку перегиба • • с горизонтальной касательной


• что позволяет определять константы уравнения Ван-дер-Ваальса из критических параметров газа.

• Принципиальное значение уравнения Ван-дер-Ваальса определяется следующими обстоятельствами: • 1) уравнение было получено из модельных представлений о свойствах реальных газов и жидкостей, а не явилось результатом эмпирического подбора функции f(p, V, T), описывающей свойства реальных газов; • 2) уравнение долго рассматривалось как некоторый общий вид уравнения состояния реальных газов, на основе которого было построено много других уравнений состояния (см. ниже); • 3) с помощью уравнения Ван-дер-Ваальса впервые удалось описать явление перехода газа в жидкость и проанализировать критические явления. В этом отношении уравнение Ван-дер-Ваальса имеет преимущество даже перед более точными уравнениями в вириальной форме.

• Причиной недостаточной точности уравнения Ван-дер-Ваальс считал ассоциацию молекул в газовой фазе, которую не удается описать, учитывая зависимость параметров a и b от объема и температуры, без использования дополнительных постоянных.

• The Second Law of Thermodynamics

• No process is possible whose sole result is the complete conversion of energy transferred • by heating into work (Kelvin statement).

• No process is possible whose sole result is cooling a colder body and heating a hotter • body (Clausius statement).


• There exists an additive function of state known as the entropy S that can never • decrease in an isolated system. Because the entropy cannot decrease in an isolated system, we conclude that the entropy is a maximum for an isolated system in equilibrium. The term additive means that if the entropy of two systems is SA and SB, respectively, the total entropy of the combined system is Stotal = SA +SB.

• ΔS ≥ 0, • ΔS= 0. (reversible process)

The Second Law and Heat Engines Schematic energy transfer diagram for an ideal heat engine.





• Дви гатель Сти рлинга — тепловая машина, в которой жидкое или газообразное рабочее тело движется в замкнутом объёме, разновидность двигателя внешнего сгорания. Основан на периодическом нагреве и охлаждении рабочего тела с извлечением энергии из возникающего при этом изменения объёма рабочего тела. Может работать не только от сжигания топлива, но и от любого источника тепла.

• Двигатель Стирлинга был впервые запатентован шотландским священником Робертом Стирлингом 27 сентября 1816 года (английский патент № 4081). Однако первые элементарные «двигатели горячего воздуха» были известны ещё в конце XVII века, задолго до Стирлинга. Достижением Стирлинга является добавление очистителя, который он назвал «эконом» .


• Цикл Стирлинга состоит из четырёх фаз и разделён двумя переходными фазами: нагрев, расширение, переход к источнику холода, охлаждение, сжатие и переход к источнику тепла. Таким образом, при переходе от тёплого источника к холодному источнику происходит расширение и сжатие газа, находящегося в цилиндре. При этом изменяется давление, за счёт чего можно получить полезную работу. • Нагрев и охлаждение рабочего тела (участки 4 и 2) производится рекуператором. В идеале количество тепла, отдаваемое и отбираемое рекуператором, одинаково. Полезная работа производится только за счёт изотерм, то есть зависит от разницы температур нагревателя и охладителя, как в цикле Карно. Рабочий цикл двигателя

• где: a — вытеснительный поршень; b — рабочий поршень; с — маховик; d — огонь (область нагревания); e — охлаждающие ребра (область охлаждения). • Внешний источник тепла нагревает газ в нижней части теплообменного цилиндра. Создаваемое давление толкает рабочий поршень вверх (обратите внимание, что вытеснительный поршень неплотно прилегает к стенкам). • Маховик толкает вытеснительный поршень вниз, тем самым перемещая разогретый воздух из нижней части в охлаждающую камеру. • Воздух остывает и сжимается, рабочий поршень опускается вниз. • Вытеснительный поршень поднимается вверх, тем самым перемещая охлаждённый воздух в нижнюю часть. И цикл повторяется. • В машине Стирлинга движение рабочего поршня сдвинуто на 90° относительно движения поршня-вытеснителя.

Вариант современного двигателя Стирлинга


![• Тепловые насосы позволяют экономить на отоплении[5]. Принцип действия тот же, что у • Тепловые насосы позволяют экономить на отоплении[5]. Принцип действия тот же, что у](https://present5.com/presentation/1/47737566_184111585.pdf-img/47737566_184111585.pdf-50.jpg)
• Тепловые насосы позволяют экономить на отоплении[5]. Принцип действия тот же, что у кондиционера (кондиционер — это тот же тепловой насос), только кондиционер обычно охлаждает помещение, нагревая окружающее пространство, а тепловой насос, как правило, обогревает помещение, охлаждая наружный воздух, воду из скважины или другой источник низкопотенциального тепла.

Принцип действия теплового насоса 1. 2. 3. 4. 5. Охлажденный теплоноситель, проходя по внешниму трубопроводу нагревается на несколько градусов. Внутри теплового насоса теплоноситель, проходя через теплообменник, называемый испарителем, отдает собранное из окружающей среды тепло во внутренний контур теплового насоса. Внутренний контур теплового насоса заполнен хладоагентом. Хладоагент, имея очень низкую температуру кипения, проходя через испаритель, превращается из жидкого состояния в газообразное. Это происходит при низком давлении и температуре -5°С. Из испарителя газообразный хладоагент попадает в компрессор, где он сжимается до высокого давления и высокой температуры. Далее горячий газ поступает во второй теплообменник, конденсатор. В конденсаторе происходит теплообмен между горячим газом и теплоносителем из обратного трубопровода системы отопления дома. Хладоагент отдает свое тепло в систему отопления, охлаждается и снова переходит в жидкое состояние, а нагретый теплоноситель системы отопления поступает к отопительным приборам. При прохождении хладоагента через редукционный клапан давление понижается, хладоген попадает в испаритель, и цикл повторяется снова.


• Воздушный контур Вместо того, чтобы извлекать энергию из скважин, земли или водоема теплонасосная установка Thermia Atria собирает энергию из окружающего воздуха. Если возможности разместить земляной коллектор нет, данная модель теплонасосной установки является наилучшим выбором. Точно так же как и обычные теплонасосные установки, Atria дает тепло и горячую воду в дом и сокращает потребление энергии до 75%.

• • • Земляной контур При использовании в качестве источника тепла участка земли трубопровод зарывается в землю на глубину промерзания грунта (выбирается для конкретного региона. Минимальное расстояние между соседними трубопроводами – 0, 8. . 1, 2 м. Специальной подготовки почвы, засыпок и т. п. не требуется. Предпочтения к грунту – желательно использовать участок с влажным грунтом, идеально с близкими грунтовыми водами, однако сухой грунт не является помехой – это приводит лишь к увеличению длины контура.

• • Виды источников энергии Скважина При использовании в качестве источника тепла скалистой породы трубопровод опускается в скважину. Не обязательно использовать одну глубокую скважину, можно пробурить несколько не глубоких, более дешевых скважин, главное получить общую расчетную глубину.
Термодинамика и статфизика, 20 13.pptx