технол_осн_ б.т производств.ppt
- Количество слайдов: 74

ТЕХНОЛОГИЧЕСКИЕ ОСНОВЫ БИОТЕХНОЛОГИЧЕСКИХ ПРОИЗВОДСТВ Лектор: доцент каф. БИОХ Тимощенко Л. В.
2 ПРОЦЕССЫ В БИОТЕХНОЛОГИИ • Главная задача в создании любого биотехнологического процесса - разработка и оптимизация научно-обоснованной технологии и аппаратуры для него. • Каждый биологический объект (клетка, фермент и т. д. ) – это автономная саморегулирующаяся система. • Природа биологических процессов сложна и далеко не выяснена окончательно.

3 Микробные популяции гетерогенны по : • возрасту; • физиологической активности; • устойчивости к воздействию неблагоприятных факторов среды, случайным мутациям; • гетерогенность также может быть обусловлена наличием поверхностей раздела фаз и неоднородностью среды

Биотехнологические процессы делятся на: 4 • Биологические - использование акариот, прокариот и эукариот; • Биохимические - использование ферментов; • Биоаналогичные - химический синтез или полусинтез веществ.

5 Систематизация биотехнологических процессов По характеристике биообъекта По общности и специфичности биотехнологических процессов По числу биообъектов По условиям проведения процесса По стадиям реализации технологии производства По целевым продуктам По механизму образования конечного продукта По управлению процессом По типу биотехнологического процесса

6 Любой биотехнологический процесс включает 3 основные стадии: • предферментационная, • постферментационная.
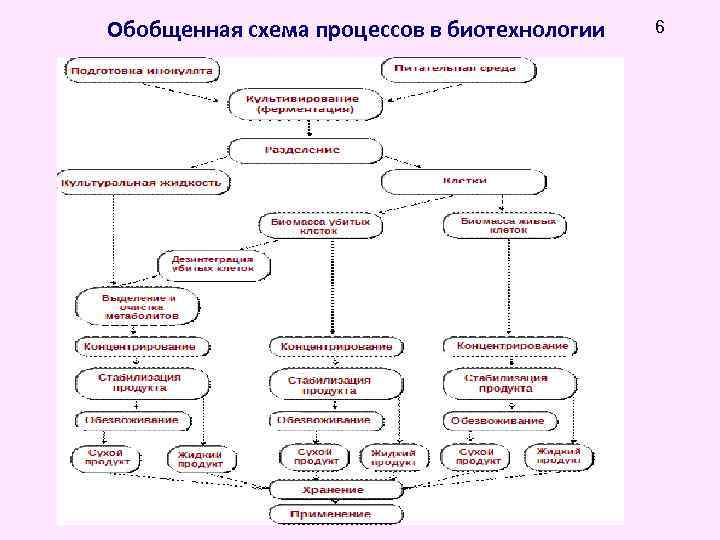
Обобщенная схема процессов в биотехнологии 6

Обобщенная схема процессов в биотехнологии 7

8 1. Предферментационная стадия

1) хранение и подготовка культуры продуцента (инокулята); подготовка и получение питательных субстратов и сред, 2) ферментационной аппаратуры, технологических и рециркулируемых воды и воздуха. 9

Поддержание и подготовка чистой культуры Промышленный штамм в идеале должен удовлетворять следующим основным требованиям: 1) стабильности структурно-морфологических признаков и физиологической активности и эксплуатации в производстве; 2) повышенной скорости роста и биосинтеза целевых продуктов; 3) достаточно широкому диапазону устойчивости к воздействию неблагоприятных внешних факторов (колебания температуры, р. Н, перемешиванию, вязкости среды); 4) умеренной требовательности к ограниченному числу источников питания; чем более широкий набор источников углерода, азота и других элементов может использовать производственный штамм, тем легче его культивировать, и с большей выгодой. 10

Принцип масштабирования • последовательное наращивание биомассы продуцента в колбах, бутылях, далее в серии последовательных ферментаторов. Каждый последующий этап данного процесса отличается по объему от предыдущего обычно на порядок. Полученный продуцент по стерильной посевной линии направляется далее в аппарат, в котором реализуется ферментационная стадия. 11

12 Приготовление питательных сред Осуществляется в специальных реакторах, оборудованных мешалками. Технология приготовления сред значительно усложняется, если в их состав входят нерастворимые компоненты. Дозирование питательных компонентов подбирается и осуществляется индивидуально на каждом производстве в соответствии с технологическим регламентом конкретного процесса. В качестве дозирующего оборудования применяются весовые и объемные устройства, используемые в пищевой и химической промышленности. Транспорт веществ осуществляется насосами, ленточными и шнековыми транспортерами. Сыпучие компоненты подают в ферментаторы с помощью вакуумных насосов.

13 2. Ферментация

Ферментация 14 • в строго асептических условиях или без соблюдения правил стерильности ( «незащищенная» ферментация); • на жидких и твердых средах, • в анаэробных и аэробных условиях. Аэробная ферментация может протекать поверхностно или глубинно. Культивирование биологических объектов может осуществляться в периодическом и проточном режимах, полунепрерывно с подпиткой субстратом.

Схема биореактора периодического действия Х – концентрация биомассы в культуре, г/л; S – текущая концентрация субстрата, г/л; P – концентрация продукта, г/л 16
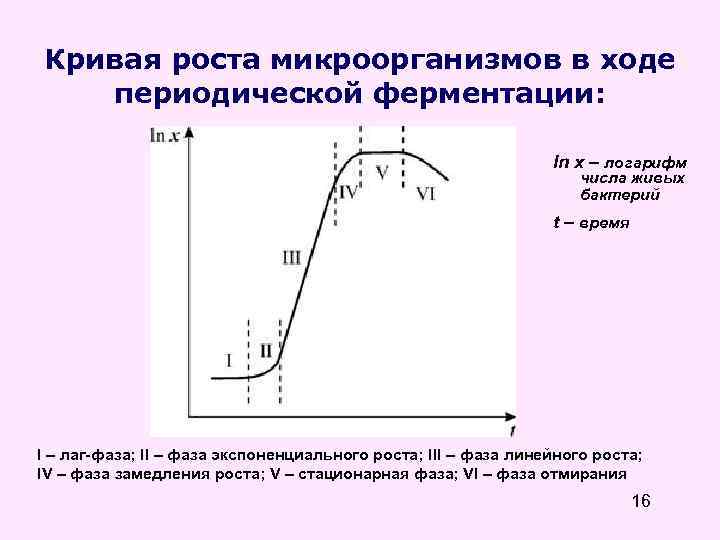
Кривая роста микроорганизмов в ходе периодической ферментации: ln x – логарифм числа живых бактерий t – время I – лаг-фаза; II – фаза экспоненциального роста; III – фаза линейного роста; IV – фаза замедления роста; V – стационарная фаза; VI – фаза отмирания 16

Непрерывная ферментация Системы непрерывной ферментации могут быть организованы по принципу полного вытеснения или полного смешения. • Первый пример – так называемая тубулярная культура: процесс ферментации осуществляется в длинной трубе, в которую с одного конца непрерывно поступают питательная среда и инокулят, а с другой – с той же скоростью вытекает культуральная жидкость и целевые продукты. Данная система проточной ферментации является гетерогенной и реализуется, как правило, без перемешивания. • При непрерывной ферментации в ферментаторах полного смешения (гомогенно-проточный способ) во всей массе ферментационного аппарата создаются одинаковые условия. Применение таких систем ферментации позволяет эффективно управлять отдельными стадиями, а также всем биотехнологическим процессом и стабилизировать продуцент в практически любом требуемом экспериментатору или биотехнологу состоянии. 17

Схема тубулярного биореактора полного вытеснения 18

Схемы биореакторов для проточного культивирования микроорганизмов А – хемостат; Б – турбидостат с автоматической регуляцией оптической плотности; 1 – поступление среды, 2 – мешалка, 3 – сток культуры, 4 – насос, 5 – фотоэлемент, 6 – источник света 20

В ходе ферментации образуются сложные смеси, содержащие клетки, внеклеточные метаболиты, остаточные концентрации исходного субстрата. При этом целевые продукты, находятся в этой смеси в небольших концентрациях, а многие из них легко разрушаются. Все это накладывает ограничения на методы выделения и сушки биологических препаратов. 20
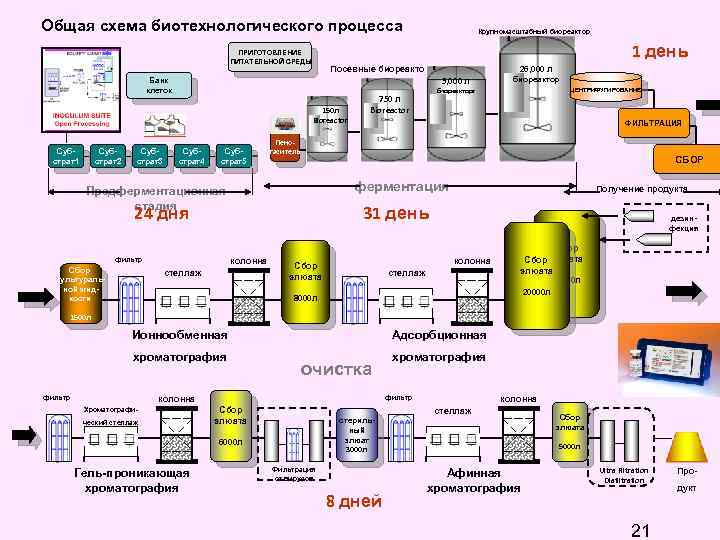
Общая схема биотехнологического процесса 1 день ПРИГОТОВЛЕНИЕ ПИТАТЕЛЬНОЙ СРЕДЫ 5, 000 л 150 л Bioreactor Субстрат2 Субстрат3 Субстрат4 Субстрат5 ЦЕНТРИФУГИРОВАНИЕ биореакторr 750 л Bioreactor ФИЛЬТРАЦИЯ СБОР ферментация 24 дня фильтр биореактор Пеногаситель Предферментационная стадия Сбор культуральной жидкости 26, 000 л Посевные биореакторы Банк клеток Субстрат1 Крупномасштабный биореактор Получение продукта 31 день колонна стеллаж дезинфекция колонна Сбор элюата стеллаж 8000 л Сбор элюата 20000 л 1500 л Адсорбционная Ионнообменная хроматография фильтр очистка фильтр колонна Хроматографический стеллаж Сбор элюата стерильный элюат 3000 л 6000 л Гель-проникающая хроматография Фильтрация от вирусов 8 дней колонна стеллаж Сбор элюата 5000 л Афинная хроматография Ultra Filtration Diafiltration 21 Продукт

3. Постферментационная стадия 22

Постферментационная стадия обеспечивает получение готовой товарной продукции и также обезвреживание отходов и побочных продуктов. Культуральная жидкость, образующаяся в процессе ферментации, представляет собой сложную многофазную систему: в водной фазе содержатся клетки продуцента, продукты их жизнедеятельности, непотребленные компоненты питательной среды, мельчайшие капельки жира и пузырьки воздуха. В свою очередь, водная фаза культуральной жидкости (нативный раствор) включает большое количество органических и неорганических веществ, коллоидных фракций белков, сухой остаток культуральной жидкости – до 17 % и более, содержание биомассы в культуральной жидкости достигает 8– 10 %. Концентрация целевого продукта чаще всего не превышает 1, 5 %, что составляет менее 10 % сухого остатка. Важнейшей задачей постферментационной стадии является выделение и очистка целевого продукта. Эта задача является фактической задачей на разделение суспензии и имеет несколько вариантов инженерного решения. 23
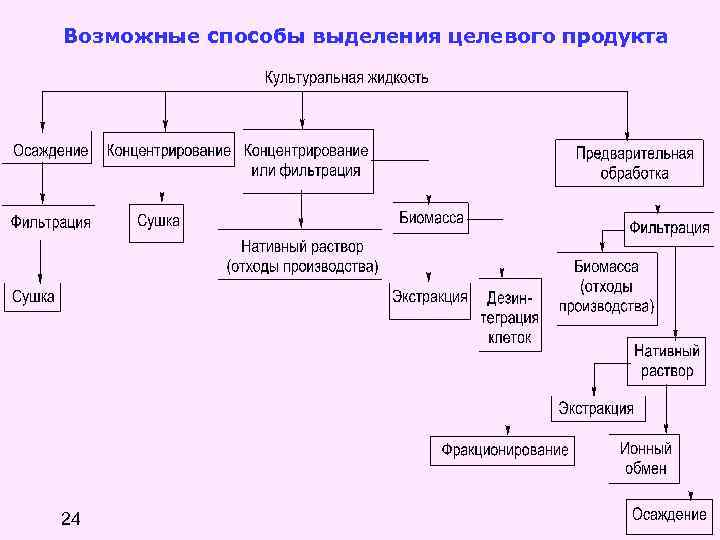
Возможные способы выделения целевого продукта 24

1. Фракционирование культуральной жидкости и отделение биомассы Наиболее распространенный метод для этих целей – сепарация, которая осуществляется в сепараторах, которые работают по различным схемам, в зависимости от свойств культуральной жидкости. Основные проблемы возникают при необходимости выделения мелко взвешенных частиц размером 0, 5– 1, 0 мкм и менее (бактериальные клетки) и переработки больших объемов жидкости (производство кормового белка). Для повышения эффективности процесса сепарации применяют предварительную специальную обработку культуры – изменение p. H, нагревание, добавление химических агентов. Сепаратор Ж 5 -ОС 2 -Д 500 25

Разделение суспензий 1. Седиментация - разделение культуры как дисперсной системы на дисперсную фазу и дисперсионную среду (в нашем случае – клетки продуцента и культуральную жидкость); • отстаивание - в процессе которого клетки продуцента, отличающиеся по плотности от культуральной жидкости, рано или поздно либо выпадут в осадок, либо всплывут; • центрифугирование; С помощью центрифугирования можно решить следующие технологические задачи: • разделение суспензии на осадок и раствор; • разделение эмульсий на две жидкие фазы различной плотности. 26

Центрифуги используют как в лабораториях, так и в промышленном производстве. Лабораторные центрифуги представляют собой аппараты периодического действия, в которые загружается определенное количество разделяемой смеси, производят в заданных условиях процесс разделения, останавливают и выгружают жидкую фазу и осадок. В промышленности чаще применяют центрифуги непрерывного действия, позволяющие перерабатывать за один цикл объемы разделяемой смеси, значительно превышающие вместимость ротора. Центрифуга непрерывного действия 27

Разделение суспензий 2. Фильтрация - клетки микроорганизмов отфильтровывают от культуральной жидкости, что и используется при стерилизации питательных сред. Для осуществления фильтрации применяется специальная аппаратура – вакуумные фильтры барабанного типа, фильтр-прессы, фильтрующие центрифуги. 3. Флотация - в культуру добавляют относительно небольшое количество несмешивающейся с водой жидкости в мелко раздробленном состоянии. На поверхности раздела капелек этой жидкости и воды сорбируются клетки культуры, и после расслаивания эмульсии микробную массу удается сконцентрировать. 28

Объемный фильтр 29

2. Разрушение клеточной массы (дезинтеграция) Дезинтеграция клеточной массы - один из важнейших элементов биотехнологического процесса Физические методы: • • баллистические методы дезинтеграции; экструзия; • ультразвуковая дезинтеграция. 30 Химические методы: • детергентный лизис клеток.

Физические методы: • Баллистические методы дезинтеграции Сущность состоит в том, что биомассу подвергают воздействию удара или истирания. Биомассу помещают в цилиндрический барабан, вращающийся вокруг оси и наполненный шариками из тяжелого твердого материала (металл или фарфор). При вращении барабана шарики перекатываются и ударяют по агломератам биомассы. Это приводит к разрушению клеточных стенок и получению однородного вязкого раствора, в котором находится содержимое клеток. Ход дезинтеграции можно описать уравнением: где А – степень дезинтеграции, %, К – константа скорости дезинтеграции, f –объемная скорость, л/час. 31

• Экструзия – суспензию клеточной массы под высоким давлением продавливают через узкое отверстие в камеру с нормальным давлением. • Ультразвуковая дезинтеграция Под действием ультразвукового поля клетки испытывают попеременные сжатия и растяжения, скручивание в различных направлениях, что, в конце концов, приводит к разрыву клеточной стенки и ее разрушение. Операция дезинтеграции с помощью ультразвука может осуществляться как в периодическом, так и в непрерывном режимах. 32

Химические методы • В ряде случаев более удобным оказывается разрушение клеточной оболочки за счет перевода в раствор отдельных ее компонентов, т. е. изменения ее состава и структуры, что делает ее более проницательной для клеточного содержимого. Детергентный лизис клеток. Биомасса продуцента в этом случае обрабатывается каким-либо из детергентов, который растворяет липидные компоненты клеточной стенки, после чего внутриклеточные компоненты через образовавшиеся поры вытекают в окружающую среду. 33

3. Фракционирование экстрактов биоматериалов Подходы к фракционированию смесей: Неспецифический Используют, когда располагают ограниченной информацией о свойствах продукта; тогда продукт проводят через ряд последовательных стадий технологического процесса, в надежде, что на каждой из этих стадий удастся реализовать какие-либо различия в свойствах продукта и сопутствующих ему веществ Специфический Основан на большем объеме информации о продукте и, следовательно, на подборе для него приемов фракционирования. Таким путем можно сократить затраты на процесс производства, повысить выход продукта и экономичность технологии, но это потребует больших затрат на разработку процесса 1. Солевое фракционирование 2. Осаждение продуктов органическими полимерами 3. Добавление органических растворителей 34

4. Тонкая очистка продуктов биотехнологического процесса логарифм степени очистки Разработка технологического процесса получения высокоочищенного целевого продукта осуществляется путем случайного подбора процедур фракционирования Процесс может быть разделен условно на три фазы: стадии 1 и 2 – грубое фракционирование, стадии 3 и 4 – основная очистка, стадия 5 – финишная очистка. Обобщенное представление технологического процесса очистки продукта 35

• Грубое фракционирование обычно включает разрушение клеточной массы и отделение целевого продукта (например, белка) от остальных компонентов экстракта (нуклеиновых кислот, полисахаридов, липидов). Цель этих процедур – облегчение последующего фракционирования. Как правило, на этой фазе технологического процесса значительного обогащения целевого продукта не наблюдается. • Вторая фаза очистки обеспечивает отделение целевого продукта от основной массы компонентов той же природы (в нашем случае – белков). Здесь используются наиболее существенные отличия в физикохимических свойствах целевого продукта от остальных белковых компонентов разделяемой смеси. За счет этих различий и достигается очистка. • На последней фазе, в которую вступает зачастую почти индивидуальный в химическом смысле целевой продукт, осуществляется его отделение от микропримесей других компонентов, близких по свойствам к целевому продукту. Очевидно, что и на этой стадии существенного обогащения продукта не достигается, однако очень часто процедуры, используемые на этом этапе процесса, самым существенным образом сказываются на качестве продукта. 36

5. Специфичность стадий технологического процесса Для характеристики эффективности стадии фракционирования используется количественный показатель – коэффициент специфичности технологической стадии. Его определяют как где pi+1 и pi – степень очистки продукта на (i+1) стадии и i–стадии соответственно. Процедуру считают удовлетворительной, если требуемая степень очистки достигается за три стадии фракционирования. При этом необходимо, чтобы коэффициент специфичности каждой из этих стадий был более пяти. Именно такие стадии считают специфичными. 37

В процессах тонкой очистки целевых продуктов специфические стадии фракционирования используются весьма широко. Наиболее распространенным вариантом является хроматография. • ионообменная хроматография - сорбент представляет собой твердый носитель, содержащий ионизируемые в водных растворах функциональные группы, с которыми связываются компоненты разделяемой смеси; • адсорбционная хроматография - сорбент представляет собой твердый носитель, на котором происходит обратимая сорбция компонентов разделяемой смеси за счет дисперсионного взаимодействия их с поверхностью твердой фазы. Разделение осуществляется за счет различия в константах равновесия связывания компонентов смеси с поверхностью сорбента; • хроматография на молекулярных ситах (гельпроникающая хроматография, гельфильтрация); сорбент представляет собой гранулы геля, имеющий поры определенного размера, в которые могут проникать молекулы компонентов с размером ниже размера пор и не могут проникать молекулы с большим размеров пор. Разделение достигается за счет разной скорости перемещения частиц с разными размерами молекул, при этом частицы большего размера движутся с большей скоростью. 38

39

• аффинная хроматография 40

6. Методы высушивания • • Сушка термостабильных препаратов осуществляется на подносах, ленточном конвейере, а также в кипящем слое; Особо чувствительные к нагреванию препараты высушивают в вакуумсушильных шкафах (при пониженном давлении и температуре) и в распылительных сушилках. 41

ЭЛЕМЕНТЫ, СЛАГАЮЩИЕ БИОТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ И БИОТЕХНОЛОГИИ биологический агент; субстрат; аппаратура; продукт. 42

Важнейшие группы биологических агентов, используемых в биотехнологических процессах: - Микроорганизмы, растительные и животные клетки - Вирусы - Компоненты клеток: мембраны, протопласты, митохондрии, ферменты - Внеклеточные продукты: ферменты, коферменты - Иммобилизованные клетки микроорганизмов, растений и животных; их компоненты и внеклеточные продукты 43

1. Биологический агент является активным началом в биологических процессах и одним из наиболее важных из элементов. 1. Микробная клетка – традиционный объект в номенклатуре биологических агентов. При выборе биологического агента и постановке его на производство следует соблюдать принцип технологичности штаммов, т. е. микробная клетка, популяция или сообщество особей должны сохранять свои основные физиолого-биохимические свойства в процессе длительного ведения ферментации. Промышленные продуценты должны также обладать устойчивостью к мутациям, фагам, заражению посторонней микрофлорой, быть безвредными для людей и окружающей среды, не иметь при выращивании побочных токсичных продуктов обмена и отходов, иметь высокие выходы продукта и приемлемые технико-экономические показатели. В настоящее время промышленные биотехнологии базируются на использовании гетеротрофных организмов, а в будущем решающее место займут: • автотрофные микроорганизмы – организмы, не нуждающиеся для роста в дефицитных органических средах; • экстремофилы – организмы, развивающиеся в экстремальных условиях (термофильные, алкало- и ацидофильные); 44
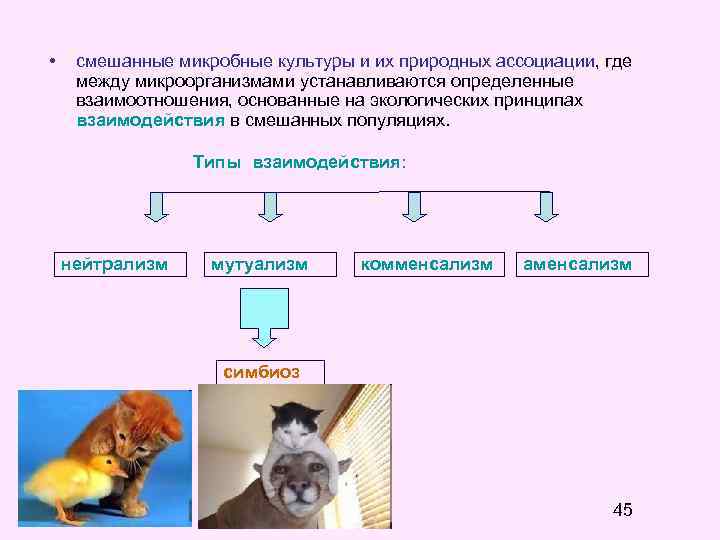
• смешанные микробные культуры и их природных ассоциации, где между микроорганизмами устанавливаются определенные взаимоотношения, основанные на экологических принципах взаимодействия в смешанных популяциях. Типы взаимодействия: нейтрализм мутуализм комменсализм аменсализм симбиоз 45

Смешанные микробные культуры и их природных ассоциации: потребляют сложные, неоднородные по составу субстраты; минерализуют сложные органические соединения; имеют повышенную устойчивость к воздействию неблагоприятных факторов среды и токсических веществ; имеют повышенную продуктивность и возможность обмена генетической информацией между отдельными видами сообщества. • • Применение смешанных культур: • • • производство пищевых продуктов; охрана окружающей среды; биодеградация и усвоение сложных субстратов нетрадиционные биологические агенты - растительные и животные ткани, в том числе гибридомы, трансплантанты; новейшие биологические агенты – трансгенные клетки микроорганизмов, растений и животных, полученные с помощью генной инженерии. 46
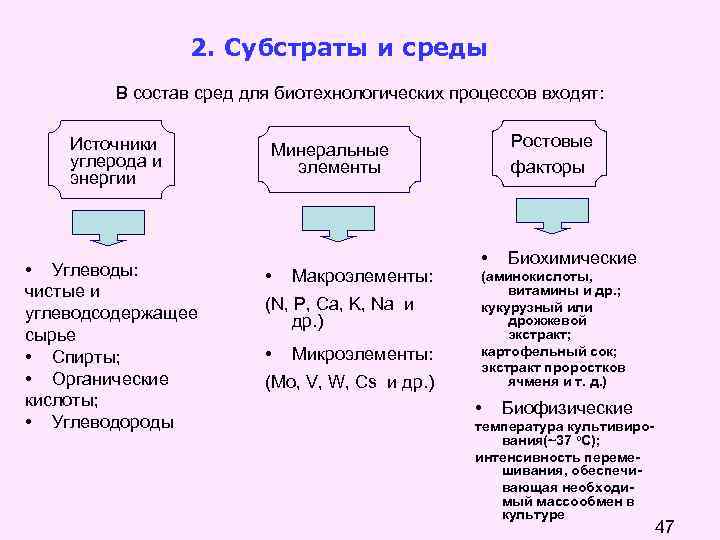
2. Субстраты и среды В состав сред для биотехнологических процессов входят: Источники углерода и энергии • Углеводы: чистые и углеводсодержащее сырье • Спирты; • Органические кислоты; • Углеводороды Ростовые факторы Минеральные элементы • Макроэлементы: (N, P, Ca, K, Na и др. ) • Микроэлементы: (Mo, V, W, Cs и др. ) • Биохимические (аминокислоты, витамины и др. ; кукурузный или дрожжевой экстракт; картофельный сок; экстракт проростков ячменя и т. д. ) • Биофизические температура культивирования(~37 о. С); интенсивность перемешивания, обеспечивающая необходимый массообмен в культуре 47

Важнейшие группы субстратов (технических источников углерода и минеральных веществ), используемых в биотехнологических процессах Чистые источники углерода и азота Сахара Спирты Органические кислоты Парафины нефти Природный газ водород Технические источники углерода и азота Меласса, Сок сахарного тростника, Гидролизаты растительных полимеров (патока, крахмал) Барда (продукт переработки спирта) Полупродукты предшественники биотрансформации (соки растений) Отходы с/х и лесной промышленности (целлюлоза) Отходы промышленности, в том числе переработки фруктов и овощей Бытовые отходы, сточные воды Молочная сыворотка Картофель, зерно Зеленая биомасса растений 48
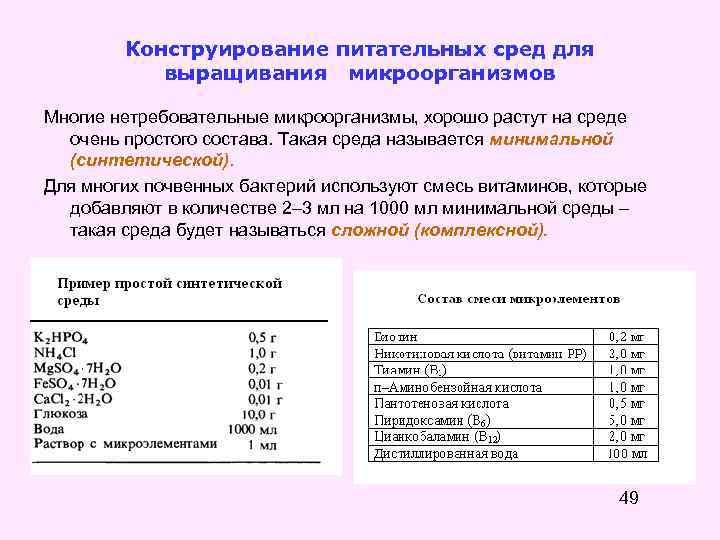
Конструирование питательных сред для выращивания микроорганизмов Многие нетребовательные микроорганизмы, хорошо растут на среде очень простого состава. Такая среда называется минимальной (синтетической). Для многих почвенных бактерий используют смесь витаминов, которые добавляют в количестве 2– 3 мл на 1000 мл минимальной среды – такая среда будет называться сложной (комплексной). 49

Технология приготовления питательных сред Питательная среда для культивирования микроорганизмов должна удовлетворять двум основным требованиям: • она должна содержать все необходимые для роста компоненты; • не должна содержать примесей каких-либо микроорганизмов, т. е. должна быть стерильной. Методы стерилизации 1. Термическая стерилизация – прогревание среды при высоких температурах, когда большинство микроорганизмов погибают. Для большинства микроорганизмов достаточным оказывается кипячение среды (~100 о. С). Обычно среду прогревают при более высокой температуре, для чего нагревание проводят при повышенном давлении (3– 5 атм). Пастеризация как вариант термической стерилизации. Используют для уничтожения спорообразующих микроорганизмов. 50

51

Методы стерилизации 2. Стерилизация фильтрацией - щадящие методы стерилизации. Часто в качестве фильтров используют: неглазурованные фарфоровые фильтры (свечи Шамберлана); фильтр Беркефельда (из прессованного кизельгура); асбестовые пластины; стеклянные фильтры; Мембранные фильтры Стерилизация фильтрацией является одним из процессов так называемой мембранной технологии, которая используется не только для стерилизации, но и для фракционирования сложных смесей. • • • Недостатки способа: адгезия частиц к мембранам; неоднородность пор по диаметру; удержание части стерилизуемой дорогостоящей жидкости на мембране при фильтрации малых объемов ее; возможная селективная адсорбция ионов из небольших объемов растворов; недостаточная или плохая смачиваемость мембран водой. 52

3. Лучевая стерилизация - облучение УФ-светом, рентгеновскими и -лучами. 4. Химическая стерилизация - обработка -пропиолактоном, окисью этилена , смесью ОБ (смесь оксида этилена и бромистого метила и др. ) 53

54 3. Аппаратура Для различных типов процессов существует огромное разнообразие аппаратуры: собственно для процесса ферментации, а также для выделения и получения готового продукта. Наиболее сложна и специфична аппаратура для ферментационной стадии. Типы ферментационных аппаратов Аппараты для анаэробных процессов • Применяются в процессах конверсии растительного сырья, в том числе растительных отходов, а также различных других отходов. Данные аппараты оборудованы системой подачи сырья, системой теплообменных труб для стабилизации температуры, несложным перемешивающим устройством для гомогенного распределения сырья и биомассы продуцента, газовым колпаком и устройством переменного объема (газгольдером) для сбора образуемого биогаза.

Ферментаторы Лабораторный ферментатор 3 л Промышленный ферментатор 25 000 л 55

Аппараты для аэробной поверхностной ферментации • широко применяются для производства органических кислот (жидкофазные) и ферментов (твердофазные). Поверхностная жидкофазная ферментация протекает в так называемых бродильных вентилируемых камерах, в которых на стеллажах размещены плоские металлические кюветы. В кюветы наливают жидкую питательную среду, высота слоя составляет 80– 150 мм, затем с потоком подаваемого воздуха среду инокулируют порами продуцента. Аппараты для аэробной глубинной ферментации • наиболее сложны как конструктивно, так и с точки зрения их эксплуатации. 56

Главная задача, возникающая при их конструировании, – обеспечение высокой интенсивности массо- и энергообмена клеток со средой. Массообмен определяется транспортом (переносом) кислорода и других биогенных элементов из среды в микробную клетку и отводом из нее продуктов обмена. Кроме этого, концентрации клеток и растворенного субстрата должны быть равномерными по всему объему ферментатора. Поэтому перемешивание является также одним из основных факторов, обеспечивающих требуемую гидродинамическую обстановку в аппарате. Классификации ферментационных аппаратов для аэробной глубинной ферментации по подводу энергии для перемешивания (Виестур и др. , 1986). Согласно этой классификации аппараты такого типа делятся на три группы по подводу энергии: 1– к газовой фазе (ФГ), 2 – к жидкой фазе (ФЖ), 3 – комбинированный подвод (ФЖГ). 57

Классификация ферментаторов по способу ввода энергии для перемешивания 58

59 Ферментаторы с подводом энергии газовой фазой • Общий признак – подвод энергии в аппарат через газовую фазу, которая является ее носителем. • Ферментаторы характеризуются достаточно простой конструкцией, высокой эксплуатационной надежностью, но имеют не очень высокие массообменные характеристики. Ферментаторы с подводом энергии жидкой фазой • • Ввод энергии осуществляется жидкой фазой, обычно самовсасывающими мешалками или насосами. Они наиболее сложны по конструкции и энергоемки Ферментаторы с подводом энергии газовой и жидкой фазы • Основные элементы- это перемешивающие устройства всех известных типов, а также наличие в совокупности насосов и перемешивающих устройств. Например, аппараты с группой самовсасывающих мешалок и насосом для перекачивания культуральной жидкости. Применяются с 1944 г.

Ферментаторы с подводом энергии газовой фазой (группа ФГ) 60 а) барботажный: 1 – корпус, 2 – воздухораспределитель, 3 – карман, 4 – коллектор; б) барботажный колонный: 1 – корпус, 2 – рубашка, 3 – воздухораспределитель; в) барботажно-эрлифтный: 1 – корпус, 2 – диффузор-теплообменник, 3 – воздухораспределитель; г) газлифтный: 1 – корпус, 2 – диффузор, 3 – диспергатор, 4 – воздухораспределитель, 5 – теплообменник; д) трубчатый: 1 –пеногаситель, 2 –емкость, 3 – диспергатор, 4 – корпус, 5 – распределительная перегородка; е) с плавающей насадкой: 1 – рубашка, 2 – тарелка, 3 – насадка, 4 – корпус

Ферментаторы с вводом энергии жидкой фазой (группа ЖФ) а) с самовсасывающей мешалкой: 1 – корпус, 2 – мешалка, 3 – циркуляционный контуртеплообменник; б) эжекционный: 1 – корпус, 2 – насос, 3 – эжектор; в) струйный с затопленной струей: 1 – эжектор, 2 – теплообменник, 3 – корпус, 4 – насос, 5 – рассекатель, 6 – труба с насадкой; г) струйный с плавающей струей: 1 – теплообменник, 2 – насос, 3 – корпус, 4 – эжектор 61

4. ПРОДУКТЫ ОСНОВНОЙ БОИТЕХНОЛОГИИ ПРОДУКТЫ ТОНКОЙ БИОТЕХНОЛОГИИ 62

• Продукты основной биотехнологии – это крупнотоннажные производства с невысокой степенью очистки. – технические ферментные препараты: • протеазы • амилазы • пектиназы – пищевые добавки или сырье для их приготовления (белок одноклеточных организмов); – микробиологические средства защиты растений, часто представляющих собой высушенную культуру микроорганизмов, патогенных для насекомых-вредителей с/х; – метаболиты для использования в пище и кормах: • • первичные метаболиты – аминокислоты, витамины, кислоты (лимонная кислота), спирты, растворители; вторичные метаболиты – антибиотики для медицины 63 и ветеринарии.

Продукты основной биотехнологии Биогаз (метан) Биоудобрения Биоинсектициды Микробная биомасса Белок одноклеточных организмов Газохол (смесь этанола и бензина) Органические кислоты Полисахариды Пищевые продукты Экстракты Ферментные препараты Спирты Органические растворители Металлы, неметаллы 65
Продукты тонкой биотехнологии – 64 это комплекс процессов и производств, ориентированный на получение высокоочищенных продуктов. - высокоочищенные ферментные препараты, используемые в медицине в качестве лекарственных средств, при обработке пищевых продуктов, в качестве аналитических реагентов в клинической лабораторной диагностике и производстве - действующие основы лекарственных средств (инсулин)
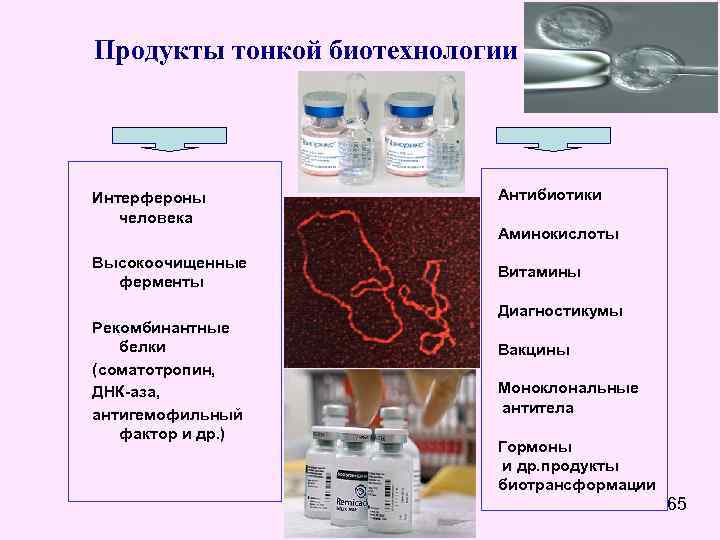
Продукты тонкой биотехнологии Интерфероны человека Высокоочищенные ферменты Рекомбинантные белки (соматотропин, ДНК-аза, антигемофильный фактор и др. ) Антибиотики Аминокислоты Витамины Диагностикумы Вакцины Моноклональные антитела Гормоны и др. продукты биотрансформации 65

КРИТЕРИИ ОЦЕНКИ ЭФФЕКТИВНОСТИ ПРОЦЕССОВ 66

Скорость роста продуцента -(увеличения биомассы) организмов с бинарным делением в хорошо перемешиваемой среде в периодической культуре будет пропорциональна концентрации микробной биомассы : d. X /dt = X, где d. X/dt – скорость роста, Х – биомасса, – коэффициент пропорциональности ( «удельная скорость роста» ). Продуктивность процесса П = qs Yp/s X [г/л·ч], где qs – скорость потребления субстрата (метаболический коэффициент), Yp/s – выход продукта (экономический коэффициент), X – концентрация биомассы, р – продукт, s – субстрат. Выход продукта (Y) (экономический коэффициент) Y = X / Sо – S, где S и Sо – конечная и исходная концентрации субстрата. Непродуктивные затраты субстрата (h) – это затраты энергии субстрата, которые не проявляются в приросте продукта. h = Y экспериментальный /Y теоретический < 1. 69

1. Скорость роста продуцента (увеличения биомассы) организмов с бинарным делением в хорошо перемешиваемой среде в периодической культуре будет пропорциональна концентрации микробной биомассы: d. X/dt= X где d. X/dt – скорость роста, X – концентрация биомассы, – коэффициент пропорциональности ( «удельная скорость роста» ); Если величина постоянна, то ln X=ln. X 0+ t где X 0 — биомасса в начальный период времени t. 67

1. • • • Продуктивность процессахарактеризуется количеством продукта, получаемого на единицу объема биореактора в единицу времени. Зависит от многих факторов: активности продуцента, значений коэффициента выхода продукта из потребительного субстрата, количества активной биомассы в ферментаторе : П=q. S Yp/s X [г/л час], где q. S – скорость потребления субстрата, Yp/s – выход продукта, X – концентрация биомассы , Р – продукт, S – субстрат. Влиять на величину продуктивности можно в результате изменения различных ее составляющих. 68

3. Выход продукта (Y) - (экономический коэффициент ) определяется как количество продукта, получаемого из данного количества субстрата: Y = X /Sо – S, где S и S 0 — конечная и исходная концентрация субстрата. Данный коэффициент выражает эффективность использования субстрата для получения целевого продукта и является очень важной характеристикой, так как непосредственно связан с продуктивностью и позволяет влиять на себестоимость конечного продукта. Физический смысл характеризует степень перехода энергии, заключенной в субстрате, в продукт. Данная величина для расчетов и прогнозирования процесса в целом используется в качестве параметра для контроля и управления ходом различных процессов и сопоставления их эффективности. 69

70 4. Конечная концентрация продукта должна планироваться с учетом продолжительности процесса и величины выхода продукта. Достижение конечной высокой концентрации продукта оправдано, когда трудоемки и дорогостоящи этапы постферментационной стадии (выделение, концентрирование). 5. Удельные энергозатраты -существенно варьируют в зависимости от направленности и схемы процесса ферментации, а также условий подготовки сырья на предферментационной стадии и от постферментационных процедур. Удельные энергозатраты очень существенно также зависят от типа ферментационного оборудования. 6. Непродуктивные затраты субстрата (h) – затраты энергии субстрата, которые не проявляются в приросте продукта. В общем виде они выражаются через экономический коэффициент: Непродуктивные затраты субстрата могут быть связаны с ошибками при считывании генетической информации в ходе быстрого роста продуцента и из-за возрастания трат энергии на поддержание жизни без размножения (транспорт субстратов и мономеров в клетке, защитные реакции, процессы репарации).

Спасибо за внимание
технол_осн_ б.т производств.ppt