Лекция 3 Первое начало термодинамики.ppt
- Количество слайдов: 24
 ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА И ТЕПЛОТЕХНИКА ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА И ТЕПЛОТЕХНИКА ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
 I начало термодинамики Открытию I начала термодинамики предшествовало: - многочисленные экспериментальные и теоретические исследования в области физики, химии, развития тепловых двигателей, принцип исключения построения вечного двигателя первого рода (1775 год – решение французской академии наук) (невозможно производить работу без получения энергии извне) - закон Гесса (1840 год) – закон о независимости теплового эффекта химической реакции от промежуточных стадий; - принцип эквивалентности тепла и работы (опыт Джоуля) (1850 год). l
I начало термодинамики Открытию I начала термодинамики предшествовало: - многочисленные экспериментальные и теоретические исследования в области физики, химии, развития тепловых двигателей, принцип исключения построения вечного двигателя первого рода (1775 год – решение французской академии наук) (невозможно производить работу без получения энергии извне) - закон Гесса (1840 год) – закон о независимости теплового эффекта химической реакции от промежуточных стадий; - принцип эквивалентности тепла и работы (опыт Джоуля) (1850 год). l
 I начало термодинамики l Пример выражения закона Гесса
I начало термодинамики l Пример выражения закона Гесса
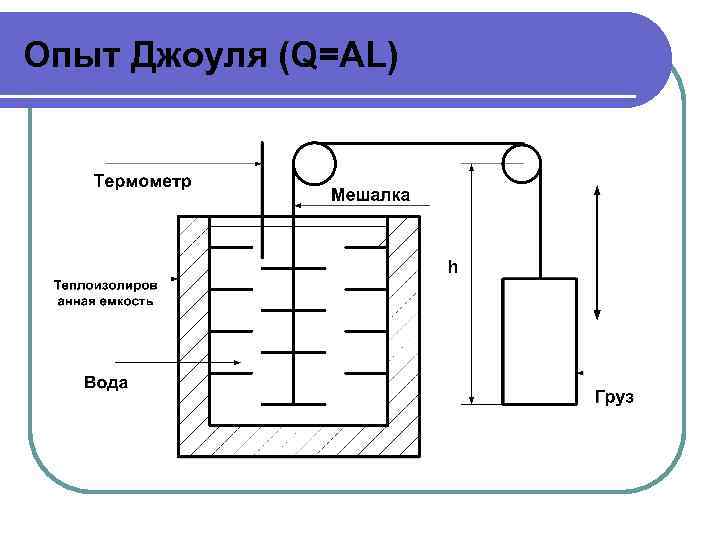 Опыт Джоуля (Q=AL)
Опыт Джоуля (Q=AL)
 Опыт Джоуля (Q=AL) l Превращение теплоты в работу и работы в теплоту осуществляется всегда в одном и том же строго постоянном количественном соотношении Q=AL А = 1 Дж/Дж – коэффициент пропорциональности, величина всегда постоянная, не зависит от способа получения теплоты и работы, не зависит от температуры.
Опыт Джоуля (Q=AL) l Превращение теплоты в работу и работы в теплоту осуществляется всегда в одном и том же строго постоянном количественном соотношении Q=AL А = 1 Дж/Дж – коэффициент пропорциональности, величина всегда постоянная, не зависит от способа получения теплоты и работы, не зависит от температуры.
 I начало термодинамики Суть первого начала термодинамики – работа совершается только за счет теплоты или какой-либо другой формы энергии l Первое начало устанавливает, что внутренняя энергия системы является функцией ее состояния и изменяется только под влиянием внешних воздействий l Все энергетические взаимодействия сводятся к передаче теплоты и работы l
I начало термодинамики Суть первого начала термодинамики – работа совершается только за счет теплоты или какой-либо другой формы энергии l Первое начало устанавливает, что внутренняя энергия системы является функцией ее состояния и изменяется только под влиянием внешних воздействий l Все энергетические взаимодействия сводятся к передаче теплоты и работы l
 I начало термодинамики Математическое определение первого начала термодинамики: изменение внутренней энергии тела или системы (ΔU=U 2 -U 1) равно алгебраической сумме подведенных из вне количества теплоты (Q*12) и работы (-L*12 ): или d. U – изменение внутренней энергии в элементарном процессе; δQ* - количество теплоты, подведенное в элементарном процессе (если δQ* >0 – теплота подводится к системе (телу), если δQ*<0 – теплота отводится от системы (тела)); δL* - элементарная внешняя эффективная работа (если δL*>0 – система сама совершает работу, если δL* <0 – над системой (к системе подводится) совершается работа).
I начало термодинамики Математическое определение первого начала термодинамики: изменение внутренней энергии тела или системы (ΔU=U 2 -U 1) равно алгебраической сумме подведенных из вне количества теплоты (Q*12) и работы (-L*12 ): или d. U – изменение внутренней энергии в элементарном процессе; δQ* - количество теплоты, подведенное в элементарном процессе (если δQ* >0 – теплота подводится к системе (телу), если δQ*<0 – теплота отводится от системы (тела)); δL* - элементарная внешняя эффективная работа (если δL*>0 – система сама совершает работу, если δL* <0 – над системой (к системе подводится) совершается работа).
 I начало термодинамики Уравнения не учитывают потери работы на необратимости, которые существуют в реальных процессах. l Полная термодинамическая работа с учетом необратимых потерь определяется как l δL= δL* +δL**, где δL** - работа необратимых потерь, превращается в теплоту внутреннего теплообмена δQ**, где δL** = δQ** > 0.
I начало термодинамики Уравнения не учитывают потери работы на необратимости, которые существуют в реальных процессах. l Полная термодинамическая работа с учетом необратимых потерь определяется как l δL= δL* +δL**, где δL** - работа необратимых потерь, превращается в теплоту внутреннего теплообмена δQ**, где δL** = δQ** > 0.
 I начало термодинамики l Выражения первое начало термодинамики по балансу рабочего тела в дифференциальной и интегральной форме: δQ = δQ* + δQ** = d. U + δL, Q 12 = Q*12 + Q**12 = U 2 - U 1 + L 12. Данные уравнения используются для анализа реальных процессов. l В условиях обратимого процесса δQ**= 0. l
I начало термодинамики l Выражения первое начало термодинамики по балансу рабочего тела в дифференциальной и интегральной форме: δQ = δQ* + δQ** = d. U + δL, Q 12 = Q*12 + Q**12 = U 2 - U 1 + L 12. Данные уравнения используются для анализа реальных процессов. l В условиях обратимого процесса δQ**= 0. l
 I начало термодинамики для простых тел l Простое тело - тело, состояние которого определяется двумя независимыми параметрами (р, v), (р, t) или (v, t) (пары, газы, жидкости, твердые изотропные тела) l Термодинамическая работа для простых тел определяется формулой
I начало термодинамики для простых тел l Простое тело - тело, состояние которого определяется двумя независимыми параметрами (р, v), (р, t) или (v, t) (пары, газы, жидкости, твердые изотропные тела) l Термодинамическая работа для простых тел определяется формулой
 I начало термодинамики для простых тел l Потенциальная работа: l l - энтальпия или теплосодержание. Теплосодержание (энтальпия) определяется суммой внутренней энергии и потенциальной функцией (pv), не имеет определенного физического смысла, но является удобной расчетной величиной, является функцией состояния.
I начало термодинамики для простых тел l Потенциальная работа: l l - энтальпия или теплосодержание. Теплосодержание (энтальпия) определяется суммой внутренней энергии и потенциальной функцией (pv), не имеет определенного физического смысла, но является удобной расчетной величиной, является функцией состояния.
 I начало термодинамики для простых тел l. I начало термодинамики для простых тел по балансу рабочего тела:
I начало термодинамики для простых тел l. I начало термодинамики для простых тел по балансу рабочего тела:
 I начало термодинамики для идеальных газов l Количество теплоты можно определить через теплоемкость: - Для изобарного процесса р=idem, - Для изохорного процесса
I начало термодинамики для идеальных газов l Количество теплоты можно определить через теплоемкость: - Для изобарного процесса р=idem, - Для изохорного процесса
 I начало термодинамики для идеальных газов l I начало термодинамики в аналитической форме: l Из закона Джоуля для идеальных газов - в изохорном процессе: - в изобарном процессе:
I начало термодинамики для идеальных газов l I начало термодинамики в аналитической форме: l Из закона Джоуля для идеальных газов - в изохорном процессе: - в изобарном процессе:
 I начало термодинамики для идеальных газов l Первое начало термодинамики для идеальных газов
I начало термодинамики для идеальных газов l Первое начало термодинамики для идеальных газов
 I начало термодинамики для идеальных газов Из первого начала термодинамики для идеальных газов следует закон Майера. l Закон Майера устанавливает равенство между разностью изобарной и изохорной теплоемкостями и удельной газовой постоянной. l Для мольных теплоемкостей: изобарная изохорная l
I начало термодинамики для идеальных газов Из первого начала термодинамики для идеальных газов следует закон Майера. l Закон Майера устанавливает равенство между разностью изобарной и изохорной теплоемкостями и удельной газовой постоянной. l Для мольных теплоемкостей: изобарная изохорная l
 Энтропия идеального газа l Согласно понятию энтропия при использовании уравнения I начала термодинамики для идеального газа
Энтропия идеального газа l Согласно понятию энтропия при использовании уравнения I начала термодинамики для идеального газа
 Энтропия идеального газа l Согласно l. В уравнению Клапейрона интегральной форме:
Энтропия идеального газа l Согласно l. В уравнению Клапейрона интегральной форме:
 I начало термодинамики для потока l Для потока справедливо уравнение первого начала термодинамики где (u 2 -u 1) определяется как Δ l u=cv(t 2 -t 1) Для определения Q 1 -2 рассмотрим канал
I начало термодинамики для потока l Для потока справедливо уравнение первого начала термодинамики где (u 2 -u 1) определяется как Δ l u=cv(t 2 -t 1) Для определения Q 1 -2 рассмотрим канал
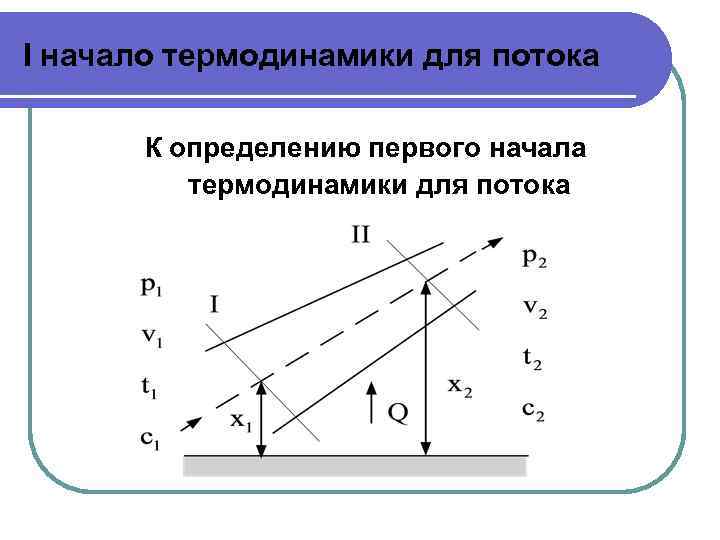 I начало термодинамики для потока К определению первого начала термодинамики для потока
I начало термодинамики для потока К определению первого начала термодинамики для потока
 I начало термодинамики для потока G - массовый расход 1) т. к. давление и объем в сечениях различны, учитываем работу проталкивания: l 2) т. к. скорости потока в сечениях различны С 1 ≠ С 2 , находим изменение кинетической энергии:
I начало термодинамики для потока G - массовый расход 1) т. к. давление и объем в сечениях различны, учитываем работу проталкивания: l 2) т. к. скорости потока в сечениях различны С 1 ≠ С 2 , находим изменение кинетической энергии:
 I начало термодинамики для потока 3) т. к. канал расположен под углом к горизонту, т. е. высоты сечений по отношению к горизонту не равны х1 ≠ х2 , учитываем изменение потенциальной работы 4) в канале может быть установлено какое-либо устройство, производящее техническую работу, тогда техническая работа равна Lтех; 5) в канале существуют силы трения потока вещества о стенки канала, поэтому учитывается работа трения Lтр.
I начало термодинамики для потока 3) т. к. канал расположен под углом к горизонту, т. е. высоты сечений по отношению к горизонту не равны х1 ≠ х2 , учитываем изменение потенциальной работы 4) в канале может быть установлено какое-либо устройство, производящее техническую работу, тогда техническая работа равна Lтех; 5) в канале существуют силы трения потока вещества о стенки канала, поэтому учитывается работа трения Lтр.
 I начало термодинамики для потока l Подставляя полученные выражения в формулу первого начала термодинамики, получим: l Перейдем к удельным единицам, поделив обе части уравнения G:
I начало термодинамики для потока l Подставляя полученные выражения в формулу первого начала термодинамики, получим: l Перейдем к удельным единицам, поделив обе части уравнения G:
 I начало термодинамики для потока Т. к. l Первое начало термодинамики для потока в интегральной форме l в дифференциальной форме
I начало термодинамики для потока Т. к. l Первое начало термодинамики для потока в интегральной форме l в дифференциальной форме


