36c3acaef44ac546eb35e301e4ce4d6c.ppt
- Количество слайдов: 25
 Tests rapides de dépistage du VIH Dr C. Delamare FORMATION CDAG/CIDDIST NANCY – 13 septembre 2011
Tests rapides de dépistage du VIH Dr C. Delamare FORMATION CDAG/CIDDIST NANCY – 13 septembre 2011
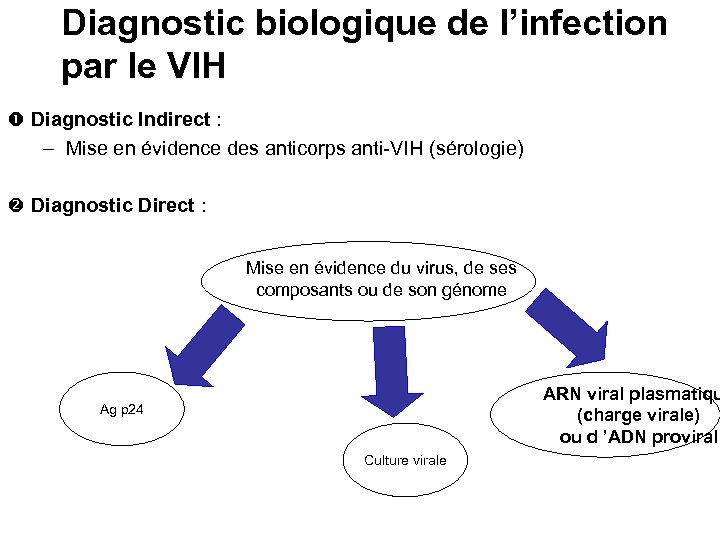 Diagnostic biologique de l’infection par le VIH Diagnostic Indirect : – Mise en évidence des anticorps anti-VIH (sérologie) Diagnostic Direct : Mise en évidence du virus, de ses composants ou de son génome ARN viral plasmatiqu (charge virale) ou d ’ADN proviral Ag p 24 Culture virale
Diagnostic biologique de l’infection par le VIH Diagnostic Indirect : – Mise en évidence des anticorps anti-VIH (sérologie) Diagnostic Direct : Mise en évidence du virus, de ses composants ou de son génome ARN viral plasmatiqu (charge virale) ou d ’ADN proviral Ag p 24 Culture virale
 Tests ELISA ou EIA 1985 1986 1987 1991 1997 Actuellement 4ème génération Techniques de dépistage des anticorps Tests de 1 ere génération : lysats de cellules infectées par VIH 1 - Faux négatifs, et spécificité médiocre Tests de 2 eme génération : Antigènes recombinants et peptides de synthèse Tests mixtes : détection des anticorps dirigés contre le VIH 1 et VIH-2 Tests sandwich (3ème génération) : - Sensibilité +++ - Spécificité +++ Tests combinés détectant simultanément les anticorps anti-VIH 1 et anti-VIH-2 et de l’antigène p 24 (4ème génération)
Tests ELISA ou EIA 1985 1986 1987 1991 1997 Actuellement 4ème génération Techniques de dépistage des anticorps Tests de 1 ere génération : lysats de cellules infectées par VIH 1 - Faux négatifs, et spécificité médiocre Tests de 2 eme génération : Antigènes recombinants et peptides de synthèse Tests mixtes : détection des anticorps dirigés contre le VIH 1 et VIH-2 Tests sandwich (3ème génération) : - Sensibilité +++ - Spécificité +++ Tests combinés détectant simultanément les anticorps anti-VIH 1 et anti-VIH-2 et de l’antigène p 24 (4ème génération)
 Recommandations de la Haute autorité de santé (HAS) Arrêté du 28 mai 2010 • Test combiné de 4 e génération • seuil de détection de l’antigène p 24 : 2 UI/ml • L’utilisation de 2 tests pour le dépistage n’est plus nécessaire • (Etude APHP sur 37 568 échantillons testés : Haute sensibilité, meilleure spécificité, réduction du cout, Dominique Costagliola , AIDS 2008, 22: 2035– 2044) • 2 prélèvements pour la confirmation d’un positif
Recommandations de la Haute autorité de santé (HAS) Arrêté du 28 mai 2010 • Test combiné de 4 e génération • seuil de détection de l’antigène p 24 : 2 UI/ml • L’utilisation de 2 tests pour le dépistage n’est plus nécessaire • (Etude APHP sur 37 568 échantillons testés : Haute sensibilité, meilleure spécificité, réduction du cout, Dominique Costagliola , AIDS 2008, 22: 2035– 2044) • 2 prélèvements pour la confirmation d’un positif
 Détection des Anticorps anti VIH Tests ELISA Microplaques §Automatisation +++ § Adaptée à de grandes séries § Traçabilité informatique § Rapide : 1 technicien =2 h 30 pour 90 échantillons §Reproductible § Sensible § Spécifique Tests EIA sur automates Haut débit rapides+++ – 1 Tests unitaires diagnostic rapide (TDR) : sérum TROD : sang capillaire
Détection des Anticorps anti VIH Tests ELISA Microplaques §Automatisation +++ § Adaptée à de grandes séries § Traçabilité informatique § Rapide : 1 technicien =2 h 30 pour 90 échantillons §Reproductible § Sensible § Spécifique Tests EIA sur automates Haut débit rapides+++ – 1 Tests unitaires diagnostic rapide (TDR) : sérum TROD : sang capillaire
 Les marqueurs de la primoinfection VIH-1 3 marqueurs biologiques ARN plasmatique viral (charge virale) antigène p 24 Anticorps anti-VIH-1
Les marqueurs de la primoinfection VIH-1 3 marqueurs biologiques ARN plasmatique viral (charge virale) antigène p 24 Anticorps anti-VIH-1
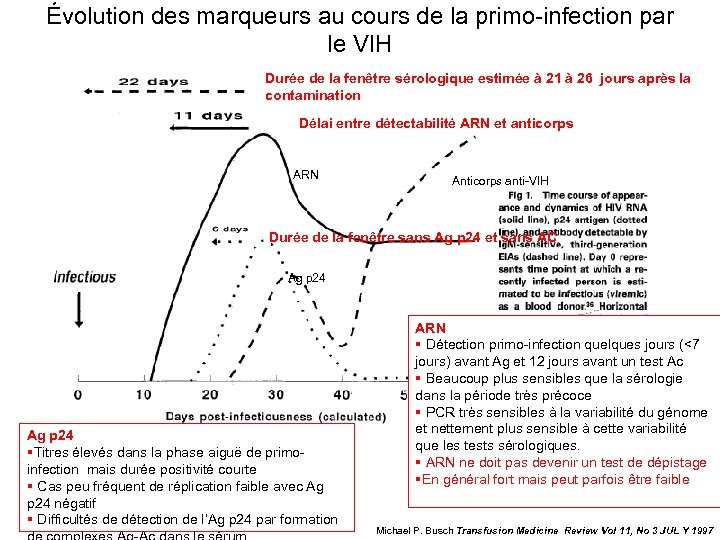 Évolution des marqueurs au cours de la primo-infection par le VIH Durée de la fenêtre sérologique estimée à 21 à 26 jours après la contamination Délai entre détectabilité ARN et anticorps ARN Anticorps anti-VIH Durée de la fenêtre sans Ag p 24 et sans AC Ag p 24 §Titres élevés dans la phase aiguë de primoinfection mais durée positivité courte § Cas peu fréquent de réplication faible avec Ag p 24 négatif § Difficultés de détection de l’Ag p 24 par formation ARN § Détection primo-infection quelques jours (<7 jours) avant Ag et 12 jours avant un test Ac § Beaucoup plus sensibles que la sérologie dans la période très précoce § PCR très sensibles à la variabilité du génome et nettement plus sensible à cette variabilité que les tests sérologiques. § ARN ne doit pas devenir un test de dépistage §En général fort mais peut parfois être faible Michael P. Busch Transfusion Medicine Review Vol 11, No 3 JUL Y 1997
Évolution des marqueurs au cours de la primo-infection par le VIH Durée de la fenêtre sérologique estimée à 21 à 26 jours après la contamination Délai entre détectabilité ARN et anticorps ARN Anticorps anti-VIH Durée de la fenêtre sans Ag p 24 et sans AC Ag p 24 §Titres élevés dans la phase aiguë de primoinfection mais durée positivité courte § Cas peu fréquent de réplication faible avec Ag p 24 négatif § Difficultés de détection de l’Ag p 24 par formation ARN § Détection primo-infection quelques jours (<7 jours) avant Ag et 12 jours avant un test Ac § Beaucoup plus sensibles que la sérologie dans la période très précoce § PCR très sensibles à la variabilité du génome et nettement plus sensible à cette variabilité que les tests sérologiques. § ARN ne doit pas devenir un test de dépistage §En général fort mais peut parfois être faible Michael P. Busch Transfusion Medicine Review Vol 11, No 3 JUL Y 1997
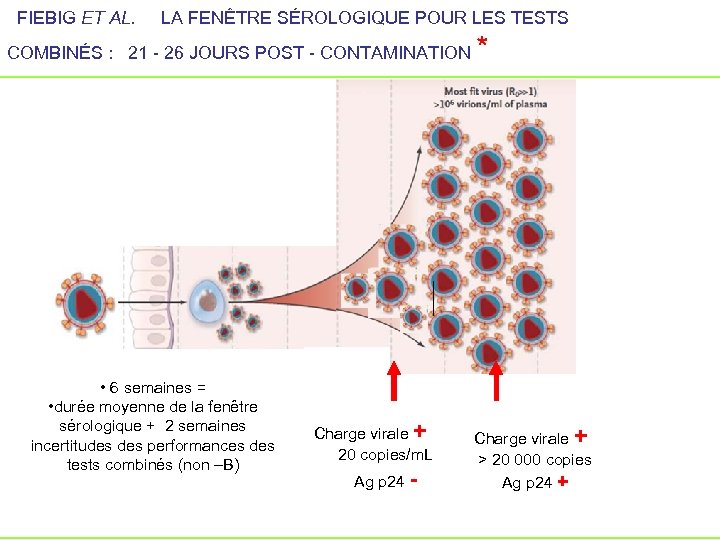 FIEBIG ET AL. LA FENÊTRE SÉROLOGIQUE POUR LES TESTS COMBINÉS : 21 - 26 JOURS POST - CONTAMINATION • 6 semaines = • durée moyenne de la fenêtre sérologique + 2 semaines incertitudes performances des tests combinés (non –B) Charge virale + 20 copies/m. L Ag p 24 - * Charge virale + > 20 000 copies Ag p 24 +
FIEBIG ET AL. LA FENÊTRE SÉROLOGIQUE POUR LES TESTS COMBINÉS : 21 - 26 JOURS POST - CONTAMINATION • 6 semaines = • durée moyenne de la fenêtre sérologique + 2 semaines incertitudes performances des tests combinés (non –B) Charge virale + 20 copies/m. L Ag p 24 - * Charge virale + > 20 000 copies Ag p 24 +
 Tests rapides de dépistage du VIH Deux arrêtés • 28 mai 2010 • 9 novembre 2010 fixant les conditions de réalisation du diagnostic biologique de l’infection à VIH 1 et 2 et les conditions de réalisation des TROD dans les situations d’urgence
Tests rapides de dépistage du VIH Deux arrêtés • 28 mai 2010 • 9 novembre 2010 fixant les conditions de réalisation du diagnostic biologique de l’infection à VIH 1 et 2 et les conditions de réalisation des TROD dans les situations d’urgence
 Arrêté du 28 mai 2010 q TROD dans certaines situations d’urgence (sang total, sérum ou plasma) q q q Réalisation par : q médecin exerçant en cabinet q q q Accident d’Exposition au Sang : patient « source » Accident d’exposition sexuelle : partenaires accouchement : statut sérologique inconnu ou exposition récente. Urgence diagnostique d’une pathologie aiguë évocatrice du sida. médecin ou biologiste médical (établissement ou service de santé) sage-femme infirmier ou technicien de laboratoire (sous la responsabilité d’un médecin ou d’un biologiste) Information du patient concernant les limites inhérentes à l’interprétation du résultat Consentement éclairé de la personne obligatoire Validation obligatoire par un test de 4 eme génération q Sur un échantillon biologique distinct
Arrêté du 28 mai 2010 q TROD dans certaines situations d’urgence (sang total, sérum ou plasma) q q q Réalisation par : q médecin exerçant en cabinet q q q Accident d’Exposition au Sang : patient « source » Accident d’exposition sexuelle : partenaires accouchement : statut sérologique inconnu ou exposition récente. Urgence diagnostique d’une pathologie aiguë évocatrice du sida. médecin ou biologiste médical (établissement ou service de santé) sage-femme infirmier ou technicien de laboratoire (sous la responsabilité d’un médecin ou d’un biologiste) Information du patient concernant les limites inhérentes à l’interprétation du résultat Consentement éclairé de la personne obligatoire Validation obligatoire par un test de 4 eme génération q Sur un échantillon biologique distinct
 Dépistage Arrêté du 9 novembre 2010 • En dehors des situations d'urgence mentionnées dans l'arrêté du 28 mai 2010 • En dehors des services ou établissements de santé cités dans l'arrêté du 28 mai 2010 • Elargissement aux : – structure de prévention habilitée – structure associative habilitée • médecin, sage-femme ou infirmier • Salarié ou bénévole, non professionnel de santé, q formation validée • TROD+ : test de 4ème génération
Dépistage Arrêté du 9 novembre 2010 • En dehors des situations d'urgence mentionnées dans l'arrêté du 28 mai 2010 • En dehors des services ou établissements de santé cités dans l'arrêté du 28 mai 2010 • Elargissement aux : – structure de prévention habilitée – structure associative habilitée • médecin, sage-femme ou infirmier • Salarié ou bénévole, non professionnel de santé, q formation validée • TROD+ : test de 4ème génération
 Tests rapide Principales caractéristiques q Test unitaire ou petites séries q Lecture visuelle et subjective q Pas d’équipements de laboratoire q Délai résultat < 30 mn q Détection Ac anti-VIH-1 et VIH-2. q Peut être confiée à des personnes ayant une expertise technique limitée q Processus de contrôle interne de qualité : «antigène non sang total VIH» qui lie les Ig présentes – évite l’utilisation de centrifugeuse et matériel de dans le sérum Positivité du laboratoire contrôle interne indispensable pour la – hémolyse des globules rouges peut gêner la validation réaction de liaison anticorps-antigène. Inconvénients q Absence d’automatisation q Non adaptable à de grandes séries q Pas de lecture code barre – Moins sensible : 1 ml de sang total présente 50% d’anticorps en moins qu’ 1 ml de plasma salive : - liquide craviculaire - Non autorisé en France - taux d’anticorps est 100 à 1000 fois inférieur à celui du plasma
Tests rapide Principales caractéristiques q Test unitaire ou petites séries q Lecture visuelle et subjective q Pas d’équipements de laboratoire q Délai résultat < 30 mn q Détection Ac anti-VIH-1 et VIH-2. q Peut être confiée à des personnes ayant une expertise technique limitée q Processus de contrôle interne de qualité : «antigène non sang total VIH» qui lie les Ig présentes – évite l’utilisation de centrifugeuse et matériel de dans le sérum Positivité du laboratoire contrôle interne indispensable pour la – hémolyse des globules rouges peut gêner la validation réaction de liaison anticorps-antigène. Inconvénients q Absence d’automatisation q Non adaptable à de grandes séries q Pas de lecture code barre – Moins sensible : 1 ml de sang total présente 50% d’anticorps en moins qu’ 1 ml de plasma salive : - liquide craviculaire - Non autorisé en France - taux d’anticorps est 100 à 1000 fois inférieur à celui du plasma
 Principes des TROD • Ag d’enveloppe : VIH-1 (gp 41) et VIH-2 (gp 36) • immunochromatographie ou filtration sur membrane • Migration du sérum déposé sur le support – par capillarité en entraînant avec lui des réactifs déjà présents sur TDR – rencontre des antigènes déposés sur la membrane lors de la filtration du sérum
Principes des TROD • Ag d’enveloppe : VIH-1 (gp 41) et VIH-2 (gp 36) • immunochromatographie ou filtration sur membrane • Migration du sérum déposé sur le support – par capillarité en entraînant avec lui des réactifs déjà présents sur TDR – rencontre des antigènes déposés sur la membrane lors de la filtration du sérum
 Etude prospective française - Hôpital Saint. Louis Sensibilité de 5 TROD sur sang capillaire et/ou salive q 200 HIV + adultes : 194 VIH-1 et 6 VIH-2 q 20 séronégatifs q 5 TROD q q Oraquick Advance: sang capillaire et salive VIKIA HIV ½ Determine HIV 1– 2 et combo INSTI HIV K Sensitivity of Five Rapid HIV Tests on Oral Fluid or Finger-Stick Whole Blood: A Real-Time Comparison in a Healthcare Setting Juliette Pavie, Anne Rachline, Benedicte Loze, Laurence Niedbalski, Constance Delaugerre, Eric Laforgerie, Jean. Christophe Plantie, Willy Rozenbaum, Sylvie Chevre, Jean-Michel Molina, Francois Simon. PLo. S ONE, July 2010,
Etude prospective française - Hôpital Saint. Louis Sensibilité de 5 TROD sur sang capillaire et/ou salive q 200 HIV + adultes : 194 VIH-1 et 6 VIH-2 q 20 séronégatifs q 5 TROD q q Oraquick Advance: sang capillaire et salive VIKIA HIV ½ Determine HIV 1– 2 et combo INSTI HIV K Sensitivity of Five Rapid HIV Tests on Oral Fluid or Finger-Stick Whole Blood: A Real-Time Comparison in a Healthcare Setting Juliette Pavie, Anne Rachline, Benedicte Loze, Laurence Niedbalski, Constance Delaugerre, Eric Laforgerie, Jean. Christophe Plantie, Willy Rozenbaum, Sylvie Chevre, Jean-Michel Molina, Francois Simon. PLo. S ONE, July 2010,
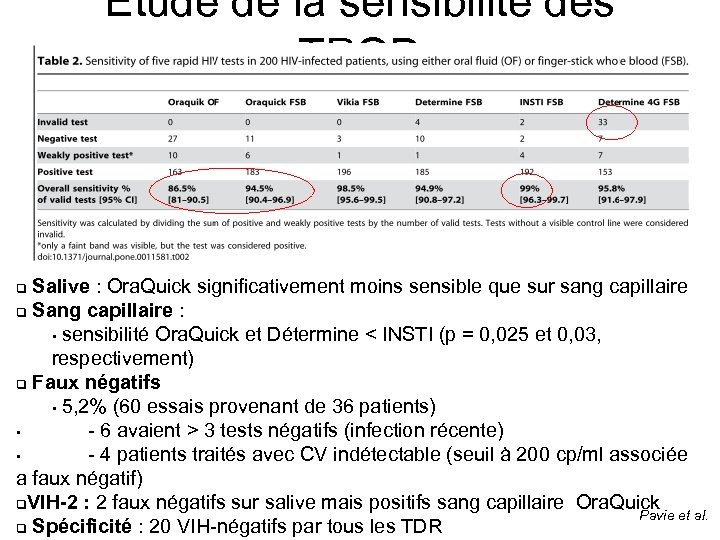 Etude de la sensibilité des TROD Salive : Ora. Quick significativement moins sensible que sur sang capillaire q Sang capillaire : • sensibilité Ora. Quick et Détermine < INSTI (p = 0, 025 et 0, 03, respectivement) q Faux négatifs • 5, 2% (60 essais provenant de 36 patients) • - 6 avaient > 3 tests négatifs (infection récente) • - 4 patients traités avec CV indétectable (seuil à 200 cp/ml associée a faux négatif) q. VIH-2 : 2 faux négatifs sur salive mais positifs sang capillaire Ora. Quick Pavie et al. q Spécificité : 20 VIH-négatifs par tous les TDR q
Etude de la sensibilité des TROD Salive : Ora. Quick significativement moins sensible que sur sang capillaire q Sang capillaire : • sensibilité Ora. Quick et Détermine < INSTI (p = 0, 025 et 0, 03, respectivement) q Faux négatifs • 5, 2% (60 essais provenant de 36 patients) • - 6 avaient > 3 tests négatifs (infection récente) • - 4 patients traités avec CV indétectable (seuil à 200 cp/ml associée a faux négatif) q. VIH-2 : 2 faux négatifs sur salive mais positifs sang capillaire Ora. Quick Pavie et al. q Spécificité : 20 VIH-négatifs par tous les TDR q
 Sensibilité sérum>sang capillaire • Faux négatifs sang capillaire : – – Oraquick : 11 Vikia : 3 Determine Ac : 10 et Ag-Ac : 7 INSTI : 2 • 18 patients avec au moins un test négatif sur sang capillaire • 12/ 18 patients : + sur le sérum
Sensibilité sérum>sang capillaire • Faux négatifs sang capillaire : – – Oraquick : 11 Vikia : 3 Determine Ac : 10 et Ag-Ac : 7 INSTI : 2 • 18 patients avec au moins un test négatif sur sang capillaire • 12/ 18 patients : + sur le sérum
 Comparaison de 8 TDR sériques • 100 patients HIV + ü 46 sous types B ü 41 sous types non-B ü 2 groupes O ü 5 HIV-2 ü WB indeterminés • 3 panels de séroconversion • 11 échantillons de séroconversion • 50 HIV- sitivity of 8 CE (European Community)-approved rapid disposable tests for anti-HIV antibody detection during and after seroconversion. Laforgerie E et al. J Virol Methods 2010
Comparaison de 8 TDR sériques • 100 patients HIV + ü 46 sous types B ü 41 sous types non-B ü 2 groupes O ü 5 HIV-2 ü WB indeterminés • 3 panels de séroconversion • 11 échantillons de séroconversion • 50 HIV- sitivity of 8 CE (European Community)-approved rapid disposable tests for anti-HIV antibody detection during and after seroconversion. Laforgerie E et al. J Virol Methods 2010
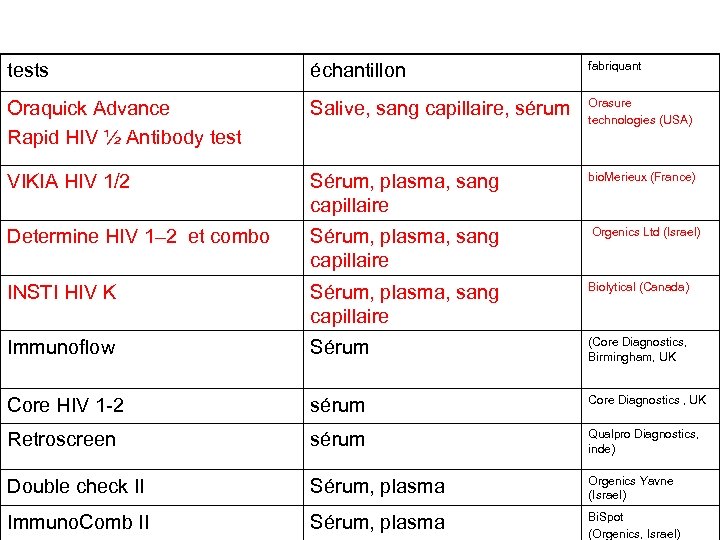 tests échantillon fabriquant Oraquick Advance Rapid HIV ½ Antibody test Salive, sang capillaire, sérum Orasure technologies (USA) VIKIA HIV 1/2 Sérum, plasma, sang capillaire bio. Merieux (France) Determine HIV 1– 2 et combo Sérum, plasma, sang capillaire Orgenics Ltd (Israel) INSTI HIV K Sérum, plasma, sang capillaire Biolytical (Canada) Immunoflow Sérum (Core Diagnostics, Birmingham, UK Core HIV 1 -2 sérum Core Diagnostics , UK Retroscreen sérum Qualpro Diagnostics, inde) Double check II Sérum, plasma Orgenics Yavne (Israel) Immuno. Comb II Sérum, plasma Bi. Spot (Orgenics, Israel)
tests échantillon fabriquant Oraquick Advance Rapid HIV ½ Antibody test Salive, sang capillaire, sérum Orasure technologies (USA) VIKIA HIV 1/2 Sérum, plasma, sang capillaire bio. Merieux (France) Determine HIV 1– 2 et combo Sérum, plasma, sang capillaire Orgenics Ltd (Israel) INSTI HIV K Sérum, plasma, sang capillaire Biolytical (Canada) Immunoflow Sérum (Core Diagnostics, Birmingham, UK Core HIV 1 -2 sérum Core Diagnostics , UK Retroscreen sérum Qualpro Diagnostics, inde) Double check II Sérum, plasma Orgenics Yavne (Israel) Immuno. Comb II Sérum, plasma Bi. Spot (Orgenics, Israel)
 Résultats discordants 1/3 sous-type A retrouvé négatifs par 3/8 tests Tous les sous types B sont détectés 100% détection des WB indéterminé s HIV 2 : 100% détection Groupe O : négatifs avec l'un des kits (Core VIH 1 & 2) 1 faux + en Determine Nb : peu d’étude avec virus non B avec les TROD, beaucoup moins d’étude qu’avec les ELISA
Résultats discordants 1/3 sous-type A retrouvé négatifs par 3/8 tests Tous les sous types B sont détectés 100% détection des WB indéterminé s HIV 2 : 100% détection Groupe O : négatifs avec l'un des kits (Core VIH 1 & 2) 1 faux + en Determine Nb : peu d’étude avec virus non B avec les TROD, beaucoup moins d’étude qu’avec les ELISA
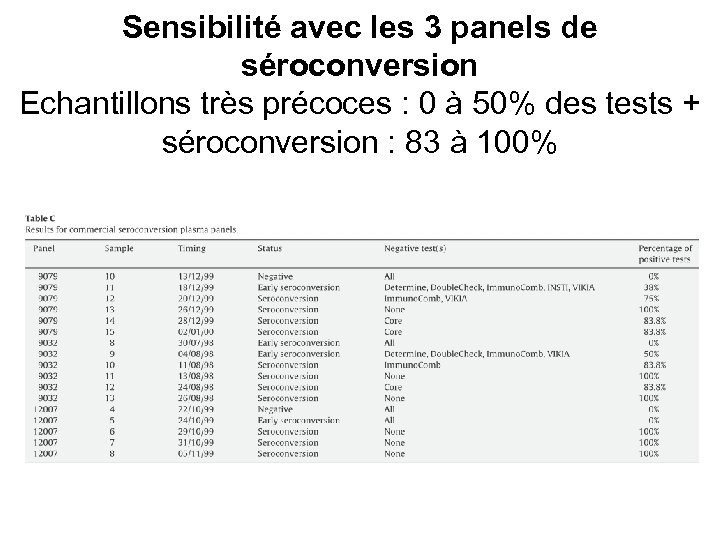 Sensibilité avec les 3 panels de séroconversion Echantillons très précoces : 0 à 50% des tests + séroconversion : 83 à 100%
Sensibilité avec les 3 panels de séroconversion Echantillons très précoces : 0 à 50% des tests + séroconversion : 83 à 100%
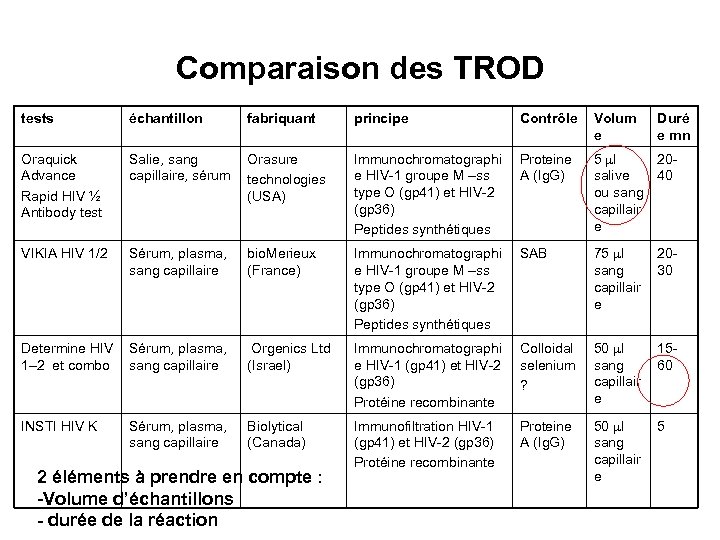 Comparaison des TROD tests échantillon fabriquant principe Contrôle Volum e Oraquick Advance Rapid HIV ½ Antibody test Salie, sang capillaire, sérum Orasure technologies (USA) Immunochromatographi e HIV-1 groupe M –ss type O (gp 41) et HIV-2 (gp 36) Peptides synthétiques Proteine A (Ig. G) 5 l 20 salive 40 ou sang capillair e VIKIA HIV 1/2 Sérum, plasma, sang capillaire bio. Merieux (France) Immunochromatographi e HIV-1 groupe M –ss type O (gp 41) et HIV-2 (gp 36) Peptides synthétiques SAB 75 l sang capillair e 2030 Determine HIV Sérum, plasma, 1– 2 et combo sang capillaire Orgenics Ltd (Israel) Immunochromatographi e HIV-1 (gp 41) et HIV-2 (gp 36) Protéine recombinante Colloidal selenium ? 50 l sang capillair e 1560 INSTI HIV K Biolytical (Canada) Immunofiltration HIV-1 (gp 41) et HIV-2 (gp 36) Protéine recombinante Proteine A (Ig. G) 50 l sang capillair e 5 Sérum, plasma, sang capillaire 2 éléments à prendre en compte : -Volume d’échantillons - durée de la réaction Duré e mn
Comparaison des TROD tests échantillon fabriquant principe Contrôle Volum e Oraquick Advance Rapid HIV ½ Antibody test Salie, sang capillaire, sérum Orasure technologies (USA) Immunochromatographi e HIV-1 groupe M –ss type O (gp 41) et HIV-2 (gp 36) Peptides synthétiques Proteine A (Ig. G) 5 l 20 salive 40 ou sang capillair e VIKIA HIV 1/2 Sérum, plasma, sang capillaire bio. Merieux (France) Immunochromatographi e HIV-1 groupe M –ss type O (gp 41) et HIV-2 (gp 36) Peptides synthétiques SAB 75 l sang capillair e 2030 Determine HIV Sérum, plasma, 1– 2 et combo sang capillaire Orgenics Ltd (Israel) Immunochromatographi e HIV-1 (gp 41) et HIV-2 (gp 36) Protéine recombinante Colloidal selenium ? 50 l sang capillair e 1560 INSTI HIV K Biolytical (Canada) Immunofiltration HIV-1 (gp 41) et HIV-2 (gp 36) Protéine recombinante Proteine A (Ig. G) 50 l sang capillair e 5 Sérum, plasma, sang capillaire 2 éléments à prendre en compte : -Volume d’échantillons - durée de la réaction Duré e mn
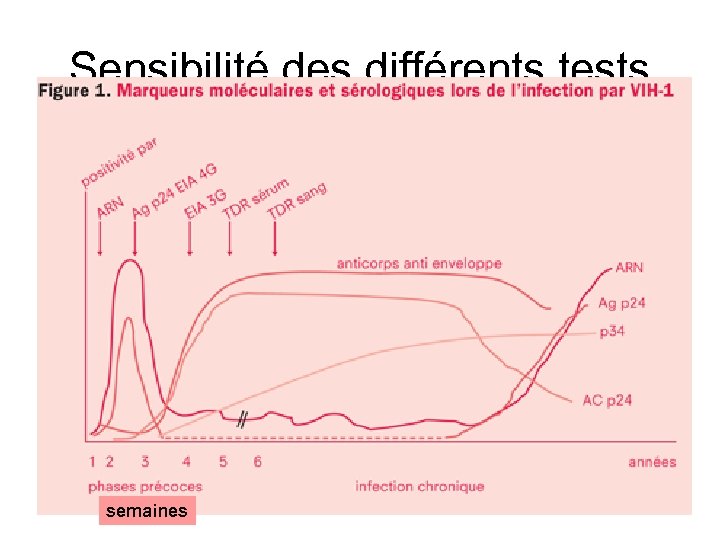 Sensibilité des différents tests semaines
Sensibilité des différents tests semaines
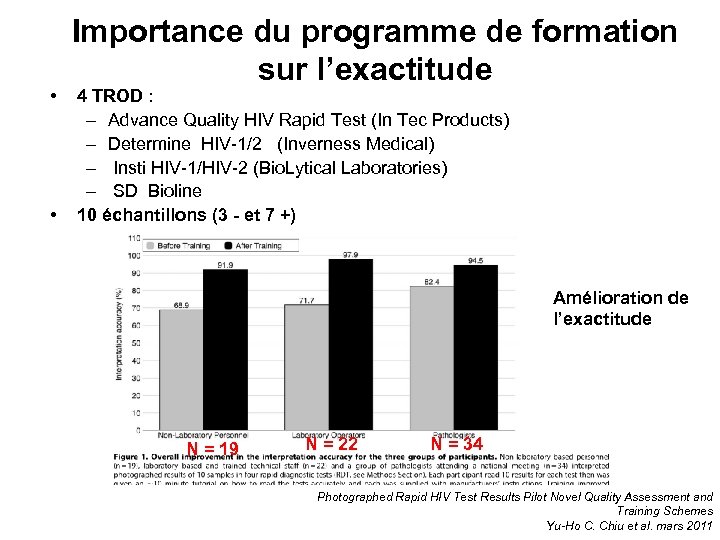 • • Importance du programme de formation sur l’exactitude 4 TROD : – Advance Quality HIV Rapid Test (In Tec Products) – Determine HIV-1/2 (Inverness Medical) – Insti HIV-1/HIV-2 (Bio. Lytical Laboratories) – SD Bioline 10 échantillons (3 - et 7 +) Amélioration de l’exactitude N = 19 N = 22 N = 34 Photographed Rapid HIV Test Results Pilot Novel Quality Assessment and Training Schemes Yu-Ho C. Chiu et al. mars 2011
• • Importance du programme de formation sur l’exactitude 4 TROD : – Advance Quality HIV Rapid Test (In Tec Products) – Determine HIV-1/2 (Inverness Medical) – Insti HIV-1/HIV-2 (Bio. Lytical Laboratories) – SD Bioline 10 échantillons (3 - et 7 +) Amélioration de l’exactitude N = 19 N = 22 N = 34 Photographed Rapid HIV Test Results Pilot Novel Quality Assessment and Training Schemes Yu-Ho C. Chiu et al. mars 2011
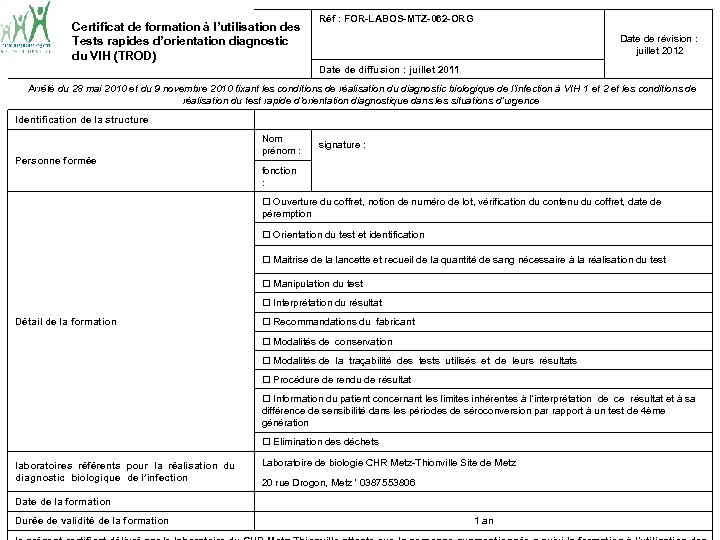 Certificat de formation à l’utilisation des Tests rapides d’orientation diagnostic du VIH (TROD) Réf : FOR-LABOS-MTZ-062 -ORG Date de révision : juillet 2012 Date de diffusion : juillet 2011 Arrêté du 28 mai 2010 et du 9 novembre 2010 fixant les conditions de réalisation du diagnostic biologique de l’infection à VIH 1 et 2 et les conditions de réalisation du test rapide d’orientation diagnostique dans les situations d’urgence Identification de la structure Personne formée Nom prénom : signature : fonction : Ouverture du coffret, notion de numéro de lot, vérification du contenu du coffret, date de péremption Orientation du test et identification Maitrise de la lancette et recueil de la quantité de sang nécessaire à la réalisation du test Manipulation du test Interprétation du résultat Détail de la formation Recommandations du fabricant Modalités de conservation Modalités de la traçabilité des tests utilisés et de leurs résultats Procédure de rendu de résultat Information du patient concernant les limites inhérentes à l’interprétation de ce résultat et à sa différence de sensibilité dans les périodes de séroconversion par rapport à un test de 4ème génération Elimination des déchets laboratoires référents pour la réalisation du diagnostic biologique de l’infection Laboratoire de biologie CHR Metz-Thionville Site de Metz Date de la formation Durée de validité de la formation 20 rue Drogon, Metz ' 0387553806 1 an
Certificat de formation à l’utilisation des Tests rapides d’orientation diagnostic du VIH (TROD) Réf : FOR-LABOS-MTZ-062 -ORG Date de révision : juillet 2012 Date de diffusion : juillet 2011 Arrêté du 28 mai 2010 et du 9 novembre 2010 fixant les conditions de réalisation du diagnostic biologique de l’infection à VIH 1 et 2 et les conditions de réalisation du test rapide d’orientation diagnostique dans les situations d’urgence Identification de la structure Personne formée Nom prénom : signature : fonction : Ouverture du coffret, notion de numéro de lot, vérification du contenu du coffret, date de péremption Orientation du test et identification Maitrise de la lancette et recueil de la quantité de sang nécessaire à la réalisation du test Manipulation du test Interprétation du résultat Détail de la formation Recommandations du fabricant Modalités de conservation Modalités de la traçabilité des tests utilisés et de leurs résultats Procédure de rendu de résultat Information du patient concernant les limites inhérentes à l’interprétation de ce résultat et à sa différence de sensibilité dans les périodes de séroconversion par rapport à un test de 4ème génération Elimination des déchets laboratoires référents pour la réalisation du diagnostic biologique de l’infection Laboratoire de biologie CHR Metz-Thionville Site de Metz Date de la formation Durée de validité de la formation 20 rue Drogon, Metz ' 0387553806 1 an
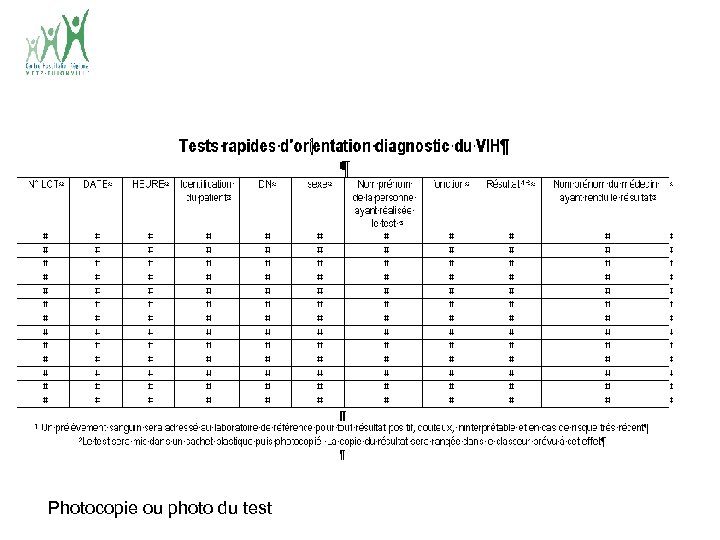 Photocopie ou photo du test
Photocopie ou photo du test


