Test water and mineral nutrition 2012.ppt
- Количество слайдов: 15

Тест – водообмен + минеральное питание 5 вопросов – 2 -3 минуты на ответ 2 балла – один вопрос, всего 10 баллов (вместе 1 балл к оценке по курсу) Подписать: Имя, Группу, Номера вопросов Вопрос переписывать не надо!

Вопрос № 1 - ДИПОЛЬ Что такое диполь? (1 балл) Каким образом дипольная природа воды влияет на её дальний транспорт? (1 балл)

Считается, что свойства воды необычны и связаны главным образом с малыми размерами молекул, с полярностью и со способностью последних соединяться ( «сцепляться» ) друг с другом при помощи водородных связей. Под полярностью подразумевают неравномерное распределение зарядов в молекуле. У воды один конец молекулы несет небольшой положительный заряд, а другой – отрицательный. Такую молекулу называют диполем. + когезия и адгезия

Вопрос № 2 – ВОДНЫЙ ПОТЕНЦИАЛ Напишите уравнение, выражающее химический потенциал воды (1 балл) и определите, где он выше – в растворе, содержащем 100 м. М К+ или 1 м. М Ca 2+? (1 балл).

Химический потенциал воды ( w) выражает максимальное количество внутренней энергии молекул воды, которое может быть превращено в работу, т. е. означает количество свободной энергии (размерность ккал/моль или Дж/моль): о + RT ln a w = w w w – химический потенциал чистой воды (принят равным нулю); аw – активность молекул воды; множитель RT необходим, чтобы перевести активность в единицы энергии.

Активность чистой воды равна единице, а внутри клетки в растворах aw меньше единицы, поэтому величина ln aw отрицательная. Таким образом, химический потенциал воды в растворах и в клетке меньший, чем в чистой воде. Водный потенциал выражает способность воды в растворе произвести работу в сравнении с работой, которую производит чистая вода в этих же условиях: Ψw = ( w- о ) w Vw где Vw – парциальный молярный объем воды, т. е. объем 1 моля воды (18, 0 см 3/моль).

Вопрос № 3 – МИКРОЭЛЕМЕНТЫ Перечислите основные микроэлементы минерального питания растений (2 балла).

Физиологические функции минеральных элементов Магний Кальц ий Желез о Марганец Цинк Медь Стабилизирует структуру рибосом. Входит в состав Mg 2+ молекулы хлорофилла, неспецифичный кофактор многих ферментов Участвует в формировании срединной пластинки (пектат кальция) клеточной стенки, стабилизатор мембран, кофактор ряда ферментов, участвующих в гидролизе АТФ и Ca 2+ фосфолипидов; вероятно, участвует в связывании РНК с белками в хромосомах, активатор хлорных каналов при возбуждении, важнейший вторичный посредник Входит в состав цитохромов и белков с негеминовым железом, участвующих в фотосинтезе, фиксации азота и Fe 2+ дыхании; катализирует первичные реакции синтеза хлорофилла Принимает участие в фотолизе воды и восстановлении СО 2 при фотосинтезе, активирует некоторые дегидрогеназы, декарбоксилазы и другие ферменты, необходим для Mn 2+ функционирования нитратредуктаз, кофактор РНКполимеразы, ауксиноксидазы Zn 2+ Составная часть алкогольдегидрогеназы, глутаматдегидрогеназы, лактатдегидрогеназы, щелочной фосфотазы и других ферментов, стабилизатор мембран Входит в состав аскорбиноксидазы, лактазы, моноаминооксидазы, уреазы, цитохромоксидазы, Cu 2+ галактооксидазы, обеспечивает терми- нальный перенос электронов в дыхательной цепи, перенос электронов при Хлороз, слабый рост Подавление роста, снижение прочности хромосом Сильный хлороз, особенно у молодых листьев Пятнистость листьев, например «серая крапчатость» у овса Деформация листьев, торможение роста Отмирание побегов
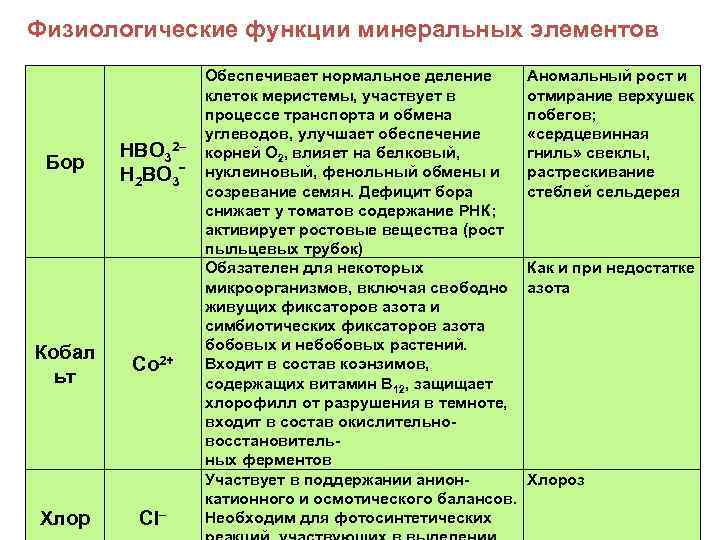
Физиологические функции минеральных элементов Бор Кобал ьт Хлор НВО 32– Н 2 ВО 3ˉ Co 2+ Cl– Обеспечивает нормальное деление клеток меристемы, участвует в процессе транспорта и обмена углеводов, улучшает обеспечение корней О 2, влияет на белковый, нуклеиновый, фенольный обмены и созревание семян. Дефицит бора снижает у томатов содержание РНК; активирует ростовые вещества (рост пыльцевых трубок) Обязателен для некоторых микроорганизмов, включая свободно живущих фиксаторов азота и симбиотических фиксаторов азота бобовых и небобовых растений. Входит в состав коэнзимов, содержащих витамин В 12, защищает хлорофилл от разрушения в темноте, входит в состав окислительновосстановительных ферментов Участвует в поддержании анионкатионного и осмотического балансов. Необходим для фотосинтетических Аномальный рост и отмирание верхушек побегов; «сердцевинная гниль» свеклы, растрескивание стеблей сельдерея Как и при недостатке азота Хлороз

Метаболизм азота Почвенные аммонифицирующие бактерии расщепляют органическое вещество почвы, выделяя NH 3, почвенные азот-фиксирующие бактерии производят NH 3, из N 2. Почвенные нитрифицирующие бактерии конвертируют NH 3 в NO 3–. Почвенные денитрифицирующие бактерии могут обратно переводить NO 3– в N 2 атмосфера почва Азот-фиксирующие бактерии нитрат и нитрогенные органические вещества экспортируются по ксилеме Денитрофицирующие в листья бактерии H+ (из почвы) Аммонифицирующие бактерии NH 4+ NH 3 (аммоний) (ион аммония) Органический материал (гумус) NH 4+ Нитрофицирующие бактерии NO 3– (нитрат) корень
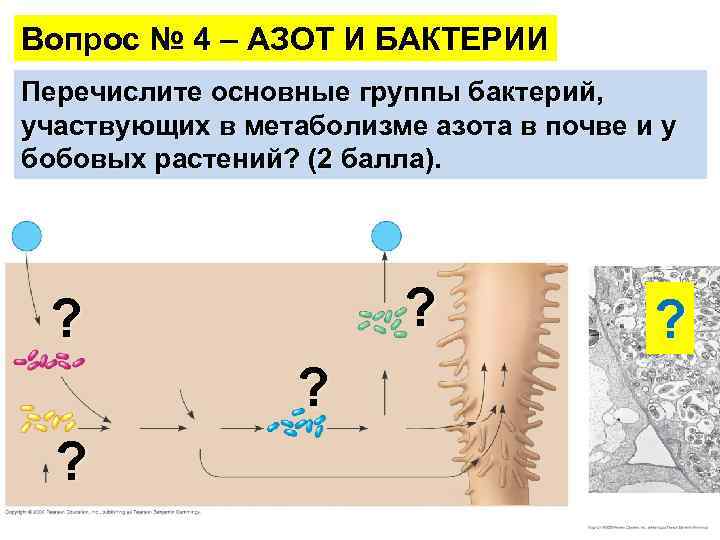
Вопрос № 4 – АЗОТ И БАКТЕРИИ Перечислите основные группы бактерий, участвующих в метаболизме азота в почве и у бобовых растений? (2 балла). ? ? ? ? ?
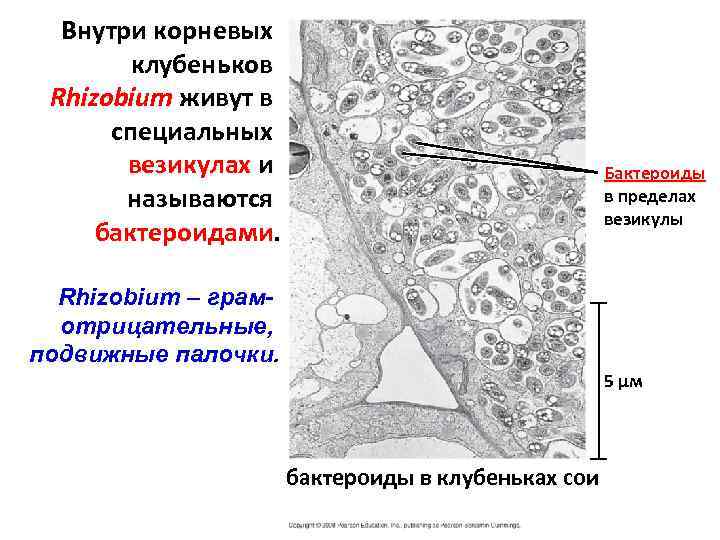
Внутри корневых клубеньков Rhizobium живут в специальных везикулах и называются бактероидами. Бактероиды в пределах везикулы Rhizobium – грамотрицательные, подвижные палочки. 5 µм бактероиды в клубеньках сои
Вопрос № 5 – ПОТЕНЦИАЛ НЕРНСТА Что такое потенциал Нернста? (1 балл). Напишите простейшее уравнение потенциала Нернста (1 балл).

Потенциал Нернста Рассмотрим клетку, находящуюся в состоянии равновесия, когда электрический потенциал иона одинаков по обе стороны плазмалемы. В этом случае нет градиента электрохимического потенциала и никакая движущая сила не действует на ион i; он проходит через мембрану в результате беспорядочного теплового движения, но при этом два противоположно направленных потока из клетки в клетку сбалансированы. Используя уравнение 7 можно записать равенство электрохимических потенциалов в виде: RT ln aнi + zi Fφн = RT ln авi + zi Fφв RT а нi Δφ = φв - φн = ―― ln ―― = φi zi F а вi (уравнение 10) (уравнение 11) Эту величину φNi называют потенциалом Нернста – это разность электрических потенциалов, необходимых для того, чтобы поддерживалось в равновесии асимметричное распределение данного иона относительно мембраны.

Потенциал Нернста Подставляя вместо констант R и F их числовые значения (0, 31 и 96, 5 соответственно) и температуру 20 о. С (293 К) и заменяя натуральный логарифм десятичным (умножив на 2, 303), уравнение 11 заметно упростится: а нi φi = 58, 2 lg -----а вi (уравнение 12) Если измеренный мембранный потенциал больше по абсолютной величине, чем вычисленный потенциал Нернста, то это означает, что электрохимический потенциал во внутренней фазе (например в цитоплазме) выше для катиона, но ниже для аниона.
Test water and mineral nutrition 2012.ppt