fcba47f46ffd11778393a81f5ee51334.ppt
- Количество слайдов: 27

Тест «Растворение» , биоэквивалентность и процедура «биовейвер» Докладчик: к. ф. н. Шохин Игорь Евгеньевич руководитель лаборатории фармакокинетики ООО «Технология лекарств» Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Оценка взаимозаменяемости воспроизведенных ЛС в РФ Ø Исследования биоэквивалентности Ø Исследования терапевтической эквивалентности Федеральный закон Российской Федерации от 12 апреля 2010 г. N 61 -ФЗ " Об обращении лекарственных средств" Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Исследования биоэквивалентности Ø Высокая стоимость (до 2 млн рублей) Ø Длительность (от полугода и более) Ø Этические проблемы (например, исследования на больных онкозаболеваниями) Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Оценка взаимозаменяемости воспроизведенных ЛС за рубежом Ø Оценка биоэквивалентности Ø Сравнительные клинические исследования Оценка эквивалентности in vitro NEW (процедура «биовейвер» ) Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Нормативная документация 1. WHO Technical Report Series 937. Annex 8. Proposal to waive in vivo bioequivalence requirements for WHO Model List of Essential Medicines immediate-release, solid oral dosage forms, 2006. 2. Guidance for Industry. Waiver of In Vivo Bioavailability and Bioequivalence Studies for Immediate-Release Solid Oral Dosage Forms Based on a Biopharmaceutics Classification System, 2000. 3. Приказ МЗ Украины № 190 «Порядок проведения дополнительных испытаний лекарственных средств при осуществлении экспертизы регистрационных материалов» , 2007. Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Нормативная документация 4. Guidance on the Investigation of Bioequivalence. European Medicines Agency (EMA), Committee for Medicinal Products of Human Use (CHMP). 2010. 5. Методические рекомендации по оценке результатов изучения сравнительной кинетики растворения лекарственных средств, а также эквивалентности in vitro генерических лекарственных средств согласно процедуре «биовейвер» . Федеральная Служба по надзору в сфере здравоохранения и социального развития. – М. , 2010. Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Процедура «биовейвер» Ø EMA: процедура «биовейвер» : I, III класс БКС Ø FDA: процедура «биовейвер» : I класс БКС Ø ВОЗ: процедура «биовейвер» : I, III класс БКС Ø МЗи. СР: процедуры «биовейвер» нет, ТСКР для оценки эквивалентности дополнительных дозировок Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Оценка эквивалентности in vitro Биовейвер – это процедура, в соответствии с которой определение взаимозаменяемости генерических лекарственных средств прово-дится на основании оценки их биофармацев-тических свойств и эквивалентности in vitro в качестве альтернативы исследованиям био-эквивалентности in vivo. Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012
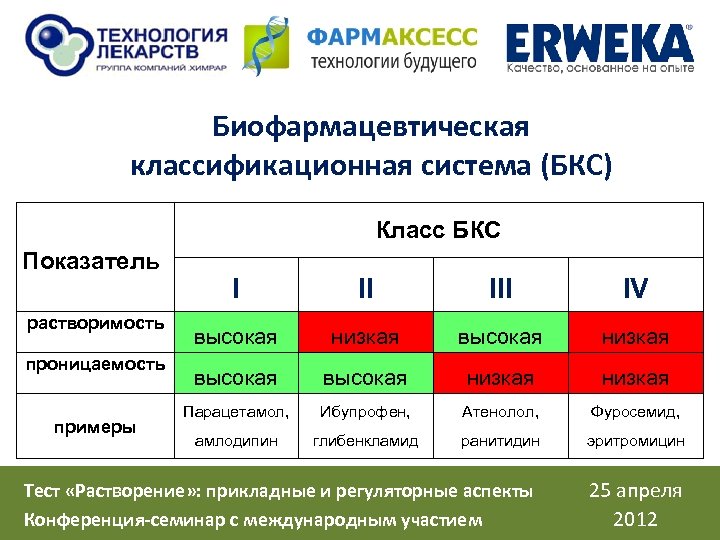
Биофармацевтическая классификационная система (БКС) Класс БКС Показатель растворимость проницаемость примеры I II IV высокая низкая Парацетамол, Ибупрофен, Атенолол, Фуросемид, амлодипин глибенкламид ранитидин эритромицин Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Растворимость (solubility) «Высокая растворимость» : соотношение между максимальной дозировкой (D, мг) твердой дозированной лекарственной формы, зарегистрированной к медицинскому применению и растворимостью (S, мг/мл), определенной в интервале р. Н 1, 2 – 6, 8 (ВОЗ, Росздравнадзор) или 1, 0 – 7, 5 (FDA), должно быть меньше или равным 250 (мл). Биофармацевтический смысл: дозировка твердой дозированной лекарственной формы должна растворяться в 1 стакане воды (250 мл), поскольку в исследованиях биоэквивалентности добровольцы запивают принятый препарат 1 стаканом воды. Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Определение растворимости Ø метод встряхивания в термостатируемой колбе Ø температура: 37 о. С Ø определение проводят при 3 значениях р. Н: 1, 2; 4, 5; 6, 8 Ø количественное определение ЛВ проводят валидированным методом Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Проницаемость (permeability) «Высокая проницаемость» : Ø кишечная проницаемость ≥ 90 % (FDA) Ø кишечная проницаемость ≥ 85 % (ВОЗ, Украина, РФ, ЕМА) Под «проницаемостью» подразумевается проницаемость действующего вещества через стенку ЖКТ Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Определение проницаемости Ø исследования методом баланса масс или абсолютной биодоступности на добровольцах in vivo; Ø исследования на моделях in situ; Ø исследования на животных in vivo; Ø оценка методом компьютерного моделирования in silico Ø исследования на моделях in vitro (через монослой культуры эпителиальных клеток, например, Caco-2). Достоверными считаются только те данные, которые были получены в исследованиях на добровольцах in vivo, дополнительно – в качественно проведенных исследованиях in vitro (EMA, 2010) Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Оценка проницаемости in vitro Ø модель – культура эпителиальных клеток Сасо-2 Ø определение проводят с использованием серии стандартных веществ (см. Перечень FDA, 2001 г. ) Ø На стадии поиска оригинальных ЛС Ø Оценка БД при закупке субстанции для дженериков Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Биовейвер для I класса БКС Ø Высвобождение более 85% активного ингредиента за 30 мин ( «быстрая» скорость растворения) в каждой из трех сред с р. Н 1, 2; 4, 5; 6, 8 Ø Эквивалентность профилей растворения в каждой из трех сред с р. Н 1, 2; 4, 5; 6, 8 при использовании вращающейся корзинки (75 об/мин) или лопастной мешалки (100 об/мин). Ø Отсутствие рисков (серьезных побочных эффектов, влияния вспомогательных веществ на всасывание). Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Биовейвер для II класса БКС Ø ЛВ – слабая кислота с «высокой» растворимостью при р. Н 6, 8 Ø Высвобождение более 85% активного ингредиента за 30 мин ( «быстрая» скорость растворения) при р. Н 6, 8 Ø Эквивалентность профилей растворения в каждой из трех сред с р. Н 1, 2; 4, 5; 6, 8 при использовании вращающейся корзинки (75 об/мин) или вращающейся лопасти (100 об/мин). Ø Отсутствие рисков (серьезных побочных эффектов, влияния вспомогательных веществ на всасывание). Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Биовейвер для III класса БКС Ø Высвобождение более 85% активного ингредиента за 15 мин ( «быстрая» скорость растворения) в каждой из трех сред с р. Н 1, 2; 4, 5; 6, 8 Ø Эквивалентность профилей сравнивать не нужно Ø Отсутствие рисков (серьезных побочных эффектов, влияния вспомогательных веществ на всасывание). Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Условия изучения кинетики растворения по процедуре «биовейвер» Ø Аппарат: вращающаяся корзинка или лопастная мешалка (DT 600, Erweka, Germany); Ø Число оборотов: 100 об/мин (для вращающейся корзинки), 75 об/мин для лопастной мешалки; Ø Среда: буферные р-ры с р. Н 1, 2; 4, 5; 6, 8. Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012
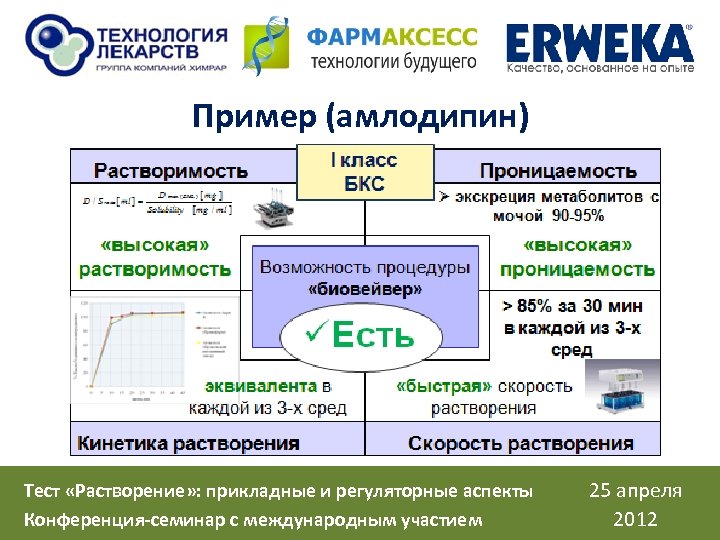
Пример (амлодипин) Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

«Монографии по биовейверу» Ø Подготовлено более 30 монографии (на февраль 2012 г. ); Ø Не носят регуляторного характера; Ø Содержат в себе наиболее полную биофармацевтических свойствах ЛВ. информацию о Ø Представляют собой обзорные статьи по биофармацевтическим и фармакокинетическим свойствам ЛВ с заключением в возможности или невозможности применения процедуры «биовейвер» Все монографии публикуются online: http: //www. fip. org/bcs Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Международное сотрудничество Совместная работа с Международной Фармацевтической Федерацией (FIP) – подготовка «монографий по биовейверу» на субстанции кетопрофена и пироксикама http: //www. fip. org/bcs Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Биоэквивалентность и биовейвер Означает ли законодательное принятие процедуры «биовейвер» полный отказ от исследований биоэквивалентности? Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Биоэквивалентность и биовейвер Ø В перечне ЖНВЛС к твердым дозированным лекарственным формам для внутреннего применения относится 266 ЛС Ø Достоверная биофармацевтическая классификация сделана только для 56 ЛС Ø Из них к I и III классу БКС относится 27 ЛC Ø I, II или III класс БКС еще не гарантирует возможность процедуры «биовейвер» Г. В. Раменская, А. Ю. Савченко, И. Е. Шохин, М. А. Котлова, Ю. И. Кулинич, Г. Ф. Василенко, В. Г. Кукес. Биофармацевтическая классификация жизненно необходимых и важнейших лекарственных средств // Фармация. – М. , 2012. – №. 5. – С. 3 -11. Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Биоэквивалентность и биовейвер В свете реализации Стратегии развития фармацевтической промышленности Российской Федерации на период до 2020 года научнообоснованное применение обоих процедур позволит обеспечить Российский рынок качественными, эффективными и безопасными ЛС Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Биоэквивалентность и биовейвер Предварительное изучение кинетики растворения согласно процедуре «биовейвер» перед подачей образцов на исследование БЭ позволит заявителям: Ø Быть уверенными в успешных результатах исследований Ø Избежать проведения дополнительных затратных исследований БЭ в случае неудовлетворительных результатов Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Наши рекомендации Ø Перед подачей образцов на исследования БЭ провести для них (при соответствии класса БКС) изучение кинетики растворения согласно процедуре «биовейвер» в трех средах Ø Перед проведением ТСКР в 3 -х средах провести фармакопейный тест «Растворение» для референтного препарата для оценки соответствия норм Ø Провести количественное определение исследуемого и референтного препаратов (различия не более 5 %) Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012

Спасибо за внимание! Тест «Растворение» : прикладные и регуляторные аспекты Конференция-семинар с международным участием 25 апреля 2012
fcba47f46ffd11778393a81f5ee51334.ppt