Тосновы термодинамики и кинетики.ppt
- Количество слайдов: 33
 Термохимия и основы термодинамики
Термохимия и основы термодинамики
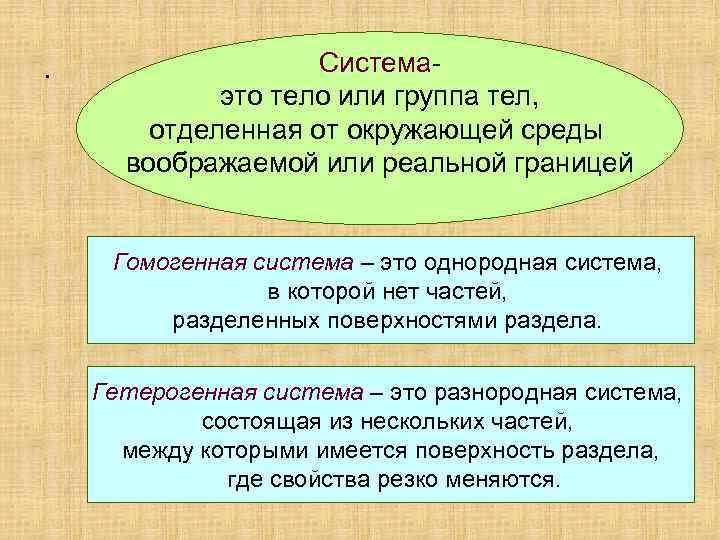 . Системаэто тело или группа тел, отделенная от окружающей среды воображаемой или реальной границей Гомогенная система – это однородная система, в которой нет частей, разделенных поверхностями раздела. Гетерогенная система – это разнородная система, состоящая из нескольких частей, между которыми имеется поверхность раздела, где свойства резко меняются.
. Системаэто тело или группа тел, отделенная от окружающей среды воображаемой или реальной границей Гомогенная система – это однородная система, в которой нет частей, разделенных поверхностями раздела. Гетерогенная система – это разнородная система, состоящая из нескольких частей, между которыми имеется поверхность раздела, где свойства резко меняются.
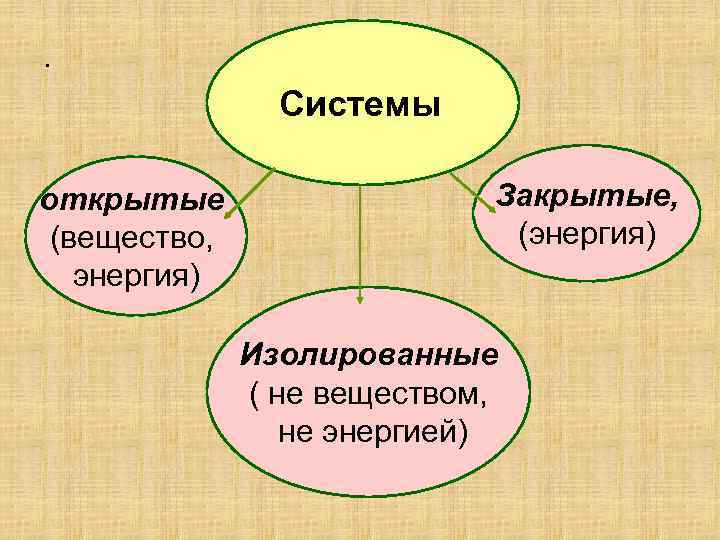 . Системы открытые (вещество, энергия) Закрытые, (энергия) Изолированные ( не веществом, не энергией)
. Системы открытые (вещество, энергия) Закрытые, (энергия) Изолированные ( не веществом, не энергией)
 Параметры состояния – величины, определяющие состояние системы (давление, температура, объем, состав системы). Состояние системы и ее изменения характеризуются функциями состояния. Они зависят от параметров состояния и не зависят от пути перехода системы из одного состояния в другое. U - внутренняя энергия, Н - энтальпия , S - энтропия, G - изобарно-изотермический потенциал (энергия Гиббса) F - изохорно-изотермический потенциал (энергия Гельмгольца
Параметры состояния – величины, определяющие состояние системы (давление, температура, объем, состав системы). Состояние системы и ее изменения характеризуются функциями состояния. Они зависят от параметров состояния и не зависят от пути перехода системы из одного состояния в другое. U - внутренняя энергия, Н - энтальпия , S - энтропия, G - изобарно-изотермический потенциал (энергия Гиббса) F - изохорно-изотермический потенциал (энергия Гельмгольца
 Внутренняя энергия - общий запас энергии, слагающийся из кинетической энергии (Екин) движения частиц системы и потенциальной энергии (Епот) их взаимодействия. Определяют изменение ∆U , которое происходит в результате обмена системы энергией с окружающей средой. Процессы бывают изотермические , изохорные, и изобарные. Полученная системой энергия расходуется на увеличение внутренней энергии и на совершение работы (ПНТ).
Внутренняя энергия - общий запас энергии, слагающийся из кинетической энергии (Екин) движения частиц системы и потенциальной энергии (Епот) их взаимодействия. Определяют изменение ∆U , которое происходит в результате обмена системы энергией с окружающей средой. Процессы бывают изотермические , изохорные, и изобарные. Полученная системой энергия расходуется на увеличение внутренней энергии и на совершение работы (ПНТ).
 1. Изохорный процесс: Qv = ΔU 2. Изобарный процесс:
1. Изохорный процесс: Qv = ΔU 2. Изобарный процесс:
 Функция Н называется энтальпией, она больше внутренней энергии системы на величину совершенной работы по расширению H = U + p. V. Для процессов, протекающих при постоянном давлении, изменение Н эквивалентно тепловому эффекту: H = U + p V = Qp. Стандартная энтальпия образования соединения f. HТ 0 равна изменению энтальпии реакции образования 1 моль этого соединения при р=101, 3 к. Па и определенной температуре из простых веществ, находящихся в стандартном состоянии. Стандартные условия: (298 К; 1, 013 ·105 Па)
Функция Н называется энтальпией, она больше внутренней энергии системы на величину совершенной работы по расширению H = U + p. V. Для процессов, протекающих при постоянном давлении, изменение Н эквивалентно тепловому эффекту: H = U + p V = Qp. Стандартная энтальпия образования соединения f. HТ 0 равна изменению энтальпии реакции образования 1 моль этого соединения при р=101, 3 к. Па и определенной температуре из простых веществ, находящихся в стандартном состоянии. Стандартные условия: (298 К; 1, 013 ·105 Па)
 Энтальпия образования соединений может быть положительной и отрицательной. Если f. H 0298 < 0 соединение более устойчиво, чем простые вещества, из которых оно образовано. Если f. H 0298 0, соединение менее устойчиво, чем простые вещества, из которых образовано вещество. Соединения, имеющие f. H 0298 0, являются химически малоустойчивыми и более реакционноспособными, чем вещества, для которых. Стандартная энтальпия простых веществ равна нулю.
Энтальпия образования соединений может быть положительной и отрицательной. Если f. H 0298 < 0 соединение более устойчиво, чем простые вещества, из которых оно образовано. Если f. H 0298 0, соединение менее устойчиво, чем простые вещества, из которых образовано вещество. Соединения, имеющие f. H 0298 0, являются химически малоустойчивыми и более реакционноспособными, чем вещества, для которых. Стандартная энтальпия простых веществ равна нулю.
 Термохимические уравнения. Закон Гесса Тепловой эффект химической реакции не зависит от пути ее протекания и определяется только начальным и конечным состояниями системы. Следствия: 1. Нпр=- Нобр 2. Н 0298 = ∑ f. Н 0298(пр-в) - ∑ f. Н 0298(и. в. )
Термохимические уравнения. Закон Гесса Тепловой эффект химической реакции не зависит от пути ее протекания и определяется только начальным и конечным состояниями системы. Следствия: 1. Нпр=- Нобр 2. Н 0298 = ∑ f. Н 0298(пр-в) - ∑ f. Н 0298(и. в. )
 C (графит) + ½ О 2 (г) СО (г) Н 2 = ? СО(г) + ½ О 2(г) СО 2(г) ; Н 3 = - 285, 5 к. Дж/моль С(графит) + О 2(г) СО 2 (г) начальное состояние С (графит) + О 2 (г) СО 2 (г) конечное , Н Н 2 Н 3 СО(г) + ½ О 2 (г) По закону Гесса: Н 1 = Н 2 + Н 3 Определяем значения Н 2, которое не измеряется экспериментально: Н 2 = Н 1 - Н 3 = = - 396 – (-285, 5) = -110, 5 к. Дж/моль
C (графит) + ½ О 2 (г) СО (г) Н 2 = ? СО(г) + ½ О 2(г) СО 2(г) ; Н 3 = - 285, 5 к. Дж/моль С(графит) + О 2(г) СО 2 (г) начальное состояние С (графит) + О 2 (г) СО 2 (г) конечное , Н Н 2 Н 3 СО(г) + ½ О 2 (г) По закону Гесса: Н 1 = Н 2 + Н 3 Определяем значения Н 2, которое не измеряется экспериментально: Н 2 = Н 1 - Н 3 = = - 396 – (-285, 5) = -110, 5 к. Дж/моль
 Энергетика и направление химических процессов Энтропия мера неупорядоченности состояния системы. Связана с термодинамической вероятностью реализации данного состояния вещества соотношением S= klg. W, где k – постоянная Больцмана; W термодинамическая вероятность, т. е. число возможных микросостояний, отвечающих данному макросостоянию вещества. Микросостояние определяется параметрами отдельной частицы, макросостояние характеризуется усредненными параметрами всей совокупности частиц.
Энергетика и направление химических процессов Энтропия мера неупорядоченности состояния системы. Связана с термодинамической вероятностью реализации данного состояния вещества соотношением S= klg. W, где k – постоянная Больцмана; W термодинамическая вероятность, т. е. число возможных микросостояний, отвечающих данному макросостоянию вещества. Микросостояние определяется параметрами отдельной частицы, макросостояние характеризуется усредненными параметрами всей совокупности частиц.
 Изменение энтропии S в результате процесса, определяется только начальным и конечным состоянием системы и не зависит от пути протекания процесса. Энтропию рассматривают при стандартных условиях. Sреакц = ∑S(продуктов) - ∑S(реагентов) Закономерности в изменении S : - усложнение молекулы ведет к росту S. Для элементарного О и веществ О 2, О 3 величина S 0298 равна 161, 205, 239 Дж/(моль К); - чем больше твердость вещества, тем меньше его энтропия. Например S 0298 (Pb) = 65, а (Cалмаз)= 2 Дж/(моль К);
Изменение энтропии S в результате процесса, определяется только начальным и конечным состоянием системы и не зависит от пути протекания процесса. Энтропию рассматривают при стандартных условиях. Sреакц = ∑S(продуктов) - ∑S(реагентов) Закономерности в изменении S : - усложнение молекулы ведет к росту S. Для элементарного О и веществ О 2, О 3 величина S 0298 равна 161, 205, 239 Дж/(моль К); - чем больше твердость вещества, тем меньше его энтропия. Например S 0298 (Pb) = 65, а (Cалмаз)= 2 Дж/(моль К);
 - чем меньше размер частиц, тем больше энтропия; - энтропия простых веществ и их соединений являются периодическим свойством. В пределах подгруппы элементов в ПС энтропия простых веществ растет. В периоде зависимость S 0298 претерпевает изменения: в ряду от натрия к кремнию S 0298 уменьшается (возрастает твердость), затем растет. Стандартная энтропия простых веществ не равна нулю.
- чем меньше размер частиц, тем больше энтропия; - энтропия простых веществ и их соединений являются периодическим свойством. В пределах подгруппы элементов в ПС энтропия простых веществ растет. В периоде зависимость S 0298 претерпевает изменения: в ряду от натрия к кремнию S 0298 уменьшается (возрастает твердость), затем растет. Стандартная энтропия простых веществ не равна нулю.
 Для учета одновременного изменения H и S введена термодинамическая функция G – энергия Гиббса. Согласно второму началу термодинамики изменение энергии Гиббса равно: G = H - T S Отражает две тенденции: стремление к минимуму энергии и стремление к максимуму энтропии. - G 0, протекание реакции принципиально возможно, но на практике может не осуществляться из-за кинетических трудностей. - G 0, то процесс принципиально невозможен. - G = 0, наступает химическое равновесие.
Для учета одновременного изменения H и S введена термодинамическая функция G – энергия Гиббса. Согласно второму началу термодинамики изменение энергии Гиббса равно: G = H - T S Отражает две тенденции: стремление к минимуму энергии и стремление к максимуму энтропии. - G 0, протекание реакции принципиально возможно, но на практике может не осуществляться из-за кинетических трудностей. - G 0, то процесс принципиально невозможен. - G = 0, наступает химическое равновесие.
 Химическая кинетика и равновесие
Химическая кинетика и равновесие
 Химические реакции могут протекать в однородной фазе (гомогенные): HCl + Na. OH = Na. Cl + H 2 O и на границе раздела фаз (гетерогенные) : Zn + 2 HCl = H 2 + Zn. Cl 2 Скорость гетерогенной реакции - это изменение количества вещества, вступающего в реакцию ( или образующегося) за единицу времени на единице поверхности раздела фаз: Vгетер = ± ∆n / (∆ S) (1)
Химические реакции могут протекать в однородной фазе (гомогенные): HCl + Na. OH = Na. Cl + H 2 O и на границе раздела фаз (гетерогенные) : Zn + 2 HCl = H 2 + Zn. Cl 2 Скорость гетерогенной реакции - это изменение количества вещества, вступающего в реакцию ( или образующегося) за единицу времени на единице поверхности раздела фаз: Vгетер = ± ∆n / (∆ S) (1)
 изменение количества вещества, вступающего в реакцию ( или образующегося) за единицу времени в единице объема системы: Vгом. = ± ∆n / (∆ V) (2) С = ∆n/V (С- молярная конц-я), Vгом. = ± ∆С / ∆ (3) Скорость реакции зависит от различных факторов: -природа реагирующих веществ; -концентрация реагентов; -температура; -присутствие катализатора.
изменение количества вещества, вступающего в реакцию ( или образующегося) за единицу времени в единице объема системы: Vгом. = ± ∆n / (∆ V) (2) С = ∆n/V (С- молярная конц-я), Vгом. = ± ∆С / ∆ (3) Скорость реакции зависит от различных факторов: -природа реагирующих веществ; -концентрация реагентов; -температура; -присутствие катализатора.
 природы реагирующих веществ Вещества с ионными и ковалентными полярными связями в водных растворах реагируют с высокими скоростями. Ионы легко реагируют друг с другом. KCl + Ag. NO 3 Ag. Cl + Na. NO 3 Ag+ + Cl- Ag. Cl Вещества с неполярными и малополярными связями взаимодействуют с различной V. Все зависит от их химической активности. Взаимодействия H 2 с F 2 протекает очень быстро (со взрывом) при комнатной температуре, а реакция между H 2 и Br 2 идет медленно при нагревании: Н 2 + F 2 2 HF H 2 +Br 2 2 HBr
природы реагирующих веществ Вещества с ионными и ковалентными полярными связями в водных растворах реагируют с высокими скоростями. Ионы легко реагируют друг с другом. KCl + Ag. NO 3 Ag. Cl + Na. NO 3 Ag+ + Cl- Ag. Cl Вещества с неполярными и малополярными связями взаимодействуют с различной V. Все зависит от их химической активности. Взаимодействия H 2 с F 2 протекает очень быстро (со взрывом) при комнатной температуре, а реакция между H 2 и Br 2 идет медленно при нагревании: Н 2 + F 2 2 HF H 2 +Br 2 2 HBr
 Взаимодействие между молекулами возможно при взаимном столкновении, когда атомы одной молекулы попадают в сферу действия электрических полей, создаваемых атомами другой. В этих условиях происходят переходы электронов и образуются новые молекулы. Чем больше число соударений (выше концентрация), тем больше V. Закон действующих масс (з-н Гульдберга и Вааге): При постоянной температуре скорость реакции прямо пропорциональна произведению
Взаимодействие между молекулами возможно при взаимном столкновении, когда атомы одной молекулы попадают в сферу действия электрических полей, создаваемых атомами другой. В этих условиях происходят переходы электронов и образуются новые молекулы. Чем больше число соударений (выше концентрация), тем больше V. Закон действующих масс (з-н Гульдберга и Вааге): При постоянной температуре скорость реакции прямо пропорциональна произведению
 2 А + В С V = k C A 2 C B CA и CB - концентрации А и В соответственно; k – константа скорости реакции. k зависит от природы реагирующих веществ, температуры и наличия катализатора, но не зависит от их концентрации. Равна скорости реакции в условиях, когда С каждого из исходных веществ- 1 моль/л. Закон действия масс справедлив для простых реакций. Если реакция протекает через ряд последовательных или параллельных стадий, то закон применим к каждой из них в отдельности, но не к реакции в целом.
2 А + В С V = k C A 2 C B CA и CB - концентрации А и В соответственно; k – константа скорости реакции. k зависит от природы реагирующих веществ, температуры и наличия катализатора, но не зависит от их концентрации. Равна скорости реакции в условиях, когда С каждого из исходных веществ- 1 моль/л. Закон действия масс справедлив для простых реакций. Если реакция протекает через ряд последовательных или параллельных стадий, то закон применим к каждой из них в отдельности, но не к реакции в целом.
 Концентрации твердых веществ в кинетическое уравнение реакции не входят. Для гетерогенной реакции WO 3(тв) + 3 H 2 (г) W(тв) + 3 H 2 O(г) кинетическое уравнение имеет вид: V=k CH 23 Реакции классифицируются по двум параметрам: по молекулярности и по порядку реакции. Молекулярность определяется числом молекул, одновременным взаимодействием которых осуществляется химическое превращение. Бывают моно-, би-, тримолекулярные реакции. Вероятность одновременного столкновения трех молекул очень мала.
Концентрации твердых веществ в кинетическое уравнение реакции не входят. Для гетерогенной реакции WO 3(тв) + 3 H 2 (г) W(тв) + 3 H 2 O(г) кинетическое уравнение имеет вид: V=k CH 23 Реакции классифицируются по двум параметрам: по молекулярности и по порядку реакции. Молекулярность определяется числом молекул, одновременным взаимодействием которых осуществляется химическое превращение. Бывают моно-, би-, тримолекулярные реакции. Вероятность одновременного столкновения трех молекул очень мала.
 Такие реакции протекают более сложным путем – через последовательные или параллельные стадии. Мономолекулярная реакция : I 2 2 I, V = k CI 2 Бимолекулярная реакция: H 2 +I 2 2 HI V=k CI 2 CH 2 или 2 HI H 2 +I 2 V = k CHI 2 Тримолекулярные реакции: 2 NO +O 2 2 NO 2 V=k CNO 2 CO 2
Такие реакции протекают более сложным путем – через последовательные или параллельные стадии. Мономолекулярная реакция : I 2 2 I, V = k CI 2 Бимолекулярная реакция: H 2 +I 2 2 HI V=k CI 2 CH 2 или 2 HI H 2 +I 2 V = k CHI 2 Тримолекулярные реакции: 2 NO +O 2 2 NO 2 V=k CNO 2 CO 2
 Порядок реакции по компоненту – это степень, в которой С вещества входит в кинетическое уравнение. а. А + b. В с. С +d. Д, V = k C Аа. C Вb. Общий порядок - n =а+b , порядок по А равен а, по В – b. Реакции подразделяются на реакции первого, второго и третьего порядка. Для простых реакции порядок реакции и молекулярность совпадают. Для многостадийных процессов - нет. Скорость всего процесса определяется наименьшей V, с которой протекает одна из стадий. Кинетическое уравнение
Порядок реакции по компоненту – это степень, в которой С вещества входит в кинетическое уравнение. а. А + b. В с. С +d. Д, V = k C Аа. C Вb. Общий порядок - n =а+b , порядок по А равен а, по В – b. Реакции подразделяются на реакции первого, второго и третьего порядка. Для простых реакции порядок реакции и молекулярность совпадают. Для многостадийных процессов - нет. Скорость всего процесса определяется наименьшей V, с которой протекает одна из стадий. Кинетическое уравнение
 реакции. Правило Вант-Гоффа : При повышении температуры на 10 С скорость химической реакции увеличивается в 2 -4 раза. - температурный коэффициент, показывает во сколько раз изменяется V при изменении t на 10 С, Общее число столкновений молекул при росте t на 10 возрастает лишь в 1, 6 раза, а число прореагировавших возрастает на 200 - 400%. С. Аррениус - увеличивается число активных молекул, столкновение
реакции. Правило Вант-Гоффа : При повышении температуры на 10 С скорость химической реакции увеличивается в 2 -4 раза. - температурный коэффициент, показывает во сколько раз изменяется V при изменении t на 10 С, Общее число столкновений молекул при росте t на 10 возрастает лишь в 1, 6 раза, а число прореагировавших возрастает на 200 - 400%. С. Аррениус - увеличивается число активных молекул, столкновение
 Энергия активации(Еа)это энергия, которой должны обладать молекулы для эффективного столкновения; R – универсальная газовая постоянная (8, 31 Дж/(моль*К), Т -температура (К), k-константа скорости реакции.
Энергия активации(Еа)это энергия, которой должны обладать молекулы для эффективного столкновения; R – универсальная газовая постоянная (8, 31 Дж/(моль*К), Т -температура (К), k-константа скорости реакции.
 веществ, образуется неустойчивое промежуточное соединение активированный комплекс, обладающее большим запасом энергии. При его распаде образуются продукты реакции. Разность между энергией активированного комплекса и средней энергией исходных молекул и есть энергия активации. 4. Влияние катализатора на скорость химической реакции Катализаторы -вещества, которые изменяют скорость реакции, а сами к концу процесса остаются неизменным как
веществ, образуется неустойчивое промежуточное соединение активированный комплекс, обладающее большим запасом энергии. При его распаде образуются продукты реакции. Разность между энергией активированного комплекса и средней энергией исходных молекул и есть энергия активации. 4. Влияние катализатора на скорость химической реакции Катализаторы -вещества, которые изменяют скорость реакции, а сами к концу процесса остаются неизменным как
 Суть катализа состоит в том, что катализатор (положительный катализ), образуя с реагентом промежуточное соединение, понижает энергию активации реакции. A +B = AB A + K = AK AK + B = AB + K При отрицательном катализе (ингибирование) энергия активации увеличивается.
Суть катализа состоит в том, что катализатор (положительный катализ), образуя с реагентом промежуточное соединение, понижает энергию активации реакции. A +B = AB A + K = AK AK + B = AB + K При отрицательном катализе (ингибирование) энергия активации увеличивается.
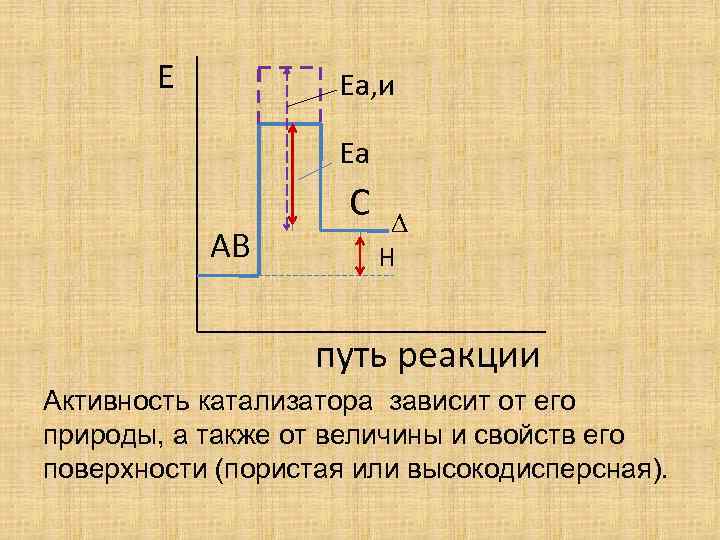 Е Еа, и Еа АВ С Н путь реакции Активность катализатора зависит от его природы, а также от величины и свойств его поверхности (пористая или высокодисперсная).
Е Еа, и Еа АВ С Н путь реакции Активность катализатора зависит от его природы, а также от величины и свойств его поверхности (пористая или высокодисперсная).
 Химическое равновесие Большинство химических процессов являются обратимыми. Для общего случая можно записать a. A + b. B c. C + d. D Скорость прямой реакции имеет выражение V 1 = k 1[A]a[B]b. По мере снижения С реагентов она убывает. Накопление продуктов реакции создает условия для протекания обратного процесса, скорость которого V 2 = k 2[C]c[D]d возрастает.
Химическое равновесие Большинство химических процессов являются обратимыми. Для общего случая можно записать a. A + b. B c. C + d. D Скорость прямой реакции имеет выражение V 1 = k 1[A]a[B]b. По мере снижения С реагентов она убывает. Накопление продуктов реакции создает условия для протекания обратного процесса, скорость которого V 2 = k 2[C]c[D]d возрастает.
 Через некоторое время скорости уравняются. Состояние системы, при котором скорости прямой и обратной реакции равны, называется химическим равновесием. Концентрации реагентов и продуктов, отвечающие состоянию равновесия, называются равновесными концентрациями. Если скорости равны Oтношение их констант – величинa постоянная (константа равновесия)
Через некоторое время скорости уравняются. Состояние системы, при котором скорости прямой и обратной реакции равны, называется химическим равновесием. Концентрации реагентов и продуктов, отвечающие состоянию равновесия, называются равновесными концентрациями. Если скорости равны Oтношение их констант – величинa постоянная (константа равновесия)
 равновесных концентраций веществ левой и правой частей уравнения, возведенных в степени их стехиометрических коэффициентов, представляют постоянную величину, независимо от условий, при которых осуществляется реакция, если температура остается постоянной. Химическое равновесия -динамическое. Уравнение Вант –Гоффа : ∆G =∆G + RT ln. Kр. При ∆G=0 ∆G = -RTln. Kр, По ∆G можно найти Кр и рассчитать равновесные С
равновесных концентраций веществ левой и правой частей уравнения, возведенных в степени их стехиометрических коэффициентов, представляют постоянную величину, независимо от условий, при которых осуществляется реакция, если температура остается постоянной. Химическое равновесия -динамическое. Уравнение Вант –Гоффа : ∆G =∆G + RT ln. Kр. При ∆G=0 ∆G = -RTln. Kр, По ∆G можно найти Кр и рассчитать равновесные С
 Внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению равновесия в направлении, при котором эффект произведенного воздействия ослабляется. Температура – ее повышение ускоряет прямую и обратную реакции в разной степени. Эндотермический процесс ускоряется больше. повышение температуры способствует смещению равновесия в сторону эндотермической реакции. Давление (газовая фаза). Если реакция
Внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению равновесия в направлении, при котором эффект произведенного воздействия ослабляется. Температура – ее повышение ускоряет прямую и обратную реакции в разной степени. Эндотермический процесс ускоряется больше. повышение температуры способствует смещению равновесия в сторону эндотермической реакции. Давление (газовая фаза). Если реакция
 из реагентов равновесие смещается вправо, при добавлении одного из продуктов превращения равновесие смещается влево. Использование катализаторов не смещает равновесие, т. к. ускоряет (замедляет) скорость как прямой, так и обратной реакции, но способствует более быстрому установлению равновесия. Пример: 3 H 2+N 2 2 NH 3; Н 0 сместить ХР вправо можно: 1. Увеличивая [N 2]или [H 2], или уменьшая [NH 3] 2. Повысив давление, Р
из реагентов равновесие смещается вправо, при добавлении одного из продуктов превращения равновесие смещается влево. Использование катализаторов не смещает равновесие, т. к. ускоряет (замедляет) скорость как прямой, так и обратной реакции, но способствует более быстрому установлению равновесия. Пример: 3 H 2+N 2 2 NH 3; Н 0 сместить ХР вправо можно: 1. Увеличивая [N 2]или [H 2], или уменьшая [NH 3] 2. Повысив давление, Р


