2 Первый закон термодин.ppt
- Количество слайдов: 16
![ТЕРМОДИНАМИКА Термодинамика [др. -греч. теплый, жаркий, горячий и δ имеющий силу] – область физики, ТЕРМОДИНАМИКА Термодинамика [др. -греч. теплый, жаркий, горячий и δ имеющий силу] – область физики,](https://present5.com/presentation/20845113_52262682/image-1.jpg) ТЕРМОДИНАМИКА Термодинамика [др. -греч. теплый, жаркий, горячий и δ имеющий силу] – область физики, исследующая процессы преобразования теплоты в работу и другие виды энергии. Термодинамическая система – это конкретный объект, например, сосуд, в котором происходит химическая реакция, газ в замкнутом сосуде или кусок плавящегося льда в стакане. Окружающая среда есть то, что находится вне границ термодинамической системы, но может обмениваться с системой веществом и энергией, например, стакан со льдом – система, а нагреватель – окружающая среда,
ТЕРМОДИНАМИКА Термодинамика [др. -греч. теплый, жаркий, горячий и δ имеющий силу] – область физики, исследующая процессы преобразования теплоты в работу и другие виды энергии. Термодинамическая система – это конкретный объект, например, сосуд, в котором происходит химическая реакция, газ в замкнутом сосуде или кусок плавящегося льда в стакане. Окружающая среда есть то, что находится вне границ термодинамической системы, но может обмениваться с системой веществом и энергией, например, стакан со льдом – система, а нагреватель – окружающая среда,
 1. ТЕМПЕРАТУРА СИСТЕМЫ Кинетическая энергия (энергия поступательного движения) (1) Энергия частицы, обладающей только поступательным движением, прямо пропорциональна температуре (2) где k – постоянная Больцмана; T – абсолютная температура. Из уравнений (1) и (2) следует
1. ТЕМПЕРАТУРА СИСТЕМЫ Кинетическая энергия (энергия поступательного движения) (1) Энергия частицы, обладающей только поступательным движением, прямо пропорциональна температуре (2) где k – постоянная Больцмана; T – абсолютная температура. Из уравнений (1) и (2) следует
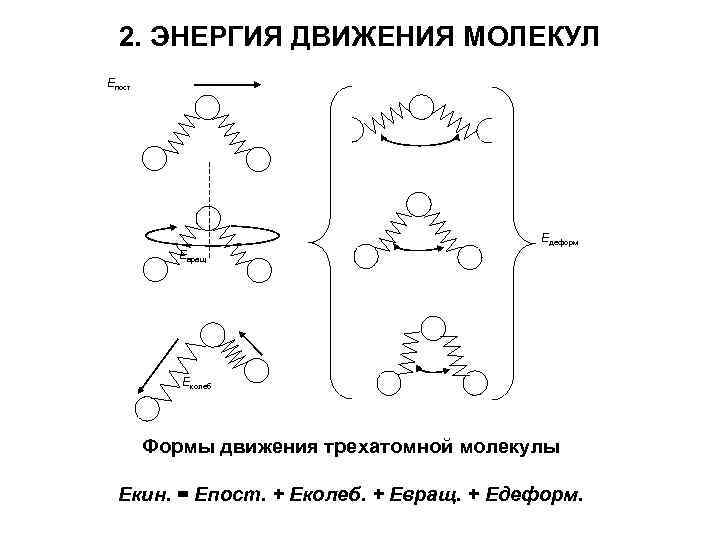 2. ЭНЕРГИЯ ДВИЖЕНИЯ МОЛЕКУЛ Епост Едеформ Евращ Еколеб Формы движения трехатомной молекулы Екин. = Епост. + Еколеб. + Евращ. + Едеформ.
2. ЭНЕРГИЯ ДВИЖЕНИЯ МОЛЕКУЛ Епост Едеформ Евращ Еколеб Формы движения трехатомной молекулы Екин. = Епост. + Еколеб. + Евращ. + Едеформ.
 3. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ Для системы (тела), состоящей из громадного числа микрочастиц (атомов, молекул, ионов) разной массы и совершающих разнообразные движения, температура системы определяется энергией движения микрочастиц, например, поступательного, вращательного, колебательного, деформационного движения. Температура системы Т определяется средней кинетической энергией микрочастиц, составляющих систему. Для одноатомного газа температура определяется энергией поступательного движения :
3. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ Для системы (тела), состоящей из громадного числа микрочастиц (атомов, молекул, ионов) разной массы и совершающих разнообразные движения, температура системы определяется энергией движения микрочастиц, например, поступательного, вращательного, колебательного, деформационного движения. Температура системы Т определяется средней кинетической энергией микрочастиц, составляющих систему. Для одноатомного газа температура определяется энергией поступательного движения :
 6. АБСОЛЮТНАЯ ШКАЛА ТЕМПЕРАТУР Экспериментально установлено, что в газовом термометре отношение давлений газа в кипящей воде и плавящемся льду равно: (1) 1. Примем, что отношение давлений прямо пропорционально отношению температур где и Тогда (2) (3) 2. Примем, что разность температур равна 100 (4) При совместном решении уравнений (3) и (4) получим, что температура кипения воды равна 373. 15 К, а температура плавления льда равна 273. 15 К. Абсолютная шкала температур охватывает диапазон температур от 0 до любого положительного значения Т.
6. АБСОЛЮТНАЯ ШКАЛА ТЕМПЕРАТУР Экспериментально установлено, что в газовом термометре отношение давлений газа в кипящей воде и плавящемся льду равно: (1) 1. Примем, что отношение давлений прямо пропорционально отношению температур где и Тогда (2) (3) 2. Примем, что разность температур равна 100 (4) При совместном решении уравнений (3) и (4) получим, что температура кипения воды равна 373. 15 К, а температура плавления льда равна 273. 15 К. Абсолютная шкала температур охватывает диапазон температур от 0 до любого положительного значения Т.
 7. ВНУТРЕННЯЯ ЭНЕРГИЯ СИСТЕМЫ В химии рассматривают неподвижные системы (сосуды, реакторы с химическими соединениями). Изменение энергетического состояния таких систем определяется изменением их внутренней энергии △U. Внутренняя энергия U есть сумма кинетической Е(кин. ) и потенциальной Е(пот. ) энергии всех микрочастиц системы: U = Е(кин. ) + Е(пот. ) Кинетическая энергия – это энергия поступательного, вращательного, колебательного, деформационного и др. видов движения микрочастиц. Потенциальная энергия – это энергия межмолекулярного и внутримолекулярного взаимодействия (притяжения и отталкивания) микрочастиц, составляющих систему.
7. ВНУТРЕННЯЯ ЭНЕРГИЯ СИСТЕМЫ В химии рассматривают неподвижные системы (сосуды, реакторы с химическими соединениями). Изменение энергетического состояния таких систем определяется изменением их внутренней энергии △U. Внутренняя энергия U есть сумма кинетической Е(кин. ) и потенциальной Е(пот. ) энергии всех микрочастиц системы: U = Е(кин. ) + Е(пот. ) Кинетическая энергия – это энергия поступательного, вращательного, колебательного, деформационного и др. видов движения микрочастиц. Потенциальная энергия – это энергия межмолекулярного и внутримолекулярного взаимодействия (притяжения и отталкивания) микрочастиц, составляющих систему.
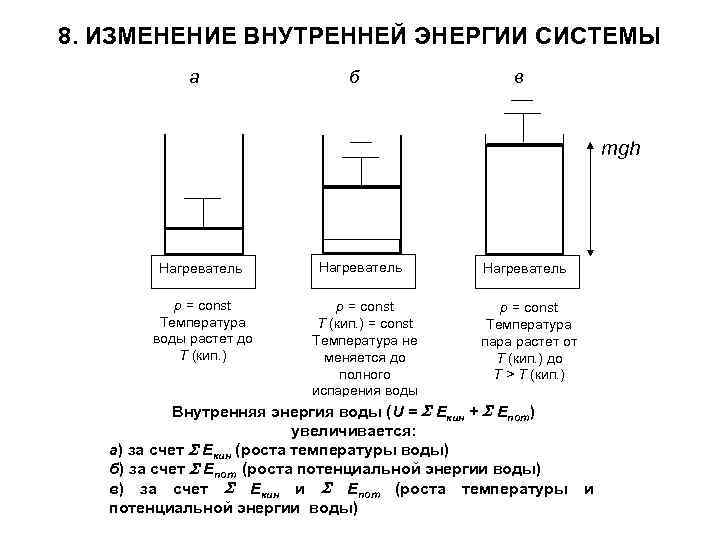 8. ИЗМЕНЕНИЕ ВНУТРЕННЕЙ ЭНЕРГИИ СИСТЕМЫ а б в mgh Нагреватель р = const Температура воды растет до Т (кип. ) Нагреватель р = const Т (кип. ) = const Температура не меняется до полного испарения воды Нагреватель р = const Температура пара растет от Т (кип. ) до Т > Т (кип. ) Внутренняя энергия воды (U = Екин + Епот) увеличивается: а) за счет Екин (роста температуры воды) б) за счет Епот (роста потенциальной энергии воды) в) за счет Екин и Епот (роста температуры потенциальной энергии воды) и
8. ИЗМЕНЕНИЕ ВНУТРЕННЕЙ ЭНЕРГИИ СИСТЕМЫ а б в mgh Нагреватель р = const Температура воды растет до Т (кип. ) Нагреватель р = const Т (кип. ) = const Температура не меняется до полного испарения воды Нагреватель р = const Температура пара растет от Т (кип. ) до Т > Т (кип. ) Внутренняя энергия воды (U = Екин + Епот) увеличивается: а) за счет Екин (роста температуры воды) б) за счет Епот (роста потенциальной энергии воды) в) за счет Екин и Епот (роста температуры потенциальной энергии воды) и
 • 9. ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА • Важным свойством идеального газа является независимость его внутренней энергии от изменения объема и давления: • и • Внутренняя энергия идеального газа является функцией только температуры: • Если система в начальном состоянии обладала внутренней энергией и перешла в конечное • состояние то изменение внутренней энергии • будет определяться разностью:
• 9. ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА • Важным свойством идеального газа является независимость его внутренней энергии от изменения объема и давления: • и • Внутренняя энергия идеального газа является функцией только температуры: • Если система в начальном состоянии обладала внутренней энергией и перешла в конечное • состояние то изменение внутренней энергии • будет определяться разностью:
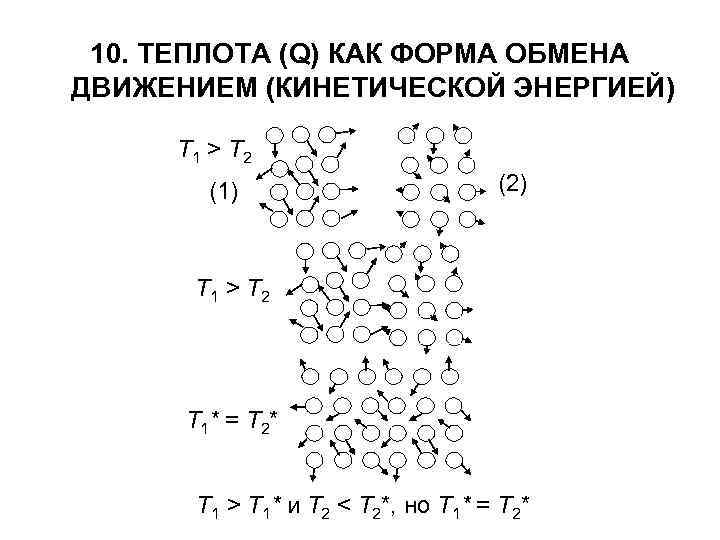 10. ТЕПЛОТА (Q) КАК ФОРМА ОБМЕНА ДВИЖЕНИЕМ (КИНЕТИЧЕСКОЙ ЭНЕРГИЕЙ) Т 1 > Т 2 (1) (2) Т 1 > Т 2 Т 1* = Т 2* Т 1 > Т 1* и Т 2 < Т 2*, но Т 1* = Т 2*
10. ТЕПЛОТА (Q) КАК ФОРМА ОБМЕНА ДВИЖЕНИЕМ (КИНЕТИЧЕСКОЙ ЭНЕРГИЕЙ) Т 1 > Т 2 (1) (2) Т 1 > Т 2 Т 1* = Т 2* Т 1 > Т 1* и Т 2 < Т 2*, но Т 1* = Т 2*
 11. ОПРЕДЕЛЕНИЕ И ХАРАКТЕРИСТИКА ТЕПЛОТЫ (Q) Теплота Q – есть форма обмена энергией между телами посредством соударения микрочастиц, составляющих тела. Теплота Q [Дж] имеет ту же размерность, что и внутренняя энергия U [Дж], но теплота есть характеристика процесса. Нет соударения микрочастиц между телами, нет процесса передачи кинетической энергии (движения), тогда Q = 0. Внутренняя энергия U есть характеристика состояния системы. Любое тело, любая макросистема обладает внутренней энергией: микрочастицы тела движутся, притягиваются и отталкиваются
11. ОПРЕДЕЛЕНИЕ И ХАРАКТЕРИСТИКА ТЕПЛОТЫ (Q) Теплота Q – есть форма обмена энергией между телами посредством соударения микрочастиц, составляющих тела. Теплота Q [Дж] имеет ту же размерность, что и внутренняя энергия U [Дж], но теплота есть характеристика процесса. Нет соударения микрочастиц между телами, нет процесса передачи кинетической энергии (движения), тогда Q = 0. Внутренняя энергия U есть характеристика состояния системы. Любое тело, любая макросистема обладает внутренней энергией: микрочастицы тела движутся, притягиваются и отталкиваются
 12. ТЕПЛОЕМКОСТЬ (С) • Средняя теплоемкость – это количество энергии в форме теплоты, затраченное на нагревание одного моля или одного грамма вещества на 1 К: • [Дж/моль К ] или [Дж/г К] • Энергия в форме теплоты, которая необходима для нагревания количества вещества (n моль) или массы вещества (m г), вычисляется по уравнениям:
12. ТЕПЛОЕМКОСТЬ (С) • Средняя теплоемкость – это количество энергии в форме теплоты, затраченное на нагревание одного моля или одного грамма вещества на 1 К: • [Дж/моль К ] или [Дж/г К] • Энергия в форме теплоты, которая необходима для нагревания количества вещества (n моль) или массы вещества (m г), вычисляется по уравнениям:
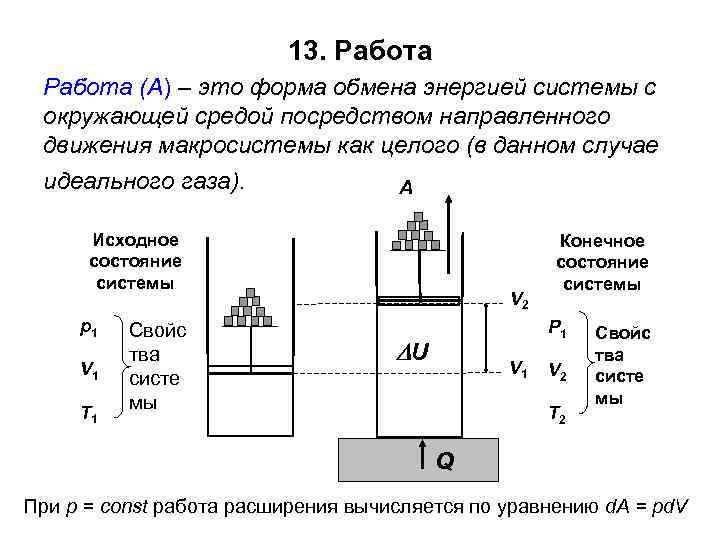 13. Работа (А) – это форма обмена энергией системы с окружающей средой посредством направленного движения макросистемы как целого (в данном случае идеального газа). A Исходное состояние системы р1 V 1 T 1 Свойс тва систе мы V 2 Конечное состояние системы Р 1 U V 1 V 2 T 2 Свойс тва систе мы Q При р = const работа расширения вычисляется по уравнению d. A = pd. V
13. Работа (А) – это форма обмена энергией системы с окружающей средой посредством направленного движения макросистемы как целого (в данном случае идеального газа). A Исходное состояние системы р1 V 1 T 1 Свойс тва систе мы V 2 Конечное состояние системы Р 1 U V 1 V 2 T 2 Свойс тва систе мы Q При р = const работа расширения вычисляется по уравнению d. A = pd. V
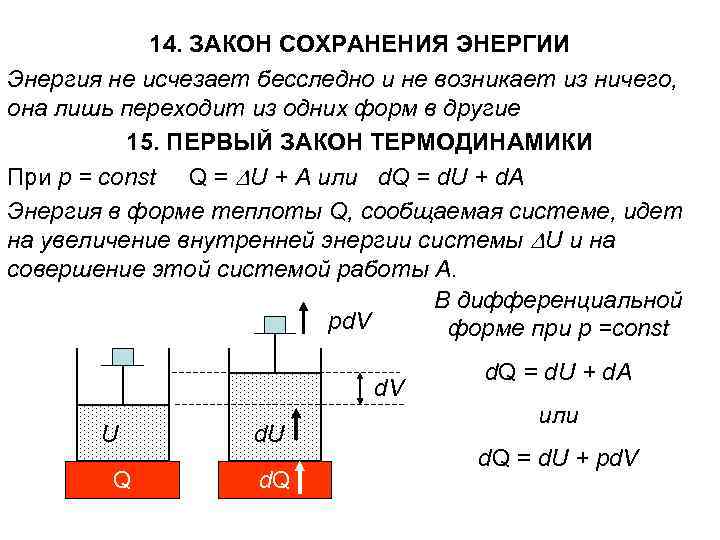 14. ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ Энергия не исчезает бесследно и не возникает из ничего, она лишь переходит из одних форм в другие 15. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ При р = const Q = U + A или d. Q = d. U + d. A Энергия в форме теплоты Q, сообщаемая системе, идет на увеличение внутренней энергии системы U и на совершение этой системой работы A. В дифференциальной pd. V форме при р =const d. V U Q d. U d. Q = d. U + d. A или d. Q = d. U + pd. V
14. ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ Энергия не исчезает бесследно и не возникает из ничего, она лишь переходит из одних форм в другие 15. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ При р = const Q = U + A или d. Q = d. U + d. A Энергия в форме теплоты Q, сообщаемая системе, идет на увеличение внутренней энергии системы U и на совершение этой системой работы A. В дифференциальной pd. V форме при р =const d. V U Q d. U d. Q = d. U + d. A или d. Q = d. U + pd. V
 16. РАБОТА АВТОМОБИЛЬНОГО ДВИГАТЕЛЯ Пример. При сгорании 10 л бензина в двигателе внутреннего сгорания выделилось Q(бенз. ) = 460000 к. Дж, из которых на движение автомобиля израсходованы А = 105000 к. Дж и на нагревание двигателя U = 10000 к. Дж. Сколько литров бензина израсходовано автомобилем на нагревание окружающей среды? Решение. В соответствии с 1 -м законом термодинамики Q(движ. , нагр. двиг. ) = U + А или Q (движ. , нагр. двиг. ) = (105000 +10000) = 115000 к. Дж Следовательно, оставшаяся при сгорании бензина энергия израсходована на нагревание окружающей среды (горячие выхлопные газы, трение и др. ): Q(бенз. ) = Q (нагр. окр. ср. ) + Q(движ. , нагр. двиг. ) 460000 = Q (нагр. окр. ср. ) + 115000 или Q (нагр. окр. ср. ) = 460000 - 115000 = 345000 к. Дж. Вывод. При остывании двигатель также нагреет окружающую среду. Из 10 л только 2. 5 литра бензина расходуется на движение автомобиля. А 7. 5 литра бензина при горении превращаются в горячие продукты и в прямом смысле слова «вылетают в выхлопную трубу» .
16. РАБОТА АВТОМОБИЛЬНОГО ДВИГАТЕЛЯ Пример. При сгорании 10 л бензина в двигателе внутреннего сгорания выделилось Q(бенз. ) = 460000 к. Дж, из которых на движение автомобиля израсходованы А = 105000 к. Дж и на нагревание двигателя U = 10000 к. Дж. Сколько литров бензина израсходовано автомобилем на нагревание окружающей среды? Решение. В соответствии с 1 -м законом термодинамики Q(движ. , нагр. двиг. ) = U + А или Q (движ. , нагр. двиг. ) = (105000 +10000) = 115000 к. Дж Следовательно, оставшаяся при сгорании бензина энергия израсходована на нагревание окружающей среды (горячие выхлопные газы, трение и др. ): Q(бенз. ) = Q (нагр. окр. ср. ) + Q(движ. , нагр. двиг. ) 460000 = Q (нагр. окр. ср. ) + 115000 или Q (нагр. окр. ср. ) = 460000 - 115000 = 345000 к. Дж. Вывод. При остывании двигатель также нагреет окружающую среду. Из 10 л только 2. 5 литра бензина расходуется на движение автомобиля. А 7. 5 литра бензина при горении превращаются в горячие продукты и в прямом смысле слова «вылетают в выхлопную трубу» .
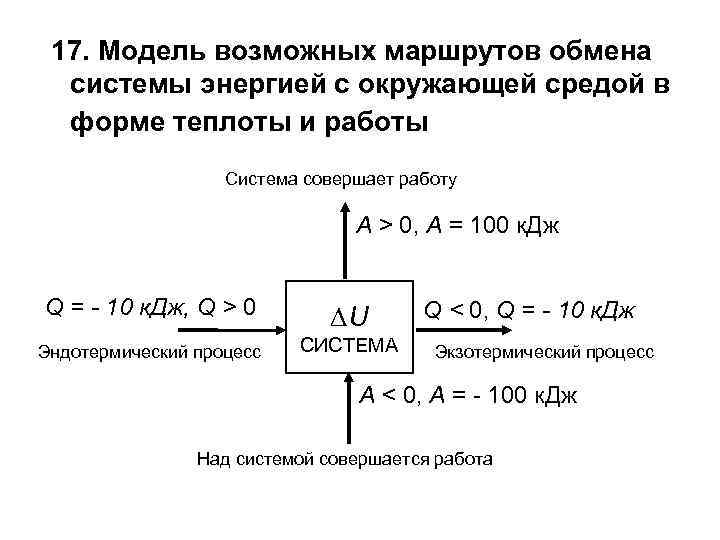 17. Модель возможных маршрутов обмена системы энергией с окружающей средой в форме теплоты и работы Система совершает работу А > 0, А = 100 к. Дж Q = - 10 к. Дж, Q > 0 U Эндотермический процесс СИСТЕМА Q < 0, Q = - 10 к. Дж Экзотермический процесс А < 0, А = - 100 к. Дж Над системой совершается работа
17. Модель возможных маршрутов обмена системы энергией с окружающей средой в форме теплоты и работы Система совершает работу А > 0, А = 100 к. Дж Q = - 10 к. Дж, Q > 0 U Эндотермический процесс СИСТЕМА Q < 0, Q = - 10 к. Дж Экзотермический процесс А < 0, А = - 100 к. Дж Над системой совершается работа
 18. ЭКЗО- И ЭНДОТЕРМИЧЕСКИЕ ПРОЦЕССЫ Теплота (Q) берется со знаком плюс, например, (Q) = + 100 к. Дж, если система получает энергию из окружающей среды. Такой процесс называется эндотермическим [ др. -греч. внутри, тепло]. Теплота (Q) берется со знаком минус, например, (Q) = 100 к. Дж, если система отдает энергию в окружающую среду. Такой процесс называется экзотермическим [др. -греч. снаружи, вне, тепло]. Работа (А) считается положительной, если совершается системой. Например, автомобиль (система) везет пассажиров. Работа (А) считается отрицательной, если совершается над системой. Например, пассажиры толкают машину, у которой заглох двигатель.
18. ЭКЗО- И ЭНДОТЕРМИЧЕСКИЕ ПРОЦЕССЫ Теплота (Q) берется со знаком плюс, например, (Q) = + 100 к. Дж, если система получает энергию из окружающей среды. Такой процесс называется эндотермическим [ др. -греч. внутри, тепло]. Теплота (Q) берется со знаком минус, например, (Q) = 100 к. Дж, если система отдает энергию в окружающую среду. Такой процесс называется экзотермическим [др. -греч. снаружи, вне, тепло]. Работа (А) считается положительной, если совершается системой. Например, автомобиль (система) везет пассажиров. Работа (А) считается отрицательной, если совершается над системой. Например, пассажиры толкают машину, у которой заглох двигатель.


