Основные понятия и определения.ppt
- Количество слайдов: 32

Термодинамика Основные понятия и определения. Теплота и работа как форма передачи энергии. Внутренняя энергия, энтальпия, энтропия, теплоемкость, смесь рабочих тел.

Техническая термодинамика o o o Изучает закономерности взаимного превращения теплоты и работы, происходящие в макроскопических системах; Изучает свойства тел, участвующих в этих превращениях; Свойства процессов, протекающих в тепловом оборудовании;

Теплота и работа o o Теплота и работа представляют две формы передачи энергии от одного тела к другому. Общее: Необходимо два тела; Пополняется запас энергии. Мерой энергии, передаваемой этими двумя формами передачи энергии от одного тела к другому, является количество теплоты и работы.

Различия Работа o Макроскопический процесс; o Пополняет запас любого вида энергии; Теплота o Совокупность микроскопических процессов; o Пополняет только внутреннюю энергию;

Эквивалентность теплоты и работы o Эквивалентность теплоты и работы численно установлена Ю. Майером и У. Томсоном: 1 ккал=4, 18 к. Дж

Рабочее тело o o o Посредник, с помощью которого в тепловых машинах, установках получают работу, теплоту или холод. Рабочее тело может состоять из одного или нескольких веществ, быть гомогенным или гетерогенным. Рабочие тела в термодинамике – газы и пары.

Термодинамическая система (ТДС) o o o Совокупность рабочих тел, обменивающихся энергией и веществом между собой и окружающей средой, – ТДС. Окружающая среда – все, что не включено в систему, но может с ней взаимодействовать. ТДС отделяется от окружающей среды реальной или мысленной границей

Классификация ТДС o o Изолированные – отсутствует обмен веществом и энергией с окружающей средой; Закрытые или замкнутые – отсутствует обмен веществом; Открытые – присутствует обмен веществом (поток пара или газа в турбинах); Термодинамически изолированные – отсутствует обмен теплотой.

Макропараметры o o o При взаимодействии с окружающей средой рабочее тело переходит из одного состояния в другое. Макропараметры поддаются прямому измерению. Физические величины, свойственные конкретному состоянию рабочего тела, подразделяются на интенсивные, экстенсивные и удельные.

o o o Интенсивные – не зависят от количества вещества в системе; Экстенсивные – изменяются пропорционально величине системы; Удельные – отнесенные к единице количества вещества (относятся к интенсивным) o o t, p V, энергия, масса Удельный объем (V/M); Удельная теплота (Q/M, A/M)

Состояния рабочего тела o o Стационарное – не изменяется …. Равновесное -

Термодинамические параметры o o Макроскопические физические величины, характеризующие систему в состоянии равновесия, - термодинамические параметры состояния системы. T, p, v, внутренняя энергия (u), энтальпия (I), энтропия (S), теплоемкость (с).

Основные параметры o o o Абсолютное давление –p, Па; Абсолютная температура – T, K; Удельный объем – ν=V/M, м 3/кг.

Термическое уравнение состояния рабочего тела o Характеризует термодинамическое состояние вещества, находящегося в состоянии равновесия (во всей массе устанавливается постоянство термодинамических параметров), в равновесном состоянии не происходит никаких превращений энергии. f(p, v, T)=0

Термодинамические процессы o o o Равновесный – рабочее тело проходит непрерывный ряд равновесных состояний. Обратимый – процесс, допускающий возвращение рабочего тела в первоначальное состояние без изменений в окружающей среде. Необратимый -

Теплоемкость o Теплоемкость с - количество теплоты, необходимой для изменения на 1 градус единичной массы рабочего тела (вещества): Дж/(кг. К), к. Дж/(кг. К). o Ø Различают: Удельную массовую теплоемкость – с; Ø Удельную мольную теплоемкость - Ø Удельную объемную теплоемкость - ; ;

Теплоемкость o ü ü Теплоемкость газов величина переменная, зависит от температуры – истинная; средняя Теплоемкость газов зависит от протекания процесса: изохорная; изобарная

Теплоемкость изохорная o o o -массовая изохорная теплоемкость - объемная изохорная теплоемкость - мольная (молярная) изохорная теплоемкость изобарная o o o - массовая изобарная теплоемкость - объемная изобарная теплоемкость - мольная (молярная) изобарная теплоемкость

Внутренняя энергия o o Совокупность всех видов энергии тела или системы в данном состоянии, не связанных с движением системы как единого целого или с наличием внешнего силового поля. Включает энергию теплового движения молекул и потенциальную энергию их взаимодействия.

Внутренняя энергия o Идеальные газы – энергия взаимодействия равна нулю, энергия их теплового движения зависит от температуры:

Энтальпия o o Тепловая функция: Удельная энтальпия: где u – внутренняя энергия газа; pv – потенциальная энергия давления газа o При постоянном давлении изменение энтальпии равно количеству теплоты, подведенной к системе. Поэтому энтальпию наз. теплосодержанием. o Изменение энтальпии определяется только начальным и конечным состоянием газа и не зависит от характера процесса o

Энтропия o При обмене энергией в форме теплоты: обобщенная сила – абсолютная температура; обобщенная координата – энтропия. o Энтропия – параметр, изменяющийся от количества переданной теплоты. Энтропию нельзя измерить, только рассчитать. o

Тепловая теорема Нернста (ТРЕТИЙ ЗАКОН ТЕРМОДИНАМИКИ) o При температуре, стремящейся к абсолютному нулю, энтропия вещества, находящегося в конденсированном состоянии с упорядоченной кристаллической структурой, стремится к нулю. o Закон позволяет рассчитать абсолютное значение энтропии, в отличии от внутренней энергии и энтальпии, которые отсчитываются от произвольного уровня. Рассчитывают изменение энтропии в процессе: o
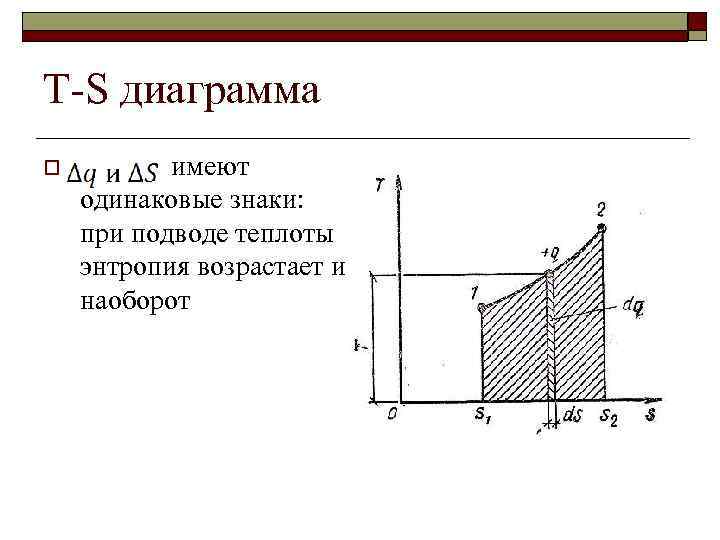
T-S диаграмма o имеют одинаковые знаки: при подводе теплоты энтропия возрастает и наоборот

Идеальный и реальный газ o o Идеальный газ – отсутствуют силы сцепления между молекулами, молекулы материальные точки, не имеющие объема. Реальный газ – нельзя пренебречь силами сцепления между молекулами и объемом молекул.

Термическое уравнение состояния идеальных газов где o – газовая постоянная, Дж/(кг. К); - универсальна газовая постоянная, 8314 Дж/(кмоль. К). Для идеальной смеси газов, химически не взаимодействующих друг с другом, :

Законы идеальных газов o Закон Дальтона – давление смеси газов равно сумме парциальных давлений компонентов смеси: o Закон Амаго – объем смеси равен сумме парциальных объемов компонентов. Парциальный объем – объем, который занимал бы компонент, если бы он один находился при параметрах смеси (T, p):

Состав смеси, концентрации o Мольная доля: o Относительная мольная доля: o Массовая доля: o Относительная массовая доля:

Концентрации o Объемная (мольная) доля: o Для идеальных газов мольные и объемные доли численно равны.

Уравнение состояния реальных газов Межмолекулярные силы отталкивания позволяют молекулам сближаться до некоторого минимального расстояния. o Свободный для движения молекул объем. где В – наименьший объем, до которого можно сжать газ. o Длина свободного пробега молекул уменьшается и давление увеличивается: o

Уравнение состояния реальных газов o Сила притяжения по направлению совпадает с внешним давлением и приводит к возникновению молекулярного (внутреннего) давления: o Уравнение Ван-дер-Ваальса

Уравнение Ван-дер-Ваальса o o При больших удельных объемах и невысоких давлениях реального газа уравнение Ван-дер-Ваальса превращается в уравнение состояния идеального газа. Уравнение не учитывает склонность молекул к ассоциации в отдельные группы.
Основные понятия и определения.ppt