Лекция 27.pptx
- Количество слайдов: 14

Термодинамика

Объект изучения – системы состоящий из очень большого числа частиц (например, газ) и называющиеся макросистемами. Рассмотрение поведения макросистем на основе законов классической механики невозможно. Однако, именно огромное число частиц системы позволяет ввести так называемые термодинамические параметры (например Т и Р), которые характеризуют макросистему и при неизменных условиях остаются постоянными с огромной точностью. Изучением поведения таких систем занимается термодинамика (общая теория теплоты) и молекулярная (статистическая) физика. Термодинамика – не исследует саму природу теплоты и не интересуется конкретным строением вещества. Выводы термодинамики основаны на ряде постулатов, которые называются началами и представляют собой обобщение опытных данных. Молекулярная (статистическая) физика – исходит из представлений о молекулярном строении вещества и позволяет объяснить свойства макросистем, как результат суммарного эффекта от действий отдельных молекул. Используемый статистический метод позволяет определять средние значения величин, характеризующие отдельные частицы, которые по сути и являются термодинамическими параметрами.

Состояние системы Набор термодинамических параметров (обычно это давление Р, объём V и температура T) характеризуют состояние системы. При неизменных внешних условиях, когда все термодинамические параметры имеют определённые и постоянные значения для любой части макросистемы это состояние называется равновесным. Равновесное состояние можно представить точкой на диаграмме, по координатным осям которой откладываются значения параметров состояния. Неравновесная система спонтанно переходит в равновесное (характерное время – время релаксации). Уравнение состояния системы – уравнение связывающее термодинамические параметры в той или иной модели.

Обратимые и необратимые процессы Любой процесс (переход из одного состояния в другое) происходит в общем случае через последовательность неравновесных состояний. Если процесс протекает достаточно медленно, то он проходит через последовательность состояний близких к равновесным. Квазистатический (равновесный) процесс Квазистатический процесс может быть изображён линией на диаграмме (например, на диаграмме p, V). Стрелка показывает направление процесса. Равновесный процесс может быть проведён в обратном направлении через ту же совокупность равновесных состояний, т. е. по той же кривой но в обратном направлении. Квазистатические (равновесные) процессы обратимы. Неравновесные процессы – необратимы. Неравновесное состояние нельзя изобразить точкой на диаграмме (например, p, V) Неравновесный (необратимый) процесс нельзя изобразить линией на диаграмме.

Многие реальные процессы, идущие с конечными скоростями (и в том числе очень быстро) можно приближённо считать квазистатическими. Например процессы расширения газов в цилиндрах тепловых двигателей. Уравнение состояния системы – уравнение связывающее термодинамические параметры в той или иной модели.

Уравнение состояния идеального газа Идеальный газ – это газ, уравнение состояния которого даётся уравнением Клапейрона - число молей газа R= 8, 314 Дж/(моль К ) постоянная В 1 моле содержится - универсальная газовая число Авагадро Масса моля, выраженная в граммах, численно равняется его молекулярной массе. Свойства идеального газа Молекулы идеального газа – жёсткие сферы взаимодействующие друг с другом только путём упругих соударений Полный объём молекул идеального газа – много меньше объёма сосуда в который заключён газ.

Основное уравнение молекулярно-кинетической теории (МКТ) Основные положениями МКТ: 1. Любое вещество состоит из мельчайших частиц — молекул и атомов. 2. Атомы или молекулы вещества находятся в состоянии беспорядочного движения , которое никогда не прекращается. 3. Атомы или молекулы вещества взаимодействуют друг с другом силами притяжения и отталкивания, которые зависят от расстояний между частицами. Эти положения являются обобщением многочисленных наблюдений и экспериментальных фактов.


Закон сохранения механической энергии справедлив для замкнутых систем, в которых действуют только консервативные силы. Диссипативные силы Механическая энергия замкнутой системы уменьшается. (силы трения) Выделяется тепло Опыты показали (Майер, Джоуль, Гельмгольц) Принцип сохранения энергии остаётся справедливым и при наличии диссипативных сил, если учесть также внутреннюю энергию.

Первое начало термодинамики Первое начало даёт связь между тремя величинами: Внутренней энергией U Работой А Теплотой Q Внутренняя энергия складывается из (1) Суммарной кинетической энергии хаотического движения молекул (в системе отсчёта, в которой система как целое покоится); (2) Потенциальной энергии взаимодействия всех молекул системы; (3) Внутренней энергии самих молекул, атомов, ядер. Обычно интерес представляет изменение U и именно оно может быть измерено. Поэтому те составляющие внутренней энергии, которые не меняются (п. 3), образуют некоторую постоянную, с точностью до которой определяется U. Пример: для идеального газа U это кинетическая энергия всех его молекул
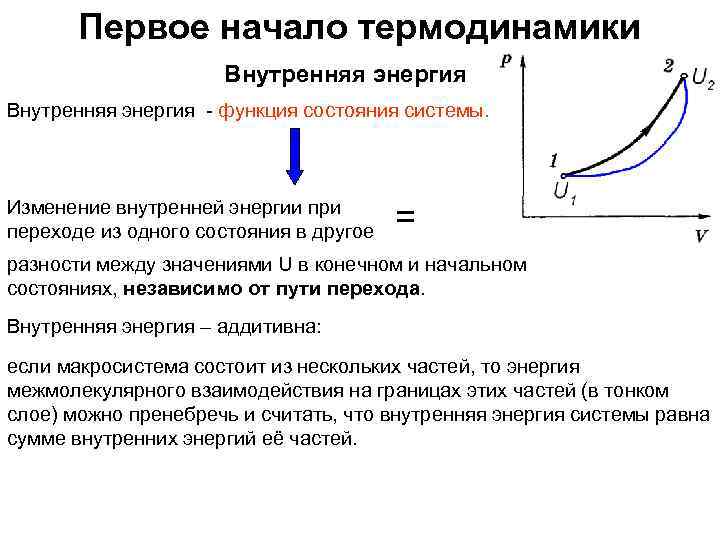
Первое начало термодинамики Внутренняя энергия - функция состояния системы. Изменение внутренней энергии при переходе из одного состояния в другое = разности между значениями U в конечном и начальном состояниях, независимо от пути перехода. Внутренняя энергия – аддитивна: если макросистема состоит из нескольких частей, то энергия межмолекулярного взаимодействия на границах этих частей (в тонком слое) можно пренебречь и считать, что внутренняя энергия системы равна сумме внутренних энергий её частей.

Первое начало термодинамики Работа и количество тепла Внутреннюю энергию макросистемы можно изменить, совершив над системой работу А’ внешними силами, либо путём теплопередачи. Как с помощью механической работы произвести тепло (изменить внутреннюю энергию)? С помощью трения и других диссипативных процессов. Пример: Камень, падающий на землю, в момент удара отдает накопленную им механическую (кинетическую) энергию, за счет чего оба тела нагреваются. Переход механической энергии направленного поступательного движения камня в энергию хаотического теплового движения атомов обоих тел. А возможно ли обратное: получение механической энергии счёт внутренней? По законам соударений упругих тел молекулы отлетают от поршня с меньшей скоростью

Первое начало термодинамики Опыт показывает: превращение механической энергии в тепловую и обратно совершается всегда в строго эквивалентных количествах. Закон сохранения энергии, включающий тепловое движение первое начало термодинамики Рассмотрим в качестве примера газ в цилиндре с подвижным поршнем, Газ может обмениваться энергией с окружающими телами и при этом изменять свою внутреннюю энергию непосредственно путём подвода или отвода тепловой энергии Δ Q, за счёт совершения ими или им самим механической работы ΔA над внешними телами (поршнем). Учитывая процессы теплообмена и совершения механической работы, закон сохранения энергии можно записать в виде Изменение внутренней энергии тела (газа) ΔU равно разности сообщенного телу (газу) количества теплоты ΔQ и произведенной телом (газом) механической работы ΔА

Первое начало термодинамики Все величины здесь алгебраические. Если механическая энергия окружающих тел уменьшится, то ΔA < 0, при этом окружающая среда совершила работу — ΔA. Наоборот, ΔA считается положительной, если тело производит механическую работу над окружающими телами, т. е. за счет произведенной механической работы убывает внутренняя энергия тела. ΔQ считается положительным, если тепло передается от окружающей среды данному телу, т. е. за счет притока тепла ΔQ извне внутренняя энергия тела возрастает. Закон можно переписать в виде Первое начало термодинамики Количество теплоты, сообщенное телу (ΔQ), идет на увеличение его внутренней энергии (ΔU) и на совершение телом работы (ΔA).
Лекция 27.pptx