 Термодинамика ИЛ НГТУ Пятаева И. Н. 2012
Термодинамика ИЛ НГТУ Пятаева И. Н. 2012
 Цель: Рассмотреть явления с точки зрения энергетических преобразований o o Внутренняя энергия Работа в термодинамике 1 закон термодинамики Тепловые двигатели Д. З. Кабардин § § 3135
Цель: Рассмотреть явления с точки зрения энергетических преобразований o o Внутренняя энергия Работа в термодинамике 1 закон термодинамики Тепловые двигатели Д. З. Кабардин § § 3135
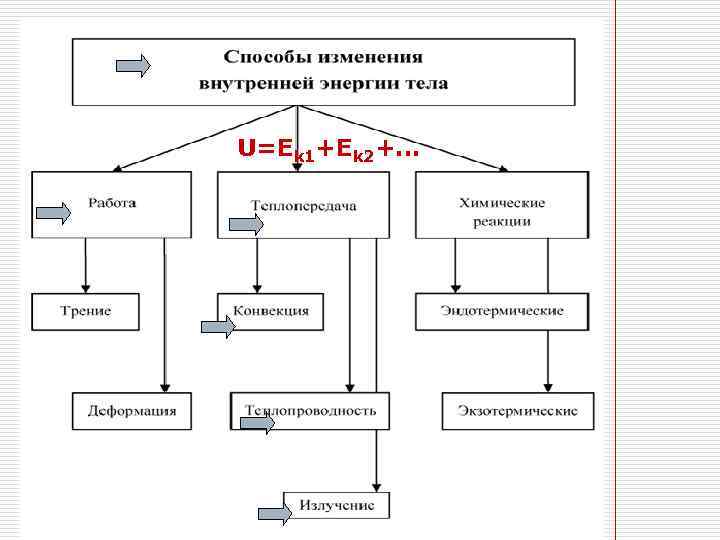 Внутренняя энергия U=Ekм+Eпм. U=Еk 1+Ek 2+…
Внутренняя энергия U=Ekм+Eпм. U=Еk 1+Ek 2+…
 Опыт Джоуля 1850 -е годы: механический эквивалент теплоты
Опыт Джоуля 1850 -е годы: механический эквивалент теплоты
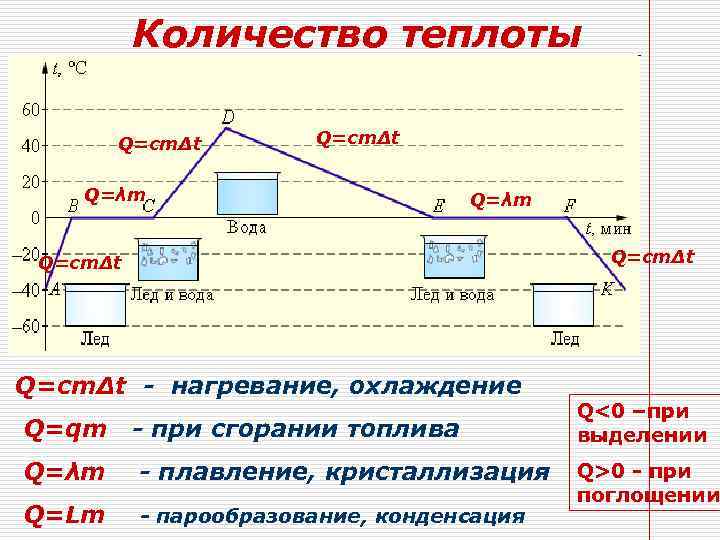 Количество теплоты Q=cmΔt Q=λm Q=cmΔt - нагревание, охлаждение Q=qm - при сгорании топлива Q=λm - плавление, кристаллизация Q=Lm - парообразование, конденсация Q<0 –при выделении Q>0 - при поглощении
Количество теплоты Q=cmΔt Q=λm Q=cmΔt - нагревание, охлаждение Q=qm - при сгорании топлива Q=λm - плавление, кристаллизация Q=Lm - парообразование, конденсация Q<0 –при выделении Q>0 - при поглощении
 Удельной теплоемкостью с называется количество теплоты, которое необходимо передать единице массы вещества, чтобы его температура увеличилась на 1 кельвин: Молярной теплоемкостью C называется количество теплоты, которое необходимо передать 1 молю вещества, чтобы его температура увеличилась на 1 кельвин: Теплоемкостью тела называют количество теплоты необходимое для нагревания тела на 1 градус
Удельной теплоемкостью с называется количество теплоты, которое необходимо передать единице массы вещества, чтобы его температура увеличилась на 1 кельвин: Молярной теплоемкостью C называется количество теплоты, которое необходимо передать 1 молю вещества, чтобы его температура увеличилась на 1 кельвин: Теплоемкостью тела называют количество теплоты необходимое для нагревания тела на 1 градус
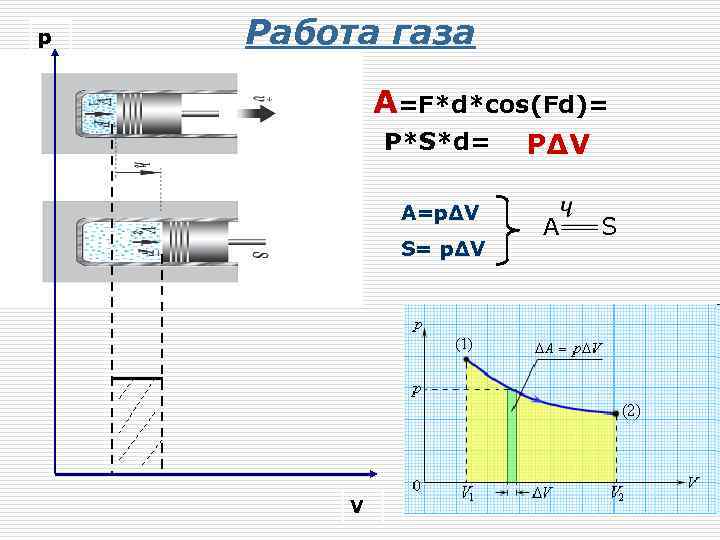 р Работа газа A=F*d*cos(Fd)= P*S*d= A=pΔV S= pΔV V PΔV A S
р Работа газа A=F*d*cos(Fd)= P*S*d= A=pΔV S= pΔV V PΔV A S
 1 Закон термодинамики (Первое начало термодинамики. ) Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и на совершение работы термодинамической системой (газом): Q = ΔU + Aг
1 Закон термодинамики (Первое начало термодинамики. ) Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и на совершение работы термодинамической системой (газом): Q = ΔU + Aг
 Аг = - Авн Чтобы изменить внутреннюю энергию тела, нужно совершить над ним работу и (или) передать ему количество теплоты ΔU =Q+ Aвн.
Аг = - Авн Чтобы изменить внутреннюю энергию тела, нужно совершить над ним работу и (или) передать ему количество теплоты ΔU =Q+ Aвн.
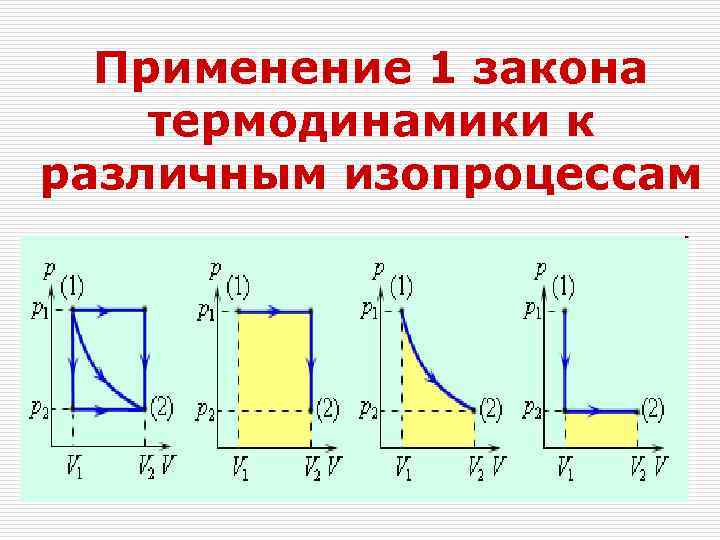 Применение 1 закона термодинамики к различным изопроцессам
Применение 1 закона термодинамики к различным изопроцессам
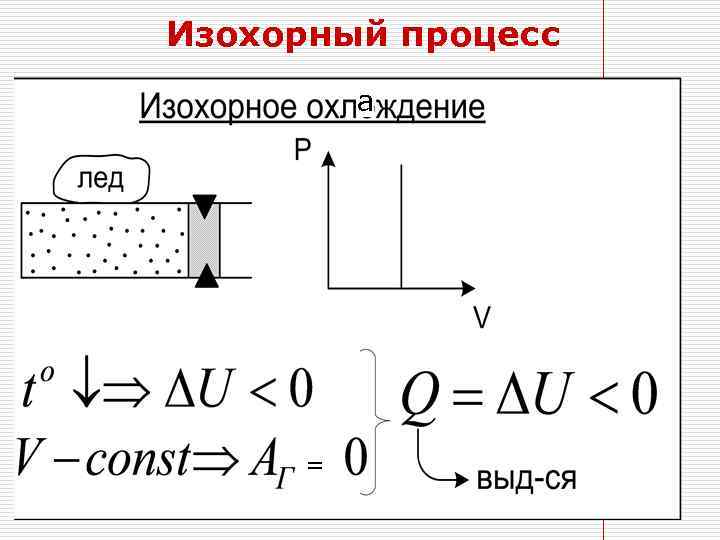 Изохорный процесс а Q=ΔU =
Изохорный процесс а Q=ΔU =
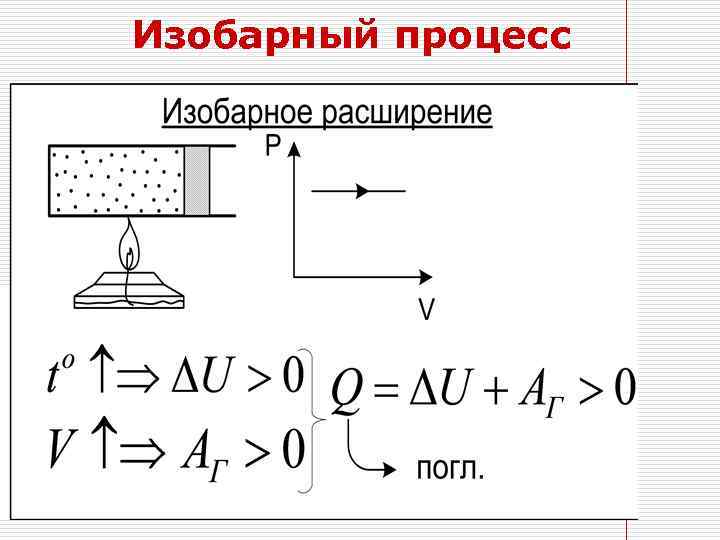 Изобарный процесс Q=ΔU+Aг
Изобарный процесс Q=ΔU+Aг
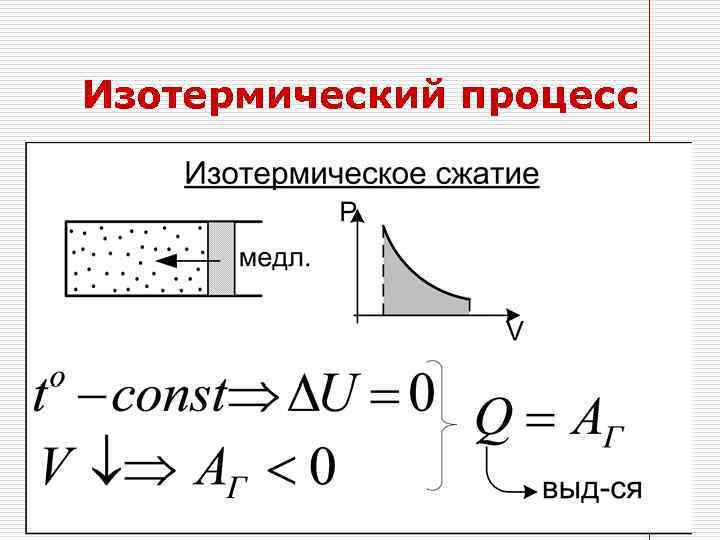 Изотермический процесс Q=Aг
Изотермический процесс Q=Aг
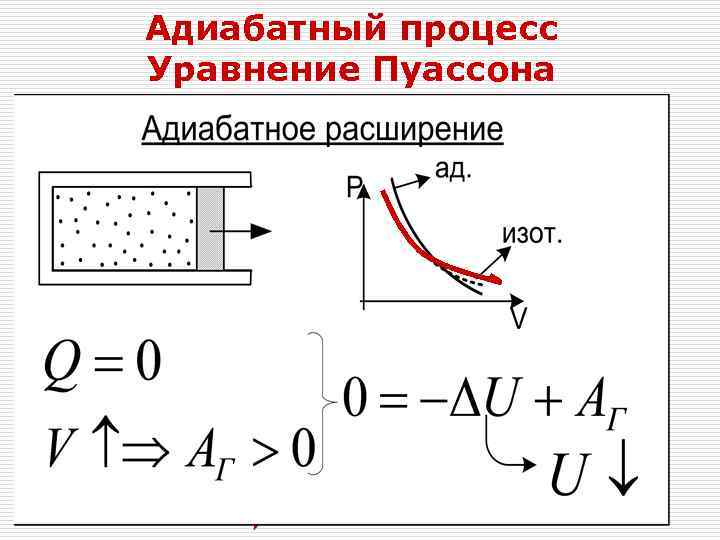 Адиабатный процесс Уравнение Пуассона Q=-ΔU
Адиабатный процесс Уравнение Пуассона Q=-ΔU
 ; Уравнение Майера V=const; Q=ΔU; P= const; Q=ΔU+A Cp = CV +R.
; Уравнение Майера V=const; Q=ΔU; P= const; Q=ΔU+A Cp = CV +R.
 Второй закон термодинамики Невозможен термодинамический процесс, единственным результатом которого была бы передача внутренней энергии от менее нагретого тела к более нагретому (постулат Клаузиуса) (Указанный процесс не должен вызывать изменений в окружающих телах)
Второй закон термодинамики Невозможен термодинамический процесс, единственным результатом которого была бы передача внутренней энергии от менее нагретого тела к более нагретому (постулат Клаузиуса) (Указанный процесс не должен вызывать изменений в окружающих телах)
 Постулат Томсона Невозможен круговой процесс, единственным результатом которого было бы совершение работы за счет внутренней энергии путем теплообмена
Постулат Томсона Невозможен круговой процесс, единственным результатом которого было бы совершение работы за счет внутренней энергии путем теплообмена
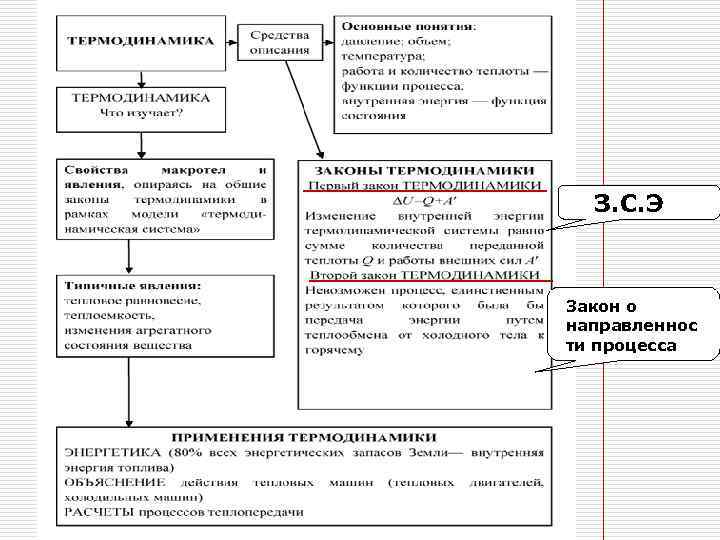 З. С. Э Закон о направленнос ти процесса
З. С. Э Закон о направленнос ти процесса
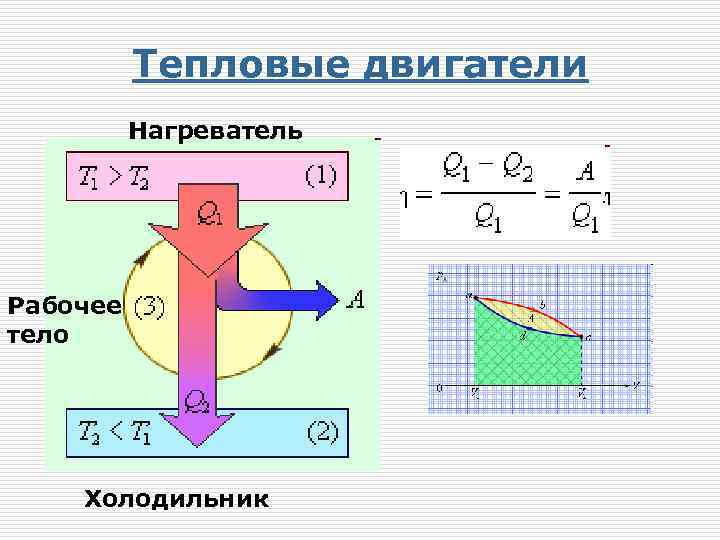 Тепловые двигатели Нагреватель Рабочее тело Холодильник
Тепловые двигатели Нагреватель Рабочее тело Холодильник
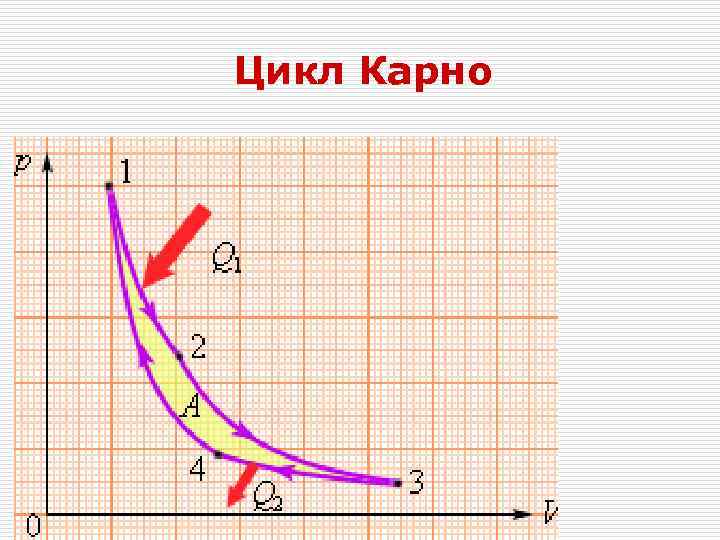 Цикл Карно
Цикл Карно