Adsorbtsia-2.pptx
- Количество слайдов: 48
 Термодинамическое равновесие поверхностного слоя Для равновесия замкнутой системы, состоящей из I и II объемных фаз должно соблюдаться условие: - изменение внутренней энергии поверхностного слоя τ –толщина 1
Термодинамическое равновесие поверхностного слоя Для равновесия замкнутой системы, состоящей из I и II объемных фаз должно соблюдаться условие: - изменение внутренней энергии поверхностного слоя τ –толщина 1
 Рассмотрим два важных случая: 1) Поверхность раздела не изменяется; 3 Т Складываем 2
Рассмотрим два важных случая: 1) Поверхность раздела не изменяется; 3 Т Складываем 2
 Система замкнута, внешние условия наложенные на нее: (5) ………………. Кроме условия (5) еще и Учитывая (4) общие условия можно свести к: 3
Система замкнута, внешние условия наложенные на нее: (5) ………………. Кроме условия (5) еще и Учитывая (4) общие условия можно свести к: 3
 Таким образом, условия термического и химического равновесия аналогичны условиям равновесия объемных фаз: В поверхностных слоях будем говорить не о всей внутренней энергии или энтропии поверхностного слоя и не о всем количестве каждого компонента, а лишь о избытке. Именно эти избытки и характеризуют отличие поверхности от объемных фаз: - полная поверхностная энергия 4
Таким образом, условия термического и химического равновесия аналогичны условиям равновесия объемных фаз: В поверхностных слоях будем говорить не о всей внутренней энергии или энтропии поверхностного слоя и не о всем количестве каждого компонента, а лишь о избытке. Именно эти избытки и характеризуют отличие поверхности от объемных фаз: - полная поверхностная энергия 4
 Тогда 2) Поверхность раздела меняется: где поверхностное натяжение, аналогично давлению в объемной фазе ( ) Если P эрг/см 3 или дин/см 2, то σ- эрг/см 2 или дин/см. Смещение поверхности S вызывает изменение объема соседних фаз I и II на и , причем 5
Тогда 2) Поверхность раздела меняется: где поверхностное натяжение, аналогично давлению в объемной фазе ( ) Если P эрг/см 3 или дин/см 2, то σ- эрг/см 2 или дин/см. Смещение поверхности S вызывает изменение объема соседних фаз I и II на и , причем 5
 Эти изменения вызовут дополнительные изменения и на и Общее изменение энергии, связанное со смещением поверхности S при равновесии равно 0, поэтому Это условие механического равновесия: Это выражение показывает, что в случае возможности изменения смещения поверхности S гидростатические давления в обьемных средах не равны другу. 6
Эти изменения вызовут дополнительные изменения и на и Общее изменение энергии, связанное со смещением поверхности S при равновесии равно 0, поэтому Это условие механического равновесия: Это выражение показывает, что в случае возможности изменения смещения поверхности S гидростатические давления в обьемных средах не равны другу. 6
 7
7
 8
8
 Это уравнение показывает, что разность гидростатических давлений в смежных фазах равна произведению σ на d. S. , если плоская поверхность раздела, т. е. k 1=k 2=0 9
Это уравнение показывает, что разность гидростатических давлений в смежных фазах равна произведению σ на d. S. , если плоская поверхность раздела, т. е. k 1=k 2=0 9
 Частные случаи 1. Давление газа внутри сферического пузырька. 10
Частные случаи 1. Давление газа внутри сферического пузырька. 10
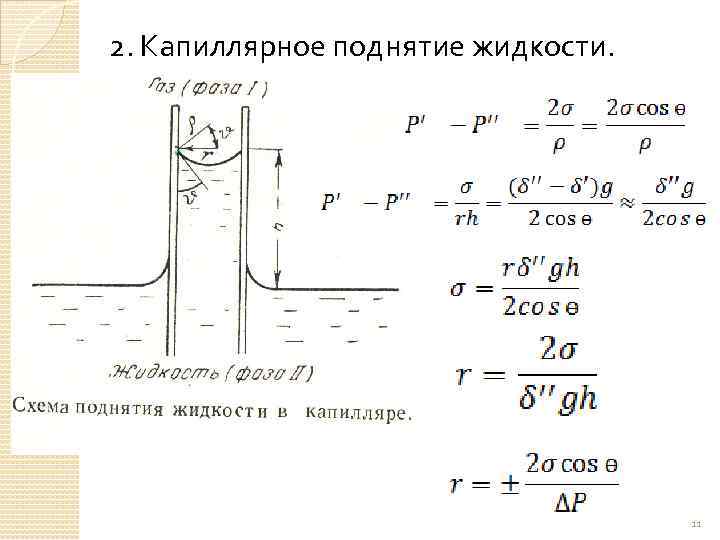 2. Капиллярное поднятие жидкости. 11
2. Капиллярное поднятие жидкости. 11
 Физическая адсорбция на непористых твёрдых телах Уравнение изотермы адсорбции Генри Адсорбционное равновесие: Молекула в газе молекула на адсорбенте (адсорбционный комплекс) Са – концентрация в адсорбционном слое γa - коэффициент активности в адсорбционном слое 12
Физическая адсорбция на непористых твёрдых телах Уравнение изотермы адсорбции Генри Адсорбционное равновесие: Молекула в газе молекула на адсорбенте (адсорбционный комплекс) Са – концентрация в адсорбционном слое γa - коэффициент активности в адсорбционном слое 12
 (1) Так как К=const при Т при невысоких концентрациях в газовой фазе γ=1 (2) 13
(1) Так как К=const при Т при невысоких концентрациях в газовой фазе γ=1 (2) 13
 В случае сильной адсорбции даже при малых с γa ≠ 1. γa =1 в случае малой сорбируемости, то есть при малой са (3) Для идеальных газов 14
В случае сильной адсорбции даже при малых с γa ≠ 1. γa =1 в случае малой сорбируемости, то есть при малой са (3) Для идеальных газов 14
 Это простейшие уравнения изотермы сорбции, это уравнения Генри, а К = константа Генри Вместо са удобно пользоваться Θ - степень заполнения 15
Это простейшие уравнения изотермы сорбции, это уравнения Генри, а К = константа Генри Вместо са удобно пользоваться Θ - степень заполнения 15
 16
16
 17
17
 Уравнения изотермы адсорбции Ленгмюра Адсорбция мономолекулярная и локализованная молекула газа + свободное место на поверхности локализованный адсорбционный комплекс 18
Уравнения изотермы адсорбции Ленгмюра Адсорбция мономолекулярная и локализованная молекула газа + свободное место на поверхности локализованный адсорбционный комплекс 18
 19
19
 20
20
 Пренебрегаем взаимодействиями адсорбат-адсорбат Тогда константа равновесия 21
Пренебрегаем взаимодействиями адсорбат-адсорбат Тогда константа равновесия 21
 (4) 22
(4) 22
 (5) или Проанализируем при малых значениях р (уравнение Генри) при больших значениях р 23
(5) или Проанализируем при малых значениях р (уравнение Генри) при больших значениях р 23
 am – ёмкость монослоя (6) 24
am – ёмкость монослоя (6) 24
 25
25
 поверхностная концентрация (7) 26
поверхностная концентрация (7) 26
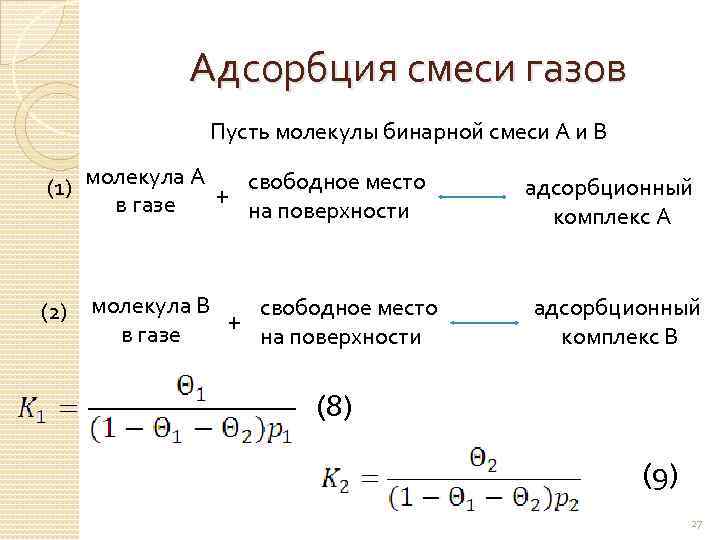 Адсорбция смеси газов Пусть молекулы бинарной смеси А и В (1) молекула А + свободное место в газе на поверхности (2) молекула В + свободное место в газе на поверхности адсорбционный комплекс А адсорбционный комплекс В (8) (9) 27
Адсорбция смеси газов Пусть молекулы бинарной смеси А и В (1) молекула А + свободное место в газе на поверхности (2) молекула В + свободное место в газе на поверхности адсорбционный комплекс А адсорбционный комплекс В (8) (9) 27
 (10) определим получим и подставим в (8) и (9) (11 а) (11 б) если i-компонентов (11 в) 28
(10) определим получим и подставим в (8) и (9) (11 а) (11 б) если i-компонентов (11 в) 28
 Уравнения изотермы полимолекулярной адсорбции Брунауэра, Эммета и Теллера (БЭТ) при p=ps начинается объёмная конденсация Используем те же допущения, что при выводе уравнения Ленгмюра 29
Уравнения изотермы полимолекулярной адсорбции Брунауэра, Эммета и Теллера (БЭТ) при p=ps начинается объёмная конденсация Используем те же допущения, что при выводе уравнения Ленгмюра 29
 30
30
 Кинетическая модель сорбции молекула газа + свободная поверхность единичные комплексы + единичный комплекс двойные комплексы + двойной комплекс тройные комплексы и т. д. 31
Кинетическая модель сорбции молекула газа + свободная поверхность единичные комплексы + единичный комплекс двойные комплексы + двойной комплекс тройные комплексы и т. д. 31
 Θ 1, Θ 2, Θ 3 – доли поверхности, занятые единичными, двойными и тройными комплексами Θ 0 – доля свободных мест на поверхности Скорость конденсации на первом слое (12) Скорость испарения 32
Θ 1, Θ 2, Θ 3 – доли поверхности, занятые единичными, двойными и тройными комплексами Θ 0 – доля свободных мест на поверхности Скорость конденсации на первом слое (12) Скорость испарения 32
 (13) Для 2 -го слоя 33
(13) Для 2 -го слоя 33
 - Кинетическая теория газов 34
- Кинетическая теория газов 34
 35
35
 36
36
 Уравнение БЭТ 37
Уравнение БЭТ 37
 Спрямление 38
Спрямление 38
 39
39
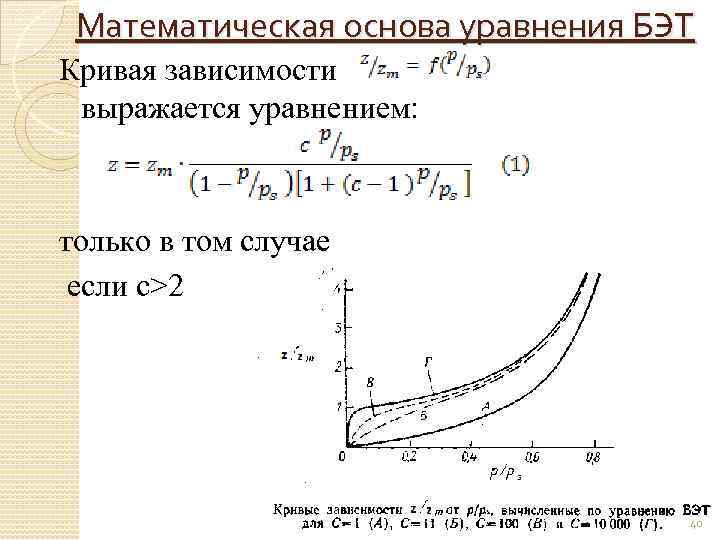 Математическая основа уравнения БЭТ Кривая зависимости выражается уравнением: только в том случае если с>2 40
Математическая основа уравнения БЭТ Кривая зависимости выражается уравнением: только в том случае если с>2 40
 Расчленяем правую часть выражения: кривую зависимости можно при этом получить как разность двух гипербол, выражается уравнением: 41
Расчленяем правую часть выражения: кривую зависимости можно при этом получить как разность двух гипербол, выражается уравнением: 41
 (3) Имеет асимптоты при пересекает ось (4) Имеет асимптоты при кривая пересекает ось в к выраженной кривой и и и 42
(3) Имеет асимптоты при пересекает ось (4) Имеет асимптоты при кривая пересекает ось в к выраженной кривой и и и 42
 Если с<2, то изотерма переходит в изотерму III типа: Точка перегиба: 43
Если с<2, то изотерма переходит в изотерму III типа: Точка перегиба: 43
 44
44
 Проявление притяжений адсорбат - адсорбат Для разветвленных молекул СCl 4, С(СH 3)4 на неполярной поверхности эти взаимодействия проявляются довольно сильно. Это проявляется в отклонении от 1 коэффициента активности γа и в увеличении теплоты адсорбции на однородной поверхности с увеличением степени заполнения: Зависимость ө от γа - приближенно Введем в уравнение Ленгмюра 45
Проявление притяжений адсорбат - адсорбат Для разветвленных молекул СCl 4, С(СH 3)4 на неполярной поверхности эти взаимодействия проявляются довольно сильно. Это проявляется в отклонении от 1 коэффициента активности γа и в увеличении теплоты адсорбции на однородной поверхности с увеличением степени заполнения: Зависимость ө от γа - приближенно Введем в уравнение Ленгмюра 45
 46
46
 Решим его относительно Наиболее простое уравнение локализованной адсорбции на однородной поверхности, учитывающее взаимодействие адсорбат, уравнение Киселева При k 1=0, уравнение переходит в уравнение Ленгмюра. 47
Решим его относительно Наиболее простое уравнение локализованной адсорбции на однородной поверхности, учитывающее взаимодействие адсорбат, уравнение Киселева При k 1=0, уравнение переходит в уравнение Ленгмюра. 47
 48
48


