иллюстрации к лекции хим термодинамика.ppt
- Количество слайдов: 88
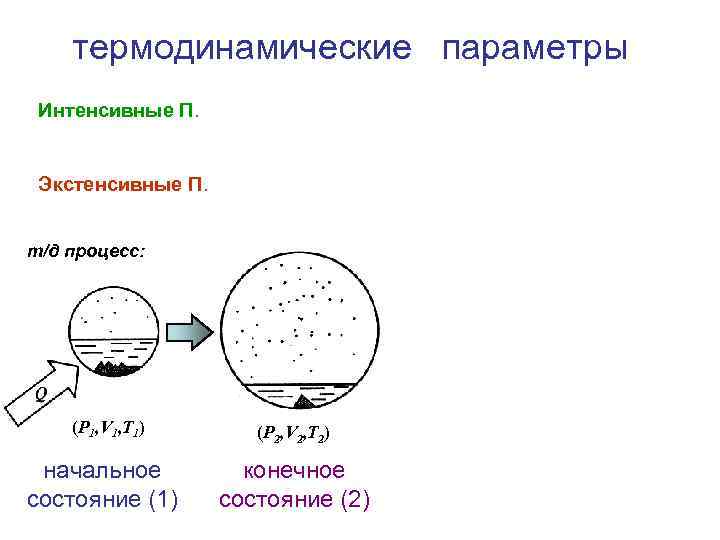 термодинамические параметры Интенсивные П. Экстенсивные П. т/д процесс: (P 1, V 1, T 1) начальное состояние (1) (P 2, V 2, T 2) конечное состояние (2)
термодинамические параметры Интенсивные П. Экстенсивные П. т/д процесс: (P 1, V 1, T 1) начальное состояние (1) (P 2, V 2, T 2) конечное состояние (2)
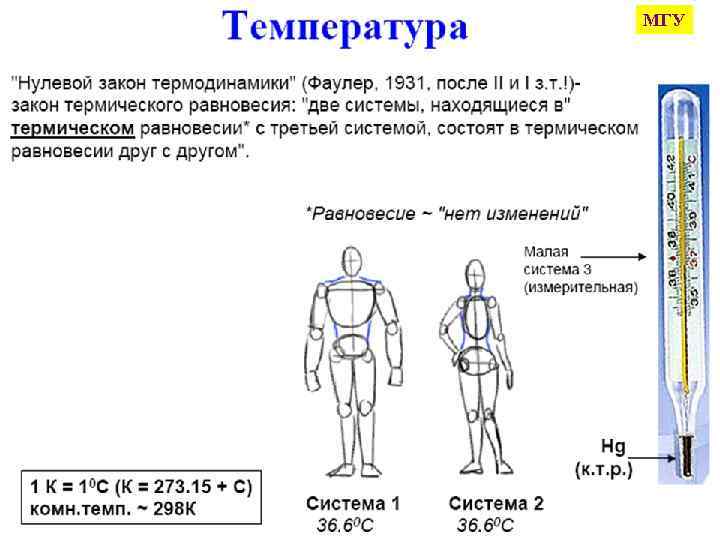 МГУ
МГУ

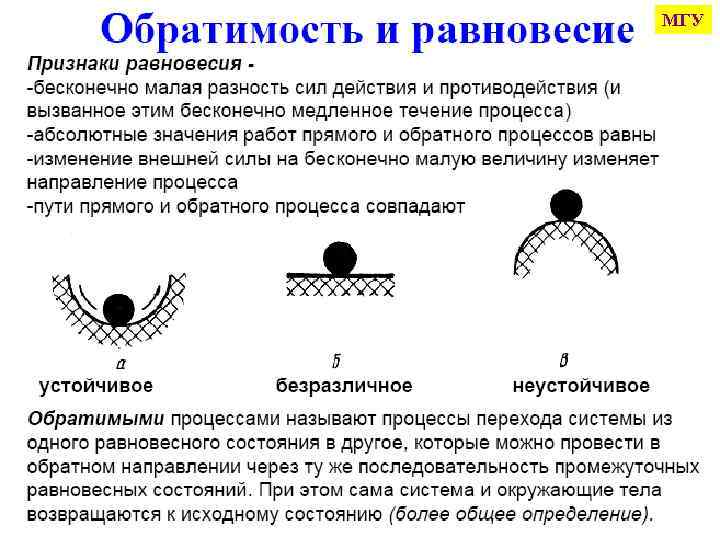 МГУ
МГУ
 При проведении процесса считаем, что каждое небольшое изменение параметров сопровождается установлением т/д равновесия, так что процесс можно считать «почти» равновесным (P 1, V 1, T 1) Функция состояния (Ф. с. ) - (P 2, V 2, T 2) представим химическую реакцию в виде: a. A + b. B + … = c. C + d. D + …
При проведении процесса считаем, что каждое небольшое изменение параметров сопровождается установлением т/д равновесия, так что процесс можно считать «почти» равновесным (P 1, V 1, T 1) Функция состояния (Ф. с. ) - (P 2, V 2, T 2) представим химическую реакцию в виде: a. A + b. B + … = c. C + d. D + …
 В химических реакциях часто выделяется или поглощается теплота U – внутренняя энергия U зависит от: 1. 2. 3. ΔU = U 2 - U 1
В химических реакциях часто выделяется или поглощается теплота U – внутренняя энергия U зависит от: 1. 2. 3. ΔU = U 2 - U 1
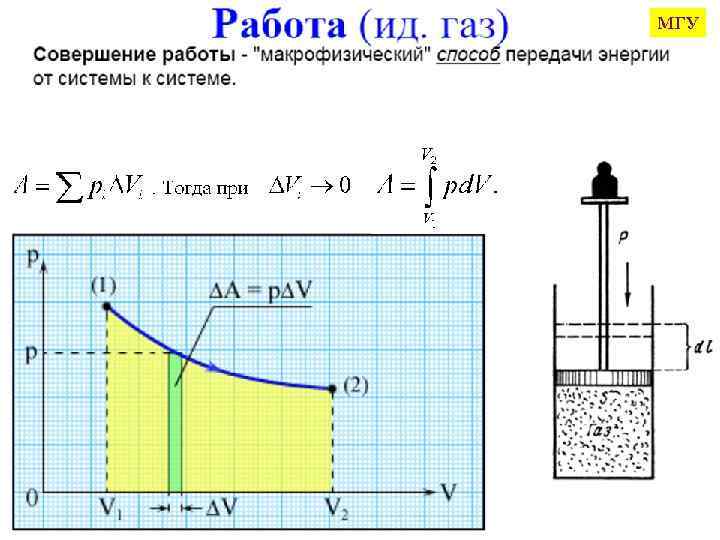
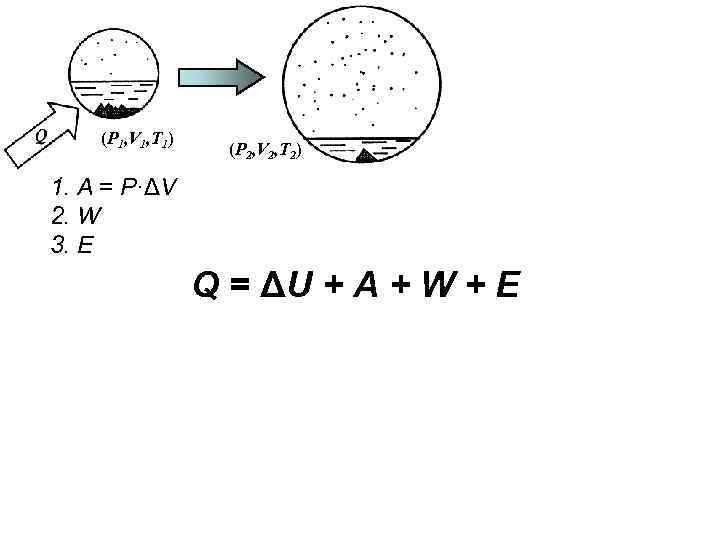 (P 1, V 1, T 1) (P 2, V 2, T 2) 1. A = P·ΔV 2. W 3. Е Q = ΔU + А + W + E
(P 1, V 1, T 1) (P 2, V 2, T 2) 1. A = P·ΔV 2. W 3. Е Q = ΔU + А + W + E
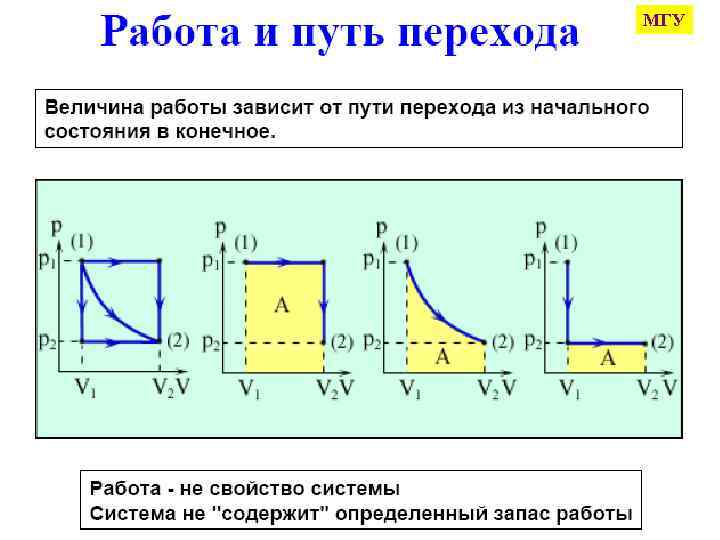 МГУ
МГУ
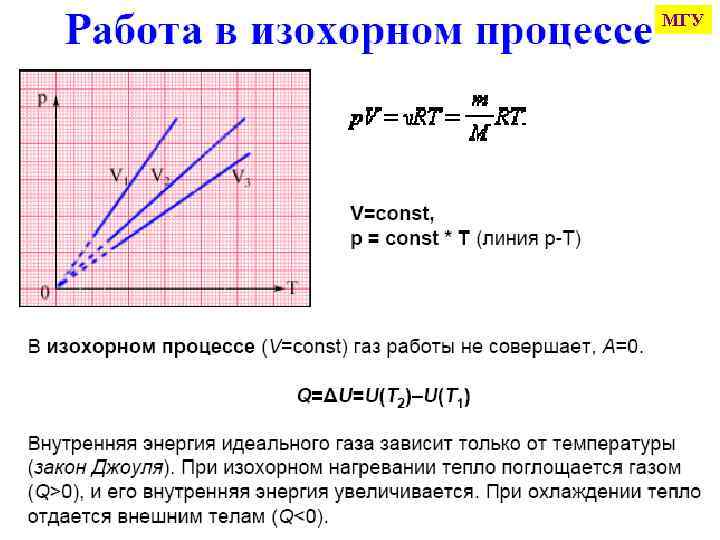
 ΔU = Q - Арасш - W QP = ΔU + Арасш QP = ΔU + P·ΔV QP = U 2 - U 1 + P·V 2 - P·V 1 QP = (U 2 + P·V 2) - (U 1 + P·V 1) QP = H 2 - H 1 = ΔH
ΔU = Q - Арасш - W QP = ΔU + Арасш QP = ΔU + P·ΔV QP = U 2 - U 1 + P·V 2 - P·V 1 QP = (U 2 + P·V 2) - (U 1 + P·V 1) QP = H 2 - H 1 = ΔH
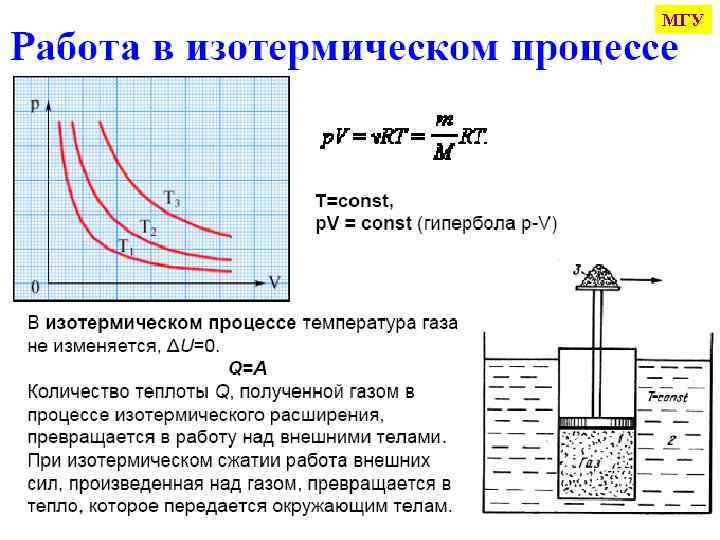
 МГУ
МГУ
 МГУ
МГУ
 МГУ
МГУ
 Термохимия Рассмотрим: + ΔH = - 242 к. Дж H 2(г) + 1/2 О 2(г) = Н 2 О(г) + 242 к. Дж H 2 О(г) = Н 2 О(ж) + 44 к. Дж H 2(г) + 1/2 О 2(г) = Н 2 О(ж) + 286 к. Дж (2 H 2(г) + О 2(г) = 2 Н 2 О(ж) + 572 к. Дж)
Термохимия Рассмотрим: + ΔH = - 242 к. Дж H 2(г) + 1/2 О 2(г) = Н 2 О(г) + 242 к. Дж H 2 О(г) = Н 2 О(ж) + 44 к. Дж H 2(г) + 1/2 О 2(г) = Н 2 О(ж) + 286 к. Дж (2 H 2(г) + О 2(г) = 2 Н 2 О(ж) + 572 к. Дж)
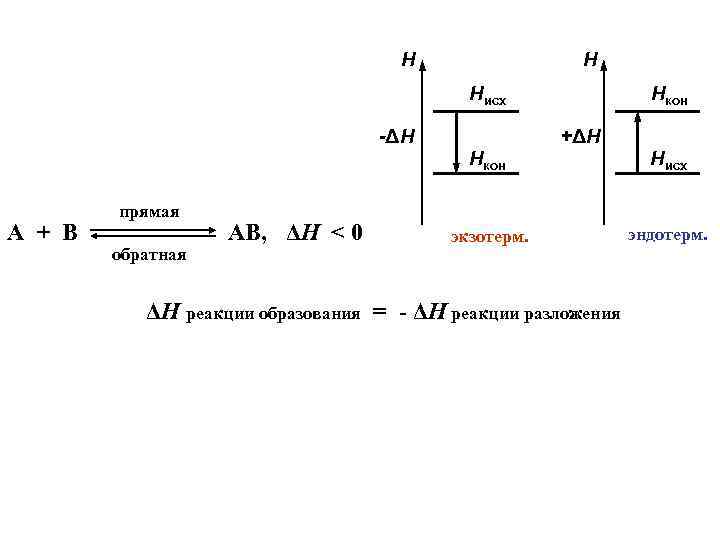 Н Н Нисх -ΔН Нкон +ΔН Нкон А + В прямая обратная АВ, ΔH < 0 Нисх экзотерм. эндотерм. ΔH реакции образования = - ΔH реакции разложения
Н Н Нисх -ΔН Нкон +ΔН Нкон А + В прямая обратная АВ, ΔH < 0 Нисх экзотерм. эндотерм. ΔH реакции образования = - ΔH реакции разложения
 Закон Гесса (1) С(гр) + ½ О 2(г) = СО(г) ΔН(1) = ? (2) С(гр) + О 2(г) = СО 2(г) ΔН(2) = -393. 5 к. Дж (3) СО(г) + ½ О 2(г) = СО 2(г) ΔН(3) = -283. 0 к. Дж ΔН(1) = ΔН(2) - ΔН(3) = -110. 5 к. Дж ΔН(3) = ΔН(2) - ΔН(1)
Закон Гесса (1) С(гр) + ½ О 2(г) = СО(г) ΔН(1) = ? (2) С(гр) + О 2(г) = СО 2(г) ΔН(2) = -393. 5 к. Дж (3) СО(г) + ½ О 2(г) = СО 2(г) ΔН(3) = -283. 0 к. Дж ΔН(1) = ΔН(2) - ΔН(3) = -110. 5 к. Дж ΔН(3) = ΔН(2) - ΔН(1)
 ΔН(1) – энтальпия образования CO (г) ΔН(2) – энтальпия образования CO 2 (г) a. A + b. B + … = c. C + d. D + … νj = c, d, … νi = a, b, …
ΔН(1) – энтальпия образования CO (г) ΔН(2) – энтальпия образования CO 2 (г) a. A + b. B + … = c. C + d. D + … νj = c, d, … νi = a, b, …
 Стандартная энтальпия образования простых веществ принята равной нулю Хлор – газообразный, Cl 2 Бром – жидкость, Br 2 Иод – кристаллический, I 2 Сера – твердое вещество, ромбическая модификация Фосфор – твердое вещество, белый Углерод – графит Металлы –твердые
Стандартная энтальпия образования простых веществ принята равной нулю Хлор – газообразный, Cl 2 Бром – жидкость, Br 2 Иод – кристаллический, I 2 Сера – твердое вещество, ромбическая модификация Фосфор – твердое вещество, белый Углерод – графит Металлы –твердые
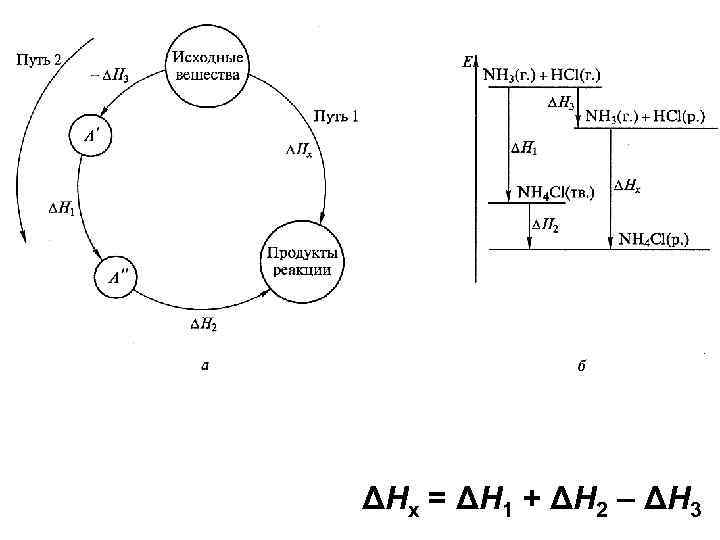 ΔНx = ΔН 1 + ΔН 2 – ΔН 3
ΔНx = ΔН 1 + ΔН 2 – ΔН 3
 Энергия связи |ΔН 0 H-Cl DА-В Пример: DH-Cl = |= ? Δf. Н 0 HCl = -92. 8 к. Дж/моль Δd. Н 0 H-H = 435 к. Дж/моль Δd. Нo. Cl-Cl = 243 к. Дж/моль ½ Cl 2 (г) = Cl (г) ½ ΔНCl-Cl = 121. 5 к. Дж ½ H 2 (г) = H (г) ½ ΔНH-H = 217. 5 к. Дж H (г) + Cl (г) = HCl (г) ΔНH-Cl = ? ½ H 2 (г) + ½ Cl 2 (г) = HCl (г) Δf. Н = - 92. 8 к. Дж По закону Гесса ΔН 0 H-Cl = Δf. Н – (½ ΔНH-H + ½ ΔНCl-Cl) ΔН 0 H-Cl = -431. 6 к. Дж, соответственно, DH-Cl = 431. 6 к. Дж/моль
Энергия связи |ΔН 0 H-Cl DА-В Пример: DH-Cl = |= ? Δf. Н 0 HCl = -92. 8 к. Дж/моль Δd. Н 0 H-H = 435 к. Дж/моль Δd. Нo. Cl-Cl = 243 к. Дж/моль ½ Cl 2 (г) = Cl (г) ½ ΔНCl-Cl = 121. 5 к. Дж ½ H 2 (г) = H (г) ½ ΔНH-H = 217. 5 к. Дж H (г) + Cl (г) = HCl (г) ΔНH-Cl = ? ½ H 2 (г) + ½ Cl 2 (г) = HCl (г) Δf. Н = - 92. 8 к. Дж По закону Гесса ΔН 0 H-Cl = Δf. Н – (½ ΔНH-H + ½ ΔНCl-Cl) ΔН 0 H-Cl = -431. 6 к. Дж, соответственно, DH-Cl = 431. 6 к. Дж/моль
 Атомарная теплота образования (Δa. f. Н 0 ABn) ABn = A + n. B СН 4 = С + 4 Н DС-Н= 412 к. Дж/моль D 1 С-Н= 427 к. Дж/моль, D 2 С-Н= 368 к. Дж/моль, D 3 С-Н= 519 к. Дж/моль, D 4 С-Н= 335 к. Дж/моль
Атомарная теплота образования (Δa. f. Н 0 ABn) ABn = A + n. B СН 4 = С + 4 Н DС-Н= 412 к. Дж/моль D 1 С-Н= 427 к. Дж/моль, D 2 С-Н= 368 к. Дж/моль, D 3 С-Н= 519 к. Дж/моль, D 4 С-Н= 335 к. Дж/моль
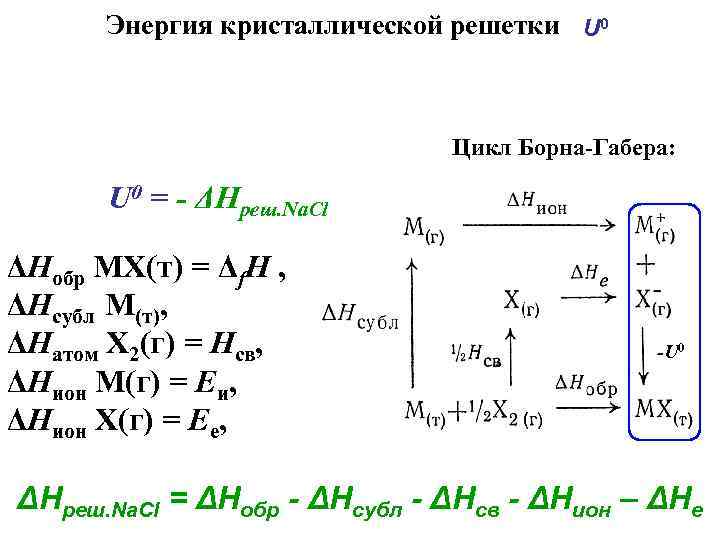 Энергия кристаллической решетки U 0 Цикл Борна-Габера: U 0 = - ΔНреш. Na. Cl ΔНобр МХ(т) = Δf. Н , ΔНсубл М(т), ΔНатом Х 2(г) = Нсв, ΔНион М(г) = Еи, ΔНион Х(г) = Ее, -U 0 ΔНреш. Na. Cl = ΔНобр - ΔНсубл - ΔНсв - ΔНион – ΔНе
Энергия кристаллической решетки U 0 Цикл Борна-Габера: U 0 = - ΔНреш. Na. Cl ΔНобр МХ(т) = Δf. Н , ΔНсубл М(т), ΔНатом Х 2(г) = Нсв, ΔНион М(г) = Еи, ΔНион Х(г) = Ее, -U 0 ΔНреш. Na. Cl = ΔНобр - ΔНсубл - ΔНсв - ΔНион – ΔНе
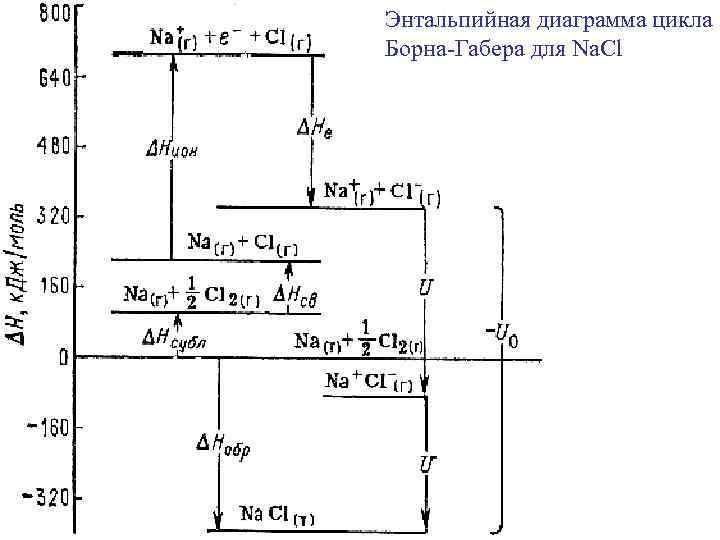 Энтальпийная диаграмма цикла Борна-Габера для Na. Cl -
Энтальпийная диаграмма цикла Борна-Габера для Na. Cl -
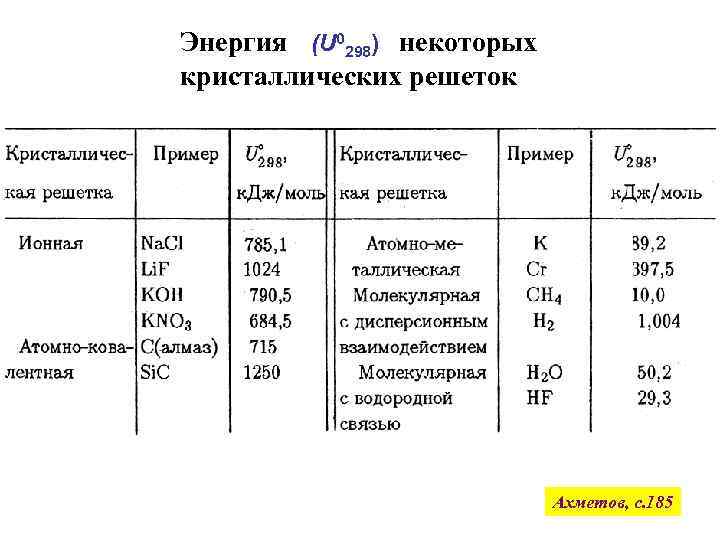 Энергия (U 0298) некоторых кристаллических решеток Ахметов, с. 185
Энергия (U 0298) некоторых кристаллических решеток Ахметов, с. 185
 Изменением энтальпии можно охарактеризовать многие процессы С 2 Н 2(г) + 2½ О 2(г) = СО 2(г) + Н 2 О(ж) Δс. Н 0(298) = -1256 к. Дж/моль Н 2 О(ж) = Н 2 О(г) Δv. Н 0(298) = 44. 0 к. Дж/моль Н 2 О(тв) = Н 2 О(ж) Δm. Н 0(298) = 6. 0 к. Дж/моль Н 2(г) + ½ О 2(г) = Н 2 О(г) Δf. Н 0(298) = -241. 8 к. Дж/моль Н 2(г) + ½ О 2(г) = Н 2 О(ж) Δf. Н 0(298) = -285. 8 к. Дж/моль Н 2(г) + ½ О 2(г) = Н 2 О(тв) Δf. Н 0(298) = -291. 8 к. Дж/моль
Изменением энтальпии можно охарактеризовать многие процессы С 2 Н 2(г) + 2½ О 2(г) = СО 2(г) + Н 2 О(ж) Δс. Н 0(298) = -1256 к. Дж/моль Н 2 О(ж) = Н 2 О(г) Δv. Н 0(298) = 44. 0 к. Дж/моль Н 2 О(тв) = Н 2 О(ж) Δm. Н 0(298) = 6. 0 к. Дж/моль Н 2(г) + ½ О 2(г) = Н 2 О(г) Δf. Н 0(298) = -241. 8 к. Дж/моль Н 2(г) + ½ О 2(г) = Н 2 О(ж) Δf. Н 0(298) = -285. 8 к. Дж/моль Н 2(г) + ½ О 2(г) = Н 2 О(тв) Δf. Н 0(298) = -291. 8 к. Дж/моль
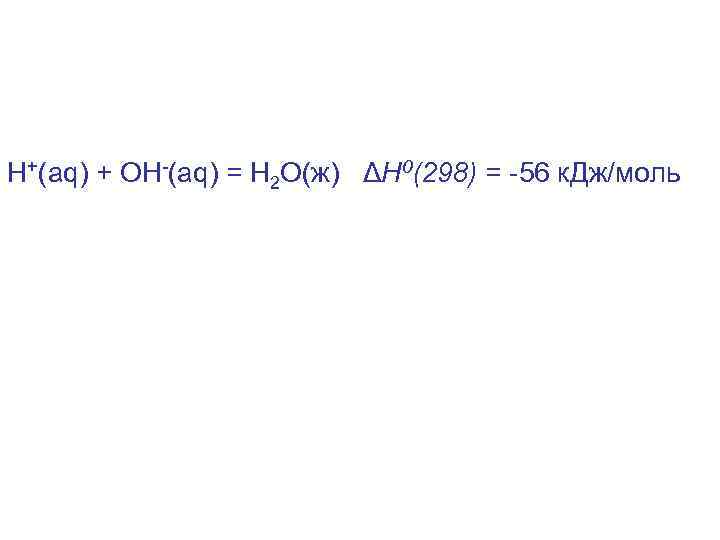 Н+(aq) + ОH-(aq) = Н 2 О(ж) ΔН 0(298) = -56 к. Дж/моль
Н+(aq) + ОH-(aq) = Н 2 О(ж) ΔН 0(298) = -56 к. Дж/моль
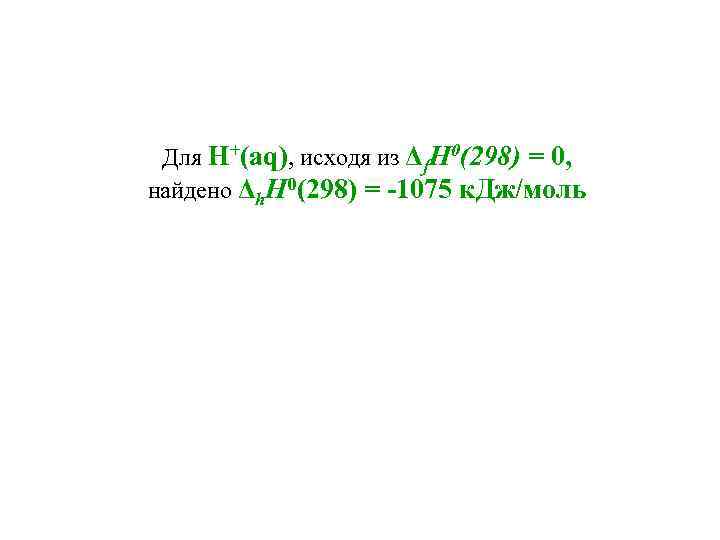 Для H+(aq), исходя из Δf. Н 0(298) = 0, найдено Δh. Н 0(298) = -1075 к. Дж/моль
Для H+(aq), исходя из Δf. Н 0(298) = 0, найдено Δh. Н 0(298) = -1075 к. Дж/моль
 Δs. HAB = - ΔHреш. AB + Δh. HA + Δh. HB Δh. HA = Δs. HAB + ΔHреш. AB - Δh. HB UAB = - ΔHреш. AB > 0 Пример: ΔH (к. Дж/моль): Δh. Hкат+ Δh. Hан - ΔHреш. Δs. HAB KOH -338. 9+(-510. 5) 790. 5 - 58. 9 KNO 3 -338. 9+(-309. 6) 684. 5 + 36. 0 эффект растворения
Δs. HAB = - ΔHреш. AB + Δh. HA + Δh. HB Δh. HA = Δs. HAB + ΔHреш. AB - Δh. HB UAB = - ΔHреш. AB > 0 Пример: ΔH (к. Дж/моль): Δh. Hкат+ Δh. Hан - ΔHреш. Δs. HAB KOH -338. 9+(-510. 5) 790. 5 - 58. 9 KNO 3 -338. 9+(-309. 6) 684. 5 + 36. 0 эффект растворения
 исходные продукты
исходные продукты
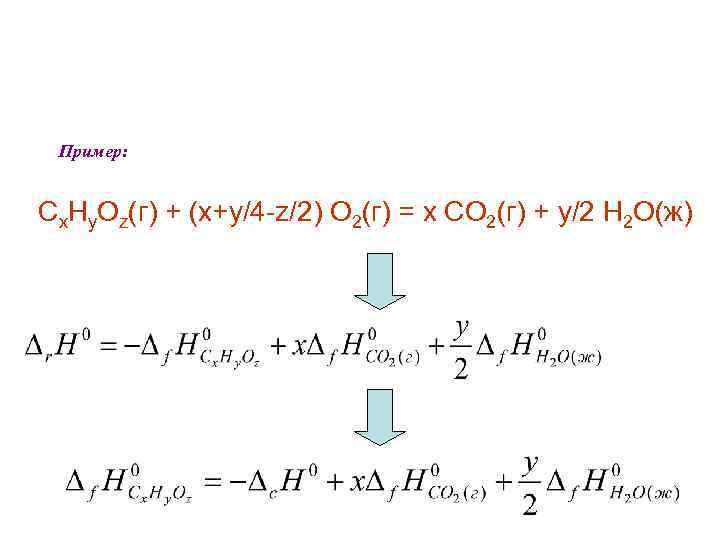 Пример: Сx. Нy. Oz(г) + (x+y/4 -z/2) О 2(г) = x СО 2(г) + y/2 Н 2 О(ж)
Пример: Сx. Нy. Oz(г) + (x+y/4 -z/2) О 2(г) = x СО 2(г) + y/2 Н 2 О(ж)
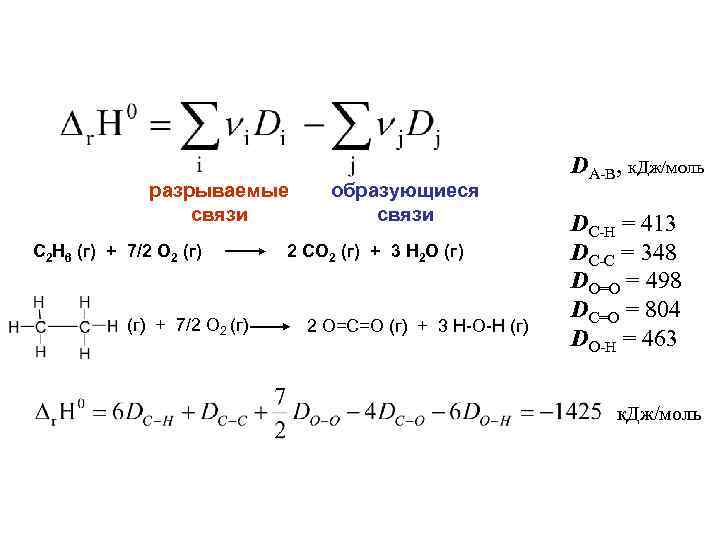 разрываемые связи С 2 Н 6 (г) + 7/2 О 2 (г) образующиеся связи 2 СО 2 (г) + 3 Н 2 О (г) 2 О=С=О (г) + 3 Н-О-Н (г) DA-B, к. Дж/моль DC-H = 413 DC-C = 348 DO=O = 498 DC=O = 804 DO-H = 463 к. Дж/моль
разрываемые связи С 2 Н 6 (г) + 7/2 О 2 (г) образующиеся связи 2 СО 2 (г) + 3 Н 2 О (г) 2 О=С=О (г) + 3 Н-О-Н (г) DA-B, к. Дж/моль DC-H = 413 DC-C = 348 DO=O = 498 DC=O = 804 DO-H = 463 к. Дж/моль
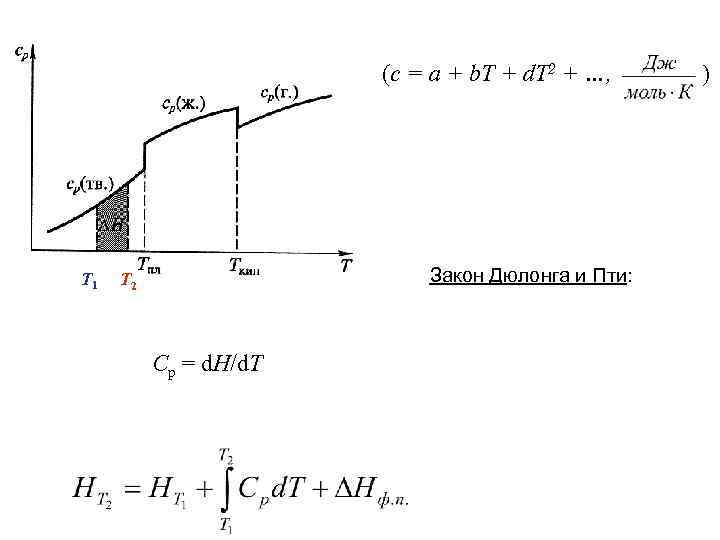 (c = a + b. T + d. T 2 + …, Т 1 Закон Дюлонга и Пти: Т 2 Cp = d. H/d. T )
(c = a + b. T + d. T 2 + …, Т 1 Закон Дюлонга и Пти: Т 2 Cp = d. H/d. T )
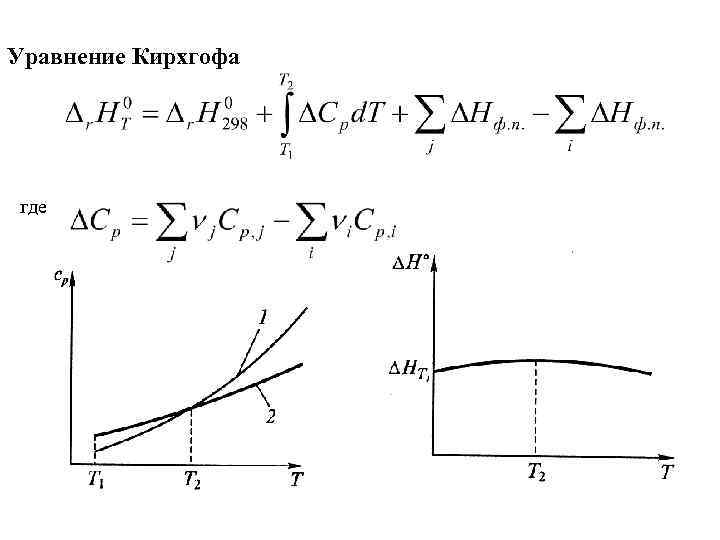 Уравнение Кирхгофа где
Уравнение Кирхгофа где
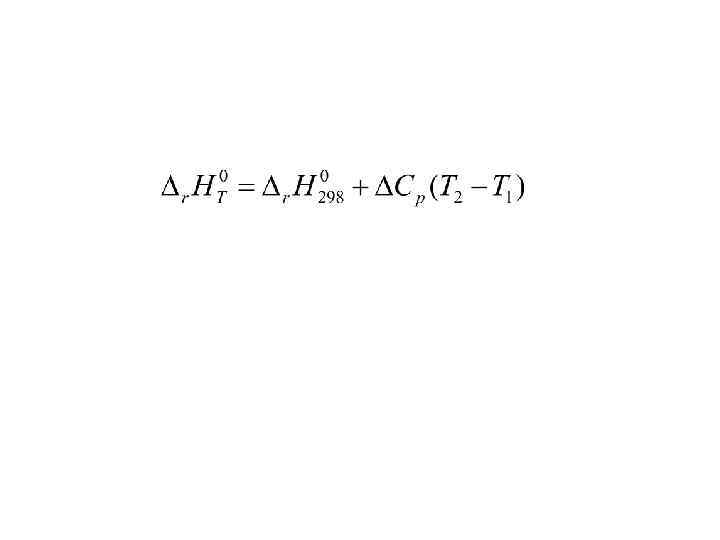
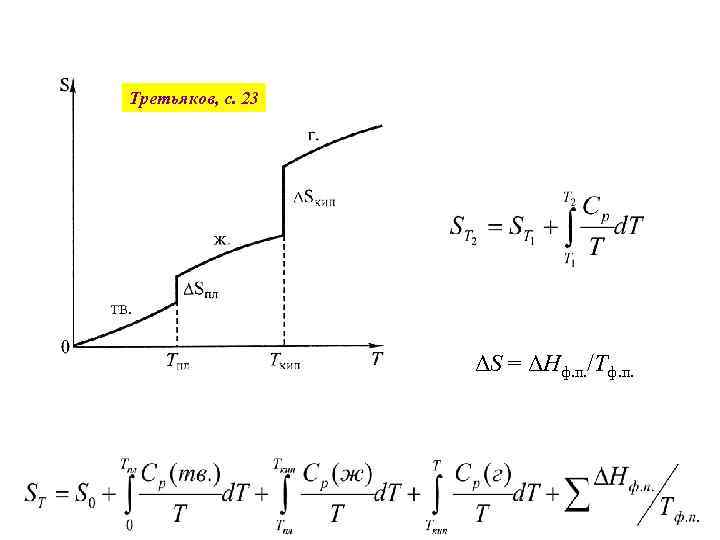 Третьяков, с. 23 ΔS = ΔНф. п. /Тф. п.
Третьяков, с. 23 ΔS = ΔНф. п. /Тф. п.
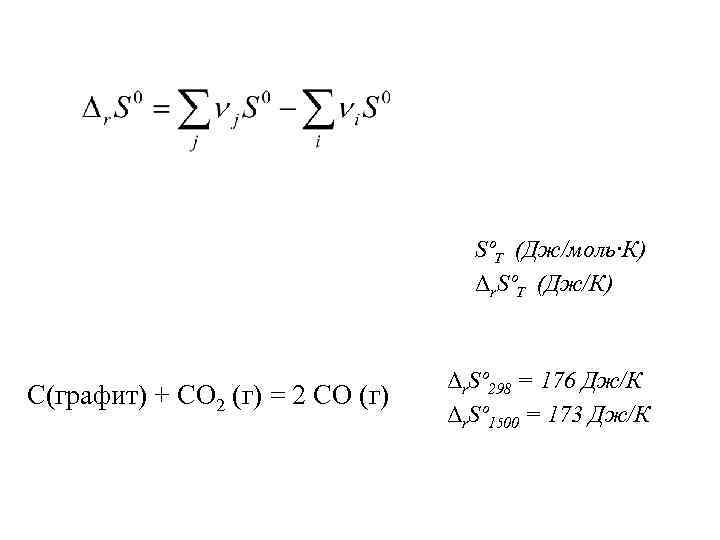 SºТ (Дж/моль·К) Δr. SºТ (Дж/К) С(графит) + СО 2 (г) = 2 СО (г) Δr. Sº 298 = 176 Дж/К Δr. Sº 1500 = 173 Дж/К
SºТ (Дж/моль·К) Δr. SºТ (Дж/К) С(графит) + СО 2 (г) = 2 СО (г) Δr. Sº 298 = 176 Дж/К Δr. Sº 1500 = 173 Дж/К
 Формулировка второго начала термодинамики для неизолированных систем:
Формулировка второго начала термодинамики для неизолированных систем:
 TΔS (Дж/моль) ΔН (к. Дж/моль) ΔН = TΔS
TΔS (Дж/моль) ΔН (к. Дж/моль) ΔН = TΔS
 В чем состоит физический смысл энтропии?
В чем состоит физический смысл энтропии?
 G = Н - TS ΔG = ΔН - TΔS ΔG < 0 ΔG > 0 ΔG = 0
G = Н - TS ΔG = ΔН - TΔS ΔG < 0 ΔG > 0 ΔG = 0
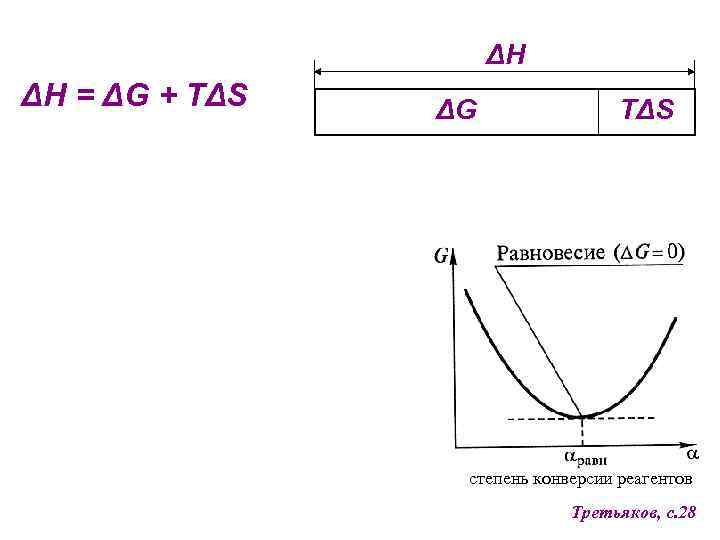 ΔH ΔH = ΔG + TΔS ΔG TΔS степень конверсии реагентов Третьяков, с. 28
ΔH ΔH = ΔG + TΔS ΔG TΔS степень конверсии реагентов Третьяков, с. 28
 ΔG = (ΔН – TΔS) < 0 ΔН < 0 и ΔS > 0
ΔG = (ΔН – TΔS) < 0 ΔН < 0 и ΔS > 0
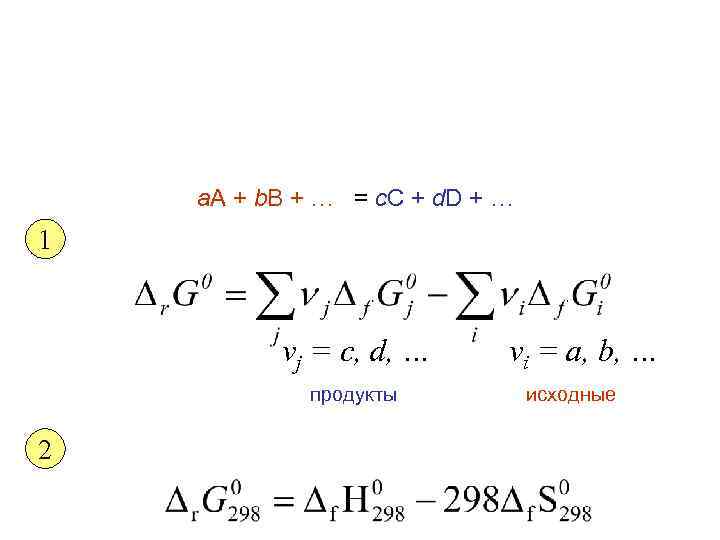 a. A + b. B + … = c. C + d. D + … 1 νj = c, d, … продукты 2 νi = a, b, … исходные
a. A + b. B + … = c. C + d. D + … 1 νj = c, d, … продукты 2 νi = a, b, … исходные
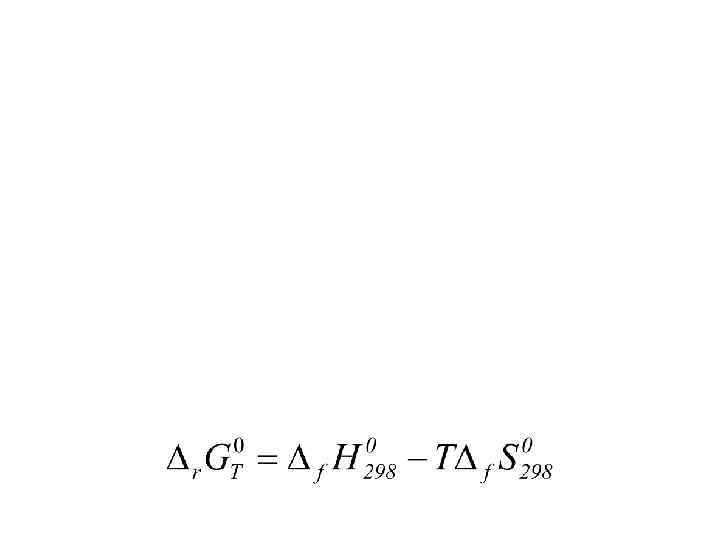
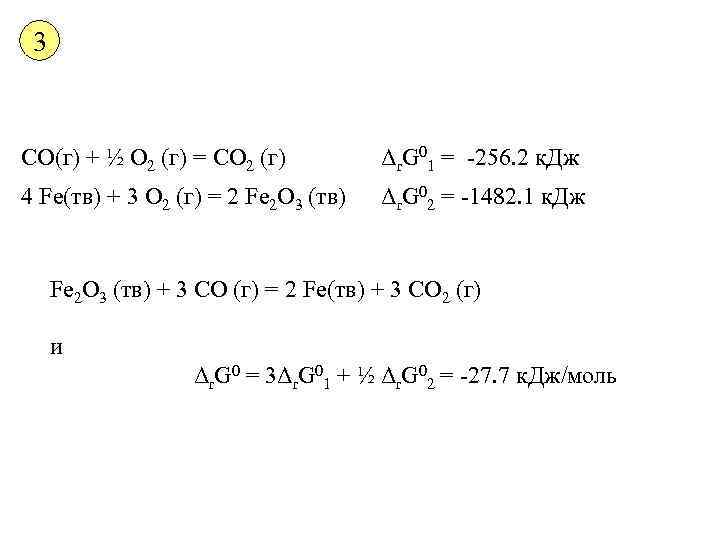 3 СО(г) + ½ О 2 (г) = СО 2 (г) Δr. G 01 = -256. 2 к. Дж 4 Fe(тв) + 3 О 2 (г) = 2 Fe 2 О 3 (тв) Δr. G 02 = -1482. 1 к. Дж Fe 2 О 3 (тв) + 3 СО (г) = 2 Fe(тв) + 3 СО 2 (г) и Δr. G 0 = 3Δr. G 01 + ½ Δr. G 02 = -27. 7 к. Дж/моль
3 СО(г) + ½ О 2 (г) = СО 2 (г) Δr. G 01 = -256. 2 к. Дж 4 Fe(тв) + 3 О 2 (г) = 2 Fe 2 О 3 (тв) Δr. G 02 = -1482. 1 к. Дж Fe 2 О 3 (тв) + 3 СО (г) = 2 Fe(тв) + 3 СО 2 (г) и Δr. G 0 = 3Δr. G 01 + ½ Δr. G 02 = -27. 7 к. Дж/моль
 Диаграммы Эллингема Реакция Ni. О(тв) + С(гр) = Ni(тв) + СО(г) идет выше 680 К Реакция Al 2 О 3(тв) + 3 Mg(тв) = 2 Al(тв) + 3 Mg. О(тв) при 1000 К идет в прямом направлении, а при 2000 К – в обратном Третьяков, с. 31 Фримантл, с. 254
Диаграммы Эллингема Реакция Ni. О(тв) + С(гр) = Ni(тв) + СО(г) идет выше 680 К Реакция Al 2 О 3(тв) + 3 Mg(тв) = 2 Al(тв) + 3 Mg. О(тв) при 1000 К идет в прямом направлении, а при 2000 К – в обратном Третьяков, с. 31 Фримантл, с. 254
 Третьяков, с. 31 Вероятность самопроизвольного протекания химических реакций
Третьяков, с. 31 Вероятность самопроизвольного протекания химических реакций
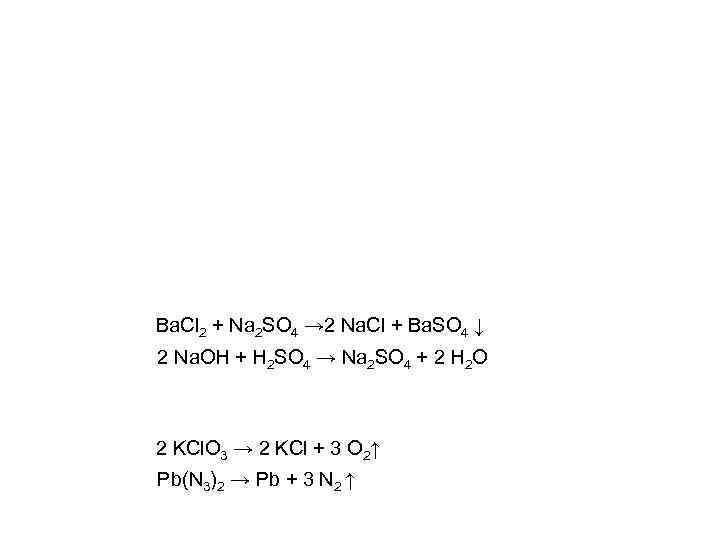 Ba. Cl 2 + Na 2 SO 4 → 2 Na. Cl + Ba. SO 4 ↓ 2 Na. OH + H 2 SO 4 → Na 2 SO 4 + 2 H 2 O 2 KCl. O 3 → 2 KCl + 3 O 2↑ Pb(N 3)2 → Pb + 3 N 2 ↑
Ba. Cl 2 + Na 2 SO 4 → 2 Na. Cl + Ba. SO 4 ↓ 2 Na. OH + H 2 SO 4 → Na 2 SO 4 + 2 H 2 O 2 KCl. O 3 → 2 KCl + 3 O 2↑ Pb(N 3)2 → Pb + 3 N 2 ↑
 Н 2(г) + ½ О 2(г) Н 2 О(ж) Fe 2 O 3(к) + 2 Al(к) Al 2 О 3(к) + 2 Fe(к) Δr. Н 0 = -286 к. Дж Δr. Н 0 = -854 к. Дж
Н 2(г) + ½ О 2(г) Н 2 О(ж) Fe 2 O 3(к) + 2 Al(к) Al 2 О 3(к) + 2 Fe(к) Δr. Н 0 = -286 к. Дж Δr. Н 0 = -854 к. Дж
 Константа химического равновесия a. A + b. B + … c. C + d. D + … или Кс и Кр – константы химического равновесия
Константа химического равновесия a. A + b. B + … c. C + d. D + … или Кс и Кр – константы химического равновесия
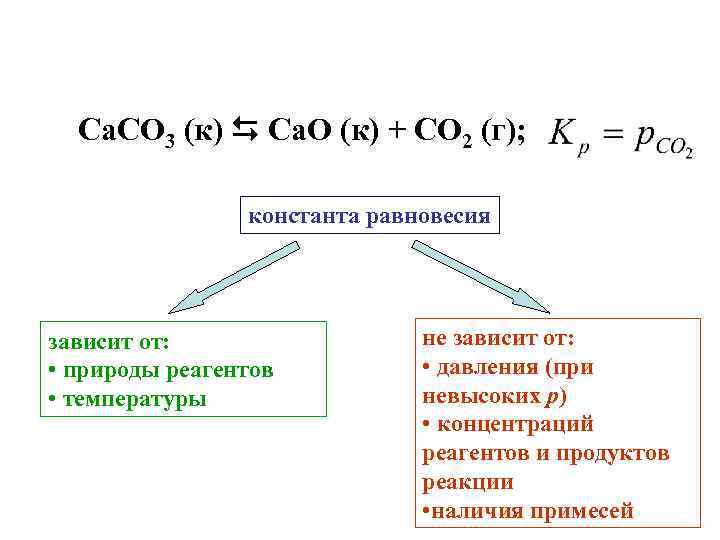 Ca. CO 3 (к) Ca. O (к) + CO 2 (г); константа равновесия зависит от: • природы реагентов • температуры не зависит от: • давления (при невысоких р) • концентраций реагентов и продуктов реакции • наличия примесей
Ca. CO 3 (к) Ca. O (к) + CO 2 (г); константа равновесия зависит от: • природы реагентов • температуры не зависит от: • давления (при невысоких р) • концентраций реагентов и продуктов реакции • наличия примесей
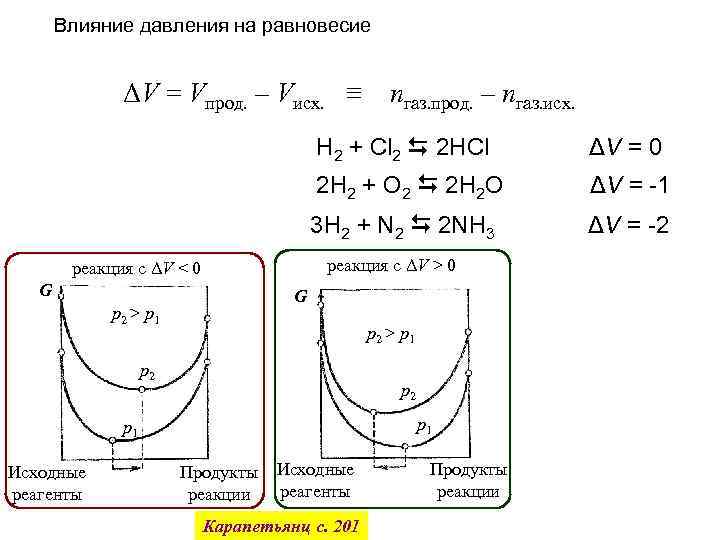 Влияние давления на равновесие ΔV = Vпрод. – Vисх. ≡ nгаз. прод. – nгаз. исх. H 2 + Cl 2 2 HCl ΔV = 0 2 H 2 + O 2 2 H 2 O ΔV = -1 3 H 2 + N 2 2 NH 3 ΔV = -2 реакция с ΔV > 0 реакция с ΔV < 0 G G p 2 > p 1 p 2 p 1 Исходные реагенты Продукты реакции Исходные реагенты Карапетьянц с. 201 Продукты реакции
Влияние давления на равновесие ΔV = Vпрод. – Vисх. ≡ nгаз. прод. – nгаз. исх. H 2 + Cl 2 2 HCl ΔV = 0 2 H 2 + O 2 2 H 2 O ΔV = -1 3 H 2 + N 2 2 NH 3 ΔV = -2 реакция с ΔV > 0 реакция с ΔV < 0 G G p 2 > p 1 p 2 p 1 Исходные реагенты Продукты реакции Исходные реагенты Карапетьянц с. 201 Продукты реакции
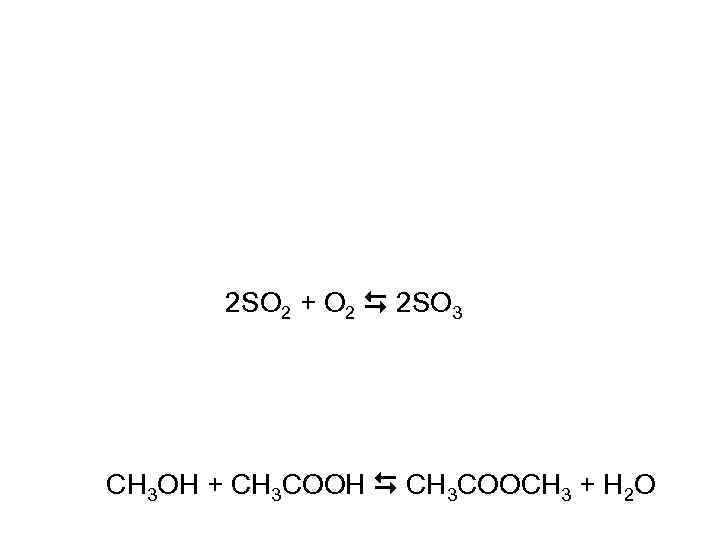 2 SO 2 + O 2 2 SO 3 СН 3 ОН + СН 3 СООН СН 3 СООСН 3 + Н 2 О
2 SO 2 + O 2 2 SO 3 СН 3 ОН + СН 3 СООН СН 3 СООСН 3 + Н 2 О
 Изменения ΔG в реальных условиях химических реакций (изотерма реакции):
Изменения ΔG в реальных условиях химических реакций (изотерма реакции):
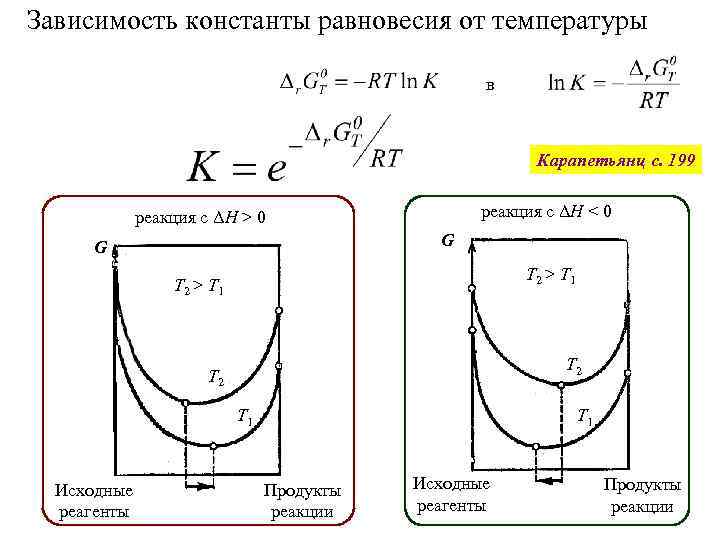 Зависимость константы равновесия от температуры в Карапетьянц с. 199 реакция с ΔH < 0 реакция с ΔH > 0 G G T 2 > T 1 T 2 T 1 Исходные реагенты T 1 Продукты реакции Исходные реагенты Продукты реакции
Зависимость константы равновесия от температуры в Карапетьянц с. 199 реакция с ΔH < 0 реакция с ΔH > 0 G G T 2 > T 1 T 2 T 1 Исходные реагенты T 1 Продукты реакции Исходные реагенты Продукты реакции
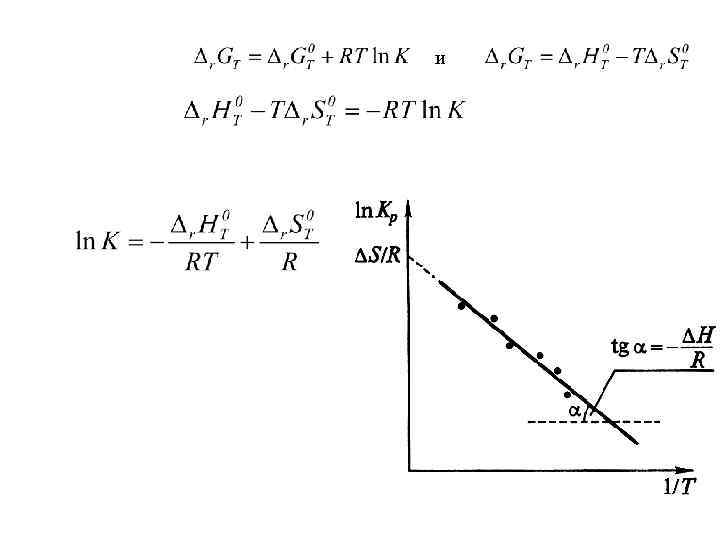 и
и
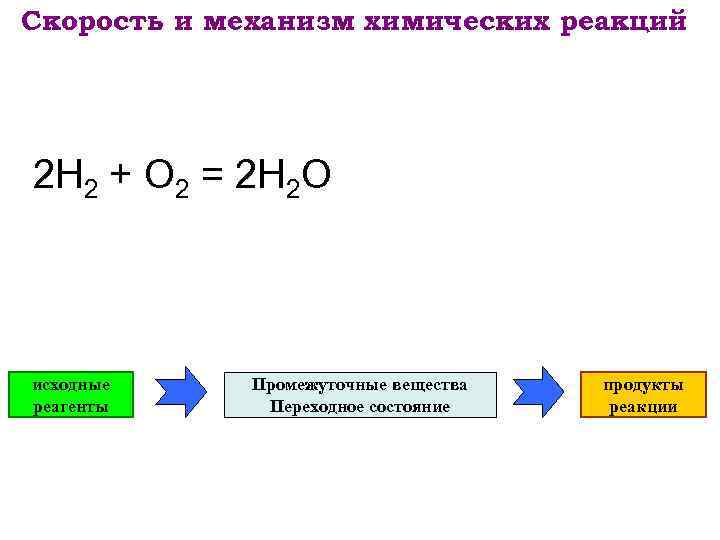 Скорость и механизм химических реакций 2 Н 2 + О 2 = 2 Н 2 О исходные реагенты Промежуточные вещества Переходное состояние продукты реакции
Скорость и механизм химических реакций 2 Н 2 + О 2 = 2 Н 2 О исходные реагенты Промежуточные вещества Переходное состояние продукты реакции
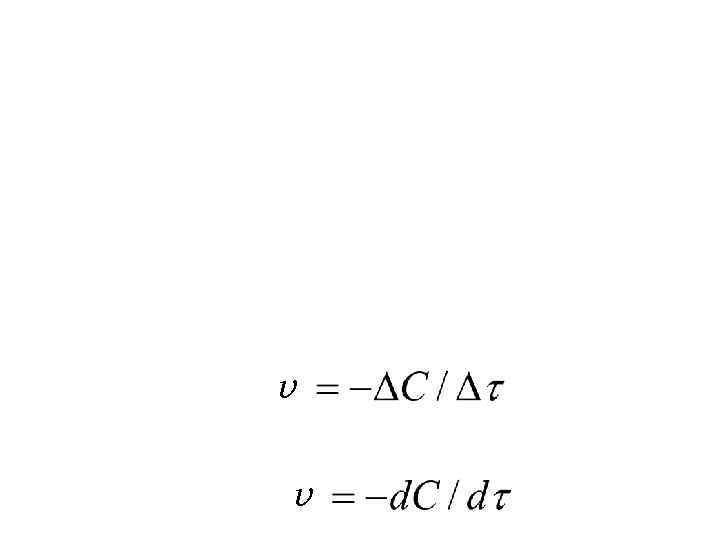 v v
v v
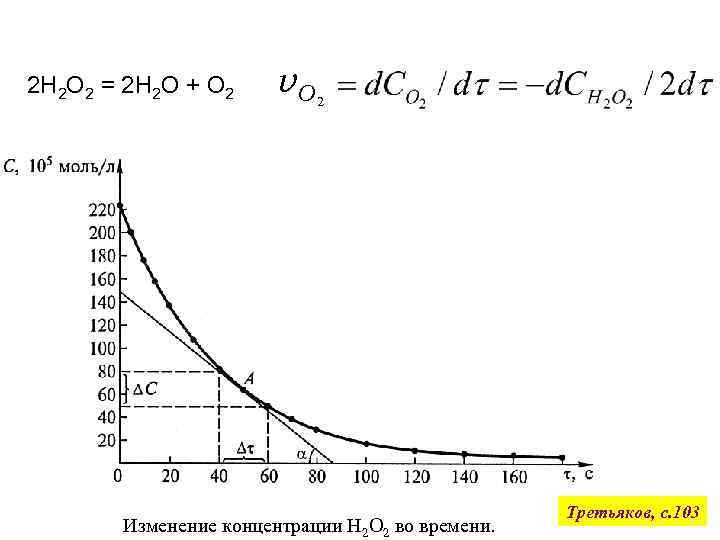 2 Н 2 О 2 = 2 Н 2 О + О 2 v. О 2 Изменение концентрации Н 2 О 2 во времени. Третьяков, с. 103
2 Н 2 О 2 = 2 Н 2 О + О 2 v. О 2 Изменение концентрации Н 2 О 2 во времени. Третьяков, с. 103
 Закон действия масс (Гульдберг и Вааге, 1867 г. ) АВ + С → А + ВС v = k[C]m[AB]n,
Закон действия масс (Гульдберг и Вааге, 1867 г. ) АВ + С → А + ВС v = k[C]m[AB]n,
![v = k[C]m[AB]n, берем СС = const (>>CAB), и получаем v затем берем СAB v = k[C]m[AB]n, берем СС = const (>>CAB), и получаем v затем берем СAB](https://present5.com/presentation/3/-29882262_17230563.pdf-img/-29882262_17230563.pdf-62.jpg) v = k[C]m[AB]n, берем СС = const (>>CAB), и получаем v затем берем СAB = const (>>CС), и получаем v = k’’[C]m. = k’[AB]n,
v = k[C]m[AB]n, берем СС = const (>>CAB), и получаем v затем берем СAB = const (>>CС), и получаем v = k’’[C]m. = k’[AB]n,
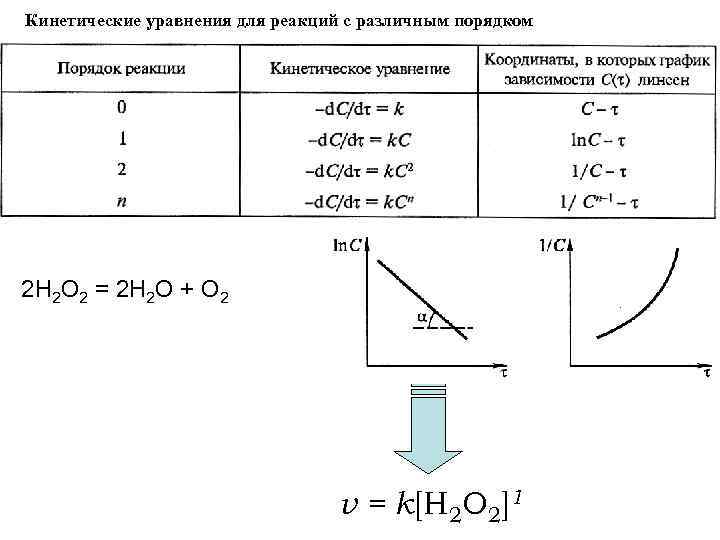 Кинетические уравнения для реакций с различным порядком 2 Н 2 О 2 = 2 Н 2 О + О 2 v = k[Н 2 О 2]1
Кинетические уравнения для реакций с различным порядком 2 Н 2 О 2 = 2 Н 2 О + О 2 v = k[Н 2 О 2]1
![v = k[C]m[AB]n lgv = lgk + m lg[C] + n lg[AB] v = k[C]m[AB]n lgv = lgk + m lg[C] + n lg[AB]](https://present5.com/presentation/3/-29882262_17230563.pdf-img/-29882262_17230563.pdf-64.jpg) v = k[C]m[AB]n lgv = lgk + m lg[C] + n lg[AB]
v = k[C]m[AB]n lgv = lgk + m lg[C] + n lg[AB]
![Физический смысл величины k: v = k[C]m[AB]n = k v = k[C] , (моль/л·с) Физический смысл величины k: v = k[C]m[AB]n = k v = k[C] , (моль/л·с)](https://present5.com/presentation/3/-29882262_17230563.pdf-img/-29882262_17230563.pdf-65.jpg) Физический смысл величины k: v = k[C]m[AB]n = k v = k[C] , (моль/л·с) k = v/[C] , (с-1) v = k[C]2 , (моль/л·с) k = v/[C]2, (л/моль·с) v = k[C]3, (моль/л·с) k = v/[C]3, (л 2/моль2·с)
Физический смысл величины k: v = k[C]m[AB]n = k v = k[C] , (моль/л·с) k = v/[C] , (с-1) v = k[C]2 , (моль/л·с) k = v/[C]2, (л/моль·с) v = k[C]3, (моль/л·с) k = v/[C]3, (л 2/моль2·с)
 Период полупревращения вещества ln. C = ln. C 0 – kt Примечание: 1/C = 1/C 0 + kt
Период полупревращения вещества ln. C = ln. C 0 – kt Примечание: 1/C = 1/C 0 + kt
![«Кинетический» вывод константы равновесия А + В АВ vпр = k[А][B] vобр = «Кинетический» вывод константы равновесия А + В АВ vпр = k[А][B] vобр =](https://present5.com/presentation/3/-29882262_17230563.pdf-img/-29882262_17230563.pdf-67.jpg) «Кинетический» вывод константы равновесия А + В АВ vпр = k[А][B] vобр = k’[АB] vпр = vобр k[А][B] = k’[АB] или a. A + b. B + … c. C + d. D + …
«Кинетический» вывод константы равновесия А + В АВ vпр = k[А][B] vобр = k’[АB] vпр = vобр k[А][B] = k’[АB] или a. A + b. B + … c. C + d. D + …
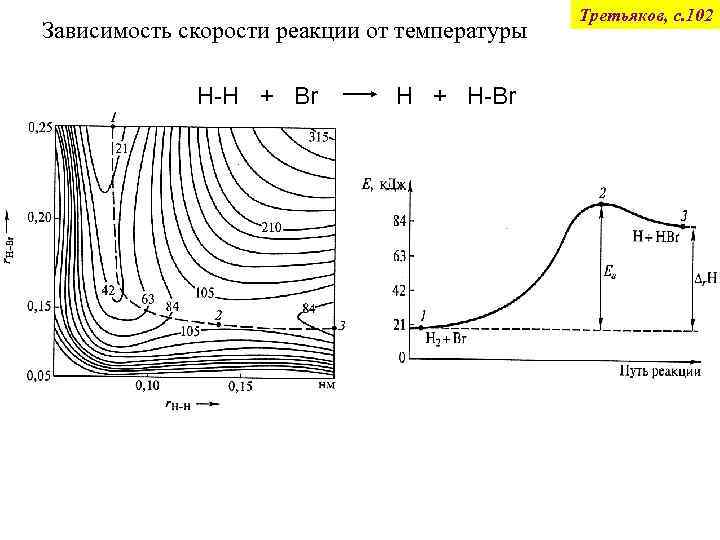 Зависимость скорости реакции от температуры H-H + Br H + H-Br Третьяков, с. 102
Зависимость скорости реакции от температуры H-H + Br H + H-Br Третьяков, с. 102
 (правило где Вант-Гоффа, 1884 г. )
(правило где Вант-Гоффа, 1884 г. )
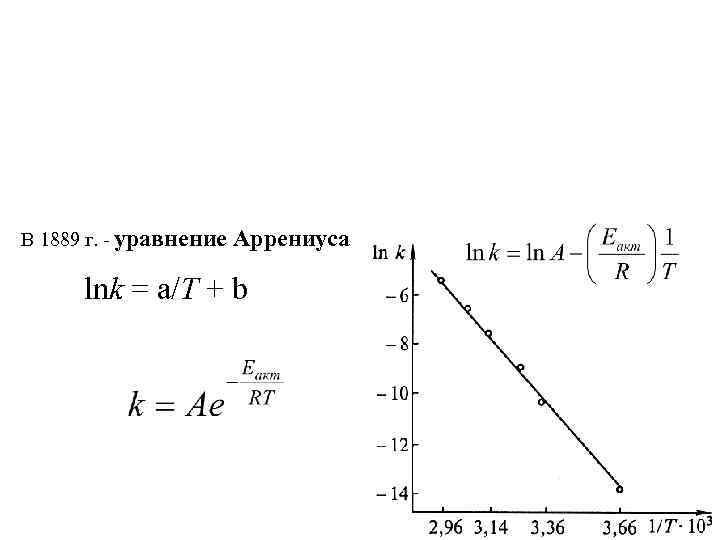 В 1889 г. - уравнение Аррениуса lnk = a/T + b
В 1889 г. - уравнение Аррениуса lnk = a/T + b
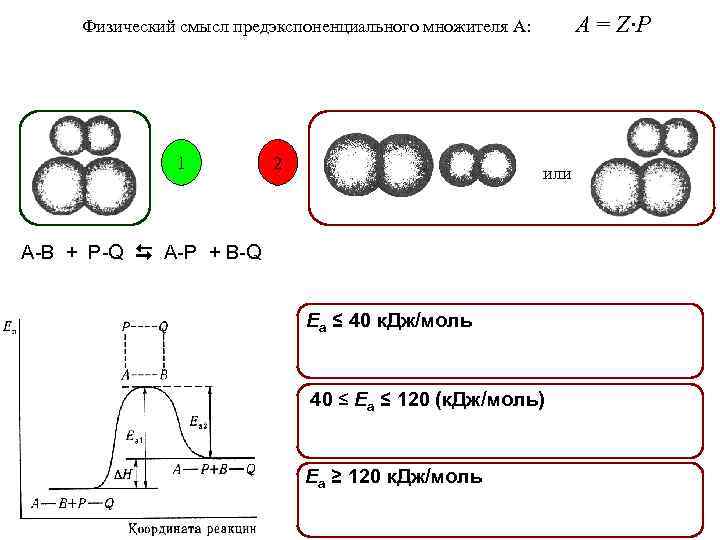 A = Z·P Физический смысл предэкспоненциального множителя А: 1 2 или A-B + P-Q A-P + B-Q Еа ≤ 40 к. Дж/моль 40 ≤ Еа ≤ 120 (к. Дж/моль) Еа ≥ 120 к. Дж/моль
A = Z·P Физический смысл предэкспоненциального множителя А: 1 2 или A-B + P-Q A-P + B-Q Еа ≤ 40 к. Дж/моль 40 ≤ Еа ≤ 120 (к. Дж/моль) Еа ≥ 120 к. Дж/моль
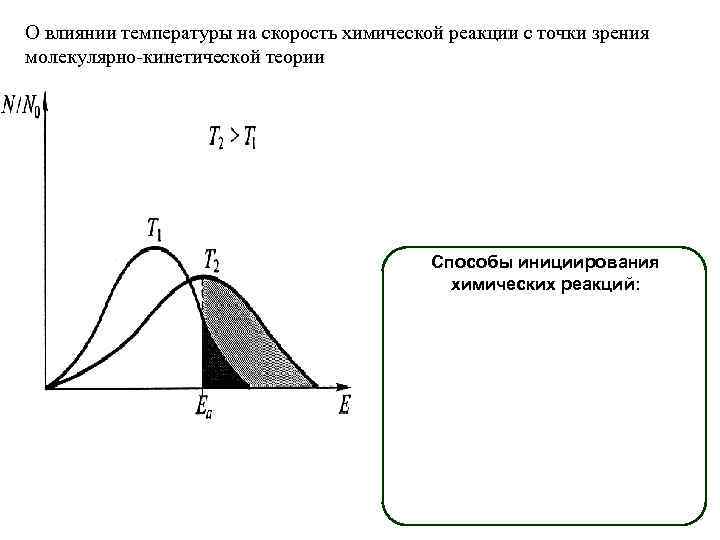 О влиянии температуры на скорость химической реакции с точки зрения молекулярно-кинетической теории Способы инициирования химических реакций:
О влиянии температуры на скорость химической реакции с точки зрения молекулярно-кинетической теории Способы инициирования химических реакций:
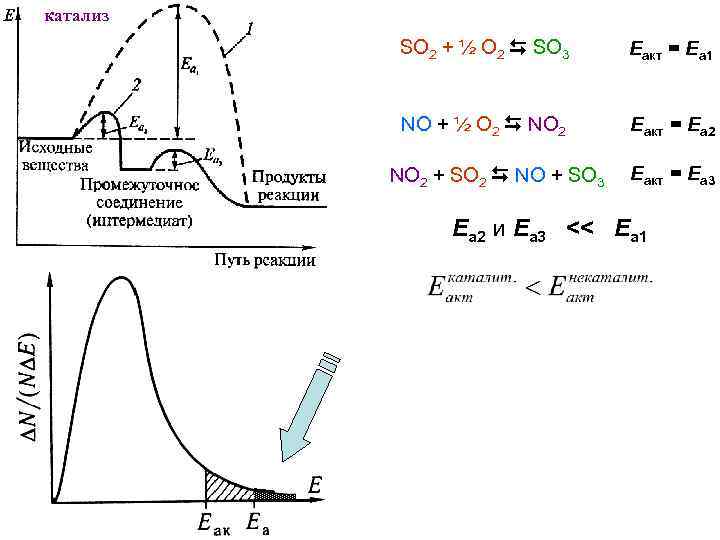 катализ SO 2 + ½ O 2 SO 3 Eакт = Еа 1 NO + ½ O 2 NO 2 Eакт = Еа 2 NO 2 + SO 2 NO + SO 3 Eакт = Еа 3 Еа 2 и Еа 3 << Eа 1
катализ SO 2 + ½ O 2 SO 3 Eакт = Еа 1 NO + ½ O 2 NO 2 Eакт = Еа 2 NO 2 + SO 2 NO + SO 3 Eакт = Еа 3 Еа 2 и Еа 3 << Eа 1
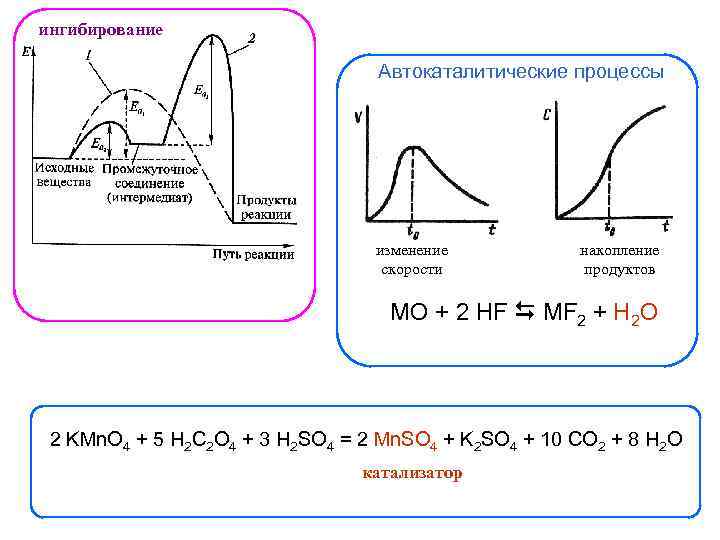 ингибирование Автокаталитические процессы изменение скорости накопление продуктов MO + 2 HF MF 2 + H 2 O 2 KMn. O 4 + 5 H 2 C 2 O 4 + 3 H 2 SO 4 = 2 Mn. SO 4 + K 2 SO 4 + 10 CO 2 + 8 H 2 O катализатор
ингибирование Автокаталитические процессы изменение скорости накопление продуктов MO + 2 HF MF 2 + H 2 O 2 KMn. O 4 + 5 H 2 C 2 O 4 + 3 H 2 SO 4 = 2 Mn. SO 4 + K 2 SO 4 + 10 CO 2 + 8 H 2 O катализатор
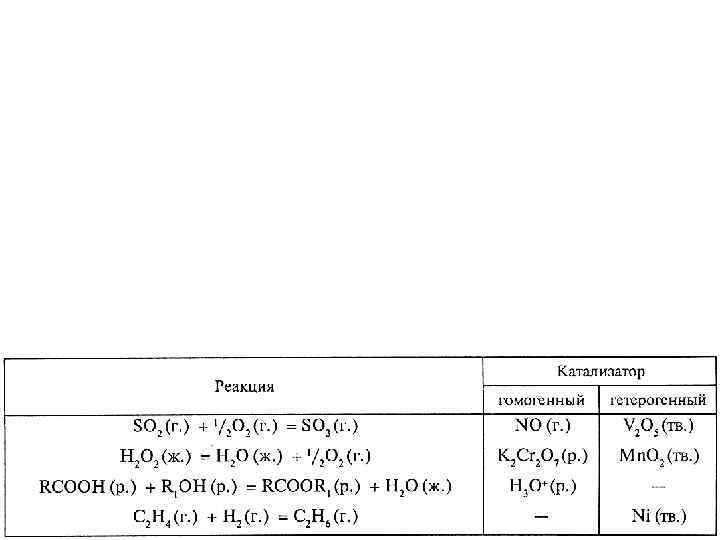
 Гомогенный катализ в газовой фазе – рассмотрен выше на примере реакции SO 2 → SO 3 (Кт NO) в водной фазе – примеров очень много H 2 O 2 → H 2 O + O 2 , катализаторы: ионы I-, оксоанионы Cr 2 O 72 -, Mo. O 42 -, WO 42 - ионы I-: Стадия 1: H 2 O 2 (водн. ) + I- (водн. ) → H 2 O (ж. ) + IO- (водн. ) Стадия 2: H 2 O 2 (водн. ) + IO- (водн. ) → H 2 O (ж. ) + О 2 (г. ) + I- (водн. ) оксоанионы: за счет образования с Н 2 О 2 промежуточных соединений сложного состава
Гомогенный катализ в газовой фазе – рассмотрен выше на примере реакции SO 2 → SO 3 (Кт NO) в водной фазе – примеров очень много H 2 O 2 → H 2 O + O 2 , катализаторы: ионы I-, оксоанионы Cr 2 O 72 -, Mo. O 42 -, WO 42 - ионы I-: Стадия 1: H 2 O 2 (водн. ) + I- (водн. ) → H 2 O (ж. ) + IO- (водн. ) Стадия 2: H 2 O 2 (водн. ) + IO- (водн. ) → H 2 O (ж. ) + О 2 (г. ) + I- (водн. ) оксоанионы: за счет образования с Н 2 О 2 промежуточных соединений сложного состава
 Гетерогенный катализ С 2 Н 4 (г. ) + Н 2 (г. ) → С 2 Н 6 (г. ) катализатор Ni (металл. ), 400ºС
Гетерогенный катализ С 2 Н 4 (г. ) + Н 2 (г. ) → С 2 Н 6 (г. ) катализатор Ni (металл. ), 400ºС
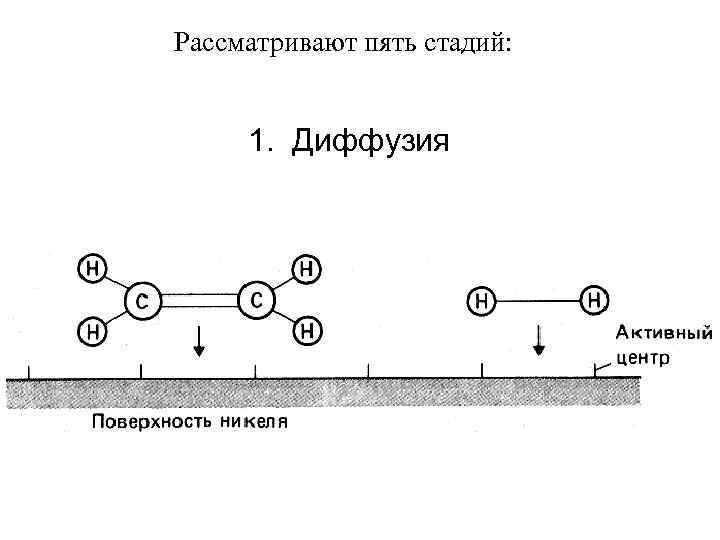 Рассматривают пять стадий: 1. Диффузия
Рассматривают пять стадий: 1. Диффузия
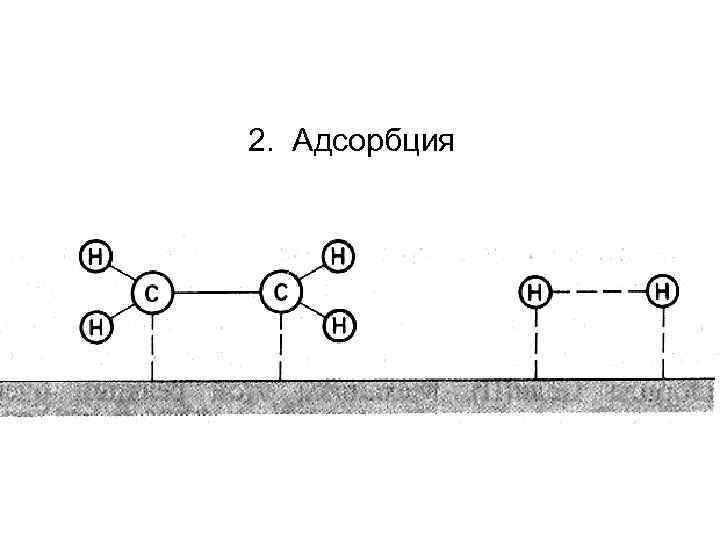 2. Адсорбция
2. Адсорбция
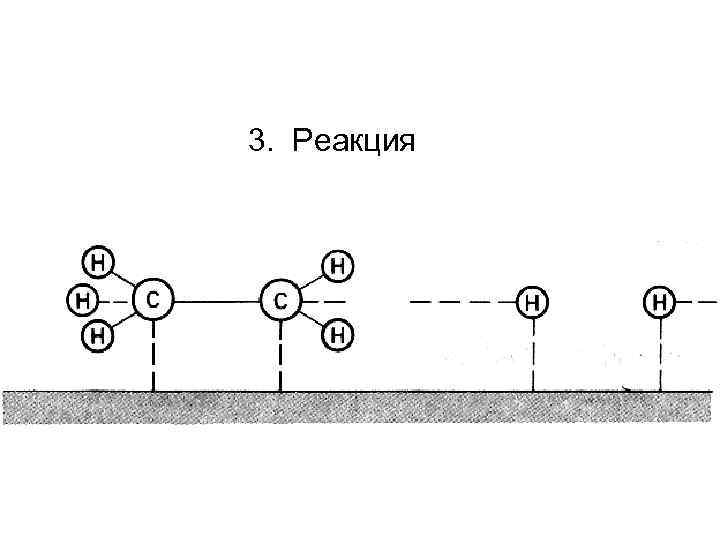 3. Реакция
3. Реакция
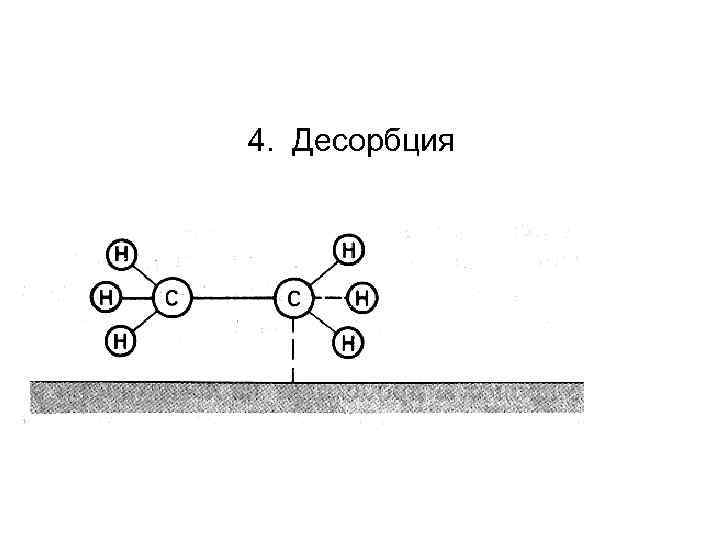 4. Десорбция
4. Десорбция
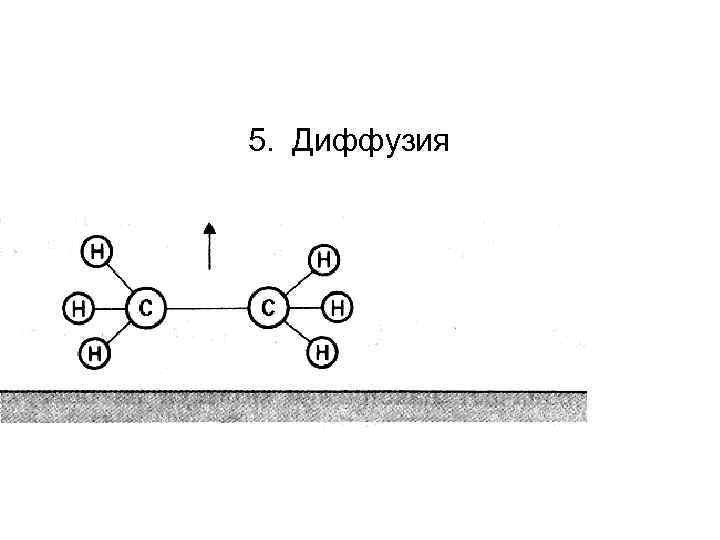 5. Диффузия
5. Диффузия
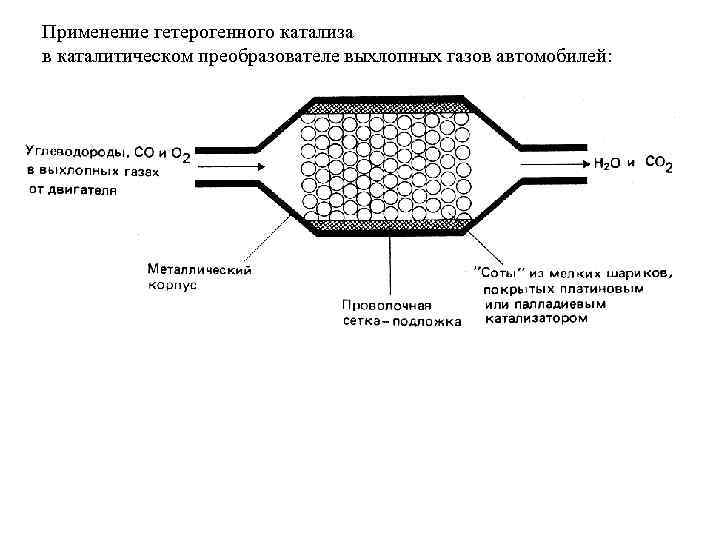 Применение гетерогенного катализа в каталитическом преобразователе выхлопных газов автомобилей:
Применение гетерогенного катализа в каталитическом преобразователе выхлопных газов автомобилей:
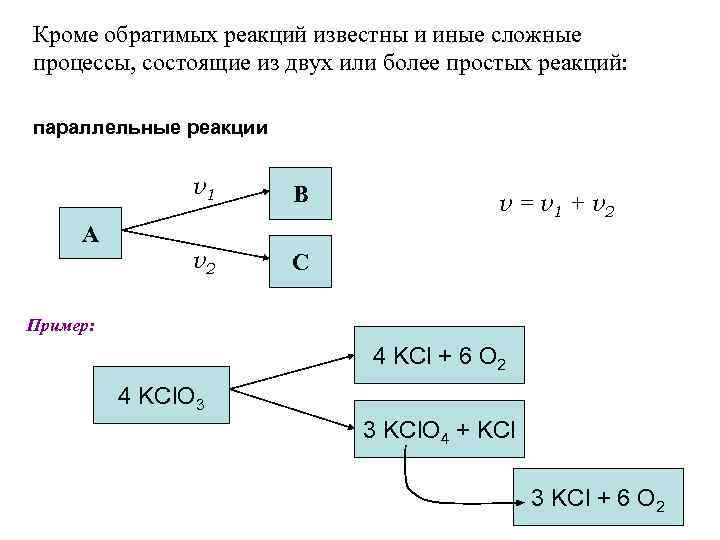 Кроме обратимых реакций известны и иные сложные процессы, состоящие из двух или более простых реакций: параллельные реакции v 1 А В v 2 С v = v 1 + v 2 Пример: 4 KCl + 6 O 2 4 KCl. O 3 3 KCl. O 4 + KCl 3 KCl + 6 O 2
Кроме обратимых реакций известны и иные сложные процессы, состоящие из двух или более простых реакций: параллельные реакции v 1 А В v 2 С v = v 1 + v 2 Пример: 4 KCl + 6 O 2 4 KCl. O 3 3 KCl. O 4 + KCl 3 KCl + 6 O 2
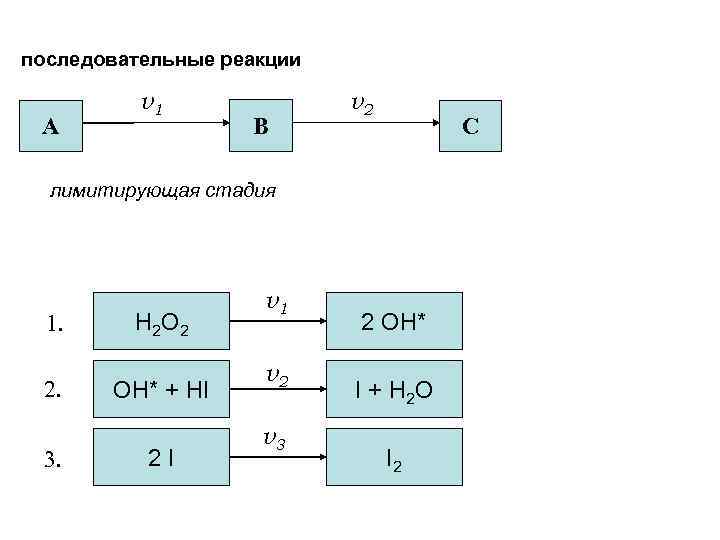 последовательные реакции А v 1 v 2 В С лимитирующая стадия Пример: 1. 2. 3. H 2 O 2 + 2 HI H 2 O 2 OH* + HI 2 I v 1 v 2 v 3 v → I 2 + 2 H 2 O 2 OH* I + H 2 O I 2 v = v 1 = k 1 [H 2 O 2]
последовательные реакции А v 1 v 2 В С лимитирующая стадия Пример: 1. 2. 3. H 2 O 2 + 2 HI H 2 O 2 OH* + HI 2 I v 1 v 2 v 3 v → I 2 + 2 H 2 O 2 OH* I + H 2 O I 2 v = v 1 = k 1 [H 2 O 2]
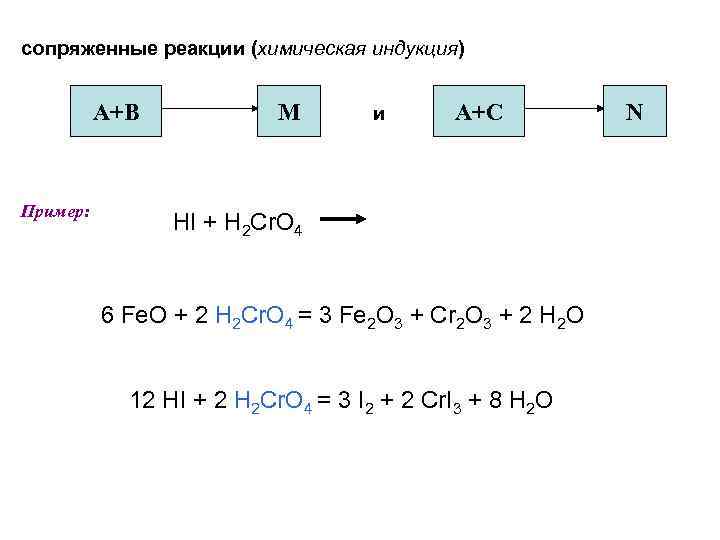 сопряженные реакции (химическая индукция) А+В Пример: M и А+C HI + H 2 Cr. O 4 6 Fe. O + 2 H 2 Cr. O 4 = 3 Fe 2 O 3 + Cr 2 O 3 + 2 H 2 O 12 HI + 2 H 2 Cr. O 4 = 3 I 2 + 2 Cr. I 3 + 8 H 2 O N
сопряженные реакции (химическая индукция) А+В Пример: M и А+C HI + H 2 Cr. O 4 6 Fe. O + 2 H 2 Cr. O 4 = 3 Fe 2 O 3 + Cr 2 O 3 + 2 H 2 O 12 HI + 2 H 2 Cr. O 4 = 3 I 2 + 2 Cr. I 3 + 8 H 2 O N
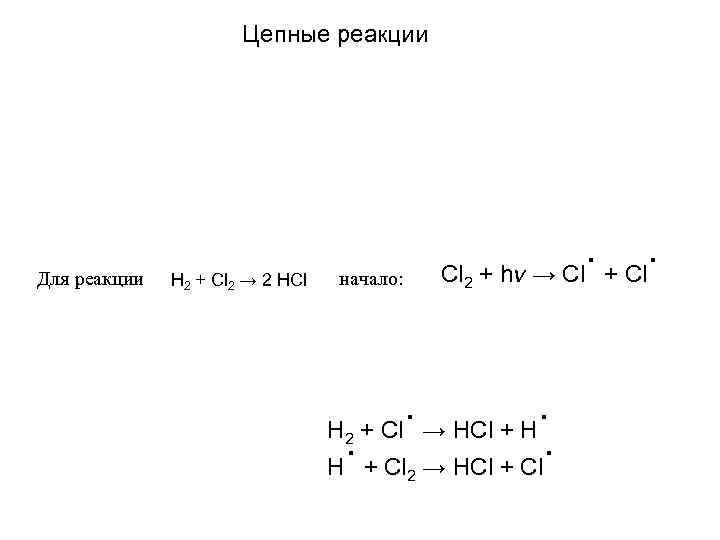 Цепные реакции Для реакции H 2 + Cl 2 → 2 HCl Cl 2 начало: . + Cl. + hν → Cl . → HCl + H. H + Cl → HCl + Cl. H 2 2
Цепные реакции Для реакции H 2 + Cl 2 → 2 HCl Cl 2 начало: . + Cl. + hν → Cl . → HCl + H. H + Cl → HCl + Cl. H 2 2
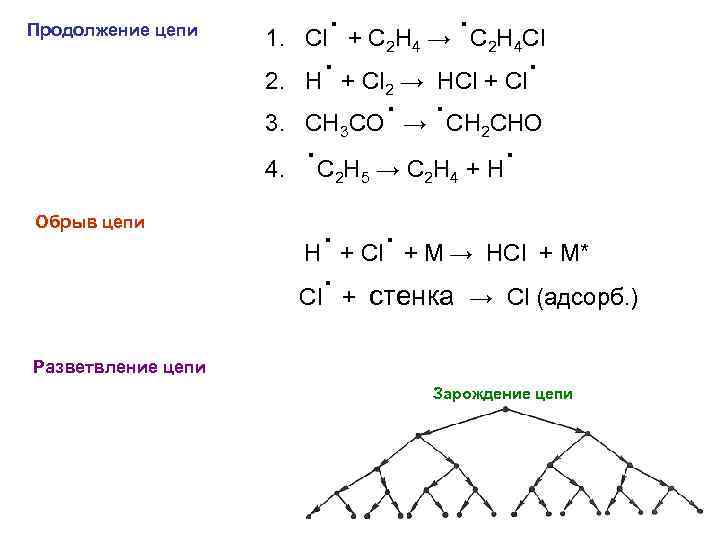 Продолжение цепи 1. 2. 3. 4. Обрыв цепи . + C H →. C H Cl Cl. + Cl → HCl + Cl. H. →. CH CHO CH CO. C H → C H + H. 2 4 2 3 2 2 5 2 4 . + Cl. + M → HCl + M* H. + стенка → Cl (адсорб. ) Cl Разветвление цепи Зарождение цепи
Продолжение цепи 1. 2. 3. 4. Обрыв цепи . + C H →. C H Cl Cl. + Cl → HCl + Cl. H. →. CH CHO CH CO. C H → C H + H. 2 4 2 3 2 2 5 2 4 . + Cl. + M → HCl + M* H. + стенка → Cl (адсорб. ) Cl Разветвление цепи Зарождение цепи


