Урок 10-40 идеальный газ .ppt
- Количество слайдов: 61

• Термины: определение, обозначение, единица измерения, формула: • молярная масса, • число Авогадро, • относительная молекулярная масса, • плотность вещества, • количество вещества, • концентрация,

• Термины: определение, обозначение, единица измерения, формула: • средне квадратичная скорость, • универсальная газовая постоянная, • средняя кинетическая энергия поступательного движения молекулы, • давление, • объем,

• Термины: определение, обозначение, единица измерения, формула: • температура, • абсолютная температура, • абсолютный нуль • основные положения МКТ и их опытное подтаерждение


Большинство законов молекулярнокинетической теории описывают процессы в идеальном газе.

Идеальный газ это модель использую которую, изучают поведение реального газа.

Идеальный газ это абстрактный газ, молекулы которого являются материальными точками и не притягиваются друг с другом.

Идеальный газ это абстрактный газ, молекулы которого не обладают потенциальной энергией.

Идеальным газом является газ под низким давлением и при высокой температуре.

Идеальным газом является любой ненасыщенный пар, который достаточно далек от состояния насыщения.

Идеальным газом является воздух при нормальных условиях р = Па Т = 273 К

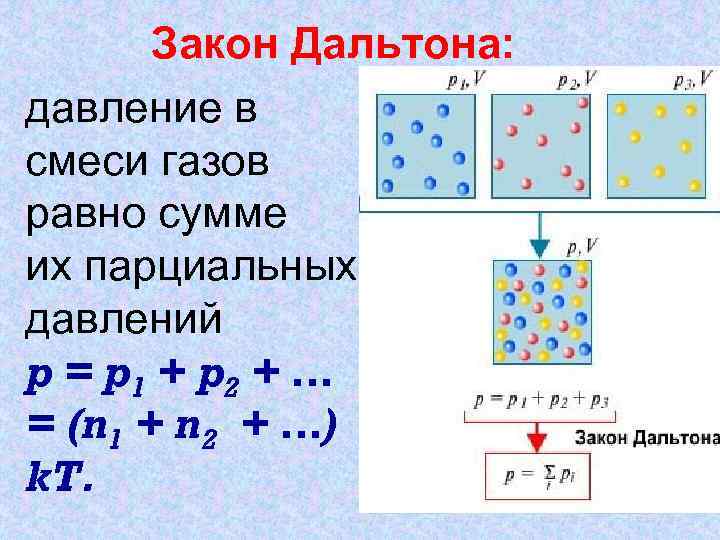
Закон Дальтона: Основное уравнение давление в МКТ газов. смеси газов равно сумме их парциальных давлений p = p 1 + p 2 + … = (n 1 + n 2 + …) k. T.
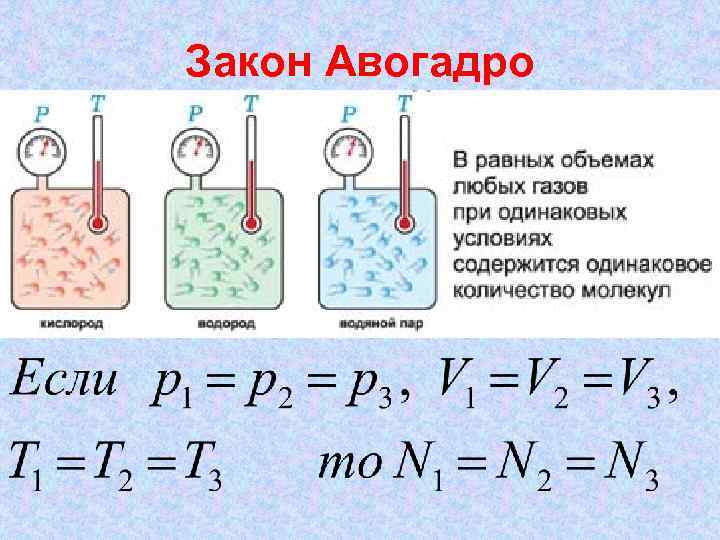
Закон Авогадро

Закон Авогадро один моль любого газа при нормальных условиях занимает один и тот же объем V 0, равный V 0 = 0, 0224 м 3/моль = 22, 4 дм 3/моль.


Основное уравнение МКТ газов. это уравнение которое устанавливает связь между макро и микро параметрами

Основное уравнение МКТ идеального газа записывается


Уравнение состояния идеального газа — это уравнение, которое связывает три основных термодинамических макро параметра. (давление, объём, температура)

в двух более состояниях называется уравнением Клапейрона или объединенным газовым законом. При т = const, он записывается или

• в одном состоянии называется уравнением Менделеева - Клапейрона. • Оно записывается,


Газовые законы (изопроцессы) • Изопроцессы (газовые законы) – это процессы, в которых один из макро параметров (p, V или T) остается неизменным.
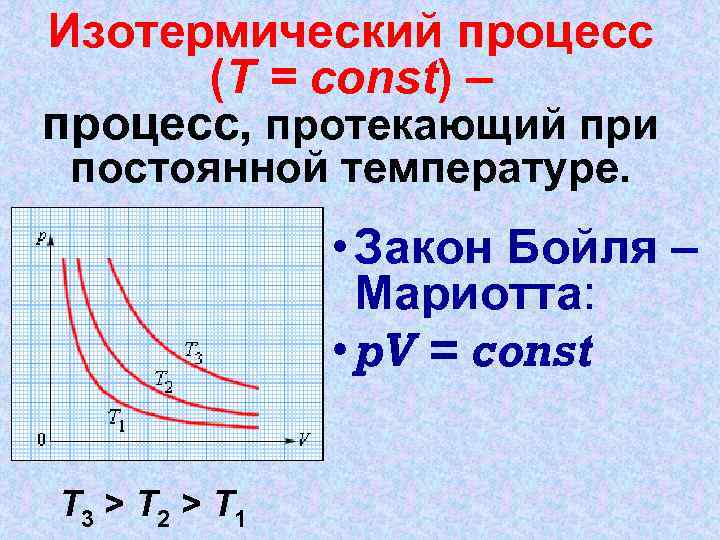
Изотермический процесс (T = const) – процесс, протекающий при постоянной температуре. • Закон Бойля – Мариотта: • p. V = const T 3 > T 2 > T 1
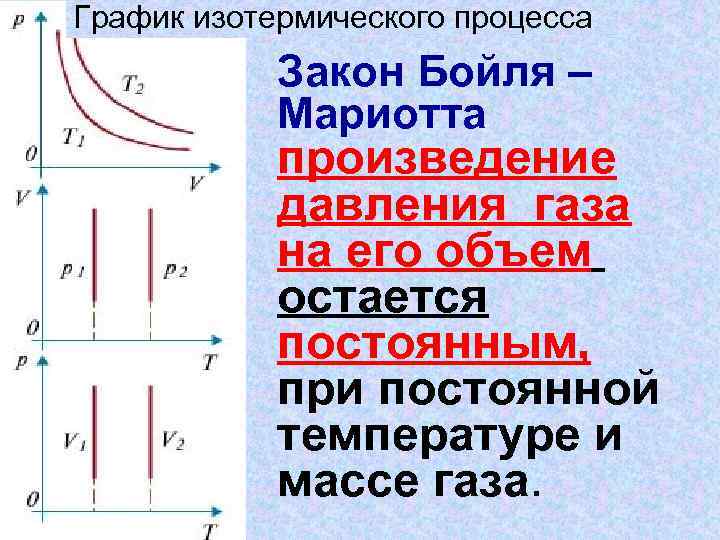
График изотермического процесса Закон Бойля – Мариотта произведение давления газа на его объем остается постоянным, при постоянной температуре и массе газа.
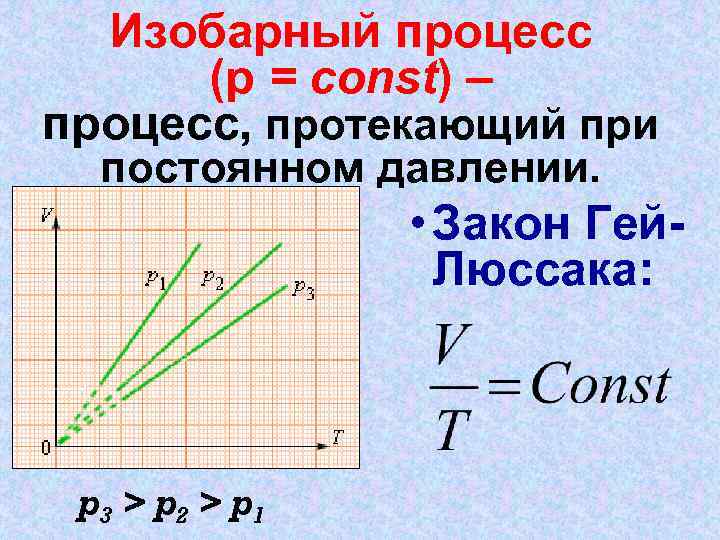
Изобарный процесс (р = const) – процесс, протекающий при постоянном давлении. • Закон Гей. Люссака: p 3 > p 2 > p 1

График изобарного процесса Закон Гей - Люссака p 3 > p 2 > p 1 отношение объёма газа к его температуре остается постоянным, при постоянном давлении и массе газа.
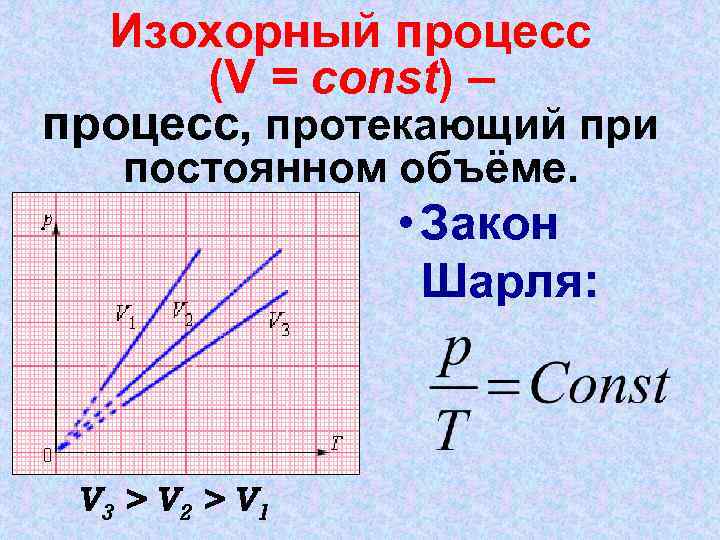
Изохорный процесс (V = const) – процесс, протекающий при постоянном объёме. • Закон Шарля: V 3 > V 2 > V 1
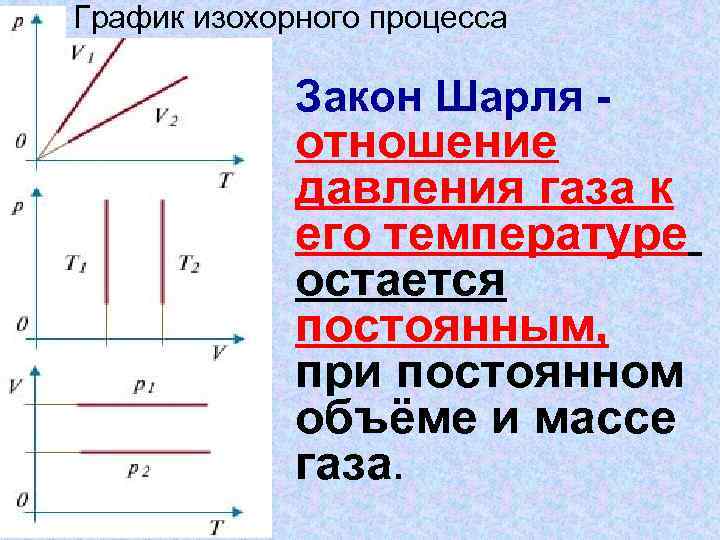
График изохорного процесса Закон Шарля - отношение давления газа к его температуре остается постоянным, при постоянном объёме и массе газа.


• Если жидкость находится в каком -то сосуде с открытой поверхностью, то обязательно с этой поверхности будут вылетать из жидкости молекулы, направление скорости которых перпендикулярно поверхности жидкости, а кинетической энергии достаточно для преодоления сил межмолекулярного притяжения.

• Подобный процесс называется испарением. • Образующийся в этом случае газ будет называться паром.

• Газ, находящийся в контакте со своей жидкостью, называется паром. • Одновременно с испарением жидкости будет протекать процесс конденсации газа.

• Отдельные молекулы газа, имея направление скорости в сторону жидкости, будут попадать в поле притяжения межмолекулярных сил.

• Газы, находящиеся в контакте со своей жидкостью, могут быть • насыщенным, • не насыщенным, • перенасыщенным паром.

• Состояние газа зависит от соотношения (скорости протекания) процессов испарения и конденсации.

• Если пар и жидкость находятся в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы, то

• такой газ называется насыщенным паром. • Соответственно - если преобладает процесс испарения, газ называется не насыщенным паром

- если преобладает процесс конденсации, газ называется перенасыщенным пар

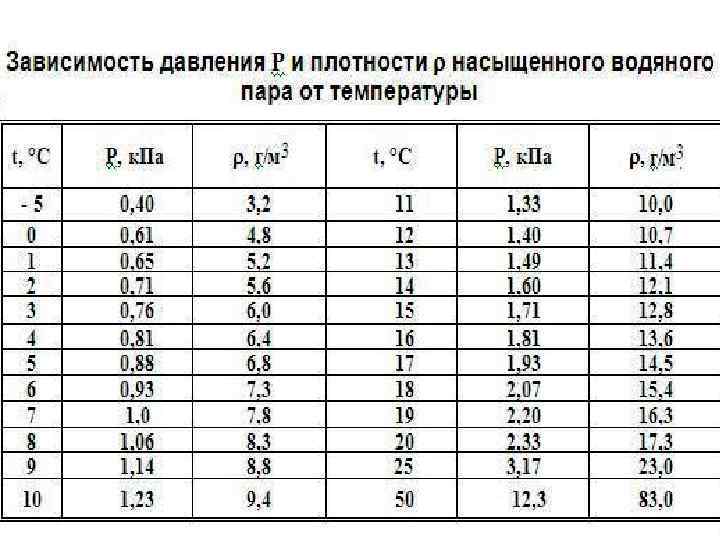
• Давление насыщенного пара p 0 данного вещества зависит только от его температуры и не зависит от объема • При повышении температуры давление насыщенного пара и его плотность возрастают

Для каждой температуры T давление p 0 насыщенного пара и плотность насыщенного пара определяется по таблице для данного вещества

• В атмосферном воздухе всегда присутствуют пары воды при некотором парциальном давлении p, которое, как правило, меньше давления насыщенного пара при данной температуре p 0.

• Отношение парциального давления водяных паров находящихся в воздухе к давлению насыщенного пара при данной температуре p/p 0, выраженное в процентах, называется относительной влажностью воздуха.

• Количество водяных паров находящихся в воздухе выраженное в грамма в одном метре кубическом называется абсолютной влажностью воздуха.

• Относительная влажность воздуха обозначается буквой – • Абсолютная влажность воздуха обозначается буквой -

Для определения относительно влажности воздуха пользуемся формулой

Для определения абсолютной влажности воздуха пользуемся формулой

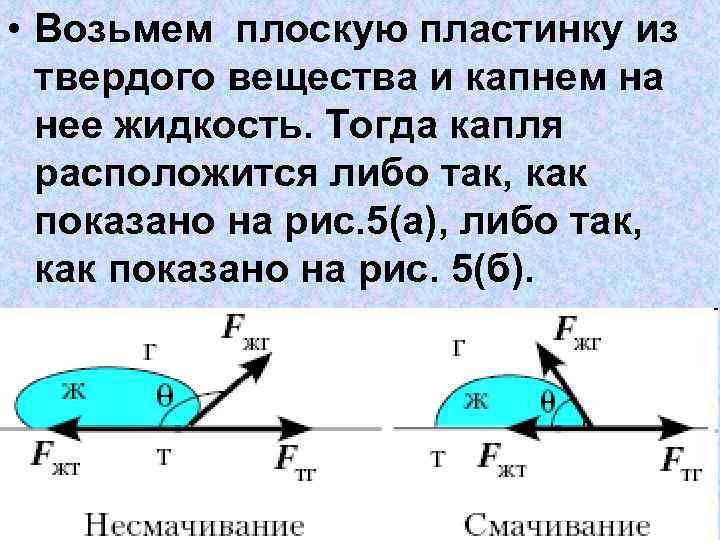
• Возьмем плоскую пластинку из твердого вещества и капнем на нее жидкость. Тогда капля расположится либо так, как показано на рис. 5(а), либо так, как показано на рис. 5(б).

• В первом случае жидкость смачивает твердое вещество, а во втором — нет. Отмеченный на рисунке угол θ называют краевым углом. • Для смачивающих жидкостей краевой угол острый, а для не смачивающих — тупой.
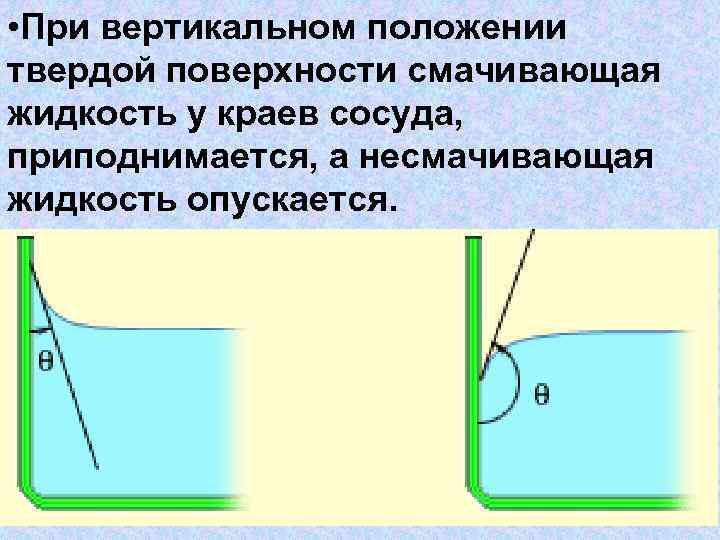
• При вертикальном положении твердой поверхности смачивающая жидкость у краев сосуда, приподнимается, а несмачивающая жидкость опускается.


Капиллярными явлениями называют подъем или опускание жидкости в трубках малого диаметра – капиллярах. • Смачивающие жидкости поднимаются по капиллярам, не смачивающие – опускаются. •

Подъем жидкости в капилляре продолжается до тех пор, пока сила тяжести действующая на столб жидкости в капилляре, не станет равной по модулю силе поверхностного натяжения,

• Высота подъема тем больше, чем меньше внутренний радиус трубки. Подъем воды имеет значительную величину в трубках, внутренний диаметр которых соизмерим с диаметром волоса (или еще меньше); поэтому такие трубки называют капиллярами (от греческого «капиллярис» — волосной, тонкий.

Капиллярные явления можно наблюдать и в узких щелях. Если опустить в воду две стеклянные пластины так, чтобы между ними образовалась узкая щель, то вода между пластинами поднимется, и тем выше, чем ближе они расположены. Капиллярные явления играют большую роль в природе. Множество мельчайших капилляров имеется в растениях. В деревьях по капиллярам влага из почвы поднимается до вершин деревьев, где через листья испаряется в атмосферу.

• В почве имеются капилляры, которые тем уже, чем плотнее почва. Вода по этим капиллярам поднимается до поверхности и быстро испаряется, а земля становится сухой. • Ранняя весенняя вспашка земли разрушает капилляры, т. е. сохраняет подпочвенную влагу и увеличивает урожай.

• Капиллярные явления имеют значение, в процессах сушки капиллярно-пористых тел в строительном деле. Чтобы кирпичная стена не сырела, между фундаментом дома и стеной делают прокладку из вещества, в котором нет капилляров. • В бумажной промышленности приходится учитывать капиллярность при изготовлении различных сортов бумаги, при изготовлении писчей бумаги ее пропитывают специальным составом, закупоривающим капилляры. • В быту капиллярные явления используют в фитилях, в промокательной бумаге, в перьях для подачи чернил и т. п.

• На дом: § 51 – 53, 64, 65. • Термины:
Урок 10-40 идеальный газ .ppt