Тепловое и цеп.воспл.ppt
- Количество слайдов: 13
 ТЕПЛОВОЕ И ЦЕПНОЕ ВОСПЛАМЕНЕНИЕ
ТЕПЛОВОЕ И ЦЕПНОЕ ВОСПЛАМЕНЕНИЕ
 Самовоспламенение – это явление резкого увеличения скорости экзотермических реакций, приводящее к самопроизвольному возникновению горения вещества в отсутствии источника зажигания. Теория теплового самовоспламенения (или взрыва) разработана академиком Семеновым Н. Н. , который исходил из представления об ускорении реакций окисления с температурой и преобладания скорости тепловыделения над теплоотводом.
Самовоспламенение – это явление резкого увеличения скорости экзотермических реакций, приводящее к самопроизвольному возникновению горения вещества в отсутствии источника зажигания. Теория теплового самовоспламенения (или взрыва) разработана академиком Семеновым Н. Н. , который исходил из представления об ускорении реакций окисления с температурой и преобладания скорости тепловыделения над теплоотводом.
 При окислительной реакции, проходящей с полной отдачей образующегося тепла, горение не возникает. Горение возникает лишь в условиях резкого самоускорения химического процесса, связанного с накоплением либо тепла в системе (так называемое тепловое самовоспламенение), либо катали зирующих промежуточных продуктов реакции (цепное самовоспламенение). Решающим условием возникновения процесса горения является превышение или равенство скорости выделения тепла реакции над скоростью отдачи тепла реагирующей системой в окружающую среду, например, стенкам реакционного сосуда.
При окислительной реакции, проходящей с полной отдачей образующегося тепла, горение не возникает. Горение возникает лишь в условиях резкого самоускорения химического процесса, связанного с накоплением либо тепла в системе (так называемое тепловое самовоспламенение), либо катали зирующих промежуточных продуктов реакции (цепное самовоспламенение). Решающим условием возникновения процесса горения является превышение или равенство скорости выделения тепла реакции над скоростью отдачи тепла реагирующей системой в окружающую среду, например, стенкам реакционного сосуда.
 Цепное самовоспламенение (цепной взрыв). Тепловая теория не в состоянии объяснить ряд особенностей горения, как, например, катализ и ингибирование при введении в реагирующую смесь малых добавок некоторых веществ (воды, галоидоводородов и т. п. ), светохимические реакции (Н 2+Cl 2) и т. д. Эти явления объясняются цепной теорией самовоспламенения, в соответствии с которой химическая реакция самоускоряется не путем непосредственного взаимодействия исходных молекул с выделением тепла, а с помощью активных "осколков" (радикалов, атомарных частиц и др. ), образующихся при распаде этих молекул. При этом скорость реакций может прогрессивно возрастать и в изотермических условиях.
Цепное самовоспламенение (цепной взрыв). Тепловая теория не в состоянии объяснить ряд особенностей горения, как, например, катализ и ингибирование при введении в реагирующую смесь малых добавок некоторых веществ (воды, галоидоводородов и т. п. ), светохимические реакции (Н 2+Cl 2) и т. д. Эти явления объясняются цепной теорией самовоспламенения, в соответствии с которой химическая реакция самоускоряется не путем непосредственного взаимодействия исходных молекул с выделением тепла, а с помощью активных "осколков" (радикалов, атомарных частиц и др. ), образующихся при распаде этих молекул. При этом скорость реакций может прогрессивно возрастать и в изотермических условиях.
 Цепной механизм реакции объясняется перераспределением избыточной энергии, которая реализуется в реакции следующим образом: запас химической энергии, сосредоточенный в молекуле продукта первичной реакции, передается одной из реагирующих молекул, которая переходит в химически активное состояние. Подобные условия более благоприятны для протекания реакции, чем условия, при которых химическая энергия взаимодействия переходит в энергию теплового ха отического движения. При таком механизме передачи энергии реакция приводит к образованию одной или нескольких новых активных частиц – возбужденных молекул, свободных радикалов или атомов.
Цепной механизм реакции объясняется перераспределением избыточной энергии, которая реализуется в реакции следующим образом: запас химической энергии, сосредоточенный в молекуле продукта первичной реакции, передается одной из реагирующих молекул, которая переходит в химически активное состояние. Подобные условия более благоприятны для протекания реакции, чем условия, при которых химическая энергия взаимодействия переходит в энергию теплового ха отического движения. При таком механизме передачи энергии реакция приводит к образованию одной или нескольких новых активных частиц – возбужденных молекул, свободных радикалов или атомов.
 Цепная реакция протекает различно, в зависимости от того, сколько активных вторичных центров образуется на каждый израсходованный активный центр – один или больше одного. В первом случае общее число активных центров остается неизменным, и реакция протекает с постоянной (при данных температуре и концент рации) скоростью, т. е. стационарно. Во втором случае число активных центров непрерывно возрастает, цепь разветвляяется и реакция самоускоряется.
Цепная реакция протекает различно, в зависимости от того, сколько активных вторичных центров образуется на каждый израсходованный активный центр – один или больше одного. В первом случае общее число активных центров остается неизменным, и реакция протекает с постоянной (при данных температуре и концент рации) скоростью, т. е. стационарно. Во втором случае число активных центров непрерывно возрастает, цепь разветвляяется и реакция самоускоряется.
 Это неограниченное, до полного израсходования реагирующих компонентов, самоускорение воспринимается как самовоспламенение. Внешне реакция протекает так же, как и при тепловом самовоспламенении. Различие состоит в том, что при тепловом механизме в реагирующей смеси накапливается теп ло, а при цепном механизме – активные центры. Оба фактора ведут к ускорению реакции. Цепное воспламенение принципиально может осуществляться при постоянной температуре без заметного разогрева смеси.
Это неограниченное, до полного израсходования реагирующих компонентов, самоускорение воспринимается как самовоспламенение. Внешне реакция протекает так же, как и при тепловом самовоспламенении. Различие состоит в том, что при тепловом механизме в реагирующей смеси накапливается теп ло, а при цепном механизме – активные центры. Оба фактора ведут к ускорению реакции. Цепное воспламенение принципиально может осуществляться при постоянной температуре без заметного разогрева смеси.
 Типичным примером цепной разветвленной реакции является про цесс окисления водорода (взрыв гремучего газа). Реакция протекает по схеме: 2 Н 2 + О 2 = 2 Н 2 О Обрыв цепей проходит либо на стенке: либо в объеме, с образованием малоактивного радикала НО 2.
Типичным примером цепной разветвленной реакции является про цесс окисления водорода (взрыв гремучего газа). Реакция протекает по схеме: 2 Н 2 + О 2 = 2 Н 2 О Обрыв цепей проходит либо на стенке: либо в объеме, с образованием малоактивного радикала НО 2.
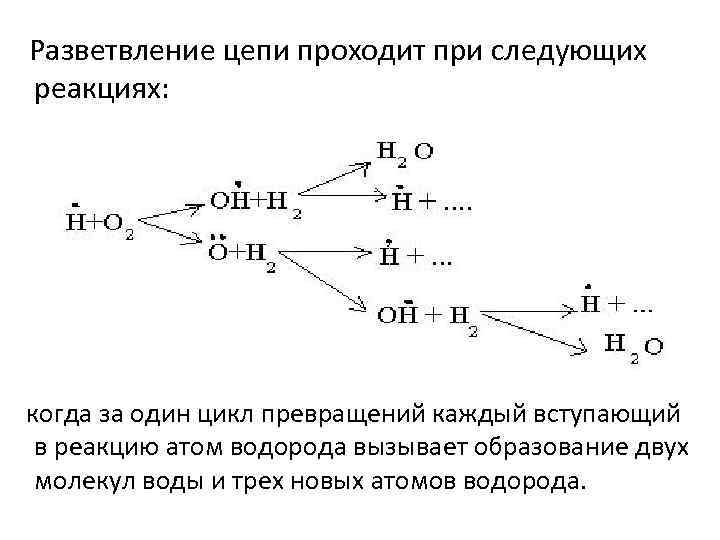 Разветвление цепи проходит при следующих реакциях: когда за один цикл превращений каждый вступающий в реакцию атом водорода вызывает образование двух молекул воды и трех новых атомов водорода.
Разветвление цепи проходит при следующих реакциях: когда за один цикл превращений каждый вступающий в реакцию атом водорода вызывает образование двух молекул воды и трех новых атомов водорода.
 О Н Н 2 О 2 Н 2 О НО Н О 2 Н 2 О Н НО О 2 О Н Н 2 О НО Н 2 О Н О Н Н 2 О 2 НО Н 2 Н НО Н 2 О
О Н Н 2 О 2 Н 2 О НО Н О 2 Н 2 О Н НО О 2 О Н Н 2 О НО Н 2 О Н О Н Н 2 О 2 НО Н 2 Н НО Н 2 О
 Механизм горения оксида углерода (II) 2 СО + О 2 2 СО 2 Зарождение цепи: М* + Н 2 О ОН. + Н. Продолжение цепи: Н. + О 2 ОН. + ∙О∙ ОН. + СО 2 + Н. ∙О∙ + СО 2 Обрыв цепи НО + Н + М Н 2 О + М*
Механизм горения оксида углерода (II) 2 СО + О 2 2 СО 2 Зарождение цепи: М* + Н 2 О ОН. + Н. Продолжение цепи: Н. + О 2 ОН. + ∙О∙ ОН. + СО 2 + Н. ∙О∙ + СО 2 Обрыв цепи НО + Н + М Н 2 О + М*
 Механизм горения метана СН 4 + 2 О 2 СО 2 + 2 Н 2 О Таким образом, в процессе протекания реакций Зарождение цепи: продолжения цепи СН 4 + М* ∙СН 3 + Н∙ + М происходит + Н∙ М* + Н 2 О ОН∙ последовательная потеря у Продолжение цепи. углеродов атомов водорода Н. + О 2 ∙ОН + ∙О∙ и превращения метана по цепочке: СН 4 + ∙ОН ∙СН 3 + Н 2 О СН 4 → ∙СН 3 → : СН 2 → НСО∙ СН 4 + ∙О∙ ∙СН 3 + ∙ОН → СО 2. ∙СН 3 + О 2 Н 2 СО + О: СО + Н 2 О Обрыв цепи Н 2 СО + ОН. НСО∙ + Н 2 О НО + Н + М Н 2 О + М* О: + СО 2 ОН∙ + СО 2 + Н∙ НСО∙ + О 2 СО + О: + ОН
Механизм горения метана СН 4 + 2 О 2 СО 2 + 2 Н 2 О Таким образом, в процессе протекания реакций Зарождение цепи: продолжения цепи СН 4 + М* ∙СН 3 + Н∙ + М происходит + Н∙ М* + Н 2 О ОН∙ последовательная потеря у Продолжение цепи. углеродов атомов водорода Н. + О 2 ∙ОН + ∙О∙ и превращения метана по цепочке: СН 4 + ∙ОН ∙СН 3 + Н 2 О СН 4 → ∙СН 3 → : СН 2 → НСО∙ СН 4 + ∙О∙ ∙СН 3 + ∙ОН → СО 2. ∙СН 3 + О 2 Н 2 СО + О: СО + Н 2 О Обрыв цепи Н 2 СО + ОН. НСО∙ + Н 2 О НО + Н + М Н 2 О + М* О: + СО 2 ОН∙ + СО 2 + Н∙ НСО∙ + О 2 СО + О: + ОН
 Механизм горения углерода С(т) + О 2(г) СО 2(г) Зарождение цепи: М* + Н 2 О ОН. + Н. Продолжение цепи: Н. + О 2 = ОН. + О: Сх + ОН = Сх-1 СО + Н. Сх-1 СО = Сх-1 + СО↑ 2 Сх-1 СО + ∙О∙ = 2 Сх-1 + СО↑ + СО 2↑ Сх + ∙О∙ = Сх-1 СО Сх + СО 2 = Сх-1 СО + СО↑ Обрыв цепи Сх + СО 2 = Сх-1 СО + СО↑
Механизм горения углерода С(т) + О 2(г) СО 2(г) Зарождение цепи: М* + Н 2 О ОН. + Н. Продолжение цепи: Н. + О 2 = ОН. + О: Сх + ОН = Сх-1 СО + Н. Сх-1 СО = Сх-1 + СО↑ 2 Сх-1 СО + ∙О∙ = 2 Сх-1 + СО↑ + СО 2↑ Сх + ∙О∙ = Сх-1 СО Сх + СО 2 = Сх-1 СО + СО↑ Обрыв цепи Сх + СО 2 = Сх-1 СО + СО↑


