ТЕПЛОТЕХНИКА.pptx
- Количество слайдов: 30
 ТЕПЛОТЕХНИКА Техническая термодинамика
ТЕПЛОТЕХНИКА Техническая термодинамика
 Теплотехника специальная дисциплина, изучающая методы преобразования, передачи и использования теплоты, а так же принцип действия и конструктивные особенности тепло- и парогенераторов, тепловых машин, аппаратов и устройств. Техническая термодинамика Теплотехника Теория теплообмена и теплопередача
Теплотехника специальная дисциплина, изучающая методы преобразования, передачи и использования теплоты, а так же принцип действия и конструктивные особенности тепло- и парогенераторов, тепловых машин, аппаратов и устройств. Техническая термодинамика Теплотехника Теория теплообмена и теплопередача
 Термодинамика – наука, изучающая закономерности взаимного превращения тепловой и механической энергии, сопровождающиеся тепловыми явлениями. Она лежит в основе расчетов и проектирования всех тепловых двигателей (компрессорных машин, двигателей внутреннего сгорания, паровых и газовых турбин, холодильных установок и т. д. ). Объектом изучения термодинамики являются различные термодинамические системы. Термодинамическая система (ТДС) – это совокупность материальных тел, находящихся в механическом и тепловом взаимодействии друг с другом и окружающими систему внешними силами.
Термодинамика – наука, изучающая закономерности взаимного превращения тепловой и механической энергии, сопровождающиеся тепловыми явлениями. Она лежит в основе расчетов и проектирования всех тепловых двигателей (компрессорных машин, двигателей внутреннего сгорания, паровых и газовых турбин, холодильных установок и т. д. ). Объектом изучения термодинамики являются различные термодинамические системы. Термодинамическая система (ТДС) – это совокупность материальных тел, находящихся в механическом и тепловом взаимодействии друг с другом и окружающими систему внешними силами.
 ТДС: - гомогенная - гетерогенная - изолированная. Процессы превращения теплоты в работу и работы в теплоту, реализуемые в тепловых машинах, осуществляются ТДС – так называемым рабочим телом. Рабочее тело – это, как правило, газообразные вещества (пары жидкостей и газы), которые способны значительно изменять свой объем при изменении внешних условий. Источниками теплоты являются тела, способные отдавать или получать теплоту при взаимодействии с более или менее нагретыми телами.
ТДС: - гомогенная - гетерогенная - изолированная. Процессы превращения теплоты в работу и работы в теплоту, реализуемые в тепловых машинах, осуществляются ТДС – так называемым рабочим телом. Рабочее тело – это, как правило, газообразные вещества (пары жидкостей и газы), которые способны значительно изменять свой объем при изменении внешних условий. Источниками теплоты являются тела, способные отдавать или получать теплоту при взаимодействии с более или менее нагретыми телами.
 Параметры состояния ТДС Дополнительные (определяются расчетом): Основные (определяются экспериментально): давление - температура - объем - энтальпия - -энтропия - внутренняя энергия - и др.
Параметры состояния ТДС Дополнительные (определяются расчетом): Основные (определяются экспериментально): давление - температура - объем - энтальпия - -энтропия - внутренняя энергия - и др.
 Давление газа, пара или жидкости на стенки сосуда, в котором они заключены – это средний результат ударов о его стенки молекул находящихся в непрерывном хаотическом движении. Давление измеряется силой, действующей на единицу поверхности:
Давление газа, пара или жидкости на стенки сосуда, в котором они заключены – это средний результат ударов о его стенки молекул находящихся в непрерывном хаотическом движении. Давление измеряется силой, действующей на единицу поверхности:
 1 атмосфера физическая (1 ат. ф) = 760 мм рт. ст. = 10, 33 м вод. ст. = 1, 033 кг с/см² = 101325 Па; 1 атмосфера техническая (1 ат. т) = 738 мм рт. ст. = 10 м вод. ст. = 1, 0 кг с/см² = 98100 Па. Распределение давления внутри жидкости
1 атмосфера физическая (1 ат. ф) = 760 мм рт. ст. = 10, 33 м вод. ст. = 1, 033 кг с/см² = 101325 Па; 1 атмосфера техническая (1 ат. т) = 738 мм рт. ст. = 10 м вод. ст. = 1, 0 кг с/см² = 98100 Па. Распределение давления внутри жидкости
 Температура: – это величина, характеризующая степень нагретости тела: Т = 273, 15 + t , К Удельный объем – это объем, заключенный в единице массы рабочего тела.
Температура: – это величина, характеризующая степень нагретости тела: Т = 273, 15 + t , К Удельный объем – это объем, заключенный в единице массы рабочего тела.
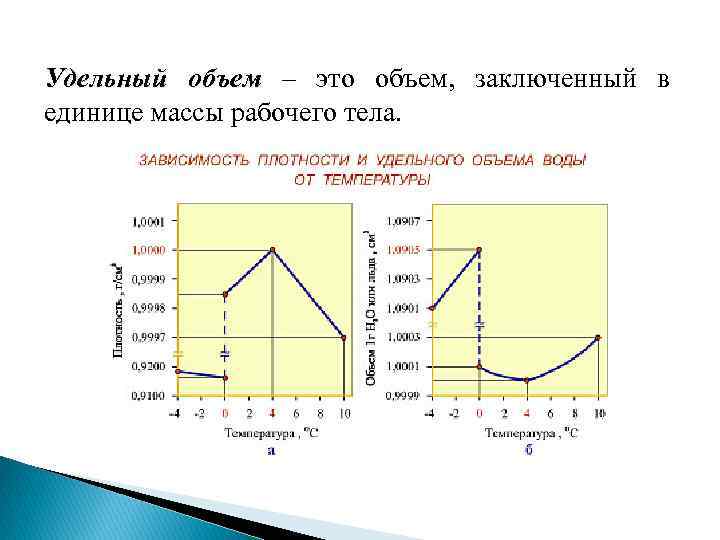 Удельный объем – это объем, заключенный в единице массы рабочего тела.
Удельный объем – это объем, заключенный в единице массы рабочего тела.
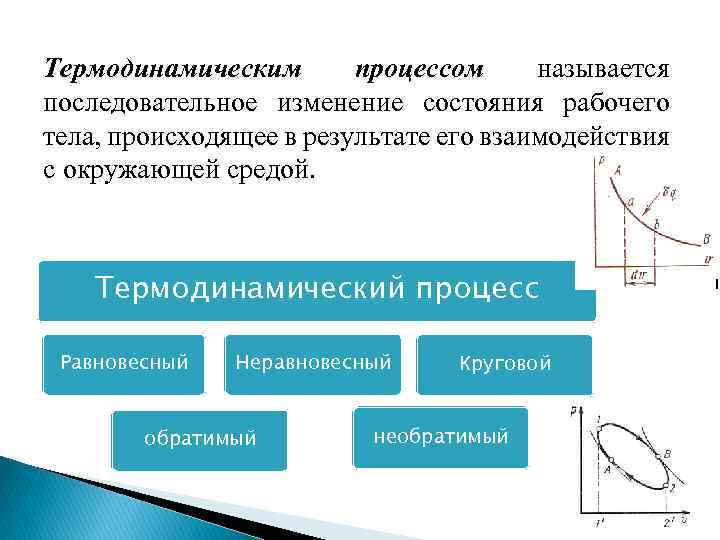 Термодинамическим процессом называется последовательное изменение состояния рабочего тела, происходящее в результате его взаимодействия с окружающей средой. Термодинамический процесс Равновесный Неравновесный обратимый Круговой необратимый
Термодинамическим процессом называется последовательное изменение состояния рабочего тела, происходящее в результате его взаимодействия с окружающей средой. Термодинамический процесс Равновесный Неравновесный обратимый Круговой необратимый
 Уравнение состояния идеального газа
Уравнение состояния идеального газа
 Уравнение состояния реальных газов В реальных газах, в отличие от идеальных, преобладают силы межмолекулярного взаимодействия, а объемом самих молекул пренебречь нельзя. Наличие сил отталкивания приводит к тому, что молекулы могут сближаться между собой лишь до некоторого минимального расстояния. Длина свободного пробега молекул уменьшается и число ударов о стенки сосуда, а, следовательно, и давление, увеличиваются по сравнению с идеальным газом. Силы притяжения действуют в том же направлении, что и внешнее давление, что приводит к возникновению молекулярного давления.
Уравнение состояния реальных газов В реальных газах, в отличие от идеальных, преобладают силы межмолекулярного взаимодействия, а объемом самих молекул пренебречь нельзя. Наличие сил отталкивания приводит к тому, что молекулы могут сближаться между собой лишь до некоторого минимального расстояния. Длина свободного пробега молекул уменьшается и число ударов о стенки сосуда, а, следовательно, и давление, увеличиваются по сравнению с идеальным газом. Силы притяжения действуют в том же направлении, что и внешнее давление, что приводит к возникновению молекулярного давления.
 Уравнение Ван-дер-Ваальса: Уравнение Вукаловича - Новикова: так как молекулы при нормальных условиях способны вступать в ассоциации
Уравнение Ван-дер-Ваальса: Уравнение Вукаловича - Новикова: так как молекулы при нормальных условиях способны вступать в ассоциации
 Газовые смеси Газовая смесь – это механическая смесь газов разного состава, в которой газы химически не взаимодействуют друг с другом. Температуры всех газов в смеси одинаковы и равны температуре смеси. Полное давление смеси идеальных газов равно сумме их парциальных давлений (закон Дальтона) :
Газовые смеси Газовая смесь – это механическая смесь газов разного состава, в которой газы химически не взаимодействуют друг с другом. Температуры всех газов в смеси одинаковы и равны температуре смеси. Полное давление смеси идеальных газов равно сумме их парциальных давлений (закон Дальтона) :
 Газовая смесь может быть выражена следующими способами: - массовыми долями; - объемными долями; - мольными долями.
Газовая смесь может быть выражена следующими способами: - массовыми долями; - объемными долями; - мольными долями.
 Соотношения между массовыми и объемными долями: Парциальное давление – давление, которое имел бы каждый газ, входящий в состав смеси, если бы он находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
Соотношения между массовыми и объемными долями: Парциальное давление – давление, которое имел бы каждый газ, входящий в состав смеси, если бы он находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
 Термодинамические процессы Изох орны й Изобарный Изотермный Адиа батн ый Термодинамические процессы
Термодинамические процессы Изох орны й Изобарный Изотермный Адиа батн ый Термодинамические процессы
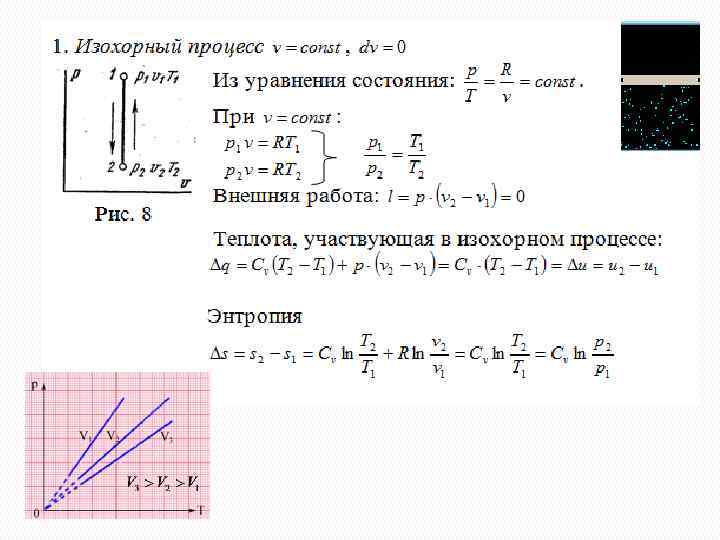

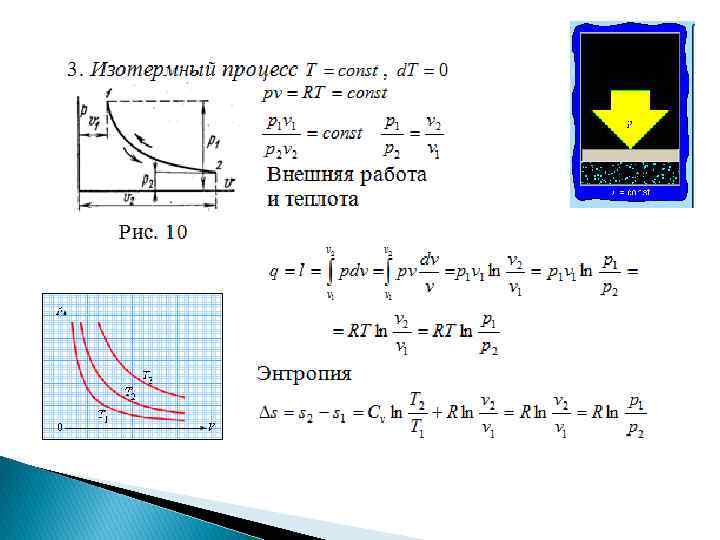
 Изображение термодинамических процессов
Изображение термодинамических процессов

 Водяной пар. Основные определения. pv - , TS- , i. S-диаграммы водяного пара. Водяной пар – это реальный газ близкий к состоянию насыщения, т. е. состоит из паровой и жидкой фаз. Насыщенный пар – это пар находящийся в термодинамическом равновесии с жидкостью. Влажный насыщенный пар – насыщенный пар, в котором содержатся высокодисперсные частицы жидкой фазы, равномерно распределенные по всей массе пара (получается при неполном испарении жидкости). Сухой насыщенный пар – образуется при полном испарении жидкости, основной характеристикой является. Перегретый пар – пар, температура которого выше температуры насыщения при данном давлении. Высоко перегретый пар может рассматриваться как реальный газ, получаемый в парогенераторах
Водяной пар. Основные определения. pv - , TS- , i. S-диаграммы водяного пара. Водяной пар – это реальный газ близкий к состоянию насыщения, т. е. состоит из паровой и жидкой фаз. Насыщенный пар – это пар находящийся в термодинамическом равновесии с жидкостью. Влажный насыщенный пар – насыщенный пар, в котором содержатся высокодисперсные частицы жидкой фазы, равномерно распределенные по всей массе пара (получается при неполном испарении жидкости). Сухой насыщенный пар – образуется при полном испарении жидкости, основной характеристикой является. Перегретый пар – пар, температура которого выше температуры насыщения при данном давлении. Высоко перегретый пар может рассматриваться как реальный газ, получаемый в парогенераторах
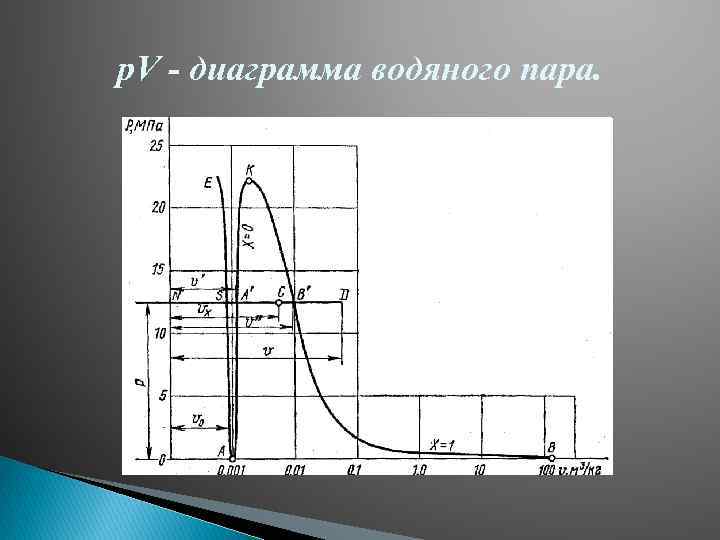 p. V - диаграмма водяного пара.
p. V - диаграмма водяного пара.
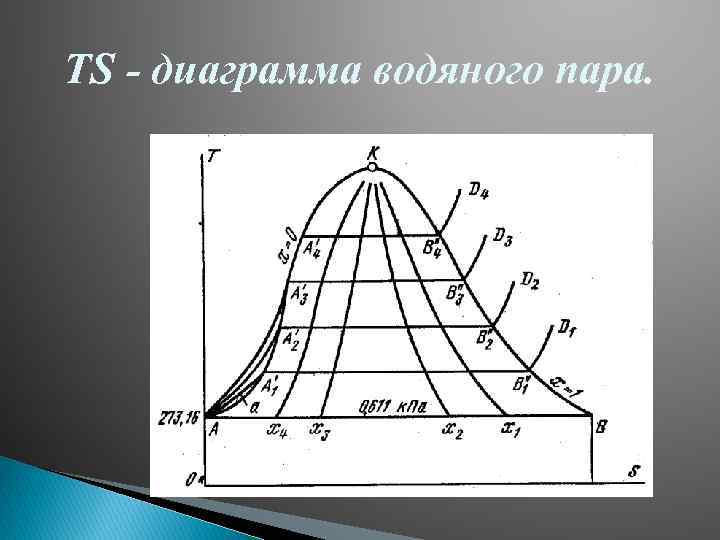 TS - диаграмма водяного пара.
TS - диаграмма водяного пара.
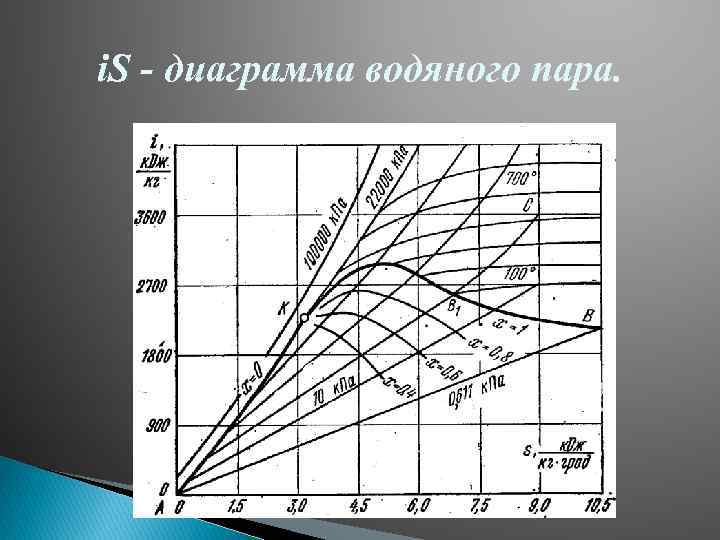 i. S - диаграмма водяного пара.
i. S - диаграмма водяного пара.
 Основные термодинамические процессы водяного пара
Основные термодинамические процессы водяного пара





