Лекция 4 Теплота Порядок Хаос.ppt
- Количество слайдов: 24
 Теплота. Порядок-хаос Тема лекции: 1. Характеристики термодинамических систем. Первое и второе начала термодинамики. 2. Энтропия - мера необратимости или хаоса. Закон возрастания энтропии. 3. Неравновесные системы. Синергетика.
Теплота. Порядок-хаос Тема лекции: 1. Характеристики термодинамических систем. Первое и второе начала термодинамики. 2. Энтропия - мера необратимости или хаоса. Закон возрастания энтропии. 3. Неравновесные системы. Синергетика.
 • термодинамика описывает тепловые явления в макромире и опирается на положения молекулярно-кинетической теории строения вещества. • термодинамическая система – это система тел, обменивающихся энергией между собой и внешними телами. • термодинамический процесс - переход термодинамической системы в другое равновесное состояние под внешним воздействием.
• термодинамика описывает тепловые явления в макромире и опирается на положения молекулярно-кинетической теории строения вещества. • термодинамическая система – это система тел, обменивающихся энергией между собой и внешними телами. • термодинамический процесс - переход термодинамической системы в другое равновесное состояние под внешним воздействием.
 Макроскопические характеристики термодинамических систем • Давление • Температура • Объем
Макроскопические характеристики термодинамических систем • Давление • Температура • Объем
 Теплота и работа Термодинамическая система может обмениваться энергией с окружающими телами. а) обмен энергией в форме механической работы А; б) обмен энергией в форме теплоты Q. 1. Обмен энергией в форме механической работы А происходит при макроскопическом перемещении тел, взаимодействующих с силой F.
Теплота и работа Термодинамическая система может обмениваться энергией с окружающими телами. а) обмен энергией в форме механической работы А; б) обмен энергией в форме теплоты Q. 1. Обмен энергией в форме механической работы А происходит при макроскопическом перемещении тел, взаимодействующих с силой F.
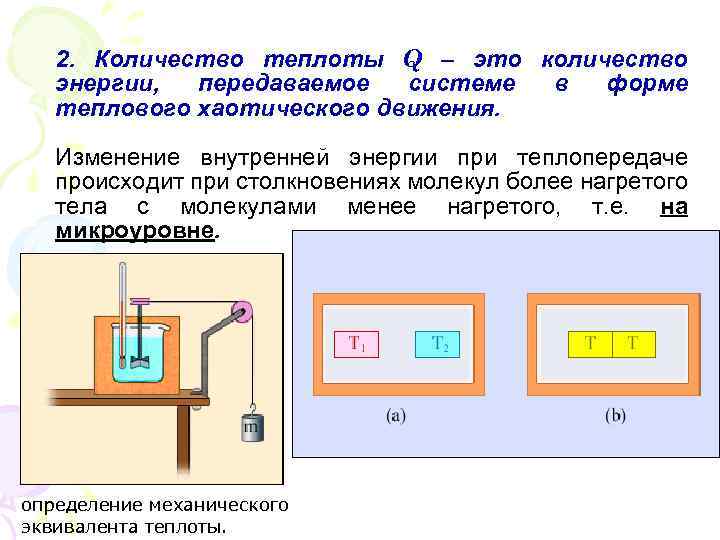 2. Количество теплоты Q – это количество энергии, передаваемое системе в форме теплового хаотического движения. Изменение внутренней энергии при теплопередаче происходит при столкновениях молекул более нагретого тела с молекулами менее нагретого, т. е. на микроуровне. определение механического эквивалента теплоты.
2. Количество теплоты Q – это количество энергии, передаваемое системе в форме теплового хаотического движения. Изменение внутренней энергии при теплопередаче происходит при столкновениях молекул более нагретого тела с молекулами менее нагретого, т. е. на микроуровне. определение механического эквивалента теплоты.
 Первое начало термодинамики –это закон сохранения энергии, учитывающий обмен энергией между системой и окружающей средой по разным каналам: Количество теплоты, сообщенное системе, идет на приращение внутренней энергии и совершение системой работы над внешними телами. Q = ∆U+A
Первое начало термодинамики –это закон сохранения энергии, учитывающий обмен энергией между системой и окружающей средой по разным каналам: Количество теплоты, сообщенное системе, идет на приращение внутренней энергии и совершение системой работы над внешними телами. Q = ∆U+A
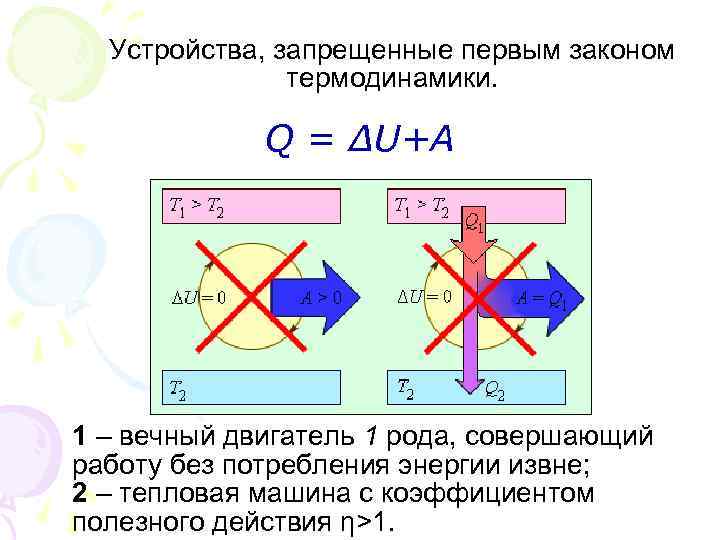 Устройства, запрещенные первым законом термодинамики. Q = ∆U+A 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η>1.
Устройства, запрещенные первым законом термодинамики. Q = ∆U+A 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η>1.
 Обратимый процесс • — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния. • Обратимые процессы дают наибольшую работу. • На практике обратимый процесс реализовать невозможно.
Обратимый процесс • — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния. • Обратимые процессы дают наибольшую работу. • На практике обратимый процесс реализовать невозможно.
 Необратимые процессы - диффузия, теплопроводность, вязкое течение жидкости (газа) и др. физические процессы, которые могут самопроизвольно протекать только в одном направлении - в сторону равномерного распределения вещества, теплоты и т. д. ;
Необратимые процессы - диффузия, теплопроводность, вязкое течение жидкости (газа) и др. физические процессы, которые могут самопроизвольно протекать только в одном направлении - в сторону равномерного распределения вещества, теплоты и т. д. ;
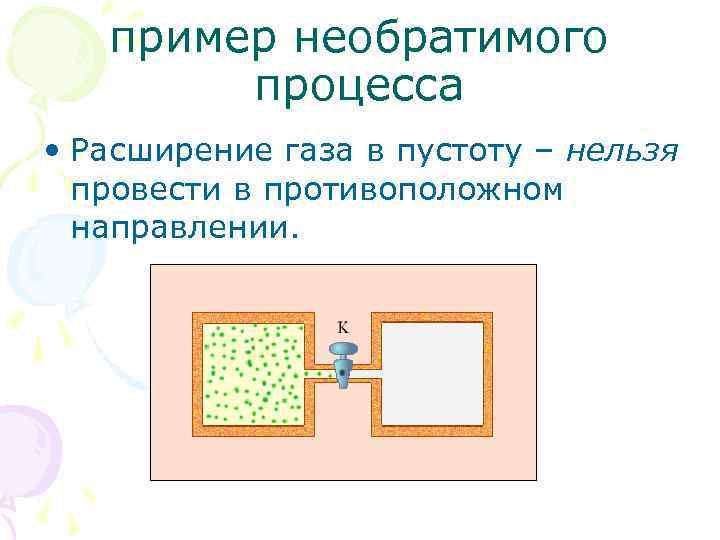 пример необратимого процесса • Расширение газа в пустоту – нельзя провести в противоположном направлении.
пример необратимого процесса • Расширение газа в пустоту – нельзя провести в противоположном направлении.
 второй закон термодинамики устанавливает направление протекающих процессов. самопроизвольно Английский физик У. Кельвин дал в 1851 г. следующую формулировку второго закона: В циклически действующей тепловой машине невозможен процесс, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара
второй закон термодинамики устанавливает направление протекающих процессов. самопроизвольно Английский физик У. Кельвин дал в 1851 г. следующую формулировку второго закона: В циклически действующей тепловой машине невозможен процесс, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара
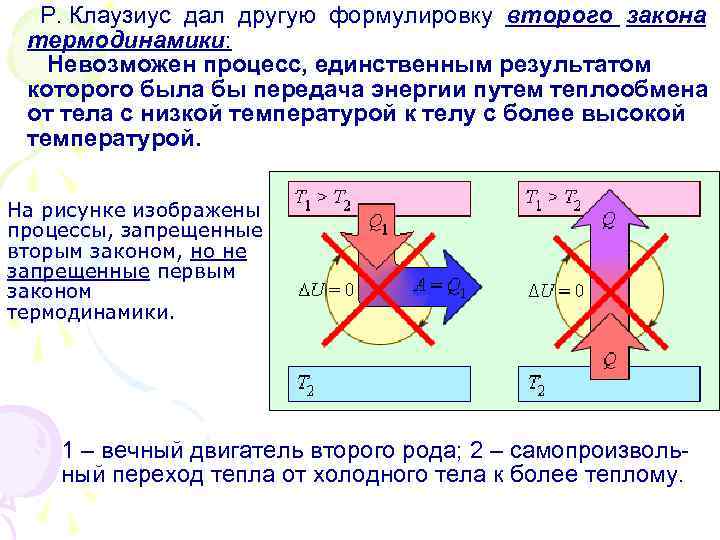 Р. Клаузиус дал другую формулировку второго закона термодинамики: Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой. На рисунке изображены процессы, запрещенные вторым законом, но не запрещенные первым законом термодинамики. 1 – вечный двигатель второго рода; 2 – самопроизволь- ный переход тепла от холодного тела к более теплому.
Р. Клаузиус дал другую формулировку второго закона термодинамики: Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой. На рисунке изображены процессы, запрещенные вторым законом, но не запрещенные первым законом термодинамики. 1 – вечный двигатель второго рода; 2 – самопроизволь- ный переход тепла от холодного тела к более теплому.
 2. Энтропия - мера необратимости или хаоса. Закон возрастания энтропии. • Энтропия (S) – величина, которая характеризует состояние системы и является мерой ее неупорядоченности (беспорядка, хаоса). Когда к системе подводится некоторое количество теплоты, ΔQ, то энтропия системы S возрастает на величину, равную ΔS = ΔQ/T.
2. Энтропия - мера необратимости или хаоса. Закон возрастания энтропии. • Энтропия (S) – величина, которая характеризует состояние системы и является мерой ее неупорядоченности (беспорядка, хаоса). Когда к системе подводится некоторое количество теплоты, ΔQ, то энтропия системы S возрастает на величину, равную ΔS = ΔQ/T.
 закон возрастания энтропии При любых процессах, протекающих в термодинамических изолированных системах, энтропия либо остается неизменной, либо увеличивается. ΔS ≥ 0. • Рост энтропии указывает на приближение системы к состоянию термодинамического равновесия. • В состоянии равновесия энтропия принимает максимальное значение.
закон возрастания энтропии При любых процессах, протекающих в термодинамических изолированных системах, энтропия либо остается неизменной, либо увеличивается. ΔS ≥ 0. • Рост энтропии указывает на приближение системы к состоянию термодинамического равновесия. • В состоянии равновесия энтропия принимает максимальное значение.
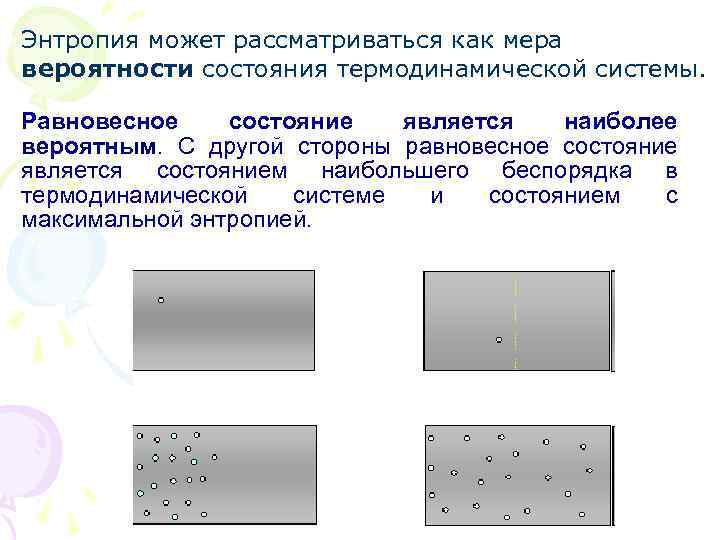 Энтропия может рассматриваться как мера вероятности состояния термодинамической системы. Равновесное состояние является наиболее вероятным. С другой стороны равновесное состояние является состоянием наибольшего беспорядка в термодинамической системе и состоянием с максимальной энтропией.
Энтропия может рассматриваться как мера вероятности состояния термодинамической системы. Равновесное состояние является наиболее вероятным. С другой стороны равновесное состояние является состоянием наибольшего беспорядка в термодинамической системе и состоянием с максимальной энтропией.
 3. Неравновесные системы Флуктуация – самопроизвольное случайное отклонение системы от состояния термодинамического равновесия.
3. Неравновесные системы Флуктуация – самопроизвольное случайное отклонение системы от состояния термодинамического равновесия.
 Принцип отрицательной обратной связи: равным изменениям одной независимой величины должны обязательно отвечать равные изменения в зависимой величине.
Принцип отрицательной обратной связи: равным изменениям одной независимой величины должны обязательно отвечать равные изменения в зависимой величине.
 открытые и нелинейные системы - это системы, способные к самоорганизации. • Физический смысл нелинейности: множеству решений соответствует множество путей эволюции нелинейной системы, описываемой этими уравнениями.
открытые и нелинейные системы - это системы, способные к самоорганизации. • Физический смысл нелинейности: множеству решений соответствует множество путей эволюции нелинейной системы, описываемой этими уравнениями.
 диссипативные структуры в виде ячеек Бенара • Если на более горячей поверхности находится жидкий слой, то в нем возникают вертикальные хаотические конвекционные потоки, которые самоорганизуются в виде пчелиных ячеексот. • Например, масло на горячей сковороде, или на горячем твердом ядре Земли жидкая магма мантии образуют характерные ячейки Бенара.
диссипативные структуры в виде ячеек Бенара • Если на более горячей поверхности находится жидкий слой, то в нем возникают вертикальные хаотические конвекционные потоки, которые самоорганизуются в виде пчелиных ячеексот. • Например, масло на горячей сковороде, или на горячем твердом ядре Земли жидкая магма мантии образуют характерные ячейки Бенара.
 Бифуркация — термин происходит от лат. bifurcus — Бифуркация «раздвоенный» и употребляется в широком смысле для обозначения всевозможных качественных перестроек или метаморфоз различных объектов при изменении параметров, от которых они зависят.
Бифуркация — термин происходит от лат. bifurcus — Бифуркация «раздвоенный» и употребляется в широком смысле для обозначения всевозможных качественных перестроек или метаморфоз различных объектов при изменении параметров, от которых они зависят.
 Физический смысл бифуркации • точка бифуркации - это точка ветвления путей эволюции открытой нелинейной системы. • бифуркации - это ветвления в поле путей развития открытой нелинейной системы в узловых точках аттракторов. • Бифуркация - это событие. Нелинейные системы всегда "таят" в себе бифуркации.
Физический смысл бифуркации • точка бифуркации - это точка ветвления путей эволюции открытой нелинейной системы. • бифуркации - это ветвления в поле путей развития открытой нелинейной системы в узловых точках аттракторов. • Бифуркация - это событие. Нелинейные системы всегда "таят" в себе бифуркации.
 Аттрактор— множество состояний (точнее — точек фазового пространства) динамической системы, к которому она стремится с течением времени. Простейший аттрактор - притягивающая неподвижная точка (к примеру, в задаче о маятнике с трением о воздух)
Аттрактор— множество состояний (точнее — точек фазового пространства) динамической системы, к которому она стремится с течением времени. Простейший аттрактор - притягивающая неподвижная точка (к примеру, в задаче о маятнике с трением о воздух)
 аттрактор
аттрактор
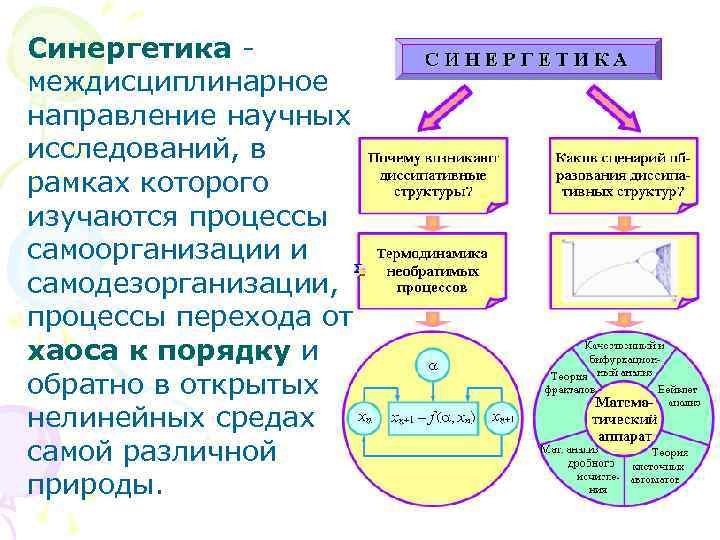 Синергетика - междисциплинарное направление научных исследований, в рамках которого изучаются процессы самоорганизации и самодезорганизации, процессы перехода от хаоса к порядку и обратно в открытых нелинейных средах самой различной природы.
Синергетика - междисциплинарное направление научных исследований, в рамках которого изучаются процессы самоорганизации и самодезорганизации, процессы перехода от хаоса к порядку и обратно в открытых нелинейных средах самой различной природы.


